
食品技术原理课程讲稿-第十一章 酶技术 第 1 页 ,共 25 页 第十一章 食品酶加工技术 第一节 概述(酶学基础) 酶是一种生物催化剂,生物体内的各种生化反应几乎都是在酶的催化作用 下进行的。 一、酶的化学本质 1926 年,萨姆纳(Sumner)首次从刀豆提取液中分离得到脲酶结晶,证明了它 具有蛋白质的性质,此后的一系列实验都证明酶的化学本质是蛋白质。 与其它蛋白质一样,酶的基本组成单位是氨基酸,并且由肽键相连形成氨基 酸长链,具有一、二、三级乃至四级结构。酶的一级结构是指由 L—氨基酸按千 定顺序连接起来,并以复杂形式卷曲,形成具有活性中心的两性离子结构。所谓 活性中心指的是酶蛋白分子中直接与底物结合形成酶—-底物复合物的特性部 位。其中,直接与底物相结合的部位称为结合部位,催化底物进行特定的化学反 应的部位称为催化部位。酶的二级结构是呈现出某种完整结构(如α螺旋)的肽链 部分,而三级结构是指由次级键,如离子键、氢键和疏水键等维系的多肽链的总 体盘卷结构。由数条相同或相类似的肽链组成的酶呈现四级结构,其中每一条肽 链称为一个亚基,亚基在四级结构被破坏后即分离。 正如蛋白质按其组成可分为单纯蛋白和结合蛋白两大类一样,酶按其分子组 成也可分为单纯酶和结合酶。单纯酶的基本组成只是氨基酸,它的催化活性仅取 决于蛋白质的结构,如脲酶、蛋白酶、淀粉酶;结合酶除蛋白质以外还有非蛋白 部分,这两部分对酶的催化活性缺一不可。我们把其中的蛋白质部分称为酶蛋白, 非蛋白部分称为辅助因子,两者结合形成的复合物称全酶。如果全酶中酶蛋白与 辅助因子结合得比较牢固,不易用透析方法把它们分开,这种辅助因子称为辅基。 反之,容易分开的称为辅酶。辅酶能与不同的酶蛋白结合,形成不同的酶。它们 能催化同一类型的化学反应,但所作用的底物不同。例如,乙醇脱氢酶与乳酸脱 氢酶的辅酶均为 NAD(烟酰胺腺嘌呤二核苷酸),与酶蛋白结合后均能催化脱氢反 应,但前者只能催化乙醇脱氢,而后者只能催化乳酸脱氢。 近 10 年来的研究发现,除蛋白质外,某些核糖核酸(RNA)也具有催化活性, 这类 RNA 被称为核酸类酶或催化活性 RNA。 二、酶的催化特性 酶是生物催化剂,因而它除了具有一般催化剂的特点,如缩短反应达到平衡 点的时间,反应过程中本身不被消耗外,还具有反应专一性强,催化效率高,作 用条件温和等特点。 (一)酶的专一性 一种酶仅能作用于某一种物质或一类结构相似的物质,并催化某种类型的反 应,这种特性称为酶的专一性。酶的专一性可以按其严格程度的不同,分为下列 两类: 1.绝对专一性 一种酶只能催化一种化合物进行一种反应,这种高度的专一性称为绝对专一 性。例如脲酶只能催化尿素进行水解生成 CO2 和 NH3,它不能催化尿素以外的 任何物质发生水解,也不能使尿素发生水解以外的其它反应。当底物含有不对称 碳原子时,酶只能作用于它异构体中的一种,而对另一种则全无反应,这种绝对 专一性称为立体异构专一性。例如乳酸脱氢酶催化丙酮酸生成 L—乳酸,而 D— 乳酸脱氢酶却只能催化丙酮酸生成 D—乳酸
食品技术原理课程讲稿-第十一章 酶技术 第 1 页 ,共 25 页 第十一章 食品酶加工技术 第一节 概述(酶学基础) 酶是一种生物催化剂,生物体内的各种生化反应几乎都是在酶的催化作用 下进行的。 一、酶的化学本质 1926 年,萨姆纳(Sumner)首次从刀豆提取液中分离得到脲酶结晶,证明了它 具有蛋白质的性质,此后的一系列实验都证明酶的化学本质是蛋白质。 与其它蛋白质一样,酶的基本组成单位是氨基酸,并且由肽键相连形成氨基 酸长链,具有一、二、三级乃至四级结构。酶的一级结构是指由 L—氨基酸按千 定顺序连接起来,并以复杂形式卷曲,形成具有活性中心的两性离子结构。所谓 活性中心指的是酶蛋白分子中直接与底物结合形成酶—-底物复合物的特性部 位。其中,直接与底物相结合的部位称为结合部位,催化底物进行特定的化学反 应的部位称为催化部位。酶的二级结构是呈现出某种完整结构(如α螺旋)的肽链 部分,而三级结构是指由次级键,如离子键、氢键和疏水键等维系的多肽链的总 体盘卷结构。由数条相同或相类似的肽链组成的酶呈现四级结构,其中每一条肽 链称为一个亚基,亚基在四级结构被破坏后即分离。 正如蛋白质按其组成可分为单纯蛋白和结合蛋白两大类一样,酶按其分子组 成也可分为单纯酶和结合酶。单纯酶的基本组成只是氨基酸,它的催化活性仅取 决于蛋白质的结构,如脲酶、蛋白酶、淀粉酶;结合酶除蛋白质以外还有非蛋白 部分,这两部分对酶的催化活性缺一不可。我们把其中的蛋白质部分称为酶蛋白, 非蛋白部分称为辅助因子,两者结合形成的复合物称全酶。如果全酶中酶蛋白与 辅助因子结合得比较牢固,不易用透析方法把它们分开,这种辅助因子称为辅基。 反之,容易分开的称为辅酶。辅酶能与不同的酶蛋白结合,形成不同的酶。它们 能催化同一类型的化学反应,但所作用的底物不同。例如,乙醇脱氢酶与乳酸脱 氢酶的辅酶均为 NAD(烟酰胺腺嘌呤二核苷酸),与酶蛋白结合后均能催化脱氢反 应,但前者只能催化乙醇脱氢,而后者只能催化乳酸脱氢。 近 10 年来的研究发现,除蛋白质外,某些核糖核酸(RNA)也具有催化活性, 这类 RNA 被称为核酸类酶或催化活性 RNA。 二、酶的催化特性 酶是生物催化剂,因而它除了具有一般催化剂的特点,如缩短反应达到平衡 点的时间,反应过程中本身不被消耗外,还具有反应专一性强,催化效率高,作 用条件温和等特点。 (一)酶的专一性 一种酶仅能作用于某一种物质或一类结构相似的物质,并催化某种类型的反 应,这种特性称为酶的专一性。酶的专一性可以按其严格程度的不同,分为下列 两类: 1.绝对专一性 一种酶只能催化一种化合物进行一种反应,这种高度的专一性称为绝对专一 性。例如脲酶只能催化尿素进行水解生成 CO2 和 NH3,它不能催化尿素以外的 任何物质发生水解,也不能使尿素发生水解以外的其它反应。当底物含有不对称 碳原子时,酶只能作用于它异构体中的一种,而对另一种则全无反应,这种绝对 专一性称为立体异构专一性。例如乳酸脱氢酶催化丙酮酸生成 L—乳酸,而 D— 乳酸脱氢酶却只能催化丙酮酸生成 D—乳酸

食品技术原理课程讲稿-第十一章 酶技术 第 2 页 ,共 25 页 2.相对专一性 一种酶能够催化一类结构类似的物质进行某种相同类型的反应,这种专一性 称为相对专一性。例如脂肪酶能够催化所有含酯键的一类物质水解。 (二)酶的催化反应条件 酶的催化反应一般都在温和的 pH、温度条件下进行。强酸、强碱、高温等 致使蛋白质变性的因素都可使酶失去催化活性。 (三)酶催化的高效性 酶催化反应比非酶反应快,每分钟每个酶活性中心可有多达 106 个底物分子 被代谢 转变。 (四)酶催化反应的广泛性 酶催化反应的范围很宽,比化学催化剂能催化的反应多得多,特别是近些年 来随着遗传工程酶、酶的类似物(或称“合成酶”)的问世,例如用固相合成催化 剂方法按一定顺序将氨基酸进行体外聚合而形成的“合成酶”类,为天然存在的 酶催化反应以外的化学反应能以与天然酶相仿的速度和相似的温和条件进行,提 供了可能性。 由上述酶催化反应的特性不难看出,酶是一种强有力的催化剂,对于工业酶 用户而言,了解酶对底物具有高的亲和力,特别适用于低底物浓度的催化反应尤 为重要。而一般情况下,由于许多工艺过程中使用的底物是纯的一种分子,并不 需要每种酶都具有很高的底物专一性。 三、酶的命名 为了准确地识别某一种酶,避免发生混乱和误解,需要对已知的 3000 多种 酶进行科学的分类与命名。为此,国际酶学委员会做了大量的工作,对酶的分类 和命名方案不断修改和完善,以酶的专一性为基础,建议每种具体的酶都有其推 荐名和系统命名。 (一)酶的推荐名 酶的推荐名是由底物名称和催化反应的类型两部分构成。例如葡萄糖氧化 酶,它表明酶作用的底物是葡萄糖,催化反应的类型为氧化反应。 (二)酶的系统命名 酶的系统命名包括酶作用的底物、酶作用的基因及催化反应的类型三部分构 成,它更详细、准确地反映出该酶所催化的反应。例如上述葡萄糖氧化酶的系统 命名为“β—D—葡萄糖,氧 1-氧化还原酶”,它表明该酶所催化的反应是以β —D—葡萄糖为脱氢的受体,催化作用在第一位碳原子基团上进行,催化的反应 类型为氧化还原反应。系统命名法首先根据酶所催化的类型将酶分成 6 大类,即 氧化还原酶类、转移酶类、水解酶类、裂解酶类、异构酶类和合成酶类,再根据 底物及被作用基团的性质将每一大类分为若干亚类及次亚类,每一次亚类直接包 括若干个别酶。系统命名采用四码编号方法,每个号码之间用圆点分开。例如上 述“β—D—葡萄糖,氧 1—氧化还原酶”的系统编号为[ECl.1.3.4],其中 EC 表 示国际酶学委员会(Enzyme Commission);第 1 个号码“1”表示该酶属氧化还原 酶类;第 2 个号码“1”表示属于氧化还原酶类中的第一亚类,该亚类所催化的 反应系在供体的 CH—OH 基团上进行;第 3 个号码“3”,表示该酶属第一亚类 中的第 3 小类,该小类的酶所催化的反应是以氧为受体的,第 4 个号码“4”就 是该酶在小类中的特定序号。 四、酶活性的测定
食品技术原理课程讲稿-第十一章 酶技术 第 2 页 ,共 25 页 2.相对专一性 一种酶能够催化一类结构类似的物质进行某种相同类型的反应,这种专一性 称为相对专一性。例如脂肪酶能够催化所有含酯键的一类物质水解。 (二)酶的催化反应条件 酶的催化反应一般都在温和的 pH、温度条件下进行。强酸、强碱、高温等 致使蛋白质变性的因素都可使酶失去催化活性。 (三)酶催化的高效性 酶催化反应比非酶反应快,每分钟每个酶活性中心可有多达 106 个底物分子 被代谢 转变。 (四)酶催化反应的广泛性 酶催化反应的范围很宽,比化学催化剂能催化的反应多得多,特别是近些年 来随着遗传工程酶、酶的类似物(或称“合成酶”)的问世,例如用固相合成催化 剂方法按一定顺序将氨基酸进行体外聚合而形成的“合成酶”类,为天然存在的 酶催化反应以外的化学反应能以与天然酶相仿的速度和相似的温和条件进行,提 供了可能性。 由上述酶催化反应的特性不难看出,酶是一种强有力的催化剂,对于工业酶 用户而言,了解酶对底物具有高的亲和力,特别适用于低底物浓度的催化反应尤 为重要。而一般情况下,由于许多工艺过程中使用的底物是纯的一种分子,并不 需要每种酶都具有很高的底物专一性。 三、酶的命名 为了准确地识别某一种酶,避免发生混乱和误解,需要对已知的 3000 多种 酶进行科学的分类与命名。为此,国际酶学委员会做了大量的工作,对酶的分类 和命名方案不断修改和完善,以酶的专一性为基础,建议每种具体的酶都有其推 荐名和系统命名。 (一)酶的推荐名 酶的推荐名是由底物名称和催化反应的类型两部分构成。例如葡萄糖氧化 酶,它表明酶作用的底物是葡萄糖,催化反应的类型为氧化反应。 (二)酶的系统命名 酶的系统命名包括酶作用的底物、酶作用的基因及催化反应的类型三部分构 成,它更详细、准确地反映出该酶所催化的反应。例如上述葡萄糖氧化酶的系统 命名为“β—D—葡萄糖,氧 1-氧化还原酶”,它表明该酶所催化的反应是以β —D—葡萄糖为脱氢的受体,催化作用在第一位碳原子基团上进行,催化的反应 类型为氧化还原反应。系统命名法首先根据酶所催化的类型将酶分成 6 大类,即 氧化还原酶类、转移酶类、水解酶类、裂解酶类、异构酶类和合成酶类,再根据 底物及被作用基团的性质将每一大类分为若干亚类及次亚类,每一次亚类直接包 括若干个别酶。系统命名采用四码编号方法,每个号码之间用圆点分开。例如上 述“β—D—葡萄糖,氧 1—氧化还原酶”的系统编号为[ECl.1.3.4],其中 EC 表 示国际酶学委员会(Enzyme Commission);第 1 个号码“1”表示该酶属氧化还原 酶类;第 2 个号码“1”表示属于氧化还原酶类中的第一亚类,该亚类所催化的 反应系在供体的 CH—OH 基团上进行;第 3 个号码“3”,表示该酶属第一亚类 中的第 3 小类,该小类的酶所催化的反应是以氧为受体的,第 4 个号码“4”就 是该酶在小类中的特定序号。 四、酶活性的测定

食品技术原理课程讲稿-第十一章 酶技术 第 3 页 ,共 25 页 利用酶制剂的食品加工工艺中需要掌握酶的用量,因此一般都要对市售酶制 剂的酶活性进行测定,也就是测定在一定条件下酶催化特定化学反应的能力。这 里所说的一定条件是指某种酶作用的最适条件,如温度、pH 和底物浓度等。酶 活性的大小是以在特定的反应系统和条件下测到的反应速度来表示的,而反应速 度可以以底物的减少或产物的增加来表示,反应速度越大,意味着酶活力越高, 常用的测定方法有: (一)化学法 将酶和底物反应一定时间后,中止反应,测定底物的减少或产物的增加。由 于底物通常情况下是过量的,少量底物的减少难以测定,而产物从无到有反应灵 敏,为此以测定产物增加的方法居多。此外利用产物与其它试剂的颜色反应,也 可与分光光度法结合起来测定酶活性。例如。α—淀粉酶能将淀粉分子链的α— 1,4 葡萄糖苷链任意切断成长短不一的短链糊精,以及少量麦芽糖和葡萄糖, 而使淀粉对碘呈蓝紫色的特异反应逐渐消失,以该颜色消失的速度计算酶的活 性。 (二)分光光度法 由于许多酶作用的底物、产物或它们与其它试剂反应的化合物能吸收可见光 或非可见光,所以可以用分光光度法测定酶活性。例如葡萄糖异构酶作用于葡萄 糖使其转变为果糖,果糖与半胱氨酸咔唑试剂反应生成物在 580nm 有最大吸收 峰,因此可用分光光度法测定葡萄糖异构酶活性。 (三)其它测定方法 其它方法包括用 pH 计跟踪反应过程的 pH 变化,用氧电极检测反应过程中 氧的消耗和氧逸出。在某些情况下,跟踪荧光吸收,可使测定更灵敏。 五、酶的来源和安全要求 (一)酶的来源 早期使用的酶取自动物、植物或微生物的细胞或组织。例如:从动物的胰脏 中提取胰酶,从木瓜中提取木瓜蛋白酶;从黑曲霉中提取果胶酶。自从本世纪 50 年代起,人们把酶生产的重点放在微生物发酵的方法上。如:利用枯草杆菌 发酵生产α—淀粉酶;利用绿色木霉生产纤维素酶等。80 年代以来,人们除了 利用微生物细胞发酵产酶以外,还发展了用植物、动物细胞的离体培养技术生产 酶制剂,以满足人们对酶的不同需求。 (二)食品酶制剂的安全要求 作为食品加工用的酶制剂,由于其中的各有关组分经常通过各种途径进入人 体,所以其卫生安全评价是十分重要的。为此联合国粮食农业组织和世界卫生组 织的食品添加剂专家联合委员会于1977年第21届大会上对食品酶制剂的安全要 求作出了以下规定: (1)凡从动、植物可食部位的组织制取的,以及使用传统食品加工用菌种生 产的酶制剂可作为食品对待,不需进行毒理试验,只需拟定有关它酶化学和微生 物学的说明。 (2)凡由非致病性的常见食品污染微生物生产的酶需作短期毒性试验。 (3)对于非常见微生物制取的酶,需作广泛的毒性试验。 六、固定化酶 在以往的工业生产中使用的酶,一直都是以溶于水(即水溶性酶)的状态进行 反应。酶在整个反应系统中与底物和产物混在一起,反应结束后,即使酶仍具有 较高的活力,也难于回收利用,这种一次性使用酶的方式不仅成本高,而且难于
食品技术原理课程讲稿-第十一章 酶技术 第 3 页 ,共 25 页 利用酶制剂的食品加工工艺中需要掌握酶的用量,因此一般都要对市售酶制 剂的酶活性进行测定,也就是测定在一定条件下酶催化特定化学反应的能力。这 里所说的一定条件是指某种酶作用的最适条件,如温度、pH 和底物浓度等。酶 活性的大小是以在特定的反应系统和条件下测到的反应速度来表示的,而反应速 度可以以底物的减少或产物的增加来表示,反应速度越大,意味着酶活力越高, 常用的测定方法有: (一)化学法 将酶和底物反应一定时间后,中止反应,测定底物的减少或产物的增加。由 于底物通常情况下是过量的,少量底物的减少难以测定,而产物从无到有反应灵 敏,为此以测定产物增加的方法居多。此外利用产物与其它试剂的颜色反应,也 可与分光光度法结合起来测定酶活性。例如。α—淀粉酶能将淀粉分子链的α— 1,4 葡萄糖苷链任意切断成长短不一的短链糊精,以及少量麦芽糖和葡萄糖, 而使淀粉对碘呈蓝紫色的特异反应逐渐消失,以该颜色消失的速度计算酶的活 性。 (二)分光光度法 由于许多酶作用的底物、产物或它们与其它试剂反应的化合物能吸收可见光 或非可见光,所以可以用分光光度法测定酶活性。例如葡萄糖异构酶作用于葡萄 糖使其转变为果糖,果糖与半胱氨酸咔唑试剂反应生成物在 580nm 有最大吸收 峰,因此可用分光光度法测定葡萄糖异构酶活性。 (三)其它测定方法 其它方法包括用 pH 计跟踪反应过程的 pH 变化,用氧电极检测反应过程中 氧的消耗和氧逸出。在某些情况下,跟踪荧光吸收,可使测定更灵敏。 五、酶的来源和安全要求 (一)酶的来源 早期使用的酶取自动物、植物或微生物的细胞或组织。例如:从动物的胰脏 中提取胰酶,从木瓜中提取木瓜蛋白酶;从黑曲霉中提取果胶酶。自从本世纪 50 年代起,人们把酶生产的重点放在微生物发酵的方法上。如:利用枯草杆菌 发酵生产α—淀粉酶;利用绿色木霉生产纤维素酶等。80 年代以来,人们除了 利用微生物细胞发酵产酶以外,还发展了用植物、动物细胞的离体培养技术生产 酶制剂,以满足人们对酶的不同需求。 (二)食品酶制剂的安全要求 作为食品加工用的酶制剂,由于其中的各有关组分经常通过各种途径进入人 体,所以其卫生安全评价是十分重要的。为此联合国粮食农业组织和世界卫生组 织的食品添加剂专家联合委员会于1977年第21届大会上对食品酶制剂的安全要 求作出了以下规定: (1)凡从动、植物可食部位的组织制取的,以及使用传统食品加工用菌种生 产的酶制剂可作为食品对待,不需进行毒理试验,只需拟定有关它酶化学和微生 物学的说明。 (2)凡由非致病性的常见食品污染微生物生产的酶需作短期毒性试验。 (3)对于非常见微生物制取的酶,需作广泛的毒性试验。 六、固定化酶 在以往的工业生产中使用的酶,一直都是以溶于水(即水溶性酶)的状态进行 反应。酶在整个反应系统中与底物和产物混在一起,反应结束后,即使酶仍具有 较高的活力,也难于回收利用,这种一次性使用酶的方式不仅成本高,而且难于

食品技术原理课程讲稿-第十一章 酶技术 第 4 页 ,共 25 页 连续化生产。 自 50 年代起人们开始了固定化酶的研究。所谓固定化酶是指与水不溶性载 体相结合,在一定的空间范围内起催化作用的酶。1953 年德国科学家格鲁布霍 费(Grubhofer)和施莱思(Schleith)采用聚氨基苯乙烯树脂为载体,经重氮法活化 后,分别与羧肽酶、淀粉酶、胃蛋白酶、核糖核酸酶结合制成固定化酶。60 年 代后期,固定化酶技术迅速发展,1969 年日本的千钿一郎首次以工业生产规模 应用固定化氨基酰化酶,从 DL—氨基酸连续生产 l—氨基酸,实现了酶应用史上 的一大变革。 固定化酶与一般水溶性酶相比,以固相状态作用于底物,这样不仅保留了酶 原有的各种优点,而且反应后酶易与反应液分离,有利于产物的进一步分离纯化。 酶经固定化后稳定性提高,机械强度增加,可以用搅拌或装柱的形式作用于底物 溶液。若将酶装成酶柱,底物溶液流经酶柱后即可生成反应产物,使得酶反应工 艺管道化、连续化及自动化。因此固定化酶的研究成功和应用是一项具有重大意 义的革新。 (一)固定化的方法 酶的固定化方法很多,主要可分为吸附法、包埋法、结合法和交联法等,如 图 23—1。 1.吸附法 吸附法可分为物理吸附法和离子吸附法?物理吸附法是利用各种固体吸附 剂,如活性炭、氧化铝、皂土、淀粉等将菌体吸附在其表面而使酶固定化。用物 理吸附法制备固定化酶操作简便,条件温和,不会引起酶变性失活,但物理吸附 作用结合力较弱,易于脱落,使用受到限制。离子吸附法是将酶与含有离子交换 基的水不溶性载体如 DEAE-纤维素、DEAE-葡聚糖凝胶、CM-纤维素相结合。此 种方法酶吸附于载体上较为牢固,在工业上用途较广。 2.包埋法 包埋法是将酶包埋于各种多孔载体中,这种载体的结构可使底物渗入与酶接 触,但阻止酶蛋白渗出。包埋法使用的载作主要有聚丙烯酰胺、卡拉胶、蒯旨糖 和海藻酸钠等。 3.共价结合法 此法是将酶与聚合物载体进行共价键合的固定化方法。该法酶与载体的结合 较为牢固,酶下易脱落,但因反应条件较为剧烈,酶活不免损失,且制备手续繁 杂。 4.交联法 此法是使用双功能或多功能试剂(如戊二醛)与酶分子乏向进行分子间交族 的固定化方法。如图 23-2 所示为戊二醛的酶固定化交联方式。此法由于酶蛋白
食品技术原理课程讲稿-第十一章 酶技术 第 4 页 ,共 25 页 连续化生产。 自 50 年代起人们开始了固定化酶的研究。所谓固定化酶是指与水不溶性载 体相结合,在一定的空间范围内起催化作用的酶。1953 年德国科学家格鲁布霍 费(Grubhofer)和施莱思(Schleith)采用聚氨基苯乙烯树脂为载体,经重氮法活化 后,分别与羧肽酶、淀粉酶、胃蛋白酶、核糖核酸酶结合制成固定化酶。60 年 代后期,固定化酶技术迅速发展,1969 年日本的千钿一郎首次以工业生产规模 应用固定化氨基酰化酶,从 DL—氨基酸连续生产 l—氨基酸,实现了酶应用史上 的一大变革。 固定化酶与一般水溶性酶相比,以固相状态作用于底物,这样不仅保留了酶 原有的各种优点,而且反应后酶易与反应液分离,有利于产物的进一步分离纯化。 酶经固定化后稳定性提高,机械强度增加,可以用搅拌或装柱的形式作用于底物 溶液。若将酶装成酶柱,底物溶液流经酶柱后即可生成反应产物,使得酶反应工 艺管道化、连续化及自动化。因此固定化酶的研究成功和应用是一项具有重大意 义的革新。 (一)固定化的方法 酶的固定化方法很多,主要可分为吸附法、包埋法、结合法和交联法等,如 图 23—1。 1.吸附法 吸附法可分为物理吸附法和离子吸附法?物理吸附法是利用各种固体吸附 剂,如活性炭、氧化铝、皂土、淀粉等将菌体吸附在其表面而使酶固定化。用物 理吸附法制备固定化酶操作简便,条件温和,不会引起酶变性失活,但物理吸附 作用结合力较弱,易于脱落,使用受到限制。离子吸附法是将酶与含有离子交换 基的水不溶性载体如 DEAE-纤维素、DEAE-葡聚糖凝胶、CM-纤维素相结合。此 种方法酶吸附于载体上较为牢固,在工业上用途较广。 2.包埋法 包埋法是将酶包埋于各种多孔载体中,这种载体的结构可使底物渗入与酶接 触,但阻止酶蛋白渗出。包埋法使用的载作主要有聚丙烯酰胺、卡拉胶、蒯旨糖 和海藻酸钠等。 3.共价结合法 此法是将酶与聚合物载体进行共价键合的固定化方法。该法酶与载体的结合 较为牢固,酶下易脱落,但因反应条件较为剧烈,酶活不免损失,且制备手续繁 杂。 4.交联法 此法是使用双功能或多功能试剂(如戊二醛)与酶分子乏向进行分子间交族 的固定化方法。如图 23-2 所示为戊二醛的酶固定化交联方式。此法由于酶蛋白

食品技术原理课程讲稿-第十一章 酶技术 第 5 页 ,共 25 页 的功能团,如氨基、巯基、咪唑基参与反应,所以酶的活性中心构象可能受到影 响而使酶显著失活。 (二)固定化酶的形状 固定化酶根据用途的不同可制成颗粒、线条、薄膜和酶管等形状,其中颗粒 状占绝大多数。 1.颗粒状固定化酶 用上述各种固定化方法均可制成颗粒状固定化酶。 2.线条状固定化酶 这是参照纺纱方法用三醋酸纤维与酶混合后作成线条。葡萄糖异构酶、转化 酶、葡萄糖氧化酶、过氧化氢酶,乳糖酶等均可用此法。 3.薄膜状固定化酶 酶薄膜是用火棉胶、硝酸纤维、玻璃纸、骨胶原、明胶等加戊二醛交联处理 后制成,供木瓜酶、葡萄糖氧化酶、过氧化酶等固定化之用。 4.酶管 以尼龙,聚氯基苯乙烯和聚丙烯酰胺为载体,利用共价结合或交联法制成酶 管,可供糖化酶、转化酶、脲酶等之用。 (三)固定化酶的性质 酶经固定化后由于受到载体的影响,酶的特性如酶作用的最适温度、pH、 对底物的特异性均可能会发生变化。一般而言,固定化酶的稳定性较水溶性酶有 所增加,温度、pH 值、有机溶剂和其它外界因素对酶活力的影响减少,但固定 化酶的活性较水溶性酶有所下降(个别除外)。 (四)固定化酶在食品加工中的应用 自从 1969 年日本田边制药公司首次将氨基酰化酶固定化,用以连续生产 L —氨基酸以来,固定化酶已广泛地用于食品、轻工、医药、环保等领域
食品技术原理课程讲稿-第十一章 酶技术 第 5 页 ,共 25 页 的功能团,如氨基、巯基、咪唑基参与反应,所以酶的活性中心构象可能受到影 响而使酶显著失活。 (二)固定化酶的形状 固定化酶根据用途的不同可制成颗粒、线条、薄膜和酶管等形状,其中颗粒 状占绝大多数。 1.颗粒状固定化酶 用上述各种固定化方法均可制成颗粒状固定化酶。 2.线条状固定化酶 这是参照纺纱方法用三醋酸纤维与酶混合后作成线条。葡萄糖异构酶、转化 酶、葡萄糖氧化酶、过氧化氢酶,乳糖酶等均可用此法。 3.薄膜状固定化酶 酶薄膜是用火棉胶、硝酸纤维、玻璃纸、骨胶原、明胶等加戊二醛交联处理 后制成,供木瓜酶、葡萄糖氧化酶、过氧化酶等固定化之用。 4.酶管 以尼龙,聚氯基苯乙烯和聚丙烯酰胺为载体,利用共价结合或交联法制成酶 管,可供糖化酶、转化酶、脲酶等之用。 (三)固定化酶的性质 酶经固定化后由于受到载体的影响,酶的特性如酶作用的最适温度、pH、 对底物的特异性均可能会发生变化。一般而言,固定化酶的稳定性较水溶性酶有 所增加,温度、pH 值、有机溶剂和其它外界因素对酶活力的影响减少,但固定 化酶的活性较水溶性酶有所下降(个别除外)。 (四)固定化酶在食品加工中的应用 自从 1969 年日本田边制药公司首次将氨基酰化酶固定化,用以连续生产 L —氨基酸以来,固定化酶已广泛地用于食品、轻工、医药、环保等领域

食品技术原理课程讲稿-第十一章 酶技术 第 6 页 ,共 25 页 第二节 酶反应动力学 酶反应动力学是在酶作用过程中来研究酶的学问,包括酶反应速度规律以及 各种因素对酶反应速度的影响。研究酶反应动力学对于了解酶作用机制,确定最 有效的反应系统、反应条件及酶反应器设计都具有重要意义。 一、溶液酶反应动力学 溶液酶反应动力学的基本关系式是酶反应动力学的基础,是我们首先要讨论 的问题。 (一)单底物动力学 单底物反应是由一种底物参与的反应,如:异构酶催化的反应:水解酶催化 反应。后者虽有水参与,但一般条件下水总是过量的。因此可以认为其浓度是恒 定的。 早在 1902 年,V.Heneri 在研究蔗糖酶水解蔗糖的反应中发现随着底物浓 度增加,反应速度上升呈双曲线,如图 23-3 所示。即在低底物浓度时,反应速 度与底物浓度之间 成正比关系,呈现一级反应类型,而在高底物浓度时,反应速度上升很少小呈混 合级反应类型;当底物浓度增加至某种程度时,反应速度达到一个极限值,呈零 级反应。对此现象的解释为酶能同它的底物形成复合物,而这种复合物在分解出 产物的同时,又再生出游离酶。1913 年,L.Michaelis 和 M.L.Menten 发展了前人 的理论,对酶促反应作了大量的定量研究,归纳出一个著名的米氏方程,后经 Briggs 和 Hadlane.的进一步修正,成为酶促反应的基本方程,其反应式及反应 方程如下:
食品技术原理课程讲稿-第十一章 酶技术 第 6 页 ,共 25 页 第二节 酶反应动力学 酶反应动力学是在酶作用过程中来研究酶的学问,包括酶反应速度规律以及 各种因素对酶反应速度的影响。研究酶反应动力学对于了解酶作用机制,确定最 有效的反应系统、反应条件及酶反应器设计都具有重要意义。 一、溶液酶反应动力学 溶液酶反应动力学的基本关系式是酶反应动力学的基础,是我们首先要讨论 的问题。 (一)单底物动力学 单底物反应是由一种底物参与的反应,如:异构酶催化的反应:水解酶催化 反应。后者虽有水参与,但一般条件下水总是过量的。因此可以认为其浓度是恒 定的。 早在 1902 年,V.Heneri 在研究蔗糖酶水解蔗糖的反应中发现随着底物浓 度增加,反应速度上升呈双曲线,如图 23-3 所示。即在低底物浓度时,反应速 度与底物浓度之间 成正比关系,呈现一级反应类型,而在高底物浓度时,反应速度上升很少小呈混 合级反应类型;当底物浓度增加至某种程度时,反应速度达到一个极限值,呈零 级反应。对此现象的解释为酶能同它的底物形成复合物,而这种复合物在分解出 产物的同时,又再生出游离酶。1913 年,L.Michaelis 和 M.L.Menten 发展了前人 的理论,对酶促反应作了大量的定量研究,归纳出一个著名的米氏方程,后经 Briggs 和 Hadlane.的进一步修正,成为酶促反应的基本方程,其反应式及反应 方程如下:
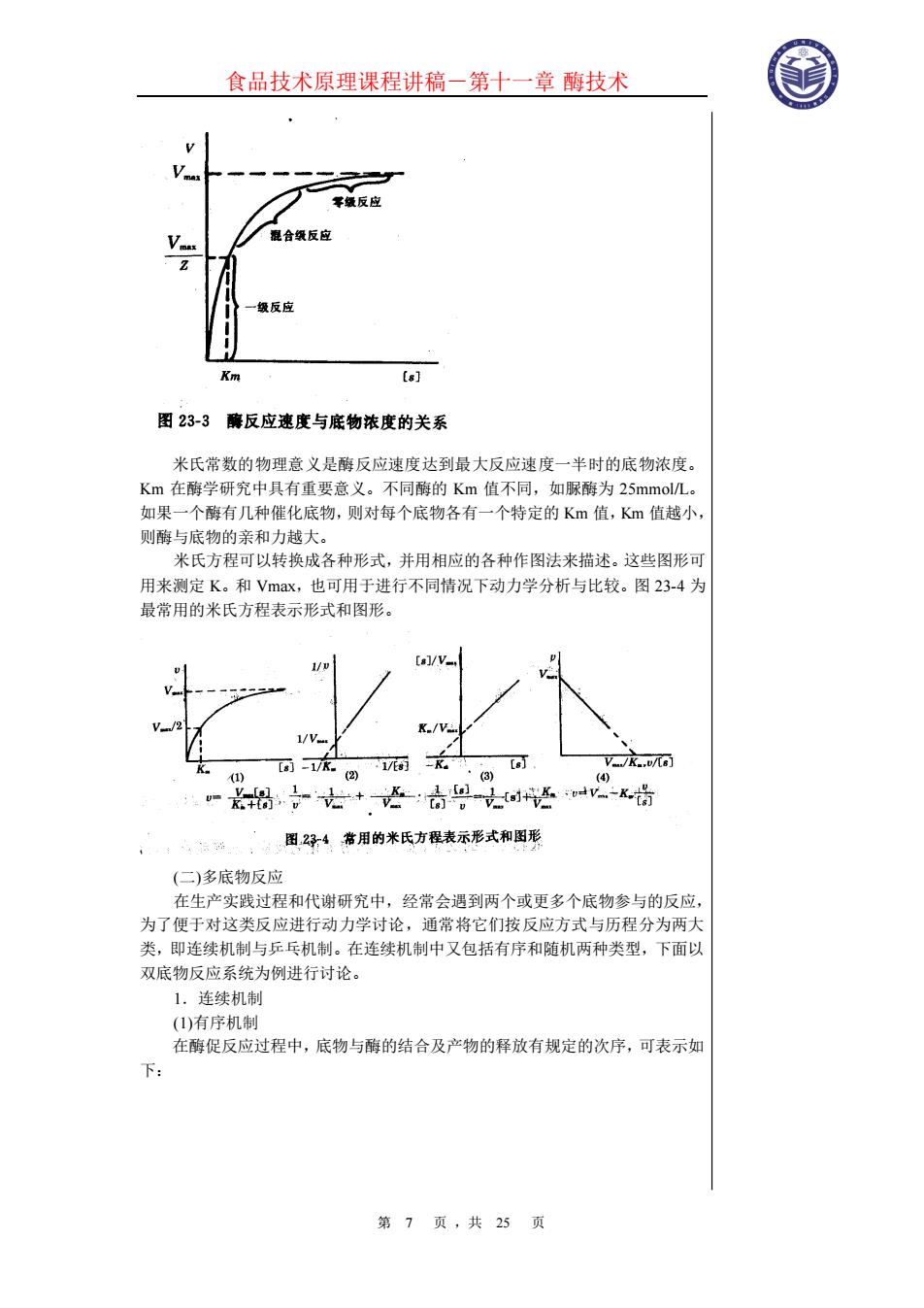
食品技术原理课程讲稿-第十一章 酶技术 第 7 页 ,共 25 页 米氏常数的物理意义是酶反应速度达到最大反应速度一半时的底物浓度。 Km 在酶学研究中具有重要意义。不同酶的 Km 值不同,如脲酶为 25mmol/L。 如果一个酶有几种催化底物,则对每个底物各有一个特定的 Km 值,Km 值越小, 则酶与底物的亲和力越大。 米氏方程可以转换成各种形式,并用相应的各种作图法来描述。这些图形可 用来测定 K。和 Vmax,也可用于进行不同情况下动力学分析与比较。图 23-4 为 最常用的米氏方程表示形式和图形。 (二)多底物反应 在生产实践过程和代谢研究中,经常会遇到两个或更多个底物参与的反应, 为了便于对这类反应进行动力学讨论,通常将它们按反应方式与历程分为两大 类,即连续机制与乒乓机制。在连续机制中又包括有序和随机两种类型,下面以 双底物反应系统为例进行讨论。 1.连续机制 (1)有序机制 在酶促反应过程中,底物与酶的结合及产物的释放有规定的次序,可表示如 下:
食品技术原理课程讲稿-第十一章 酶技术 第 7 页 ,共 25 页 米氏常数的物理意义是酶反应速度达到最大反应速度一半时的底物浓度。 Km 在酶学研究中具有重要意义。不同酶的 Km 值不同,如脲酶为 25mmol/L。 如果一个酶有几种催化底物,则对每个底物各有一个特定的 Km 值,Km 值越小, 则酶与底物的亲和力越大。 米氏方程可以转换成各种形式,并用相应的各种作图法来描述。这些图形可 用来测定 K。和 Vmax,也可用于进行不同情况下动力学分析与比较。图 23-4 为 最常用的米氏方程表示形式和图形。 (二)多底物反应 在生产实践过程和代谢研究中,经常会遇到两个或更多个底物参与的反应, 为了便于对这类反应进行动力学讨论,通常将它们按反应方式与历程分为两大 类,即连续机制与乒乓机制。在连续机制中又包括有序和随机两种类型,下面以 双底物反应系统为例进行讨论。 1.连续机制 (1)有序机制 在酶促反应过程中,底物与酶的结合及产物的释放有规定的次序,可表示如 下:
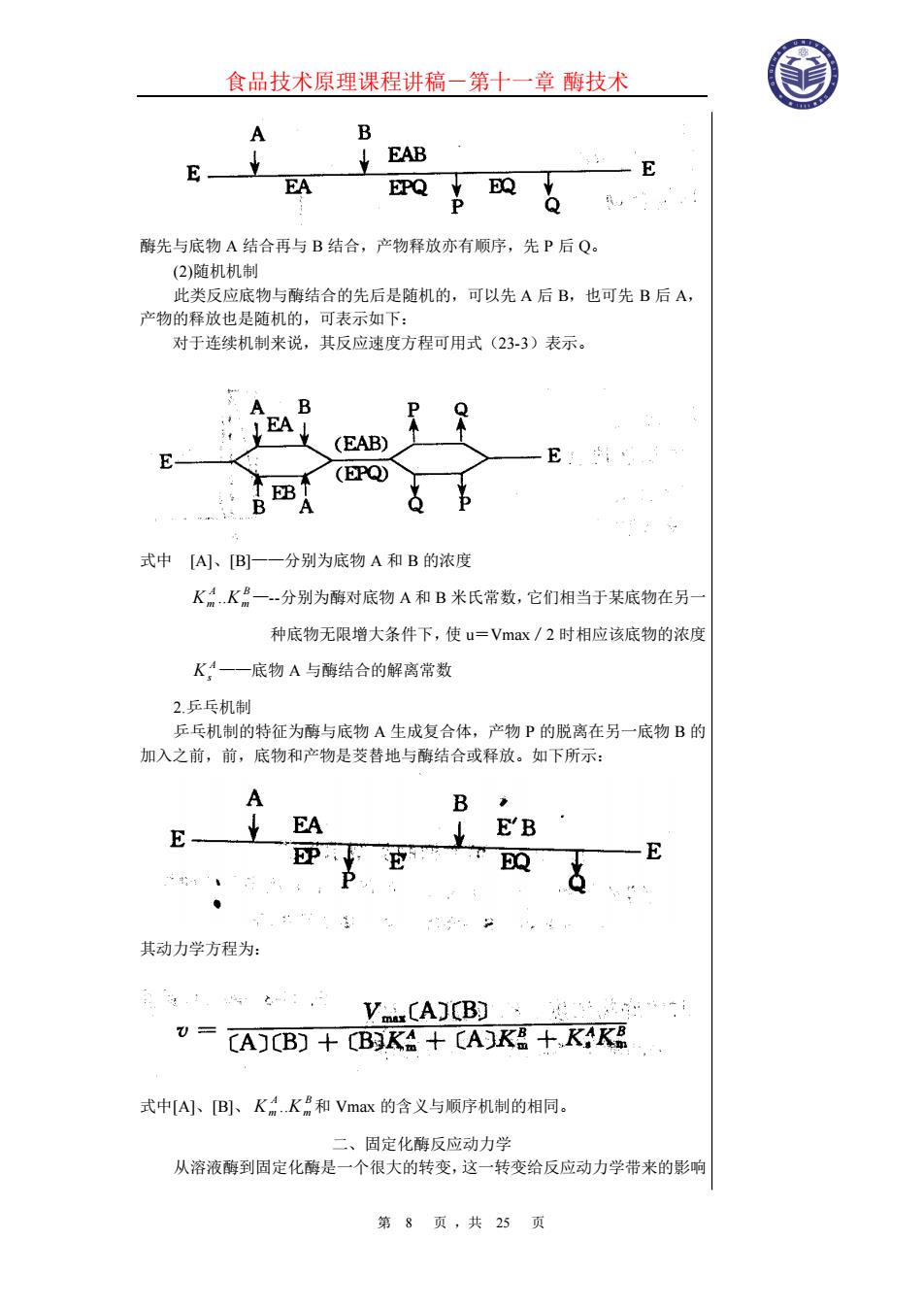
食品技术原理课程讲稿-第十一章 酶技术 第 8 页 ,共 25 页 酶先与底物 A 结合再与 B 结合,产物释放亦有顺序,先 P 后 Q。 (2)随机机制 此类反应底物与酶结合的先后是随机的,可以先 A 后 B,也可先 B 后 A, 产物的释放也是随机的,可表示如下: 对于连续机制来说,其反应速度方程可用式(23-3)表示。 式中 [A]、[B]——分别为底物 A 和 B 的浓度 B m A K m .K —-分别为酶对底物 A 和 B 米氏常数,它们相当于某底物在另一 种底物无限增大条件下,使 u=Vmax/2 时相应该底物的浓度 A Ks ——底物 A 与酶结合的解离常数 2.乒乓机制 乒乓机制的特征为酶与底物 A 生成复合体,产物 P 的脱离在另一底物 B 的 加入之前,前,底物和产物是茭替地与酶结合或释放。如下所示: 其动力学方程为: 式中[A]、[B]、 B m A K m .K 和 Vmax 的含义与顺序机制的相同。 二、固定化酶反应动力学 从溶液酶到固定化酶是一个很大的转变,这一转变给反应动力学带来的影响
食品技术原理课程讲稿-第十一章 酶技术 第 8 页 ,共 25 页 酶先与底物 A 结合再与 B 结合,产物释放亦有顺序,先 P 后 Q。 (2)随机机制 此类反应底物与酶结合的先后是随机的,可以先 A 后 B,也可先 B 后 A, 产物的释放也是随机的,可表示如下: 对于连续机制来说,其反应速度方程可用式(23-3)表示。 式中 [A]、[B]——分别为底物 A 和 B 的浓度 B m A K m .K —-分别为酶对底物 A 和 B 米氏常数,它们相当于某底物在另一 种底物无限增大条件下,使 u=Vmax/2 时相应该底物的浓度 A Ks ——底物 A 与酶结合的解离常数 2.乒乓机制 乒乓机制的特征为酶与底物 A 生成复合体,产物 P 的脱离在另一底物 B 的 加入之前,前,底物和产物是茭替地与酶结合或释放。如下所示: 其动力学方程为: 式中[A]、[B]、 B m A K m .K 和 Vmax 的含义与顺序机制的相同。 二、固定化酶反应动力学 从溶液酶到固定化酶是一个很大的转变,这一转变给反应动力学带来的影响

食品技术原理课程讲稿-第十一章 酶技术 第 9 页 ,共 25 页 是复杂的。这里仅就固定化对酶反应动力学性态(或参数)和实际反应速度的影响 做一粗浅的讨论。 (一)固定化对酶反应动力学参数的影响 1.构象改变 构象改变是指酶在固定化过程中发生了某种扭曲,影响了酶分子的空间结 构,从而导致了酶与底物结合能力或酶催化底物转化能力的改变,见图 23—8(b)。 .2.屏蔽效应 酶经固定化后,由于载体的存在,干扰与影响了酶与底物或其它效应物的结 合,见图 23-8(c) 3.微扰效应 由于载体的疏水、亲水及电荷性质,使得紧邻固定化酶的环境区域通常称为 微环境发生变化而与宏观反应体系不同(见图 23-9),从而使酶的催化能力及酶对 效应物作出调节反应的能力发生改变。 4.分配效应 由于底物和其它各种效应物(包括 H+与 OH- )在微环境与宏观体系间的不等 分布,使得酶反应速度发生变化。 5.扩散效应 扩散效应是指底物·、产物和其它效应物在酶的微环境区与宏观体系之间迁
食品技术原理课程讲稿-第十一章 酶技术 第 9 页 ,共 25 页 是复杂的。这里仅就固定化对酶反应动力学性态(或参数)和实际反应速度的影响 做一粗浅的讨论。 (一)固定化对酶反应动力学参数的影响 1.构象改变 构象改变是指酶在固定化过程中发生了某种扭曲,影响了酶分子的空间结 构,从而导致了酶与底物结合能力或酶催化底物转化能力的改变,见图 23—8(b)。 .2.屏蔽效应 酶经固定化后,由于载体的存在,干扰与影响了酶与底物或其它效应物的结 合,见图 23-8(c) 3.微扰效应 由于载体的疏水、亲水及电荷性质,使得紧邻固定化酶的环境区域通常称为 微环境发生变化而与宏观反应体系不同(见图 23-9),从而使酶的催化能力及酶对 效应物作出调节反应的能力发生改变。 4.分配效应 由于底物和其它各种效应物(包括 H+与 OH- )在微环境与宏观体系间的不等 分布,使得酶反应速度发生变化。 5.扩散效应 扩散效应是指底物·、产物和其它效应物在酶的微环境区与宏观体系之间迁

食品技术原理课程讲稿-第十一章 酶技术 第 10 页 ,共 25 页 移速度的一种限制,它的直接结果也是使上述物质在这些区域分布不等。扩散限 制与底物、产物和其它效应物的分子量大小、载体的结构以及酶反应的性质有关。 上述这些效应通常总是相互交叉、相互关联地存在着,它们综合在一起决定 着固定化酶的动力学性质,见表 23—2。 其中素质动力学参数是指溶液酶或固定化酶本身固有的特征动力学参数。固 定化酶相对溶液酶而言,增加了固定化对酶造成构象改变、屏蔽效应及微扰效应 所产生的影响。在上述基础上,考虑到分配效应及扩散效应的影响,便得到实效 动力学参数,它具有更为普遍和实际的意义,可通过实验加以测定。 (二),固定化对实际反应速度的影响 酶经固定化后,由于上述因素的影响,其实际反应速度 Vp,往往要比理论 上预期的反应速度低,通常用有效系数η来定量表示载体内部反应的有效程 度, s p V V = 。Vp 表示单位体积固定化酶的实际反应速度,Vs 表示当载体内部 浓度等于溶液中浓度时,单位体积固定化酶的理论预期反应速度,通常情况下 0<η≤1。 有效系数η的意义在于它可以作为衡量固定化酶有效作用的尺度。这是由 于: 第一,只要知道溶液中底物浓度[s], 就可通过η来获得固定化酶的实际反应 速度,而无需测定载体内的底物浓度,见方程式(23—11)。 式中 ' Vmax 、 ' K m 为固定化酶的动力学参数, 第二,η还可以反映出分配效应及扩散限制效应对实际反映速度的影响。 η值可以由微分方程推导,也可以通过在同一实验条件下求得的一定直径颗 粒的反应速度与微小颗粒的反应速度之比来计算。 三、工业酶动力学 在工业反应中,平均底物浓度一般不高,采用的是一级或一级与零级混合的 动力学。因此,反应速度直接依赖于占优势的底物浓度,即
食品技术原理课程讲稿-第十一章 酶技术 第 10 页 ,共 25 页 移速度的一种限制,它的直接结果也是使上述物质在这些区域分布不等。扩散限 制与底物、产物和其它效应物的分子量大小、载体的结构以及酶反应的性质有关。 上述这些效应通常总是相互交叉、相互关联地存在着,它们综合在一起决定 着固定化酶的动力学性质,见表 23—2。 其中素质动力学参数是指溶液酶或固定化酶本身固有的特征动力学参数。固 定化酶相对溶液酶而言,增加了固定化对酶造成构象改变、屏蔽效应及微扰效应 所产生的影响。在上述基础上,考虑到分配效应及扩散效应的影响,便得到实效 动力学参数,它具有更为普遍和实际的意义,可通过实验加以测定。 (二),固定化对实际反应速度的影响 酶经固定化后,由于上述因素的影响,其实际反应速度 Vp,往往要比理论 上预期的反应速度低,通常用有效系数η来定量表示载体内部反应的有效程 度, s p V V = 。Vp 表示单位体积固定化酶的实际反应速度,Vs 表示当载体内部 浓度等于溶液中浓度时,单位体积固定化酶的理论预期反应速度,通常情况下 0<η≤1。 有效系数η的意义在于它可以作为衡量固定化酶有效作用的尺度。这是由 于: 第一,只要知道溶液中底物浓度[s], 就可通过η来获得固定化酶的实际反应 速度,而无需测定载体内的底物浓度,见方程式(23—11)。 式中 ' Vmax 、 ' K m 为固定化酶的动力学参数, 第二,η还可以反映出分配效应及扩散限制效应对实际反映速度的影响。 η值可以由微分方程推导,也可以通过在同一实验条件下求得的一定直径颗 粒的反应速度与微小颗粒的反应速度之比来计算。 三、工业酶动力学 在工业反应中,平均底物浓度一般不高,采用的是一级或一级与零级混合的 动力学。因此,反应速度直接依赖于占优势的底物浓度,即