
目录 本章基本要求 §5-1化学反应的吉布斯函数变化 §5-2理想气体反应等温方程及标准平衡常数 §5-3理想气体反应平衡常数与平衡组成 §5-4标准摩尔反应吉布斯函数计算 §5-5温度对标准平衡常数的影响 §5-6压力和反应物组成对平衡的影响 §5-7同时平衡反应 §5-8真实气体反应平衡 §5-9混合物溶液反应平衡 理论与科研结合应用实例 科学家史话 参考书
本章基本要求 §5-1化学反应的吉布斯函数变化 §5-2理想气体反应等温方程及标准平衡常数 §5-3理想气体反应平衡常数与平衡组成 §5-4标准摩尔反应吉布斯函数计算 §5-5温度对标准平衡常数的影响 §5-6压力和反应物组成对平衡的影响 §5-7同时平衡反应 §5-8真实气体反应平衡 §5-9混合物溶液反应平衡 理论与科研结合应用实例 科学家史话 参考书 目 录

本章基本要求 1、了解热力学第三定律,规定熵、标准熵,理解标准摩尔 反应熵定义及计算。 2、理解摩尔反应吉布斯函数、标准摩尔反应吉布斯函数、 物质标准摩尔生成吉布斯函数定义及应用。 3、了解化学反应过程的推动力。 4、掌握标准平衡常数的定义。理解等温方程和范特霍夫方 程的推导及应用。 5、掌握用热力学数据计算平衡常数及平衡组成的方法判断 在一定条件下化学反应可能进行的方向,会分析温度、 压力、组成等因素对平衡的影响。 6、了解真实气体化学平衡及溶液中的化学平衡。 第五章
本章基本要求 1、了解热力学第三定律,规定熵、标准熵,理解标准摩尔 反应熵定义及计算。 2、理解摩尔反应吉布斯函数、标准摩尔反应吉布斯函数、 物质标准摩尔生成吉布斯函数定义及应用。 3、了解化学反应过程的推动力。 4、掌握标准平衡常数的定义。理解等温方程和范特霍夫方 程的推导及应用。 5、掌握用热力学数据计算平衡常数及平衡组成的方法判断 在一定条件下化学反应可能进行的方向,会分析温度、 压力、组成等因素对平衡的影响。 6、了解真实气体化学平衡及溶液中的化学平衡。 第五章

§5-0 引言 用热力学的方法研究化学反应的方向和限度 1、在反应条件下的反应方向和极限产率; 2、改变反应条件如:压力、温度物料配比 等,得到更大的产率; 3、通过理论计算同实际生产对比,估计 提高产率的幅度
§5--0 引言 用热力学的方法研究化学反应的方向和限度 1、在反应条件下的反应方向和极限产率; 2、改变反应条件如:压力、温度物料配比 等,得到更大的产率; 3、通过理论计算同实际生产对比,估计 提高产率的幅度

§5-1化学反应的吉布斯函数变化 反应进度 有反应: aA+bB=cC+dD 0=V1A1+V2A2+.+VA1+.. 0=cC+dD-aA-bB 即 0=∑yBBg nB(5)一nB(5) △h=△n2=.= △n:=号 VB V V2 飞:表示反应进行的程度,称为反应进度
§5-1 化学反应的吉布斯函数变化 反应进度 aA + bB = cC + dD 0=1A1 + 2A2+…. + iAi +…. = = = = − i i B nB nB n n n 2 2 1 ( ) ( ) 1 :表示反应进行的程度,称为反应进度。 有反应: B B B B cC dD aA bB = = + − − 0 0 即

一个mol反应 反应进行到△n恰好为各自的计量系数所示的数 量时,称发生了一个单位反应。 △n=5=1mol dni =d5 Vi dn;=vid 化学反应系统中,当各组分的原始量一定时,反应到任意 瞬间时,各组分的量决定于反应进度ξ
一个mol反应: 反应进行到△ni恰好为各自的计量系数所示的数 量时,称发生了一个单位反应。 mol n i i = =1 d dn i i = 化学反应系统中,当各组分的原始量一定时,反应到任意 瞬间时,各组分的量决定于反应进度。 dni = i d

一、摩尔反应吉布斯函数变 T、p,进行一个微小反应时组成不变引起反应的吉布斯函数变化drG dG=∑4dne B dn;=vid d,G=∑A,dn,=∑l,yd5 定义 --摩尔反应吉布斯函数变
一、摩尔反应吉布斯函数变 T、p,进行一个微小反应时组成不变引起反应的吉布斯函数变化drG B B B dG = dn dni = i d d G dn d B B B B B r = B = 定义 B r m B B T P r G G = = , -------摩尔反应吉布斯函数变

在一定T、p和组成不变的条件下,lmol反应的吉布 斯函数变,即(OG/)p称为摩尔反应吉布斯函数变,用 △rGm表示。 A称为化学亲和势,即 A=-△,Gm= O,G 05 反应推动力。 自发 A=-△,Gm≥0 平衡
T P r r m G A G , = − = − A称为化学亲和势,即 反应推动力。 = − 0 A r Gm 自发 平衡 在一定T、p和组成不变的条件下,1mol反应的吉布 斯函数变,即(G/)T,P称为摩尔反应吉布斯函数变,用 ΔrGm表示
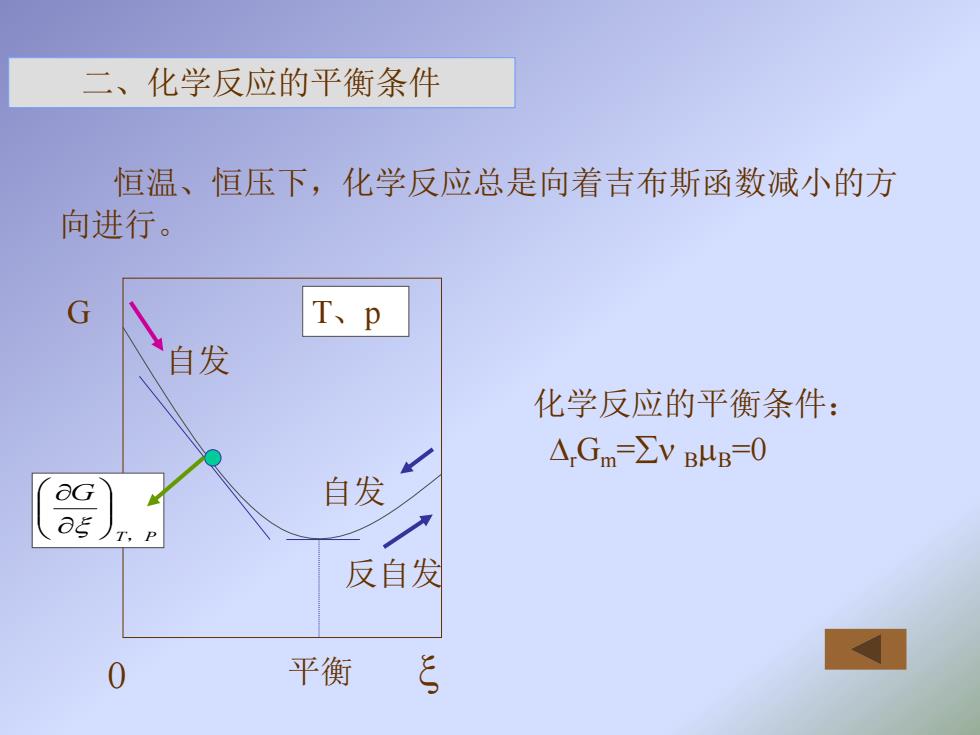
二、化学反应的平衡条件 恒温、恒压下,化学反应总是向着吉布斯函数减小的方 向进行。 G T、p 自发 化学反应的平衡条件: △,Gm=VBB=0 G 自发 1 反自发 0 平衡
化学反应的平衡条件: rGm = BB=0 二、化学反应的平衡条件 恒温、恒压下,化学反应总是向着吉布斯函数减小的方 向进行。 G 0 T P G , T、p 自发 自发 反自发 平衡

理想气体反应的化学平衡
理想气体反应的化学平衡

§5-2等温方程及标准平衡常数 一、理想气体化学反应等温方程 摩尔反应吉布斯函数变:△Gm=∑VB 代入理想气体混合物中组分B的化学势:μgg+RTInp/p° -,+2 令:∑yaH=A,G0 .=A+whn会】
§5-2等温方程及标准平衡常数 一、理想气体化学反应等温方程 代入理想气体混合物中组分 B的化学势:B =B+RTlnpB/p 摩尔反应吉布斯函数变: rGm = BB B B B B B B B B B B B B B B B p p RT p p G RT = + = = + ln ln B p p G G RT B r m r m = + ln r m B B G B 令: =