
目录 §9-1电解池、原电池和法拉第定律 §9-2电解质溶液的导电性质 §9-3电解质溶液的热力学性质 §9-4强电解质离子互吸的Debye--Huckel理论 §9-5可逆电池 §9-6可逆电池的热力学 §9-7电池反应的Nernst方程 §9-8电池电动势 §9-9浓差电池 §9-10液接电位 §9-11不可逆电化学过程 极化作用 理论与科研结合应用实例 科学家史话 参考书
目 录 §9-1 电解池、原电池和法拉第定律 §9-2 电解质溶液的导电性质 §9-3 电解质溶液的热力学性质 §9-4 强电解质离子互吸的Debye-Huckel理论 §9-5 可逆电池 §9-6 可逆电池的热力学 §9-7 电池反应的 Nernst 方程 §9-8 电池电动势 §9-9 浓差电池 §9-10 液接电位 §9-11 不可逆电化学过程——极化作用 理论与科研结合应用实例 科学家史话 参考书

Contents S 9-1 Electrolytic cell Primary cell and Faraday'laws S 9-2 Electrolytesolutions and electrochemistry S 9-3 Electrolyte solutions and thermodynamics S9-4 Debye-Huckel Theory §9-5 Reversible cell S 9-6 Thermodynamics of reversible cell S 9-7 Nernst equation of electric cell reaction S 9-8 Electric cell potentials S 9-9 Concentration cell S 9-10 Liquid junction cell S9-11 Polarization effect
§ 9-1 Electrolytic cell 、 Primary cell and Faraday’ laws § 9-2 Electrolyte solutions and electrochemistry § 9-3 Electrolyte solutions and thermodynamics § 9-4 Debye-Huckel Theory § 9-5 Reversible cell § 9-6 Thermodynamics of reversible cell § 9-7 Nernst equation of electric cell reaction § 9-8 Electric cell potentials § 9-9 Concentration cell § 9-10 Liquid junction cell § 9-11 Polarization effect Contents

本章基本要求 了解表征电解质溶液导电性质的物理量(电导、电导率、摩尔电 导率、电迁移率,迁移数)。 理解离子平均活度及平均活度系数定义并掌握其计算。了解离子 强度的定义。 。 了解德拜一休格尔极限公式计算离子平均活度系数的方法。 理解可逆电池的概念,理解能斯特方程的推导掌握其应用。 掌握电池电动势与热力学函数的关系及其计算。 掌握常用电极符号、电极反应及其电极电势的计算,掌握电池电动 势的计算及其应用。 理解原电池的设计原理。 了解极化作用和超电势的概念
本章基本要求 • 了解表征电解质溶液导电性质的物理量(电导、电导率、摩尔电 导率、电迁移率,迁移数)。 • 理解离子平均活度及平均活度系数定义并掌握其计算。了解离子 强度的定义。 • 了解德拜-休格尔极限公式计算离子平均活度系数的方法。 • 理解可逆电池的概念,理解能斯特方程的推导掌握其应用。 • 掌握电池电动势与热力学函数的关系及其计算。 • 掌握常用电极符号、电极反应及其电极电势的计算,掌握电池电动 势的计算及其应用。 • 理解原电池的设计原理。 • 了解极化作用和超电势的概念

引言 Preview 电化学研究的对象:研究化学能与电能之间的相互转化的规律 化学能→电能 Chemical energy-Electric energy 利用可自发进行的化学反应设计成的电池对外作功称: 原电池(Primary cell) 电能→化学能 Electric energy-Chemical energy 外界对系统作电功使化学反应发生称: 电解池(Electrolytic cell)
引 言 Preview 电化学研究的对象:研究化学能与电能之间的相互转化的规律 化学能→电能 Chemical energy →Electric energy 利用可自发进行的化学反应设计成的电池对外作功称: 原电池(Primary cell) 电能→化学能 Electric energy → Chemical energy 外界对系统作电功使化学反应发生称: 电解池(Electrolytic cell)

本章研究的主要内容 •电解质溶液的导电机理 ·原电池 ·电解池
本章研究的主要内容 • 电解质溶液的导电机理 • 原电池 • 电解池

§9-1电解池、原电池和法拉第定律 Electrolytic cell Primary cell and Faraday'laws 一、导体(conductor)) 能导电的物质称导体 分类: 1、第一类导体:电子导体,靠自由电子运动导电导体本身不发生化学 反应。温度升高导电能力下降。 2、第二类导体:离子导体,靠离子定向移动而导电。在电极和溶液界面 上发生化学反应。温度升高导电能力增加
§9-1电解池、原电池和法拉第定律 Electrolytic cell 、 Primary cell and Faraday’ laws 能导电的物质称导体 分类: 1、第一类导体:电子导体,靠自由电子运动导电导 体本身不发生化学 反应。温度升高导电能力下降。 2、第二类导体:离子导体,靠离子定向移动而导电。在电极和溶液界面 上发生化学反应。温度升高导电能力增加。 一、导体(conductor)
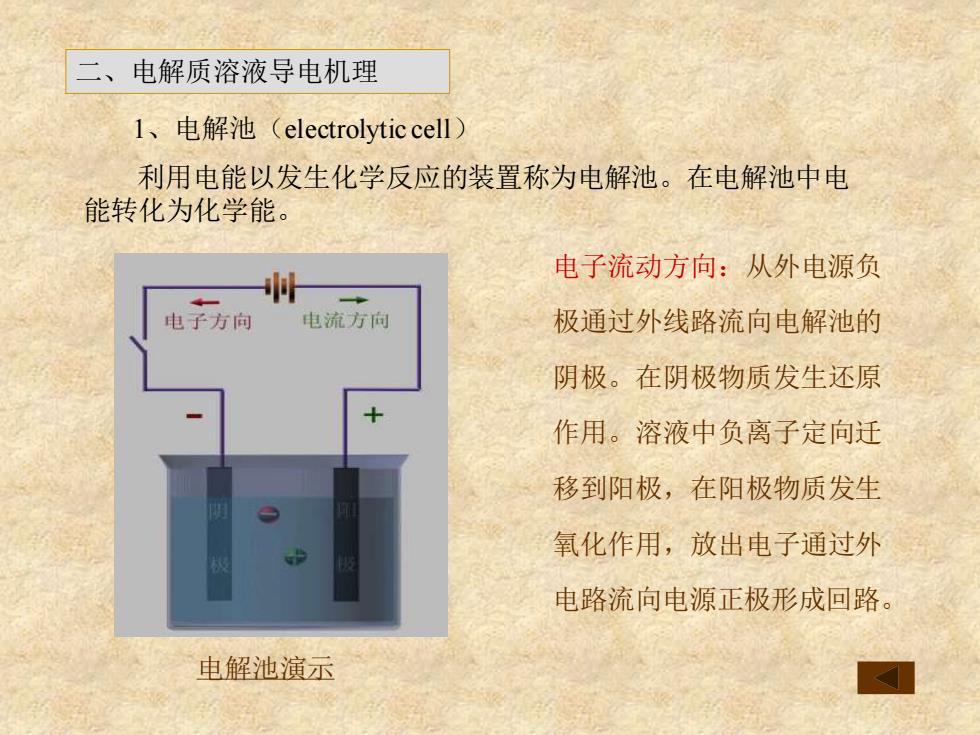
二、电解质溶液导电机理 l、电解池(electrolyticcell) 利用电能以发生化学反应的装置称为电解池。在电解池中电 能转化为化学能。 电子流动方向:从外电源负 电子方向 电流方向 极通过外线路流向电解池的 阴极。在阴极物质发生还原 作用。溶液中负离子定向迁 移到阳极,在阳极物质发生 氧化作用,放出电子通过外 电路流向电源正极形成回路。 电解池演示
1、电解池(electrolytic cell) 电子流动方向:从外电源负 极通过外线路流向电解池的 阴极。在阴极物质发生还原 作用。溶液中负离子定向迁 移到阳极,在阳极物质发生 氧化作用,放出电子通过外 电路流向电源正极形成回路。 利用电能以发生化学反应的装置称为电解池。在电解池中电 能转化为化学能。 二、电解质溶液导电机理 电解池演示

一 电子方向 电流方向 + 电解池
电解池
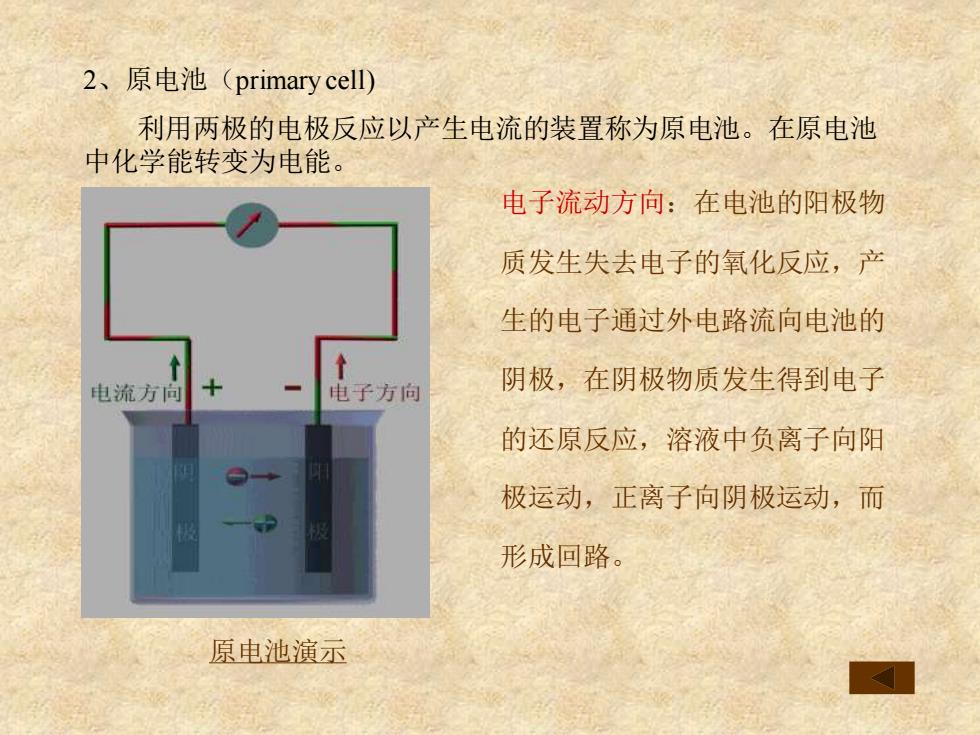
2、原电池(primary cell) 利用两极的电极反应以产生电流的装置称为原电池。在原电池 中化学能转变为电能。 电子流动方向:在电池的阳极物 质发生失去电子的氧化反应,产 生的电子通过外电路流向电池的 电流方向 电子方向 阴极,在阴极物质发生得到电子 的还原反应,溶液中负离子向阳 极运动,正离子向阴极运动,而 形成回路。 原电池演示
2、原电池(primary cell) 利用两极的电极反应以产生电流的装置称为原电池。在原电池 中化学能转变为电能。 电子流动方向:在电池的阳极物 质发生失去电子的氧化反应,产 生的电子通过外电路流向电池的 阴极,在阴极物质发生得到电子 的还原反应,溶液中负离子向阳 极运动,正离子向阴极运动,而 形成回路。 原电池演示

原电池
原电池