
第四章 多组分系统热力学 本章基本要求 §4-1 组成表示法 §4-2 拉乌尔定律 §4-3 亨利定律 §4-4 偏摩尔量 §4-5 化学势 §4-6 理想液态混合物 §4-7 理想稀溶液 §4-8 稀溶液的依数性
第四章 多组分系统热力学 多组分系统热力学 本章基本要求 §4-1 组成表示法 §4-2 拉乌尔定律 §4-3 亨利定律 §4-4 偏摩尔量 §4-5 化学势 §4-6 理想液态混合物 §4-7 理想稀溶液 §4-8 稀溶液的依数性

引言 两种或两种以上物质以任意比例相互混 混合物 合均匀的系统。该均匀系统中各组分选 用相同的标准态加以研究,称混合物。 例如:气态混合物、液态混合物、固态混合物。 两种或两种以上物质均匀混合且呈分子 溶液 分散状态的系统。该系统中的物质选不 同的标准和不同的方法加以研究称溶 液,分为溶剂(A)和溶质(B)。 例如:液态溶液、 固态溶液。或按溶质的导电性可分为: 非电解质溶液和电解质溶液
引言 溶液 两种或两种以上物质均匀混合且呈分子 分散状态的系统。该系统中的物质选不 同的标准和不同的方法加以研究称溶 液,分为溶剂(A)和溶质(B)。 两种或两种以上物质均匀混合且呈分子 分散状态的系统。该系统中的物质选不 同的标准和不同的方法加以研究称溶 液,分为溶剂(A)和溶质(B)。 例如:液态溶液、固态溶液。或按溶质的导电性可分为: 非电解质溶液和电解质溶液。 两种或两种以上物质以任意比例相互混 合均匀的系统。该均匀系统中各组分选 用相同的标准态加以研究,称混合物。 两种或两种以上物质以任意比例相互混 合均匀的系统。该均匀系统中各组分选 用相同的标准态加以研究,称混合物。 例如:气态混合物、液态混合物、固态混合物。 混合物

§4-1组成表示法 一、 物质B的物质量分数(或摩尔分数)X: nB 物质B的物质量 ∑X=1 XB- 混合物(溶液)的物质量 B 二、 物质B的质量分数WB: W mB 物质B的质量 ∑W=1 ,mB W B 混合物(溶液)的质量
§4-1 组成表示法 = ∑ =1 ∑ B B B B B B X n n X = ∑ =1 ∑ B B B B B B W m m W 混合物 溶液 的物质量 物质 的物质量 )( B X B = 混合物 溶液 的质量 物质 的质量 )( B WB = 一、物质 一、物质BB的物质量分数 的物质量分数 ((或摩尔分数 或摩尔分数)X)XBB:: 二、物质 二、物质BB的质量分数 的质量分数WWBB::

三、物质B的浓度C(体积摩尔浓度) nB 溶液中物质B的物质量 mol B 溶液的体积 dm3 CB与X的关系: CB 四、 物质B的质量摩尔浓度b3 Cx+ p- MBCB M A 溶液中物质B的物质量 mol 0 溶剂的质量 kg bg与Xg的关系: bB +bB MA
CB与XB的关系: A BB B B B M CM C C X − + = ρ bB与ΧB的关系: B A B B b M b X + = 1 三、物质B的浓度CB(体积摩尔浓度 ) ⎟⎠⎞ ⎜⎝⎛ == 3 dm B mol Vn C B B 溶液的体积 溶液中物质 的物质量 ⎟⎟⎠⎞ ⎜⎜⎝⎛ = kg B mol bB 溶剂的质量 溶液中物质 的物质量 四、物质B的质量摩尔浓度bB
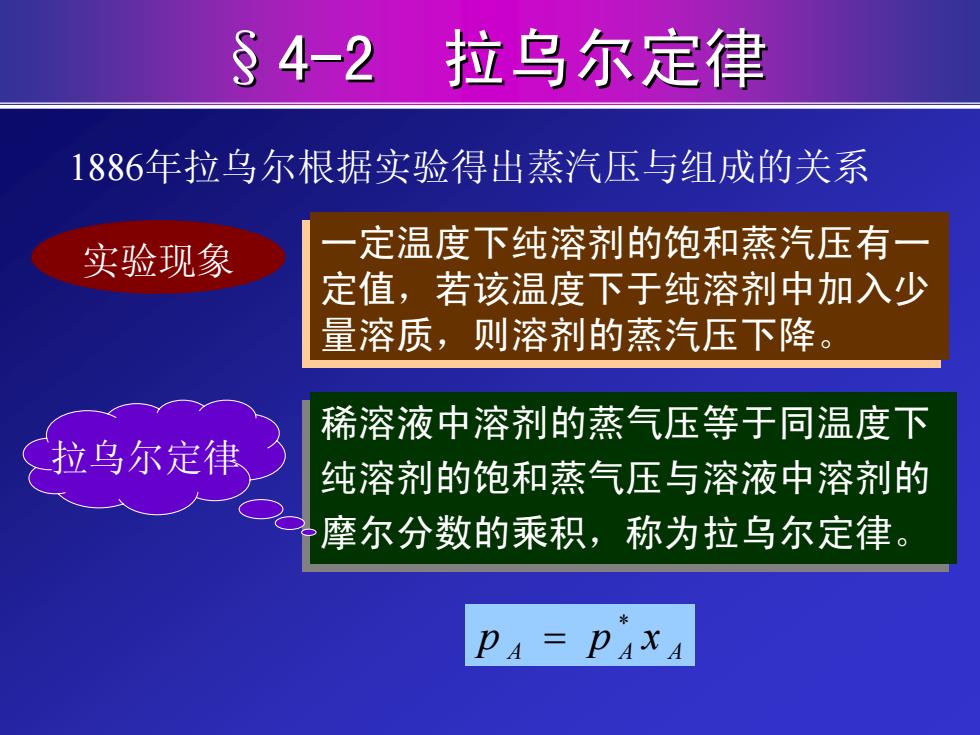
§4-2: 拉乌尔定律 1886年拉乌尔根据实验得出蒸汽压与组成的关系 实验现象 一定温度下纯溶剂的饱和蒸汽压有一 定值,若该温度下于纯溶剂中加入少 量溶质,则溶剂的蒸汽压下降。 稀溶液中溶剂的蒸气压等于同温度下 拉乌尔定律 纯溶剂的饱和蒸气压与溶液中溶剂的 摩尔分数的乘积,称为拉乌尔定律。 PA=PAXA
§4-2 拉乌尔定律 稀溶液中溶剂的蒸气压等于同温度下 纯溶剂的饱和蒸气压与溶液中溶剂的 摩尔分数的乘积,称为拉乌尔定律。 稀溶液中溶剂的蒸气压等于同温度下 纯溶剂的饱和蒸气压与溶液中溶剂的 摩尔分数的乘积,称为拉乌尔定律。 拉乌尔定律 A AA xpp * = 1886年拉乌尔根据实验得出蒸汽压与组成的关系 实验现象 一定温度下纯溶剂的饱和蒸汽压有一 定值,若该温度下于纯溶剂中加入少 量溶质,则溶剂的蒸汽压下降。 一定温度下纯溶剂的饱和蒸汽压有一 定值,若该温度下于纯溶剂中加入少 量溶质,则溶剂的蒸汽压下降

讨论 、 溶质是非挥发性物质,pA为溶液的蒸汽压; 2、溶质是挥发性物质,p为溶剂在气相中的分 压; 3、 溶质的摩尔分数xB(1-XA(PA*-PA)PA: 4、YA-PA/p=pAXA/P; 5、 拉乌尔定律的微观解释 A B 稀溶液:FA-FA≠FB-FB≠FA-FB 理想液态混合物:FA-FA-FB-FB-FA-FB
讨论讨论 1、溶质是非挥发性物质,pA为溶液的蒸汽压; 2、溶质是挥发性物质,pA为溶剂在气相中的分 压; 3、溶质的摩尔分数xB=(1 - xA)=(pA*-pA)/pA*; 4、yA=pA/p= pA*·xA/p; 5、拉乌尔定律的微观解释: A B 稀溶液: FA-FA≠FB-FB ≠FA-FB 理想液态混合物:FA-FA=FB-FB=FA-FB

§4-3亨利定律 1803年亨利根据实验得出溶质的蒸汽压与组成的关系: 实验现象 定温度下,气体在溶液中的溶解 度与气体的平衡压力成正比。溶液 中的挥发性溶质也同样适用。 亨利定律 在一定温度和平衡态下稀溶液中挥 发性溶质(B)在气相中的分压P)与 其在溶液中摩尔分数(X)成正比, 称为亨利定律。 PB-kx.B'XB kx,B单位:Pa
§4-3 亨利定律 亨利定律 在一定温度和平衡态下稀溶液中挥 发性溶质(B)在气相中的分压(PB)与 其在溶液中摩尔分数(ΧB)成正比, 称为亨利定律。 pB=kx,B·xB kx,B单位:Pa 实验现象 1803年亨利根据实验得出溶质的蒸汽压与组成的关系: 一定温度下,气体在溶液中的溶解 度与气体的平衡压力成正比。溶液 中的挥发性溶质也同样适用

讨论 1、 kB称为亨利常数,kxBT、溶剂、溶质)) 2、微观解释: ①FA-FA≠FBFB≠FA-F:kB≠PB* ②FAFA-FB-FB-FA-FB::kB=PB*(符合拉乌尔定律) 3、 拉鸟尔定律与亨利定律的关系:kA 稀溶液:溶剂--拉乌尔定律 x,B 溶质--亨利定律 理想液态混合物: PB 全部浓度--拉乌尔定律 4、亨利定律的其它表示 PB-kc,B'CB2 PB-kb.B'bB XB
1 、 kx,B称为亨利常数, kx,B=f(T、溶剂、溶质 ) 2、微观解释: ① F A-F A ≠ F B-FB ≠ F A-F : kx,B ≠ p B * ② F A-F A=F B-F B=F A-F B:kx,B = p B* (符合拉乌尔定律 ) 3、拉乌尔定律与亨利定律的关系: 稀溶液:溶剂----拉乌尔定律 溶质----亨利定律 理想液态混合物: 全部浓度----拉乌尔定律 4、亨利定律的其它表示 p B=k C,B·C B, p B=kb,B·b B 1 、 kx,B称为亨利常数, kx,B=f(T、溶剂、溶质 ) 2、微观解释: ① F A-F A ≠ F B-FB ≠ F A-F : kx,B ≠ p B * ② F A-F A=F B-F B=F A-F B:kx,B = p B* (符合拉乌尔定律 ) 3、拉乌尔定律与亨利定律的关系: 稀溶液:溶剂----拉乌尔定律 溶质----亨利定律 理想液态混合物: 全部浓度----拉乌尔定律 4、亨利定律的其它表示 p B=k C,B·C B, p B=kb,B·b B 讨论讨论 A B x B p B * kx,B p A * kx,A

5、 几点说明: ①同一种溶剂中,溶有几种气体时,形成的稀溶液 中,每一种气体分别适用于亨利定律。 ②亨利定律的几种不同表示中,亨利常数k的值 不同,单位也不同。 ③亨利常数k与溶剂、溶质的性质以及温度有关。 ④应用拉乌尔定律、亨利定律时,物质在气、液两 相的分子必须相同。 例如:C0溶于H0中,使用亨利定律计算C0,分 压时,溶质中不包括HC03
5、几点说明: ① 同一种溶剂中,溶有几种气体时,形成的稀溶液 中,每一种气体分别适用于亨利定律。 ② 亨利定律的几种不同表示中,亨利常数 k 的值 不同,单位也不同。 ③ 亨利常数 k 与溶剂、溶质的性质以及温度有关。 ④ 应用拉乌尔定律、亨利定律时,物质在气、液两 相的分子必须相同。 例如:CO 2溶于H 2O 中,使用亨利定律计算CO 2 分 压时,溶质中不包括H 2CO3。 5、几点说明: ① 同一种溶剂中,溶有几种气体时,形成的稀溶液 中,每一种气体分别适用于亨利定律。 ② 亨利定律的几种不同表示中,亨利常数 k 的值 不同,单位也不同。 ③ 亨利常数 k 与溶剂、溶质的性质以及温度有关。 ④ 应用拉乌尔定律、亨利定律时,物质在气、液两 相的分子必须相同。 例如:CO 2溶于H 2O 中,使用亨利定律计算CO 2 分 压时,溶质中不包括H 2CO3

§4-4偏摩尔量 实验 B V=ns+n' m.c 理想液态混合物 实验二 B 实例 V≠nmg+n.c 真实液态混合物 水和乙醇的摩尔体积分别为:18.09cm3/mol,58.37cm3/mol。 各取0.5mol,则V=37.20cm3≠38.22cm3。 V=ngVe +n.ve
§4-4 偏摩尔量 实验一 * , * , += VnVnV cmcBmB 实验二 + = B C * , * , +≠ VnVnV cmcBmB + ≠ B C 水和乙醇的摩尔体积分别为:18.09cm3/mol,58.37cm3/mol。 各取0.5mol,则V=37.20cm3 ≠38.22cm3 。 实例 += VnVnV ccBB 理想液态混合物 真实液态混合物