
第12卷第4期 大些化号 1997年8月 预测溶剂影响Sv1与S2 反应速率的ughes-Ingold规则 周连斌 (新疆医学院药学系乌鲁木齐830054) 摘要理论上,在溶液中进行的均相化学反应的反应速率由活化能及溶剂化作用所决定,但 实际上活化能很难测定.Hughes Ingold规侧可预测不同荷电类型的反应物按S1或S2机理反应 时溶剂极性对其反应速率的影响。分析了电荷数与溶剂化及活化能的关系,列出了该规则所适用 的反应类别,并有实例说明。 一、反应速率与活化能 在溶液中进行的饱和碳原子上的亲核取代反应,其溶剂的性质不仅影响着反应速率,甚至 影响着反应历程。如苄氯的碱性水解按S1历程进行,而在丙酮中则按S2历程进行山: ,(m+)g Sxl IGhcGo.”+ao.r.OoctctoH+ato: OH'CHCH:CI H G CHCOCH HOCHCo Hs+C C.H 这两个反应过程中,有溶剂化作用也有过渡状态形成。通常在解释溶剂对反应速率的影 响时,理论的切入点也正是过渡状态理论和溶剂化效应。代表性的定性描述是:对于一个 涉及反应速度的问题,常要考虑反应的活化能,这就涉及到反应的基态及过渡态。因此就要考 虑通过溶剂化作用后究竞是稳定了反应物还是稳定了过渡态。如果溶剂化作用更多地稳定了 反应物,使反应物基态能量下降更多,活化能就会升高,反应速率就会减慢:如果溶剂化作用更 多地稳定了过渡态,使过渡态能量下降较多,这样活化能就下降,反应速度常数就会增大。 如果活化能能够计算,就可通过计算得知反应的速度,但在目前甚至粗略地计算活化能也 还不可能,己知的少数反应的活化能还是从反应速率的实验值推算求得)。这就限制了实际 应用。另外,则是试图建立反应速率常数(即K)或活化能(即△G力同各种溶剂常数(如介 电常数ε,偶极矩4,折光率n,溶解性参数6等)之间的理论关系,即 KR或△G≠=f(e、μ、n、6…) 但这种包含有多元因素的关系式,很难确立某种实验模式,实际也很难计算。 二、HughesIngold规则与适用的反应类别 溶剂的改变能够相应地改变均相化学反应的速率和反应级数,阐述这一问题常用过渡状 28 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved.http:/Aww cnki ne
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 第 12 卷 第 4 期 1997 年 8 月 预测溶剂影响 SN1 与 SN2 反应速率的 Hughes2Ingold 规则 周 连 斌 (新疆医学院药学系 乌鲁木齐 830054) 摘要 理论上 ,在溶液中进行的均相化学反应的反应速率由活化能及溶剂化作用所决定 ,但 实际上活化能很难测定。Hughes2Ingold 规则可预测不同荷电类型的反应物按 SN1 或 SN2 机理反应 时溶剂极性对其反应速率的影响。分析了电荷数与溶剂化及活化能的关系 ,列出了该规则所适用 的反应类别 ,并有实例说明。 一、 反应速率与活化能 在溶液中进行的饱和碳原子上的亲核取代反应 ,其溶剂的性质不仅影响着反应速率 ,甚至 影响着反应历程。如苄氯的碱性水解按 SN1 历程进行 ,而在丙酮中则按 SN2 历程进行[1 ] : OH - + C6 H5CH2Cl (m + n) H2O SN1 [C6 H5CH2 (H2O) m ] + + [Cl(H2O) n ] - OH - - m H2O C6 H5CH2OH + Cl(H2O) - n CH3COCH3 SN2 HO C δ- C6 H5 Cl δ- P , H H HOCH2C6 H5 + Cl s G - 这两个反应过程中 ,有溶剂化作用也有过渡状态形成。通常在解释溶剂对反应速率的影 响时 ,理论的切入点也正是过渡状态理论和溶剂化效应。代表性的定性描述是[2 ] :对于一个 涉及反应速度的问题 ,常要考虑反应的活化能 ,这就涉及到反应的基态及过渡态。因此就要考 虑通过溶剂化作用后究竟是稳定了反应物还是稳定了过渡态。如果溶剂化作用更多地稳定了 反应物 ,使反应物基态能量下降更多 ,活化能就会升高 ,反应速率就会减慢 ;如果溶剂化作用更 多地稳定了过渡态 ,使过渡态能量下降较多 ,这样活化能就下降 ,反应速度常数就会增大。 如果活化能能够计算 ,就可通过计算得知反应的速度 ,但在目前甚至粗略地计算活化能也 还不可能 ,已知的少数反应的活化能还是从反应速率的实验值推算求得[3 ] 。这就限制了实际 应用。另外 ,则是试图建立反应速率常数 (即 KR) 或活化能 (即ΔG ≠) 同各种溶剂常数 (如介 电常数ε,偶极矩μ,折光率η,溶解性参数δ等) 之间的理论关系 ,即 : KR 或ΔG ≠ = f (ε、μ、η、δ…) 但这种包含有多元因素的关系式 ,很难确立某种实验模式 ,实际也很难计算。 二、 Hughes2Ingold 规则与适用的反应类别 溶剂的改变能够相应地改变均相化学反应的速率和反应级数 ,阐述这一问题常用过渡状 28
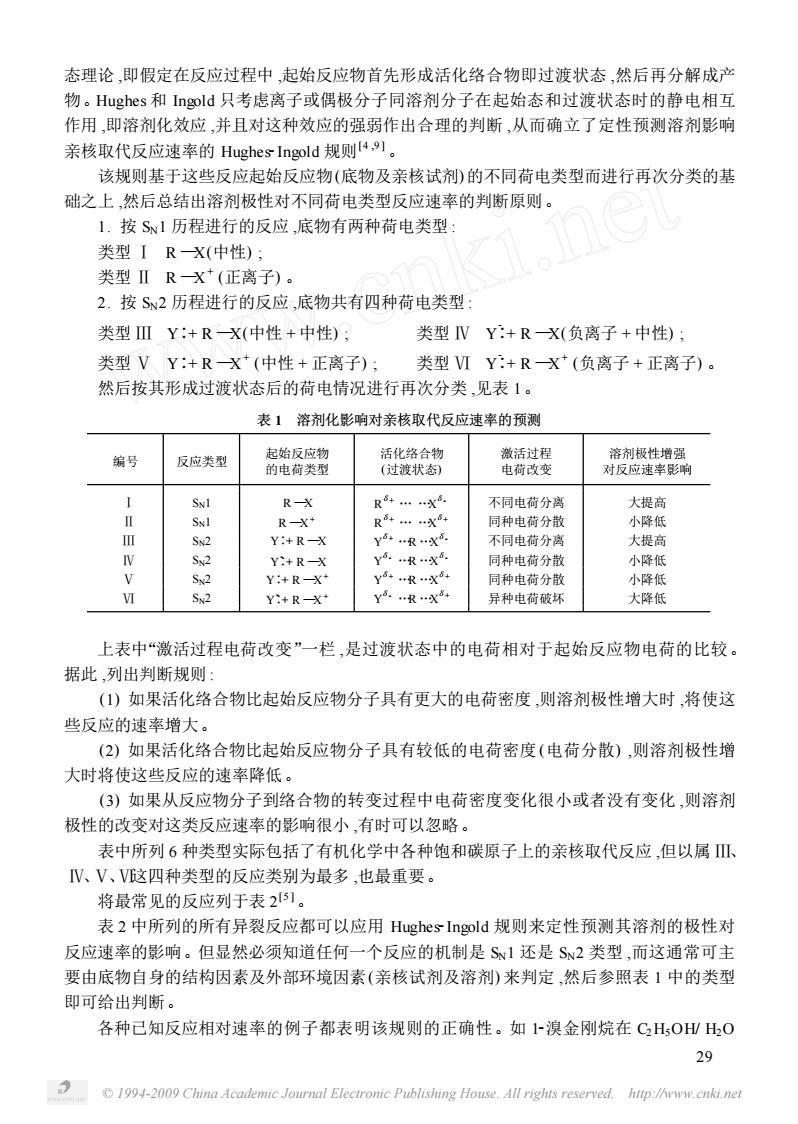
态理论,即假定在反应过程中,起始反应物首先形成活化络合物即过渡状态,然后再分解成产 物。Hughes和Ingold只考虑离子或偶极分子同溶剂分子在起始态和过渡状态时的静电相互 作用,即溶剂化效应,并且对这种效应的强弱作出合理的判断,从而确立了定性预测溶剂影响 亲核取代反应速率的Hughes Ingold规则4,。 该规则基于这些反应起始反应物(底物及亲核试剂)的不同荷电类型而进行再次分类的基 础之上,然后总结出溶剂极性对不同荷电类型反应速率的判断原则。 1.按S1历程进行的反应,底物有两种荷电类型 类型IRX(中性): 类型ⅡRX(正离子) 2.按S2历程进行的反应,底物共有四种荷电类型: 类型ⅢY:+R一X(中性+中性): 类型NY:+RX(负离子+中性): 类型VY:+RX(中性+正离子) 类型ⅥY:+RX*(负离子+正离子)。 然后按其形成过渡状态后的荷电情况进行再次分类,见表1。 表】溶剂化影响对亲核取代反应速率的预测 编号 反应类型 的电爽避 R- R……X 不同电荷分离 大提高 R-X+ R……X 同种电荷分散 小降低 Y:+R-X Y…R…X 不同电荷分义 大提高 Y:+R-X 同种电荷分剂 小降低 Y:+R-X y+x 同种电荷分者 小降低 M Y:+R- 异种电荷破坏 大降低 上表中“激活过程电荷改变”一栏,是过渡状态中的电荷相对于起始反应物电荷的比较 据此,列出判断规则: ()如果活化络合物比起始反应物分子具有更大的电荷密度,则溶剂极性增大时,将使这 些反应的速率增大。 (2)如果活化络合物比起始反应物分子具有较低的电荷密度(电荷分散),则溶剂极性增 大时将使这些反应的速率降低。 (3)如果从反应物分子到络合物的转变过程中电荷密度变化很小或者没有变化,则溶剂 极性的改变对这类反应速率的影响很小,有时可以忽略。 表中所列6种类型实际包括了有机化学中各种饱和碳原子上的亲核取代反应,但以属Ⅲ、 V、V、V这四种类型的反应类别为最多,也最重要。 将最常见的反应列于表251。 表2中所列的所有异裂反应都可以应用Hughes-Ingold规则来定性预测其溶剂的极性对 反应速率的影响。但显然必须知道任何一个反应的机制是S1还是S2类型,而这通常可主 要由底物自身的结构因素及外部环境因素(亲核试剂及溶剂)来判定,然后参照表1中的类型 即可给出判断。 各种己知反应相对速率的例子都表明该规则的正确性。如~溴金刚烷在CH,O山H,O 29 194-009 China Academic Journal Electronic Publishing House.All rights reserved.hup://ww
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 态理论 ,即假定在反应过程中 ,起始反应物首先形成活化络合物即过渡状态 ,然后再分解成产 物。Hughes 和 Ingold 只考虑离子或偶极分子同溶剂分子在起始态和过渡状态时的静电相互 作用 ,即溶剂化效应 ,并且对这种效应的强弱作出合理的判断 ,从而确立了定性预测溶剂影响 亲核取代反应速率的 Hughes2Ingold 规则[4 ,9 ] 。 该规则基于这些反应起始反应物(底物及亲核试剂) 的不同荷电类型而进行再次分类的基 础之上 ,然后总结出溶剂极性对不同荷电类型反应速率的判断原则。 1. 按 SN1 历程进行的反应 ,底物有两种荷电类型 : 类型 Ⅰ R —X(中性) ; 类型 Ⅱ R —X + (正离子) 。 2. 按 SN2 历程进行的反应 ,底物共有四种荷电类型 : 类型 Ⅲ Y∶+ R —X(中性 + 中性) ; 类型 Ⅳ Y -∶+ R —X(负离子 + 中性) ; 类型 Ⅴ Y∶+ R —X + (中性 + 正离子) ; 类型 Ⅵ Y -∶+ R —X + (负离子 + 正离子) 。 然后按其形成过渡状态后的荷电情况进行再次分类 ,见表 1。 表 1 溶剂化影响对亲核取代反应速率的预测 编号 反应类型 起始反应物 的电荷类型 活化络合物 (过渡状态) 激活过程 电荷改变 溶剂极性增强 对反应速率影响 Ⅰ SN1 R —X R δ+ … …X δ- 不同电荷分离 大提高 Ⅱ SN1 R —X + R δ+ … …X δ+ 同种电荷分散 小降低 Ⅲ SN2 Y∶+ R —X Y δ+ …R …X δ- 不同电荷分离 大提高 Ⅳ SN2 Y -∶+ R —X Y δ- …R …X δ- 同种电荷分散 小降低 Ⅴ SN2 Y∶+ R —X + Y δ+ …R …X δ+ 同种电荷分散 小降低 Ⅵ SN2 Y -∶+ R —X + Y δ- …R …X δ+ 异种电荷破坏 大降低 上表中“激活过程电荷改变”一栏 ,是过渡状态中的电荷相对于起始反应物电荷的比较。 据此 ,列出判断规则 : (1) 如果活化络合物比起始反应物分子具有更大的电荷密度 ,则溶剂极性增大时 ,将使这 些反应的速率增大。 (2) 如果活化络合物比起始反应物分子具有较低的电荷密度 (电荷分散) ,则溶剂极性增 大时将使这些反应的速率降低。 (3) 如果从反应物分子到络合物的转变过程中电荷密度变化很小或者没有变化 ,则溶剂 极性的改变对这类反应速率的影响很小 ,有时可以忽略。 表中所列 6 种类型实际包括了有机化学中各种饱和碳原子上的亲核取代反应 ,但以属 Ⅲ、 Ⅳ、Ⅴ、Ⅵ这四种类型的反应类别为最多 ,也最重要。 将最常见的反应列于表 2 [5 ] 。 表 2 中所列的所有异裂反应都可以应用 Hughes2Ingold 规则来定性预测其溶剂的极性对 反应速率的影响。但显然必须知道任何一个反应的机制是 SN1 还是 SN2 类型 ,而这通常可主 要由底物自身的结构因素及外部环境因素(亲核试剂及溶剂) 来判定 ,然后参照表 1 中的类型 即可给出判断。 各种已知反应相对速率的例子都表明该规则的正确性。如 12溴金刚烷在 C2H5OH/ H2O 29
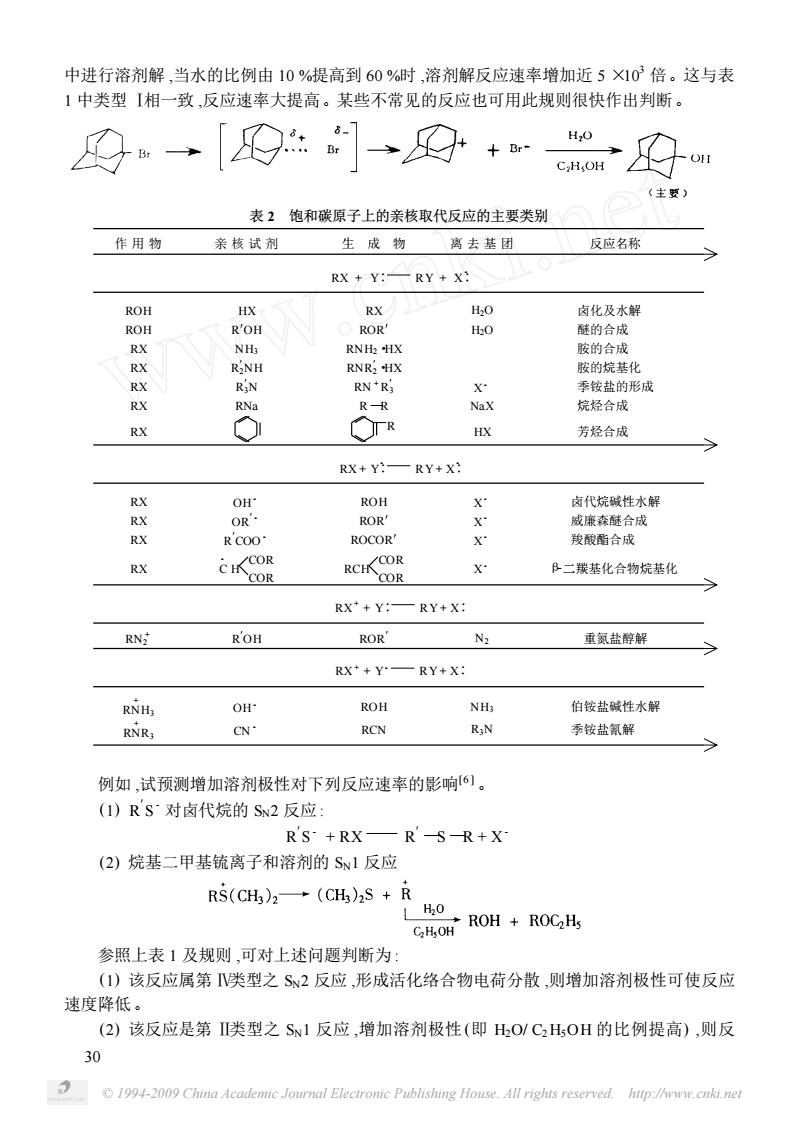
中进行溶剂解,当水的比例由10%提高到60%时,溶剂解反应速率增加近5X103倍。这与表 1中类型【相一致,反应速率大提高。某些不常见的反应也可用此规则很快作出判断。 安→9]→四+ (主题) 表2饱和碳原子上的亲核取代反应的主要类别 作用物 亲核试剂 生成物 离去基团 反应名称 RX+Y:一RY+X: ROH 卤化及水翻 ROH 的合成 RNH -HX 防的合成 RNR;Hx 密的控其化 季铵盐的形成 RX R-R Nax 烷烃合成 RX TR 芳烃合成 RX+Y:—RY+X: RX ROH 卤代烷碱性水解 ROR 成塞态酷合成 RX ROCOR 羧酸酯合成 RCH COR B一撰基化合物烷基化 RX*+Y: RY+X: RN ROR' N 重氨盐醇解 RX++Y—RY+X: RNH: OH ROH NH 伯铵盐碱性水解 RNR, C RCN RiN 季铵盐氰解 例如,试预测增加溶剂极性对下列反应速率的影响6)。 (1)RS对卤代烷的S2反应 RS+RX—RSR+X (2)烷基二甲基锍离子和溶剂的S1反应 RS(CH)2→(CH)2S+R GOH ROH +ROCHs H20 参照上表1及规则,可对上述问题判断为: (1)该反应属第类型之S2反应,形成活化络合物电荷分散,则增加溶剂极性可使反应 速度降低。 (2)该反应是第Ⅱ类型之S1反应,增加溶剂极性(即HO/C2HOH的比例提高),则反 30 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved.http:/Aww cnki ne
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 中进行溶剂解 ,当水的比例由 10 %提高到 60 %时 ,溶剂解反应速率增加近 5 ×10 3 倍。这与表 1 中类型 Ⅰ相一致 ,反应速率大提高。某些不常见的反应也可用此规则很快作出判断。 表 2 饱和碳原子上的亲核取代反应的主要类别 作 用 物 亲 核 试 剂 生 成 物 离 去 基 团 反应名称 RX + Y∶ RY + X -∶ ROH HX RX H2O 卤化及水解 ROH R′OH ROR′ H2O 醚的合成 RX NH3 RNH2·HX 胺的合成 RX R ′ 2NH RNR ′ 2·HX 胺的烷基化 RX R ′ 3N RN + R ′ 3 X - 季铵盐的形成 RX RNa R —R NaX 烷烃合成 RX R HX 芳烃合成 RX + Y -∶ RY + X -∶ RX OH - ROH X - 卤代烷碱性水解 RX OR ′- ROR′ X - 威廉森醚合成 RX R ′COO - ROCOR′ X - 羧酸酯合成 RX C - H COR COR RCH COR COR X - β2二羰基化合物烷基化 RX + + Y∶ RY + X∶ RN + 2 R ′OH ROR ′ N2 重氮盐醇解 RX + + Y - RY + X∶ RN + H3 OH - ROH NH3 伯铵盐碱性水解 RN + R3 CN - RCN R3N 季铵盐氰解 例如 ,试预测增加溶剂极性对下列反应速率的影响[6 ] 。 (1) R ′S - 对卤代烷的 SN2 反应 : R ′S - + RX R ′—S —R + X - (2) 烷基二甲基锍离子和溶剂的 SN1 反应 参照上表 1 及规则 ,可对上述问题判断为 : (1) 该反应属第 Ⅳ类型之 SN2 反应 ,形成活化络合物电荷分散 ,则增加溶剂极性可使反应 速度降低。 (2) 该反应是第 Ⅱ类型之 SN1 反应 ,增加溶剂极性 (即 H2O/ C2H5OH 的比例提高) ,则反 30
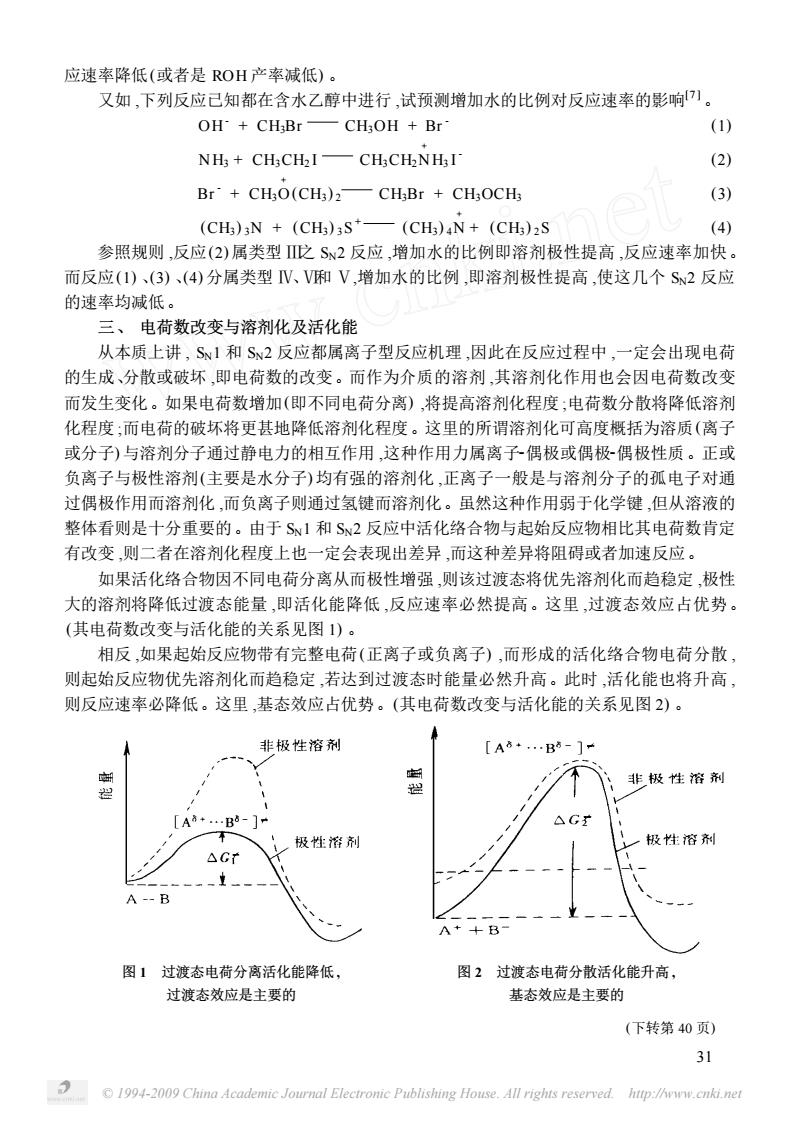
应速率降低(或者是ROH产率减低)。 又如,下列反应已知都在含水乙醇中进行,试预测增加水的比例对反应速率的影响]。 OH+CHBr—CH,OH+Br (1) NH+CHCH2I—CHCH2NHI (2) Br+CH;O(CH3)2-CH;Br CH:OCH; (3) (CH)N (CH)3S*-(CH)aN+(CHs)2S 多 参照规则,反应(2)属类型戊S2反应,增加水的比例即溶剂极性提高,反应速率加快。 而反应(I)、(3)、(4)分属类型V、V和V,增加水的比例,即溶剂极性提高,使这几个S2反应 的速率均减低。 三、电荷数改变与溶剂化及活化能 从本质上讲,S1和S2反应都属离子型反应机理,因此在反应过程中,一定会出现电荷 的生成、分散或破坏,即电荷数的改变。而作为介质的溶剂,其溶剂化作用也会因电荷数改变 而发生变化。如果电荷数增加(即不同电荷分离),将提高溶剂化程度;电荷数分散将降低溶剂 化程度:而电荷的破坏将更甚地降低溶剂化程度。这里的所谓溶剂化可高度概括为溶质(离子 或分子)与溶剂分子通过静电力的相互作用,这种作用力属离子偶极或偶极偶极性质。正或 负离子与极性溶剂(主要是水分子)均有强的溶剂化,正离子一般是与溶剂分子的孤电子对通 过偶极作用而溶剂化,而负离子则通过氢键而溶剂化。虽然这种作用弱于化学键,但从溶液的 整体看则是十分重要的。由于S1和S2反应中活化络合物与起始反应物相比其电荷数肯定 有改变则二者在溶剂化程度上也一定会表现出差异,而这种差异将阻碍或者加速反应。 如果活化络合物因不同电荷分离从而极性增强,则该过渡态将优先溶剂化而趋稳定,极性 大的溶剂将降低过渡态能量,即活化能降低,反应速率必然提高。这里,过渡态效应占优势 (其电荷数改变与活化能的关系见图1)。 相反,如果起始反应物带有完整电荷(正离子或负离子),而形成的活化络合物电荷分散, 则起始反应物优先溶剂化而趋稳定,若达到过渡态时能量必然升高。此时,活化能也将升高 则反应速率必降低。这里,基态效应占优势。(其电荷数改变与活化能的关系见图2)。 非极性溶剂 [A8…B-1- 非极性溶剂 [A8+…B5-]- △G ,极性溶剂 极性溶剂 △Gr 图1过渡态电荷分离活化能降低, 图2过波态电荷分散活化能升高, 过渡态效应是主要的 基态效应是主要的 (下转第40页) 31 94-2009 China Academic Journal Electronie Publishing House.All righis reserved.htp://ww.cnki.ne
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 应速率降低(或者是 ROH 产率减低) 。 又如 ,下列反应已知都在含水乙醇中进行 ,试预测增加水的比例对反应速率的影响[7 ] 。 OH - + CH3Br CH3OH + Br - (1) NH3 + CH3CH2 I CH3CH2N + H3 I - (2) Br - + CH3O + (CH3 ) 2 CH3Br + CH3OCH3 (3) (CH3 ) 3N + (CH3 ) 3S + (CH3 ) 4N + + (CH3 ) 2S (4) 参照规则 ,反应(2) 属类型 Ⅲ之 SN2 反应 ,增加水的比例即溶剂极性提高 ,反应速率加快。 而反应(1) 、(3) 、(4) 分属类型 Ⅳ、Ⅵ和 Ⅴ,增加水的比例 ,即溶剂极性提高 ,使这几个 SN2 反应 的速率均减低。 三、 电荷数改变与溶剂化及活化能 从本质上讲 , SN1 和 SN2 反应都属离子型反应机理 ,因此在反应过程中 ,一定会出现电荷 的生成、分散或破坏 ,即电荷数的改变。而作为介质的溶剂 ,其溶剂化作用也会因电荷数改变 而发生变化。如果电荷数增加(即不同电荷分离) ,将提高溶剂化程度 ;电荷数分散将降低溶剂 化程度 ;而电荷的破坏将更甚地降低溶剂化程度。这里的所谓溶剂化可高度概括为溶质(离子 或分子) 与溶剂分子通过静电力的相互作用 ,这种作用力属离子2偶极或偶极2偶极性质。正或 负离子与极性溶剂(主要是水分子) 均有强的溶剂化 ,正离子一般是与溶剂分子的孤电子对通 过偶极作用而溶剂化 ,而负离子则通过氢键而溶剂化。虽然这种作用弱于化学键 ,但从溶液的 整体看则是十分重要的。由于 SN1 和 SN2 反应中活化络合物与起始反应物相比其电荷数肯定 有改变 ,则二者在溶剂化程度上也一定会表现出差异 ,而这种差异将阻碍或者加速反应。 如果活化络合物因不同电荷分离从而极性增强 ,则该过渡态将优先溶剂化而趋稳定 ,极性 大的溶剂将降低过渡态能量 ,即活化能降低 ,反应速率必然提高。这里 ,过渡态效应占优势。 (其电荷数改变与活化能的关系见图 1) 。 相反 ,如果起始反应物带有完整电荷(正离子或负离子) ,而形成的活化络合物电荷分散 , 则起始反应物优先溶剂化而趋稳定 ,若达到过渡态时能量必然升高。此时 ,活化能也将升高 , 则反应速率必降低。这里 ,基态效应占优势。(其电荷数改变与活化能的关系见图 2) 。 图 1 过渡态电荷分离活化能降低 , 过渡态效应是主要的 图 2 过渡态电荷分散活化能升高 , 基态效应是主要的 (下转第 40 页) 31

5.方法的检出限 空白溶液(纯溶剂)无法测量。用c(CoHs)=2.00mmo/L的稀萘苯溶液,以1.5 K/min 的降温速率,量取△Ts。测定10次,平均偏差()的三倍作为检出限:1.26mmo/L。 6.本方法的特点 差热分析1是将试样和参比物在相同条件下加热或冷却,记录不同温度(T)下的温差 (△T),即△T~T曲线。试样相变时出现峰,根据峰高或面积来计算。也有使用纯溶剂作参 比物4。这类分析方法所用参比物在加热或冷却过程中无相变。 本方法中,试样(溶液)和参比物(纯溶剂)在冷却过程中存在相变,可以直接得到两者的相 变温差:即凝固点下降值。其次,本方法通过双差示温差△T的变化指示试样相变的开始。 由于溶液在凝固过程中浓度渐渐变大,导致△Ts也逐渐变大,因此通过△T指示溶液何 时开始凝固有着特殊的意义。本方法在实际应用时可将△T和△T通过电表或数显管直接 读出操作简单方便。 参考文献 1 Findlay A.Practical Physical Chemistry(th Edn.)Longmans.195: 2陈绩光,钟永生.中国专利93203592.CN214860493.12.18, 3 Vold MJ.Anal.Chem.,1949:21(6):683 4 Borchardt HJ,Daniels F.J.4mer.Chem.Soc.,1957:79(1):41 (上接第31页) 历史上,C.K.Ingold等首先提出Sx1和Sw2的概念并给出了其历程的一般表示式s),而 其提出的预测溶剂影响反应速率的定性规则,虽以电荷数改变作为判断依据,但实质上仍与活 化能及溶剂化效应的理论相关联,既简明实用且适用于已知机理的所有饱和碳原子上的亲核 取代反应。因此该规则可与S1和S2机理在基础有机化学有关章节联袂应用。 现代科学的特点之一是运用概念发现逻辑再发现新的概念,再把新概念构成新的科学理 论。Hughes Ingold规则的提出便是一个佐证。 参考文献 1王积涛.高等有机化学.人民教育出版社,1980:112 廖清江主编.有机化学(第三版).人民卫生出版社,1994:195 3邢其毅主编,基础有机化学示范教学。北京大学出版社,1983:127 4陈光旭主编。有机化学专题选(一).北京师范大学出版社,1987:187,191 5李正化主编,有机药物合成原理,人民卫生出版社。1985:350 6廖清江主编。有机化学(第三版.人民卫生出版社,194:199 7王常有编,有机化学习题集,北京工业出版社,1987:184 8 HarrisJ M.Fundamentals of Organic Reaction Mechanisms.New York:John Wiley&Sons Ine. 9 C.Reichardf.Solventsand Solvent Bfects in Organic Chemistry.VCH Press,1988 40 994-2009 China Academic Journal Electronic Publishing House.All rights reserved.hup:/ww.cnkne
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 5. 方法的检出限 空白溶液(纯溶剂) 无法测量。用 c (C10 H8 ) = 2100 mmol/ L 的稀萘苯溶液 ,以 115 K/ min 的降温速率 ,量取ΔT ′ RS。测定 10 次 ,平均偏差(σ) 的三倍作为检出限 : 1126 mmol/ L 。 6. 本方法的特点 差热分析[3 ]是将试样和参比物在相同条件下加热或冷却 ,记录不同温度 ( T) 下的温差 (ΔT) ,即ΔT~ T曲线。试样相变时出现峰 ,根据峰高或面积来计算。也有使用纯溶剂作参 比物[4 ] 。这类分析方法所用参比物在加热或冷却过程中无相变。 本方法中 ,试样(溶液) 和参比物(纯溶剂) 在冷却过程中存在相变 ,可以直接得到两者的相 变温差 :即凝固点下降值。其次 ,本方法通过双差示温差ΔTdd的变化 ,指示试样相变的开始。 由于溶液在凝固过程中浓度渐渐变大 ,导致ΔT RS也逐渐变大 ,因此通过ΔTdd指示溶液何 时开始凝固有着特殊的意义。本方法在实际应用时可将ΔTRS和ΔTdd通过电表或数显管直接 读出 ,操作简单方便。 参 考 文 献 1 Findlay A. Practical Physical Chemistry(8th Edn. ) , Longmans , 1955 :54 ,107 —117 2 陈缵光 ,钟永生 1 中国专利 93203592. CN2148604 ;93. 12. 18. 3 Vold M J. A nal. Chem . , 1949 ;21 (6) :683 4 Borchardt H J , Daniels F. J . A mer. Chem . Soc. , 1957 ;79 (1) :41 (上接第 31 页) 历史上 , C. K. Ingold 等首先提出 SN1 和 SN2 的概念并给出了其历程的一般表示式[8 ] ,而 其提出的预测溶剂影响反应速率的定性规则 ,虽以电荷数改变作为判断依据 ,但实质上仍与活 化能及溶剂化效应的理论相关联 ,既简明实用且适用于已知机理的所有饱和碳原子上的亲核 取代反应。因此该规则可与 SN1 和 SN2 机理在基础有机化学有关章节联袂应用。 现代科学的特点之一是运用概念发现逻辑再发现新的概念 ,再把新概念构成新的科学理 论。Hughes2Ingold 规则的提出便是一个佐证。 参 考 文 献 1 王积涛 1 高等有机化学 1 人民教育出版社 , 1980 :112 2 廖清江主编 1 有机化学(第三版) 1 人民卫生出版社 , 1994 :195 3 邢其毅主编 1 基础有机化学示范教学 1 北京大学出版社 , 1983 :127 4 陈光旭主编 1 有机化学专题选(一) 1 北京师范大学出版社 , 1987 :187 ,191 5 李正化主编 1 有机药物合成原理 1 人民卫生出版社 , 1985 :350 6 廖清江主编 1 有机化学(第三版) 1 人民卫生出版社 , 1994 :199 7 王常有编 1 有机化学习题集 1 北京工业出版社 ,1987 :184 8 Harris J M. Fundamentals of Organic Reaction Mechanisms. New York : John Wiley & Sons Inc. 9 C. Reichardf. Solventsand Solvent Effects in Organic Chemistry. VCH Press , 1988 40