
第12卷第1期 大華化 1997年2月 对映体识别 不对称合成中的新概念 李越兰关烨第 (北京大学化学与分子工程学院100871) 摘要对映体识别指的是同种构成的对映体之问的相互作用。这种现象广泛存在于固相、液 相中。本文讨论了对映体识别对于溶液的物理、化学性质的影响,以及它在对映体拆分纯度测定等 方面的应用,并介绍了由它引起的手性放大这一不对称合成中的新发现, 自然界中无不存在着手性物质,组成生物基本物质的氨基酸和糖类都具有手性。因此,生 物体内的所有底物和受体的相互作用,生物体内的分子识别都和手性有关。在日常生产、生活 中,大量的医药、农药、香料也都和手性密切相关。不对称合成已成为有机合成中最为活跃的 领域。本文拟就其发展过程中出现的一个新概念对映体识别进行阐述。 、对映体概念的产生 早在1848年巴斯德在研究酒石酸钠的品体结构时发现·外消旋西石酸钠铵盐在低于 27C时结晶,得到两种晶体,它们的构型相当于实物与镜象的关系,外形相似,但不能重叠。巴 斯德由晶体的外形联想到酒石酸钠铵的内部结构,认为晶体有旋光性是由于其分子内部的结 构具有不对称性的缘故。1874年,Van't Hoff和 00H HOOC Lebe提出了碳的正四面体学说,从而阐明了对映体 的概念两种构型互为镜象关系而不能重合的两 HO H OH H 个分子,称为对映体。以只存在一个手性中心的乳 CH CH 酸为例,连有四个不同基团的碳原子在空间有两种 D(.人乳酸 5(+上乳酸 la 排列方式(图),它们的关系就如实物与镜象的关 图1 系一样,1a和1b即为一对对映体。 对映体相互作用及识别 对映体的两种构型之间存在着选择性的分子间相互作用。基态分子间的相互作用或反应 过渡态的稳定化,有很多是与电子给体(dbmr,D)和电子受体(acceptor,A)的亲和力有关。对映 体间发生作用时,以形成二倍体为例,同种分子中的D和A的结合是和对映体之间的D和A 的结合不同的,这就构成了自体识别和异体识别(图2)的差异,它们分别对应着形成同手性二 倍体和异手性二倍体(图2)。我们称对映体之间的自体和异体识别作用为对映体识别四,它是 手性识别的一种。 对映体识别的现象在固体中是广泛存在的,它是品格形成时的一条基本原则。由于自体 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved hmp:/ww.cnkne
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 19 第 12 卷 第 1 期 1997 年 2 月 H OH L2( + )2乳酸 1b D2( - )2乳酸 1a COOH HO C * * C CH3 H HOOC CH3 图 1 对 映 体 识 别 ——不对称合成中的新概念 李越兰 关烨第 (北京大学化学与分子工程学院 100871) 摘要 对映体识别指的是同种构成的对映体之间的相互作用。这种现象广泛存在于固相、液 相中。本文讨论了对映体识别对于溶液的物理、化学性质的影响 ,以及它在对映体拆分、纯度测定等 方面的应用 ,并介绍了由它引起的手性放大这一不对称合成中的新发现。 自然界中无不存在着手性物质 ,组成生物基本物质的氨基酸和糖类都具有手性。因此 ,生 物体内的所有底物和受体的相互作用 ,生物体内的分子识别都和手性有关。在日常生产、生活 中 , 大量的医药、农药、香料也都和手性密切相关。不对称合成已成为有机合成中最为活跃的 领域。本文拟就其发展过程中出现的一个新概念对映体识别进行阐述。 一、 对映体概念的产生 早在 1848 年 , 巴斯德在研究酒石酸钠铵的晶体结构时发现 ; 外消旋酒石酸钠铵盐在低于 27 ℃时结晶 ,得到两种晶体 ,它们的构型相当于实物与镜象的关系 ,外形相似 ,但不能重叠。巴 斯德由晶体的外形联想到酒石酸钠铵的内部结构 , 认为晶体有旋光性是由于其分子内部的结 构具有不对称性的缘故 。 1874 年 , Van′t Hoff 和 Lebel 提出了碳的正四面体学说 ,从而阐明了对映体 的概念 —两种构型互为镜象关系而不能重合的两 个分子 , 称为对映体。以只存在一个手性中心的乳 酸为例 , 连有四个不同基团的碳原子在空间有两种 排列方式 (图 1) , 它们的关系就如实物与镜象的关 系一样 , 1a 和 1b 即为一对对映体。 二、 对映体相互作用及识别 对映体的两种构型之间存在着选择性的分子间相互作用。基态分子间的相互作用或反应 过渡态的稳定化 ,有很多是与电子给体(donor ,D) 和电子受体(acceptor ,A) 的亲和力有关。对映 体间发生作用时 , 以形成二倍体为例 , 同种分子中的 D 和 A 的结合是和对映体之间的 D 和 A 的结合不同的 ,这就构成了自体识别和异体识别 (图 2) 的差异 ,它们分别对应着形成同手性二 倍体和异手性二倍体(图 2) 。我们称对映体之间的自体和异体识别作用为对映体识别[1 ] ,它是 手性识别的一种。 对映体识别的现象在固体中是广泛存在的 , 它是晶格形成时的一条基本原则。由于自体

©( 同手性二倍体(ra) 异手性二倍体(hechra击mer) 自体识别 异体识别 图2 识别和异体识别的竞争,外消旋溶液在结品时可形成纯对映体或外消旋体,如前述的外消旋的 酒石酸钠铵在低于27℃下得到两种纯对映体的品体,表现出自体识别优于异体识别。对映体 识别在升华过程中也很显著,Kat和bseP1发现,将部分拆分的a-乙基苄基苯基硫醚置于 真空干燥器中,然后减压,过量的那种对映体首先升华,而剩下外消旋物质。 溶液中对映体间的相互作用一般较固相为弱,而且存在着动态平衡,但这种作用对于其物 理和化学行为的影响是不能低估的。C.J.Mhae Gnn研究了部分拆分的对映体混和物形成的 溶液,发现由于形成了不同的二倍体(或多倍体),它们之间的沸点存在差异,因而形成非对映 体共沸物,利用这种性质可以使过量的那种对映体优先被蒸出,达到纯化的目的。 自体识别和异体识别哪种作用占优势?一般认为与空间的和电性的因素有关。L.ale 等计算了当手性分子的对映体之间形成二倍体时的相互作用能,发现同手性二倍体和异手性 二倍体的作用能是有差别的,此能量差可以用来衡量对映体识别的大小程序。David Andeh mn等还从分子力场的角度进行了计算,得出判断丙氨酸模型中何种识别为优先的标准。 对映体识别和作用的现象在运用偏振仪、核磁仪、量热计等进行的测量实验中均能观测 到。它能够引起一些非光学性质的变化,如介电常数1沸点1,红外)核磁谱等和纯对映体 间往往有细微差别。这种差别在对映体的拆分、对映体纯度的测定和一些化学反应中均起着 重要作用。 1 对映体的拆分 利用结晶、升华、沸腾等过程中由于对映体识别而产生的溶解度、升华点、沸点等性质的差 异,可进行对陕体的拆分。这在前面己有介绍。再以升华为例:Paquette等通过升华使外消旋 的手性醇3(图3)自动拆分。在20℃2.7×10Pa下减压几天,得到的升华物质经X射线衍射 分析为纯对映体,而剩余的是外消旋物质。 2.对映体纯度的测定 T.Williams等发现在非手性溶剂中,外消旋的二氢奎宁和光学纯度的二氢奎宁的NMR 谱是不等价的。当R构型:S构型不是1:1的关系时,一些质子可观察到两套峰,并且峰面 积与每种对映体的浓度相应成比例。这种结果被解释为对映体之间倾向于形成同构或者异构 的二倍体。 audio Luchinat等在无手性助剂的条件下,通过NR实验决定l,z二醇的对陕体光学 纯度。他们将手性1,二醇作成二丁基氧化锡的衍生物(图4): 图 1994-2009 China Academie Journal Electronie Publishing House.All rights reserved
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 20 D A A D Ý ß 同手性二倍体(homochiral dimer) 自体识别 异手性二倍体(heterochiral dimer) 异体识别 D A A D Ý Ý D A A D ß ß 图 2 识别和异体识别的竞争 ,外消旋溶液在结晶时可形成纯对映体或外消旋体 ,如前述的外消旋的 酒石酸钠铵在低于 27 ℃下得到两种纯对映体的晶体 , 表现出自体识别优于异体识别。对映体 识别在升华过程中也很显著 , Kwart 和 Hoster [2 ]发现 , 将部分拆分的α2乙基苄基苯基硫醚置于 真空干燥器中 ,然后减压 ,过量的那种对映体首先升华 ,而剩下外消旋物质。 溶液中对映体间的相互作用一般较固相为弱 ,而且存在着动态平衡 ,但这种作用对于其物 理和化学行为的影响是不能低估的。 C.J. MacGinn [3 ]研究了部分拆分的对映体混和物形成的 溶液 ,发现由于形成了不同的二倍体 (或多倍体) ,它们之间的沸点存在差异 ,因而形成非对映 体共沸物,利用这种性质可以使过量的那种对映体优先被蒸出 ,达到纯化的目的。 自体识别和异体识别哪种作用占优势 ?一般认为与空间的和电性的因素有关。 L. Salem [4 ] 等计算了当手性分子的对映体之间形成二倍体时的相互作用能 , 发现同手性二倍体和异手性 二倍体的作用能是有差别的 , 此能量差可以用来衡量对映体识别的大小程序。 David Andel2 man [5 ]等还从分子力场的角度进行了计算 ,得出判断丙氨酸模型中何种识别为优先的标准。 对映体识别和作用的现象在运用偏振仪、核磁仪、量热计等进行的测量实验中均能观测 到。它能够引起一些非光学性质的变化 ,如介电常数[6 ]、沸点[3 ]、红外[7 ]、核磁谱[8 ]等和纯对映体 间往往有细微差别。这种差别在对映体的拆分、对映体纯度的测定和一些化学反应中均起着 重要作用。 1. 对映体的拆分 利用结晶、升华、沸腾等过程中由于对映体识别而产生的溶解度、升华点、沸点等性质的差 异 ,可进行对映体的拆分。这在前面已有介绍。再以升华为例 : Paquette [9 ]等通过升华使外消旋 的手性醇 3 (图 3) 自动拆分。在 20 ℃、217 ×10 3 Pa 下减压几天 ,得到的升华物质经 X射线衍射 分析为纯对映体 ,而剩余的是外消旋物质。 2. 对映体纯度的测定 T. Williams [8 ]等发现在非手性溶剂中 , 外消旋的二氢奎宁和光学纯度的二氢奎宁的1 HNMR 谱是不等价的。当 R2构型 ∶S2构型不是 1 ∶1 的关系时 ,一些质子可观察到两套峰 ,并且峰面 积与每种对映体的浓度相应成比例。这种结果被解释为对映体之间倾向于形成同构或者异构 的二倍体。 Claudio Luchinat [10 ]等在无手性助剂的条件下 ,通过 NMR 实验决定 1022二醇的对映体光学 纯度。他们将手性 1022二醇作成二丁基氧化锡的衍生物(图 4) : 4a 4b mesodimer 含 i chiraldimer 含 C2 R = n2C4 H9 图 4 O Sn O Sn R R O R R O O Sn O Sn R R O R R O 3 H OH 图 3
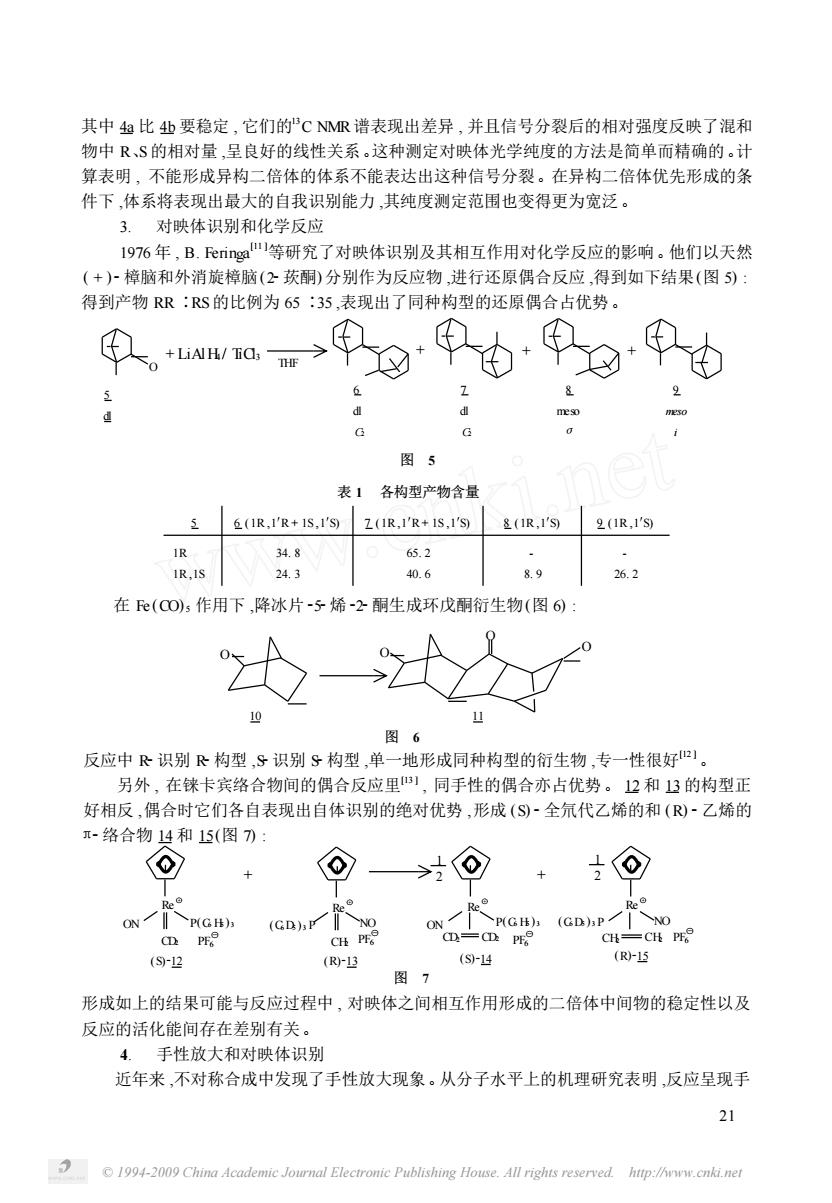
其中4比4业要稳定,它们的℃R谱表现出差异,并且信号分裂后的相对强度反映了混和 物中R、S的相对量,呈良好的线性关系。这种测定对映体光学纯度的方法是简单而精确的。计 算表明,不能形成异构二倍体的体系不能表达出这种信号分裂。在异构二倍体优先形成的条 件下,体系将表现出最大的自我识别能力,其纯度测定范围也变得更为宽泛。 3.对映体识别和化学反应 1976年,B.Feringa"等研究了对映体识别及其相互作用对化学反应的影响。他们以天然 (+)樟脑和外消旋樟脑(公莰酮)分别作为反应物进行还原偶合反应,得到如下结果(图5) 得到产物RR:RS的比例为65:35,表现出了同种构型的还原偶合占优势。 图5 表1各构型产物含量 1R,1'R+1S,1'SZ1R,1'R+1S,1S &IR,1'S2(1R,1'S9 34.8 653 1R,1S 24.3 40.6 8.g 26.2 在e(CO,作用下,降冰片-子烯2酮生成环戊酮衍生物(图6) 10 11 图6 反应中朵识别R构型,S识别9构型,单一地形成同种构型的衍生物,专一性很好 另外,在铼卡宾络合物间的偶合反应里1,同手性的偶合亦占优势。2和3的构型正 好相反,偶合时它们各自表现出自体识别的绝对优势,形成(S-全氘代乙烯的和(®)-乙烯的 -络合物4和15(图7刀: + 士⊙ (GD) CH-CH PF (S)-12 (Rr13 (S14 (R-15 图7 形成如上的结果可能与反应过程中,对映体之间相互作用形成的二倍体中间物的稳定性以及 反应的活化能间存在差别有关。 4.手性放大和对映体识别 近年来,不对称合成中发现了手性放大现象。从分子水平上的机理研究表明,反应呈现手 2 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved htp://www.cnki.net
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 21 其中 4a 比 4b 要稳定 , 它们的13 C NMR 谱表现出差异 , 并且信号分裂后的相对强度反映了混和 物中 R、S的相对量 ,呈良好的线性关系。这种测定对映体光学纯度的方法是简单而精确的。计 算表明 , 不能形成异构二倍体的体系不能表达出这种信号分裂。在异构二倍体优先形成的条 件下 ,体系将表现出最大的自我识别能力 ,其纯度测定范围也变得更为宽泛。 3. 对映体识别和化学反应 1976 年 , B. Feringa [11 ]等研究了对映体识别及其相互作用对化学反应的影响。他们以天然 ( + )2樟脑和外消旋樟脑(22莰酮) 分别作为反应物 ,进行还原偶合反应 ,得到如下结果(图 5) : 得到产物 RR ∶RS的比例为 65 ∶35 ,表现出了同种构型的还原偶合占优势。 反应中 R2识别 R2构型 ,S2识别 S2构型 ,单一地形成同种构型的衍生物 ,专一性很好[12 ]。 另外 , 在铼卡宾络合物间的偶合反应里[13 ] , 同手性的偶合亦占优势。 12 和 13 的构型正 好相反 ,偶合时它们各自表现出自体识别的绝对优势 ,形成 (S) 2全氘代乙烯的和 (R) 2乙烯的 π2络合物 14 和 15(图 7) : 形成如上的结果可能与反应过程中 , 对映体之间相互作用形成的二倍体中间物的稳定性以及 反应的活化能间存在差别有关。 4. 手性放大和对映体识别 近年来 ,不对称合成中发现了手性放大现象。从分子水平上的机理研究表明 ,反应呈现手 O O O O 10 11 图 6 Re R Ý e Ý Re Ý ON CD2 CD2 ON CD2 P(C6 H5 ) 3 P(C6 H5 ) 3 (C6D5 ) 3 P (C6D5 ) 3 P CH2 CH2 CH2 NO NO Re Ý PF ß 6 (S)212 (R)213 (S)214 (R)215 图 7 PF ß 6 PF ß 6 PF ß 6 1 2 1 + + 2 在 Fe (CO) 5 作用下 ,降冰片 252烯 222酮生成环戊酮衍生物(图 6) : 表 1 各构型产物含量 5 6 (1R ,1′R + 1S ,1′S) 7 (1R ,1′R + 1S ,1′S) 8 (1R ,1′S) 9 (1R ,1′S) 1R 1R ,1S 34. 8 24. 3 65. 2 40. 6 - 8. 9 - 26. 2 5 dl 图 5 O + LiAlH4 / TiCl3 THF 7 dl C2 9 meso i 6 dl C2 + + + 8 meso σ
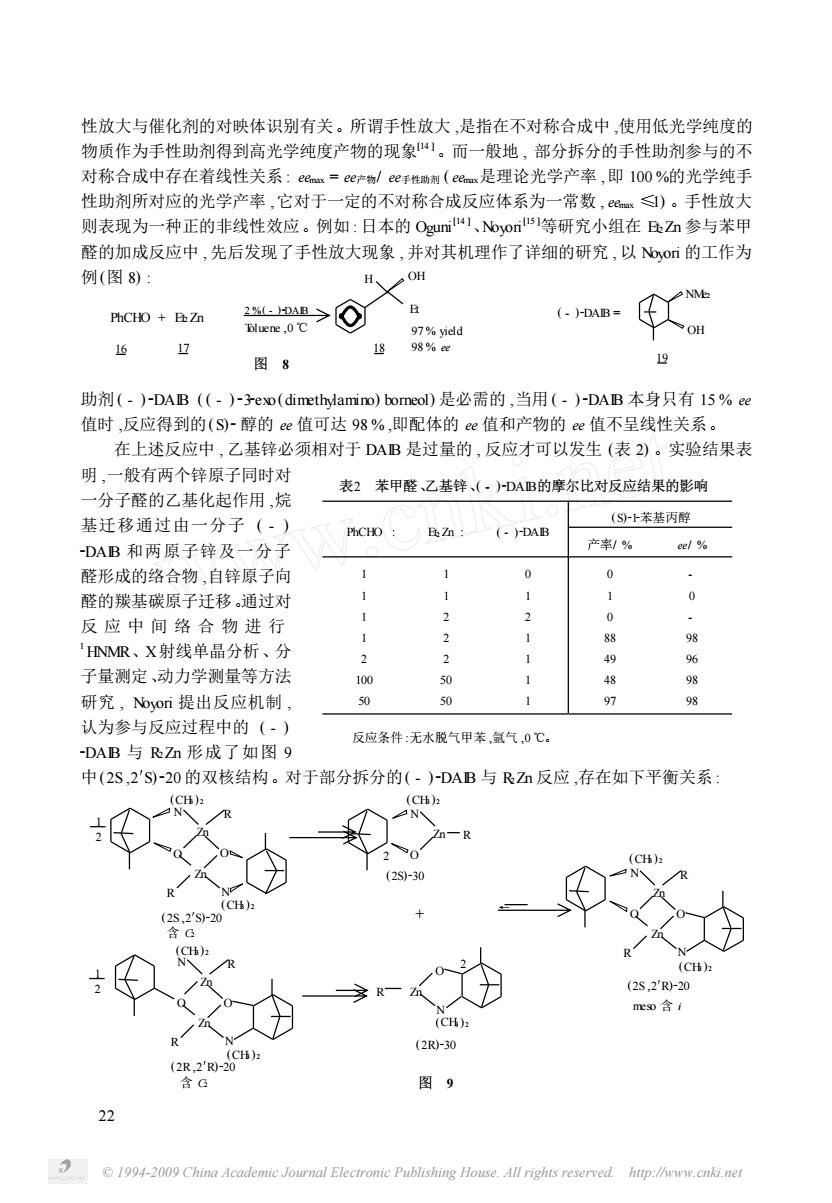
性放大与催化剂的对映体识别有关。所谓手性放大是指在不对称合成中使用低光学纯度的 物质作为手性助剂得到高光学纯度产物的现象。而一般地,部分拆分的手性助剂参与的不 对称合成中存在着线性关系:em=ee*物/ee手性制(ee是理论光学产率,即100%的光学纯手 性助剂所对应的光学产率,它对于一定的不对称合成反应体系为一常数,)。手性放大 则表现为一种正的非线性效应。例如:日本的Ogun)、oos等研究小组在DZn参与苯甲 醛的加成反应中,先后发现了手性放大现象,并对其机理作了详细的研究,以,o的工作为 例(图8): H、OH hCH0+鱼Z >@ 97%vield OH 6 17 1898% 图8 助剂(-)-DAB(-)-3eo(imethm)boreol)是必需的,当用(-)-DAB本身只有15%ce 值时,反应得到的(S)-醇的e值可达98%,即配体的e值和产物的e值不呈线性关系 在上述反应中,乙基锌必须相对于DAB是过量的,反应才可以发生(表2)。实验结果表 明,一般有两个锌原子同时对 表2苯甲醛乙基锌、()DAB的摩尔比对反应结果的影响 “分子醛的乙基化起作用,烷 基迁移通过由一分子(·) (S十苯恭丙醇 (·DAB DAB和两原子锌及一分子 产*制% e/% 醛形成的络合物自锌原子向 0 0 醛的羰基碳原子迁移,通过对 1 0 反应中间络合物进行 1 88 9 HNMR、X射线单晶分析 、分 1 40 子量测定、动力学测量等方法 100 研究,oon提出反应机制 07 认为参与反应讨时程中的(.) 反应条件:无水脱气甲苯,氢气,0℃. DAB与RZ形成了如图9 中(2S,2'S-20的双核结构。对于部分拆分的(-)-DAB与RZ反应,存在如下平衡关系: CH): (CH) 2 (2S.2'R- ro含 (2R-30 (2R2'R2C 含G 图9 Y 1994-2009 China Academie Journ Elecironie Publishing House All rights reserved
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 22 性放大与催化剂的对映体识别有关。所谓手性放大 ,是指在不对称合成中 ,使用低光学纯度的 物质作为手性助剂得到高光学纯度产物的现象[14 ]。而一般地 , 部分拆分的手性助剂参与的不 对称合成中存在着线性关系 : eemax = ee产物/ ee手性助剂 ( eemax是理论光学产率 ,即 100 %的光学纯手 性助剂所对应的光学产率 ,它对于一定的不对称合成反应体系为一常数 , eemax ≤1) 。手性放大 则表现为一种正的非线性效应。例如 : 日本的 Oguni [14 ]、Noyori [15 ]等研究小组在 Et2Zn 参与苯甲 醛的加成反应中 , 先后发现了手性放大现象 , 并对其机理作了详细的研究 , 以 Noyori 的工作为 例(图 8) : 助剂 ( - ) 2DAIB ( ( - ) 232exo (dimethylamino) borneol) 是必需的 ,当用 ( - ) 2DAIB 本身只有 15 % ee 值时 ,反应得到的(S)2醇的 ee 值可达 98 % ,即配体的 ee 值和产物的 ee 值不呈线性关系。 在上述反应中 , 乙基锌必须相对于 DAIB 是过量的 , 反应才可以发生 (表 2) 。实验结果表 反应条件 :无水脱气甲苯 ,氩气 ,0 ℃。 表2 苯甲醛、乙基锌、( - )2DAIB的摩尔比对反应结果的影响 PhCHO : Et2 Zn : ( - )2DAIB (S)212苯基丙醇 产率/ % ee/ % 1 1 1 1 2 100 50 1 1 2 2 2 50 50 0 1 2 1 1 1 1 0 1 0 88 49 48 97 - 0 - 98 96 98 98 明 ,一般有两个锌原子同时对 一分子醛的乙基化起作用 ,烷 基迁移通过由一分子 ( - ) 2DAIB 和两原子锌及一分子 醛形成的络合物 ,自锌原子向 醛的羰基碳原子迁移。通过对 反 应 中 间 络 合 物 进 行 1 HNMR、X射线单晶分析、分 子量测定、动力学测量等方法 研究 , Noyori 提出反应机制 , 认为参与反应过程中的 ( - ) 2DAIB 与 R2Zn 形成了如图 9 中(2S ,2′S)220 的双核结构。对于部分拆分的( - )2DAIB 与 R2Zn 反应 ,存在如下平衡关系 : 2 %( - )2DAIB PhCHO + Et2 Zn 17 18 Toluene ,0 ℃ 图 8 16 97 % yield 98 % ee OH Et H ( - )2DAIB = 19 NMe2 OH N N R Zn N O O O N Zn R Zn R Zn R N Zn O O N R Zn O N R N R O O Zn R Zn (CH3 ) 2 (CH3 ) 2 (CH3 ) 2 + (CH3 ) 2 (CH3 ) 2 (CH3 ) 2 含 C2 含 C2 (2S)230 (2R)230 (2R ,2′R)220 meso 含 i 图 9 ← (2S ,2′R)220 1 2 1 2 (CH3 ) 2 (2S ,2′S)220 (CH3 ) 2 2 2

可以看出,在形成二倍体时,由于对映体识别的关系,形成了二种可能的异构体,即具有G对 称性的同手性二聚体(2S,2'S-20,(2R,2'R)-20和具有对称中心1的内消旋o型的异手性 二倍体(2S,2'R)-20。X射线衍射实验证明,(2S,2'S)-20和(2R,2'R)-20的稳定性低于meo型 的(28,2')-20。因而,同手性二倍体在溶液中更倾向于解聚成活性的单体催化物种(2S-30或 (2R)-30。所以,当所用DAB是两种手性异构体混和物时即在使用光学活性不高的(-)-DAB 时,首先是较少量的那个手性异构体在溶液中和手性相反的异构体生成较稳定的、催化活性很 小的异手性二倍体mr(2S,2'R)-20,这样溶液中剩余的单体(-)-DB就具有很高光学纯度 而且成为真正的催化物种,事实上这和应用高光学纯度的(·)-DAB效果一样。反应就能有很 高的对映选择性,表现出手性放大。 显然,在上述过程中,催化剂的对映体识别及相互作用成为手性放大的根本原因。 手性放大的发现,具有很重要的意义。产生手性放大的反应是不对称增殖反应这对于有 机合成化学及其实际应用很有价值。另外,手性放大的发现,被认为可能与地球上生物分子的 手性起源有关现今的自然界往往表现出一定的手性倾向,如α~氨基酸都是L构型,而糖类均 为D构型。但一般认为太初形成的原始“混沌汤”里,左、右旋的比率是相等的,不表现出单 的手性。关于手性起源问题,人们提出了种种假说1,不一而足。但不管是哪种原因造成的 种对映体比率上极微小的差别,一定还存在着某种放大的机制使这种差别一步步衍化到今天 这个程度。6o等在化学反应里所发现的如此高的手性放大现象或许能给人们启示,为解 开这个谜提供一个突破口。 对映体识别及其引起的手性放大是不对称合成中的新概念,这个领域的研究近期发展甚 快,相信不远的将来会出现具有应用前景的重要成果。 参考文献 Sg5,00nR.化学(日),192:47:646 Koan H.Hster D P.J.Org.Chem.,1967:32:1867 Me(inn CJ.J.Phs.Chem..191:65:1896 Salem L et al J.dm Chem.Soc..1987:109:2887 5 David A.Henri O.J.Am.Chem.Soc.,1993:115:12322 6 Le Fevre RJ W et al..J.Chem.Soc..1952:17:235 waltian C H Sovn pVImo 1983-105-6174 Willians T.Rtcher R Get al..J.Am.Chem.Soc..199:91:1871 ,1987:52:1634 108:4873 rg H. 2831 J.Am.Chem.S .1974: 6:162 3 James H M et al. ,mChm.Soc 1983:105:5811 1 Oguri N et al.J.Am.Chemt.Soc..1988:110:7877 15 Noyon R.Kitamura M Angew.Chem.Im.Ed.Engl.1991:30:49 16honS.Cem5x.e,1988;17:347 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved htp://ww.enki.net
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 23 可以看出 ,在形成二倍体时 ,由于对映体识别的关系 ,形成了二种可能的异构体 ,即具有 C2 对 称性的同手性二聚体 (2S , 2′S) 220 , (2R , 2′R) 220 和具有对称中心 i 的内消旋 meso 型的异手性 二倍体(2S ,2′R)220。 X射线衍射实验证明 , (2S ,2′S)220 和(2R ,2′R)220 的稳定性低于 meso 型 的(2S ,2′R)220。因而 ,同手性二倍体在溶液中更倾向于解聚成活性的单体催化物种(2S)230 或 (2R)230。所以 ,当所用 DAIB 是两种手性异构体混和物时 ,即在使用光学活性不高的( - )2DAIB 时 ,首先是较少量的那个手性异构体在溶液中和手性相反的异构体生成较稳定的、催化活性很 小的异手性二倍体 meso2(2S ,2′R)220 ,这样溶液中剩余的单体( - )2DAIB 就具有很高光学纯度 , 而且成为真正的催化物种 ,事实上这和应用高光学纯度的( - )2DAIB 效果一样。反应就能有很 高的对映选择性 ,表现出手性放大。 显然 ,在上述过程中 ,催化剂的对映体识别及相互作用成为手性放大的根本原因。 手性放大的发现 ,具有很重要的意义。产生手性放大的反应是不对称增殖反应 ,这对于有 机合成化学及其实际应用很有价值。另外 ,手性放大的发现 ,被认为可能与地球上生物分子的 手性起源有关。现今的自然界往往表现出一定的手性倾向 ,如α2氨基酸都是 L 构型 ,而糖类均 为 D 构型。但一般认为太初形成的原始“混沌汤”里 ,左、右旋的比率是相等的 ,不表现出单一 的手性。关于手性起源问题 ,人们提出了种种假说[16 ] ,不一而足。但不管是哪种原因造成的二 种对映体比率上极微小的差别 ,一定还存在着某种放大的机制 ,使这种差别一步步衍化到今天 这个程度。 Noyori 等在化学反应里所发现的如此高的手性放大现象或许能给人们启示 , 为解 开这个谜提供一个突破口。 对映体识别及其引起的手性放大是不对称合成中的新概念 , 这个领域的研究近期发展甚 快 ,相信不远的将来会出现具有应用前景的重要成果。 参 考 文 献 1 Suga S , Noyori R. 化学(日) , 1992 ;47 :646 2 Kwart H , Hoster D P. J . Org. Chem., 1967 ;32 :1867 3 Mac Ginn CJ. J . Phys. Chem., 1961 ;65 :1896 4 Salem L et al. . J . Am. Chem. Soc., 1987 ;109 :2887 5 David A , Henri O. J . Am. Chem. Soc., 1993 ;115 :12322 6 Le Fevre R J W et al. . J . Chem. Soc., 1952 ;17 :235 7 William C H. Steven P V. J . Am. Chem. Soc., 1983 ;105 :6174 8 Williams T, Pitcher R G et al. . J . Am. Chem. Soc., 1969 ;91 :1871 9 Paquette L A et al. . J . Org. Chem., 1987 ;52 :1634 10 Luchinat C, Stefano R. J . Am. Chem. Soc., 1986 ;108 :4873 11 Wynberg H , Feringa B. Tetruhedron , 1976 ;32 :2831 12 Jean G, Laszlo P et al. . J . Am. Chem. Soc., 1974 ;96 :1622 13 James H M et al. . J . Am. Chem. Soc., 1983 ;105 :5811 14 Oguni N et al. . J . Am. Chem. Soc., 1988 ;110 :7877 15 Noyori R , Kitamura M. Angew. Chem. Int. Ed. Engl., 1991 ;30 :49 16 Mason S. Chem. Soc. Rev., 1988 ;17 :347