
第19卷第3期 大学化学 2004年6月 知识介绍 同位素效应简介 王永梅王业柳田间 (南开大学化学学院天津300071) 摘要对同位素效应的类别特征、原理在研究反应机理中的意义以及同位素效应发展的最 新动态进行简单介绍:讨论了同位素效应应用于生物化学中的一些反应。 在《大学化学词典》中对同位素效应的定义如下:“同一元素的同位素具有相同的电子构 型,因而具有相似的化学性质。但同一元素的不同的同位素具有不同的质量,它们虽然能发生 相同的化学反应,但平衡常数有所不同,反应速率也有所不同。川 在化学、,生物学等科学研究中所涉及到的同位素效应有更细致的分类和内容,下面就一些 常见的同位素效应作简要介绍并举例说明。 1平衡同位素效应 由于同位素的存在而造成平衡常数的差别,叫平衡同位素效应(Equilibrium Isotope Bfect EE),数值上等于较轻同位素参加反应的平衡常数与较重同位素参加反应的平衡常数的比值。 平衡同位素效应和反应物的△G有关,用Arrhenius方程表示为: -e (1) 2动力学同位素效应 由于同位素的存在而造成反应速率上的差别,叫做动力学同位素效应(Kinetic Isotope正 fect,KE),数值上等于较轻同位素参加反应的速率常数与较重同位素参加反应的速率常数的 比值。动力学同位素效应和反应物的△G有关,用Arrhenius方程表示为: kheavy (2) 例如 CHOH (k/k=7.7) OH 根据同位素所在键的断裂(或形成)与整个反应的关系可以将动力学同位素效应分为一级 同位素效应(Primary Isotope Bect)和二级同位素效应(Secondary Isotope Hfect) 32 C 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved.http://www.cnki.net
第 19 卷 第 3 期 大学化学 2004 年 6 月 知识介绍 同位素效应简介 王永梅 王业柳 田间 (南开大学化学学院 天津 300071) 摘要 对同位素效应的类别、特征、原理、在研究反应机理中的意义以及同位素效应发展的最 新动态进行简单介绍 ;讨论了同位素效应应用于生物化学中的一些反应。 在《大学化学词典》中对同位素效应的定义如下“: 同一元素的同位素具有相同的电子构 型 ,因而具有相似的化学性质。但同一元素的不同的同位素具有不同的质量 ,它们虽然能发生 相同的化学反应 ,但平衡常数有所不同 ,反应速率也有所不同。”[1 ] 在化学、生物学等科学研究中所涉及到的同位素效应有更细致的分类和内容 ,下面就一些 常见的同位素效应作简要介绍并举例说明。 1 平衡同位素效应 由于同位素的存在而造成平衡常数的差别 ,叫平衡同位素效应( Equilibrium Isotope Effect , EIE) ,数值上等于较轻同位素参加反应的平衡常数与较重同位素参加反应的平衡常数的比值。 平衡同位素效应和反应物的ΔG 0 有关 ,用 Arrhenius 方程表示为 : Klight Kheavy = e - ΔG 0 light -ΔG 0 heavy RT (1) 2 动力学同位素效应 由于同位素的存在而造成反应速率上的差别 ,叫做动力学同位素效应 ( Kinetic Isotope Ef2 fect ,KIE) ,数值上等于较轻同位素参加反应的速率常数与较重同位素参加反应的速率常数的 比值。动力学同位素效应和反应物的ΔG ≠有关 ,用 Arrhenius 方程表示为 : klight kheavy = e - ΔG ≠ light -ΔG ≠ heavy RT (2) 例如[1 ] : 根据同位素所在键的断裂(或形成) 与整个反应的关系可以将动力学同位素效应分为一级 同位素效应(Primary Isotope Effect) 和二级同位素效应(Secondary Isotope Effect) 。 32

2.1一级同位素效应 当一个反应进行时,在速度决定步骤中发生反应物分子的同位素化学键的形成或断裂反 应,将显现出一级同位素效应(Primary Isotope Bect)。一级同位素效应的机理现已很清楚,即 由于同位素质量不同,反应物的零点能不同,从而导致各自的反应速率不同。用数学式表示 为 Nμ (4) 其中k是与温度有关的常数,“是折合质量。对于氢的同位素来说,由于D的折合质量 大约是H的2倍所以D的零点能比H小。 这种关系可用简单的能级图(图1)表示。 能量十 过渡态 A0G-406D G =e 反应坐标 图1能级图 根据红外光谱,比较明显的CH的伸缩振动频率在2900~3100cm1之间,由于D比较 重,特征的伸缩振动频率在2050~2200℃m'之间21。可以预计,在发生反应时.,CH键比C D键活泼,通过计算可知CH键的零点振动能比CD键要高大约5N/ml((CD=I7. 4W/ml,o(CD)=12.5W/ml),这意味着CD键比CH键断裂困难。对在过渡态中涉及 CH(D)断裂或者伸展弯曲的反应,动力学同位素效应的大小直接反映键的断裂或者伸展弯 曲程度。通常当k如在2~7范围内时,才认为该反应是一级同位素效应控制的反应。一级 同位素效应能对反应历程提供两方面信息:(1)比值大于或等于2是CH键在过渡态中正在 断裂的有力证据,例如: ra,o△ (k=4.0(1910) 由k知的数值可以推断该反应涉及到CH键断裂,是速度决定步骤。这正是霍夫曼消除 的特征。(2)比值的大小定性地证明了过渡态结构与产物和反应物的关系。比值低,证明 CH(D)在过渡态中不是断裂得很彻底就是很少,而过渡态接近于产物或反应物的结构:比值 接近7,说明过渡态中氢与反应物的成键原子以及在产物中的新成键原子都有相当强的作用。 应当注意的是一级同位素效应受反应条件(例如pH、温度等)影响比较大,温度越高,比值越 小 2.2二级同位素效应 在有些被观察到的同位素效应中,被取代的氢原子和反应没有直接的关系,同位素参与的 化学键不发生断裂,但可能减弱或者重新杂化,并且在反应中是速度决定步骤,这样的效应叫 33 1994-2009 China Academic Joumal Electronic Publishing House.All righis reserved.hp://www.cnki.net
2. 1 一级同位素效应 当一个反应进行时 ,在速度决定步骤中发生反应物分子的同位素化学键的形成或断裂反 应 ,将显现出一级同位素效应(Primary Isotope Effect) 。一级同位素效应的机理现已很清楚 ,即 由于同位素质量不同 ,反应物的零点能不同 ,从而导致各自的反应速率不同。用数学式表示 为 : E0 = 1 2 v0 = h 4π k μ (4) 其中 k 是与温度有关的常数 ,μ是折合质量。对于氢的同位素来说 ,由于 D 的折合质量 大约是 H 的 2 倍 ,所以 D 的零点能比 H 小。 这种关系可用简单的能级图(图 1) 表示。 图 1 能级图 根据红外光谱 ,比较明显的 C —H 的伸缩振动频率在 2900~3100cm - 1之间 ,由于 D 比较 重 ,特征的伸缩振动频率在 2050~2200cm - 1之间[2 ] 。可以预计 ,在发生反应时 ,C —H 键比 C — D 键活泼 ,通过计算可知 C —H 键的零点振动能比 C —D 键要高大约 5kJ/ mol ( E0 (C —H) = 17. 4kJ/ mol , E0 (C —D) = 12. 5kJ/ mol) ,这意味着 C —D 键比 C —H 键断裂困难。对在过渡态中涉及 C —H(D) 断裂或者伸展弯曲的反应 ,动力学同位素效应的大小直接反映键的断裂或者伸展弯 曲程度。通常当 kH/ kD 在 2~7 范围内时 ,才认为该反应是一级同位素效应控制的反应。一级 同位素效应能对反应历程提供两方面信息 : (1) 比值大于或等于 2 是 C —H 键在过渡态中正在 断裂的有力证据[3 ] ,例如[4 ] : 3H N + (CH3 ) 3 -OH △ ( kH/ kD = 4. 0 (191 ℃) ) 由 kH/ kD 的数值可以推断该反应涉及到 C —H 键断裂 ,是速度决定步骤。这正是霍夫曼消除 的特征。(2) 比值的大小定性地证明了过渡态结构与产物和反应物的关系。比值低 ,证明 C —H(D) 在过渡态中不是断裂得很彻底就是很少 ,而过渡态接近于产物或反应物的结构 ;比值 接近 7 ,说明过渡态中氢与反应物的成键原子以及在产物中的新成键原子都有相当强的作用。 应当注意的是一级同位素效应受反应条件 (例如 pH、温度等) 影响比较大 ,温度越高 ,比值越 小。 2. 2 二级同位素效应 在有些被观察到的同位素效应中 ,被取代的氢原子和反应没有直接的关系 ,同位素参与的 化学键不发生断裂 ,但可能减弱或者重新杂化 ,并且在反应中是速度决定步骤 ,这样的效应叫 33
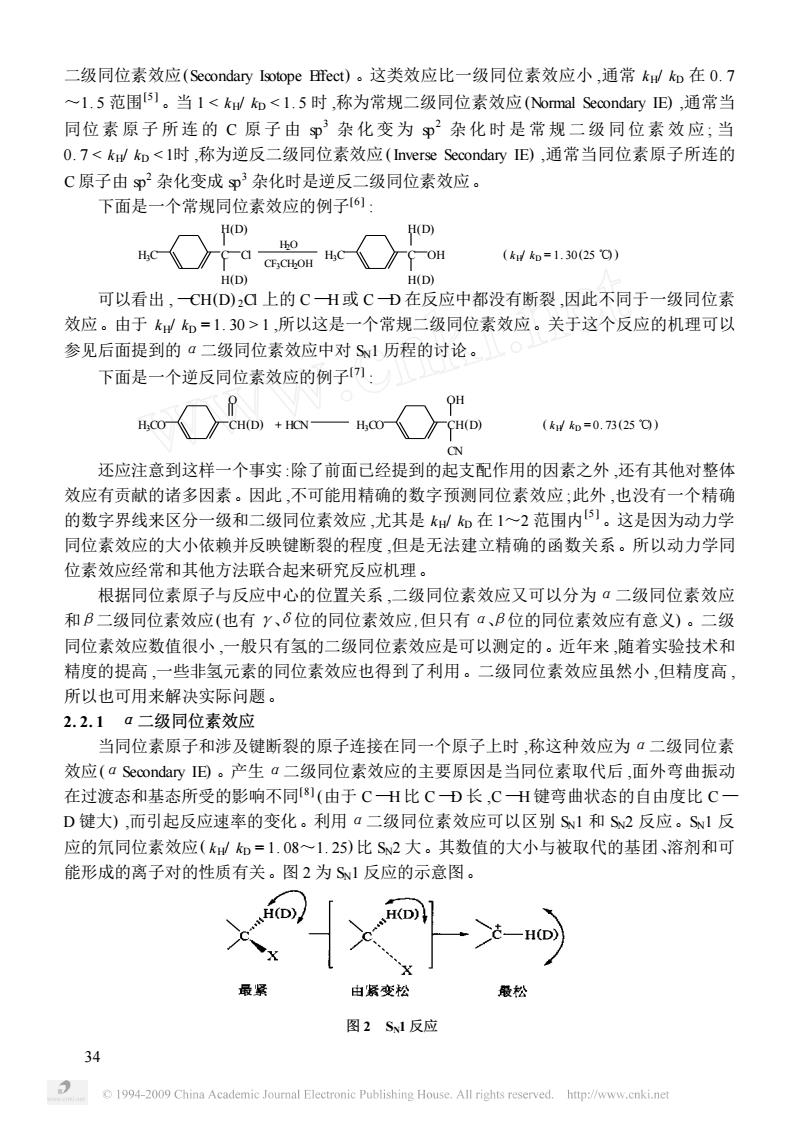
二级同位素效应(Secondary Isotope Bfect)。这类效应比一级同位素效应小,通常kd如在0.7 ~1.5范围1。当11,所以这是一个常规二级同位素效应。关于这个反应的机理可以 参见后面提到的a二级同位素效应中对Sw1历程的讨论。 下面是一个逆反同位素效应的例子川: (kd知=0.73(250) 还应注意到这样一个事实:除了前面己经提到的起支配作用的因素之外,还有其他对整体 效应有贡献的诸多因素。因此,不可能用精确的数字预测同位素效应;此外,也没有一个精确 的数字界线来区分一级和二级同位素效应,尤其是k如在1~2范围内。这是因为动力学 同位素效应的大小依赖并反映键断裂的程度,但是无法建立精确的函数关系。所以动力学同 位素效应经常和其他方法联合起来研究反应机理。 根据同位素原子与反应中心的位置关系,二级同位素效应又可以分为ā二级同位素效应 和B二级同位素效应(也有y、6位的同位素效应,但只有a、B位的同位素效应有意义)。二级 同位素效应数值很小,一般只有氢的二级同位素效应是可以测定的。近年来,随着实验技术和 精度的提高,一些非氢元素的同位素效应也得到了利用。二级同位素效应虽然小,但精度高 所以也可用来解决实际问题 2.2.1a二级同位素效应 当同位素原子和涉及键断裂的原子连接在同一个原子上时,称这种效应为·二级同位素 效应(a Secondary旧。产生a二级同位素效应的主要原因是当同位素取代后,面外弯曲振动 在过渡态和基态所受的影响不同)(由于CH比CD长,CH键弯曲状态的自由度比C一 D键大),而引起反应速率的变化。利用a二级同位素效应可以区别S1和S2反应。S1反 应的氘同位素效应(kW和=1.08~1.25)比S2大。其数值的大小与被取代的基团、溶剂和可 能形成的离子对的性质有关。图2为S1反应的示意图。 —HD》 由紧变松 最松 图2S1反应 34 C 1994-2009 China Academic foumnal Electronic Publishing House.all rights reserved.http://www.cnki ne
二级同位素效应(Secondary Isotope Effect) 。这类效应比一级同位素效应小 ,通常 kH/ kD 在 0. 7 ~1. 5 范围[5 ] 。当 1 1 ,所以这是一个常规二级同位素效应。关于这个反应的机理可以 参见后面提到的α二级同位素效应中对 SN1 历程的讨论。 下面是一个逆反同位素效应的例子[7 ] : H3CO CH(D) O + HCN H3CO CH(D) OH CN ( k H/ kD = 0. 73 (25 ℃) ) 还应注意到这样一个事实 :除了前面已经提到的起支配作用的因素之外 ,还有其他对整体 效应有贡献的诸多因素。因此 ,不可能用精确的数字预测同位素效应 ;此外 ,也没有一个精确 的数字界线来区分一级和二级同位素效应 ,尤其是 kH/ kD 在 1~2 范围内 [5 ] 。这是因为动力学 同位素效应的大小依赖并反映键断裂的程度 ,但是无法建立精确的函数关系。所以动力学同 位素效应经常和其他方法联合起来研究反应机理。 根据同位素原子与反应中心的位置关系 ,二级同位素效应又可以分为α二级同位素效应 和β二级同位素效应(也有γ、δ位的同位素效应 ,但只有α、β位的同位素效应有意义) 。二级 同位素效应数值很小 ,一般只有氢的二级同位素效应是可以测定的。近年来 ,随着实验技术和 精度的提高 ,一些非氢元素的同位素效应也得到了利用。二级同位素效应虽然小 ,但精度高 , 所以也可用来解决实际问题。 2. 2. 1 α二级同位素效应 当同位素原子和涉及键断裂的原子连接在同一个原子上时 ,称这种效应为α二级同位素 效应(αSecondary IE) 。产生α二级同位素效应的主要原因是当同位素取代后 ,面外弯曲振动 在过渡态和基态所受的影响不同[8 ] (由于 C —H 比 C —D 长 ,C —H 键弯曲状态的自由度比 C — D 键大) ,而引起反应速率的变化。利用α二级同位素效应可以区别 SN1 和 SN2 反应。SN1 反 应的氘同位素效应( kH/ kD = 1. 08~1. 25) 比 SN2 大。其数值的大小与被取代的基团、溶剂和可 能形成的离子对的性质有关。图 2 为 SN1 反应的示意图。 图 2 SN1 反应 34
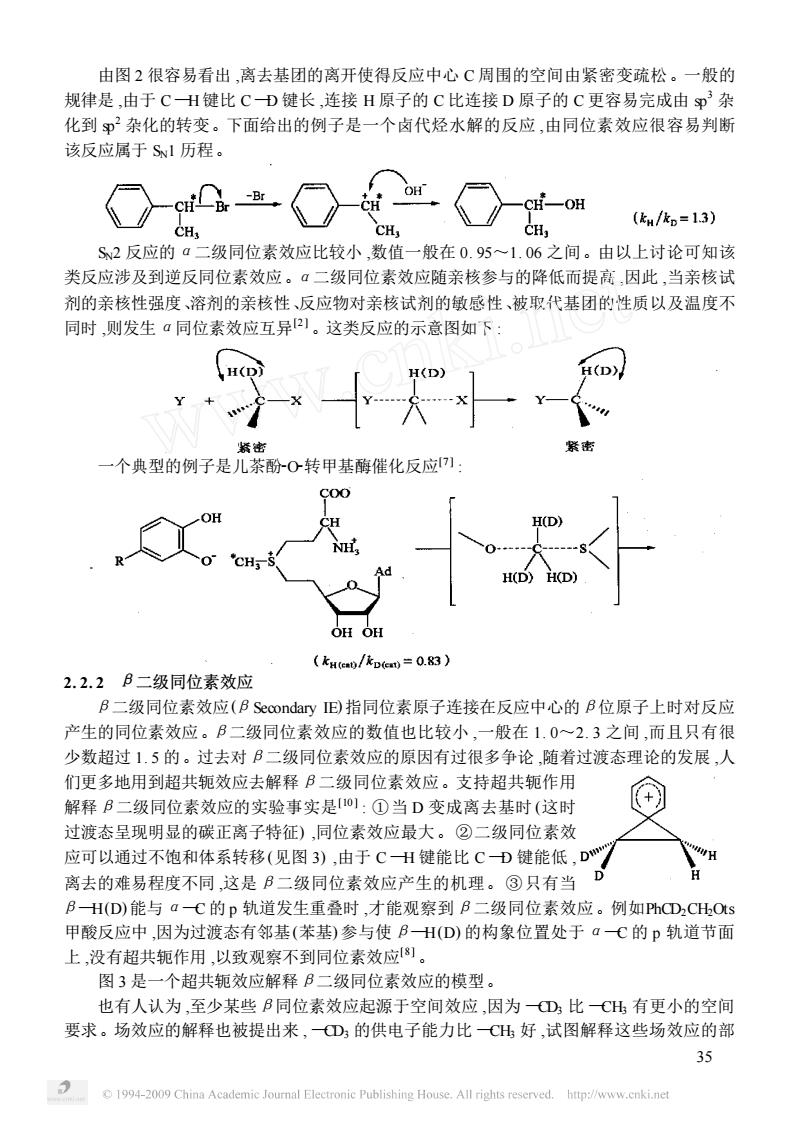
由图2很容易看出,离去基团的离开使得反应中心C周围的空间由紧密变疏松。一般的 规律是,由于CH键比CD键长,连接H原子的C比连接D原子的C更容易完成由p杂 化到尹杂化的转变。下面给出的例子是一个卤代烃水解的反应,由同位素效应很容易判断 该反应属于S1历程。 (k/k。=13) S2反应的a二级同位素效应比较小,数值一般在0.95~1.06之间。由以上讨论可知该 类反应涉及到逆反同位素效应。α二级同位素效应随亲核参与的降低而提高,因此,当亲核试 剂的亲核性强度、溶剂的亲核性、反应物对亲核试剂的敏感性、被取代基团的性质以及温度不 同时,则发生a同位素效应互异)。这类反应的示意图如下 一个典型的例子是儿茶酚O转甲基酶催化反应川: Ad /kpm=0.83) 2.2.2B二级同位素效应 B二级同位素效应(B Secondary IE)指同位素原子连接在反应中心的B位原子上时对反应 产生的同位素效应。B二级同位素效应的数值也比较小,一般在1.0~2.3之间,而且只有很 少数超过1.5的。过去对B二级同位素效应的原因有过很多争论,随着过渡态理论的发展,人 们更多地用到超共轭效应去解释B二级同位素效应。支持超共轭作用 解释B二级同位素效应的实验事实是O1:①当D变成离去基时(这时 过渡态呈现明显的碳正离子特征),同位素效应最大。②二级同位素效 应可以通过不饱和体系转移(见图3),由于CH键能比CD键能低,D H 离去的难易程度不同,这是B二级同位素效应产生的机理。③只有当 BH(D)能与aC的p轨道发生重叠时,才能观察到B二级同位素效应。例如PhCD2CH:Ots 甲酸反应中,因为过渡态有邻基(苯基)参与使BH(D)的构象位置处于aC的p轨道节面 上,没有超共轭作用,以致观察不到同位素效应。 图3是一个超共轭效应解释B二级同位素效应的模型。 也有人认为,至少某些B同位素效应起源于空间效应,因为①比CH有更小的空间 要求。场效应的解释也被提出来,D的供电子能力比CH好,试图解释这些场效应的部 35 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved.http://www.cnki.net
由图 2 很容易看出 ,离去基团的离开使得反应中心 C 周围的空间由紧密变疏松。一般的 规律是 ,由于 C —H 键比 C —D 键长 ,连接 H 原子的 C 比连接 D 原子的 C 更容易完成由 sp 3 杂 化到 sp 2 杂化的转变。下面给出的例子是一个卤代烃水解的反应 ,由同位素效应很容易判断 该反应属于 SN1 历程。 SN2 反应的α二级同位素效应比较小 ,数值一般在 0. 95~1. 06 之间。由以上讨论可知该 类反应涉及到逆反同位素效应。α二级同位素效应随亲核参与的降低而提高 ,因此 ,当亲核试 剂的亲核性强度、溶剂的亲核性、反应物对亲核试剂的敏感性、被取代基团的性质以及温度不 同时 ,则发生α同位素效应互异[2 ] 。这类反应的示意图如下 : 一个典型的例子是儿茶酚2O2转甲基酶催化反应[7 ] : 2. 2. 2 β二级同位素效应 β二级同位素效应(βSecondary IE) 指同位素原子连接在反应中心的β位原子上时对反应 产生的同位素效应。β二级同位素效应的数值也比较小 ,一般在 1. 0~2. 3 之间 ,而且只有很 少数超过 1. 5 的。过去对β二级同位素效应的原因有过很多争论 ,随着过渡态理论的发展 ,人 们更多地用到超共轭效应去解释β二级同位素效应。支持超共轭作用 解释β二级同位素效应的实验事实是[10 ] : ①当 D 变成离去基时 (这时 过渡态呈现明显的碳正离子特征) ,同位素效应最大。②二级同位素效 应可以通过不饱和体系转移(见图 3) ,由于 C —H 键能比 C —D 键能低 , 离去的难易程度不同 ,这是β二级同位素效应产生的机理。③只有当 β—H(D) 能与α—C 的 p 轨道发生重叠时 ,才能观察到β二级同位素效应。例如PhCD2CH2Ots 甲酸反应中 ,因为过渡态有邻基(苯基) 参与使β—H(D) 的构象位置处于α—C 的 p 轨道节面 上 ,没有超共轭作用 ,以致观察不到同位素效应[8 ] 。 图 3 是一个超共轭效应解释β二级同位素效应的模型。 也有人认为 ,至少某些β同位素效应起源于空间效应 ,因为 —CD3 比 —CH3 有更小的空间 要求。场效应的解释也被提出来 , —CD3 的供电子能力比 —CH3 好 ,试图解释这些场效应的部 35
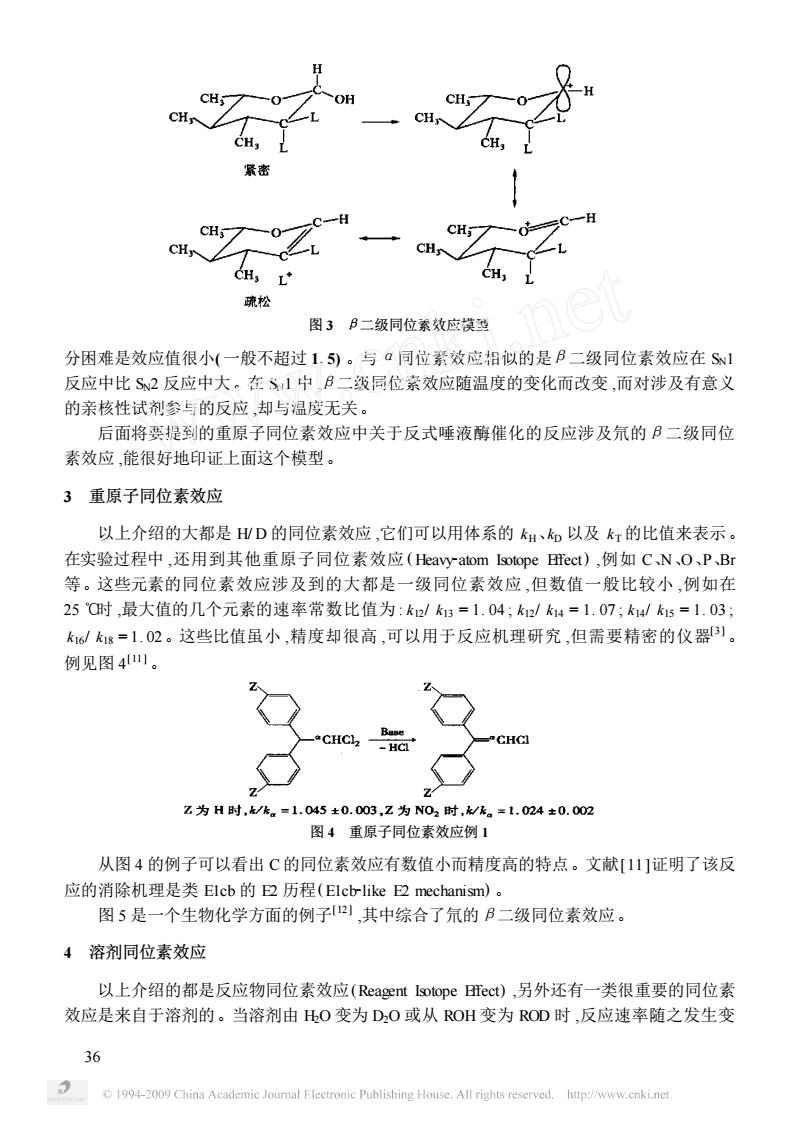
CH CH 疏松 图3B二级同位素效应模型 分困难是效应值很小(一般不超过1.5)。与·同位素效应沿似的是B二级同位素效应在S! 反应中比S2反应中大。在S1中B二级同位素效应随温度的变化而改变,而对涉及有意义 的亲核性试剂参与的反应,却与温度无关。 后面将要提到的重原子同位素效应中关于反式唾液酶催化的反应涉及氘的B二级同位 素效应,能很好地印证上面这个模型。 3重原子同位素效应 以上介绍的大都是WD的同位素效应,它们可以用体系的H、和以及k灯的比值来表示。 在实验过程中,还用到其他重原子同位素效应(Heavyatom Itope Bect),例如CN、O、PBr 等。这些元素的同位素效应涉及到的大都是一级同位素效应,但数值一般比较小,例如在 25Q时,最大值的几个元素的速率常数比值为:k/k3=1.04;k12/k4=1.07;k/k15=1.03 k6k1=1.02。这些比值虽小,精度却很高,可以用于反应机理研究,但需要精密的仪器1。 例见图41。 z为H时,k/h,=1.045±0.003,z为N02时,/k。=1.024±0.002 图4重原子同位素效应例1 从图4的例子可以看出C的同位素效应有数值小而精度高的特点。文献[11]证明了该反 应的消除机理是类Elcb的E2历程(Elcb-like E2 mechanism)。 图5是一个生物化学方面的例子)其中综合了氘的B二级同位素效应 4溶剂同位素效应 以上介绍的都是反应物同位素效应(Reagent Istope BTect),另外还有一类很重要的同位素 效应是来自于溶剂的。当溶剂由HO变为DO或从OH变为ROD时,反应速率随之发生变 36 C 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved.http://www.cnki.ne
图 3 β二级同位素效应模型 分困难是效应值很小( 一般不超过 1. 5) 。与α同位素效应相似的是β二级同位素效应在 SN1 反应中比 SN2 反应中大。在 SN1 中 ,β二级同位素效应随温度的变化而改变 ,而对涉及有意义 的亲核性试剂参与的反应 ,却与温度无关。 后面将要提到的重原子同位素效应中关于反式唾液酶催化的反应涉及氘的β二级同位 素效应 ,能很好地印证上面这个模型。 3 重原子同位素效应 以上介绍的大都是 H/ D 的同位素效应 ,它们可以用体系的 kH、kD 以及 kT 的比值来表示。 在实验过程中 ,还用到其他重原子同位素效应 ( Heavy2atom Isotope Effect) ,例如 C、N、O、P、Br 等。这些元素的同位素效应涉及到的大都是一级同位素效应 ,但数值一般比较小 ,例如在 25 ℃时 ,最大值的几个元素的速率常数比值为 : k12/ k13 = 1. 04 ; k12/ k14 = 1. 07 ; k14/ k15 = 1. 03 ; k16/ k18 = 1. 02。这些比值虽小 ,精度却很高 ,可以用于反应机理研究 ,但需要精密的仪器[3 ] 。 例见图 4 [11 ] 。 图 4 重原子同位素效应例 1 从图 4 的例子可以看出 C 的同位素效应有数值小而精度高的特点。文献[11 ]证明了该反 应的消除机理是类 E1cb 的 E2 历程(E1cb2like E2 mechanism) 。 图 5 是一个生物化学方面的例子[12 ] ,其中综合了氘的β二级同位素效应。 4 溶剂同位素效应 以上介绍的都是反应物同位素效应(Reagent Isotope Effect) ,另外还有一类很重要的同位素 效应是来自于溶剂的。当溶剂由 H2O 变为 D2O 或从 ROH 变为 ROD 时 ,反应速率随之发生变 36

0一摩反式赠液酸 AcHN D 图5重原子同位素效应例2 碳的一级同位素效应:kk=1.032.008 氘的B二级同位素效应:ka/km=1.0600.008 化这种效应称为溶剂同位素效应(Solvent Isotope BTect)。溶剂同位素效应的研究多是比较 HOD0中或者它们作为混合溶剂时反应的速率常数变化情况,被研究的体系大多数是酸碱 催化反应。观察到的同位素效应时常是一级和二级同位素效应合在一起。引起溶剂同位素 效应的原因有]:①溶剂可能是反应物,若溶剂的0H(D)键断裂是反应的速度决定步骤 观察到的是一级同位素效应:如果涉及的是DO(HO)或D,0(H0),并且OH(D)键不断 裂,发生的是二级同位素效应。②反应底物通过迅速的H交换可用氘标记,于是D参与的化 学键断裂;如果是速度决定步骤,也是一级同位素效应。③溶剂溶质相互作用的强度因溶剂 不同而引起过渡态能量的差异,从而影响整个反应的速率,并体现为二级同位素效应。④ DO的酸性比H,O*的酸性强,而且OD的碱性比OH的碱性强。溶剂同位素效应的数值 般在0.5~6.0之间,最常见的范围是1.5~2.8。 图6是一个溶剂同位素效应的例子]。 OMP脱酶/H20 OMP脱骏/D,0 图6溶剂同位素效应例 溶剂同位素效应:kkm=1.3如.2(室温pD=1.5) 溶剂同位素效应可以用来区别以下两类酸催化反应)。 类型I:反应速度依赖于亲离子(Lyonium bn)的浓度和存在的未离解的酸的浓度。最简 单的一种情况可以表示如下: S+A慢SH+ASH一产物 (反应速度v=k[S[HA]) 对于这种类型反应,由于D,0的酸性比H0强,反应物的共轭酸(SH或者SD)的浓度 在D0中比在HO中大3倍。由于第二步没有同位素效应,因而kDko0应该小于1,这种 逆反同位素效应结果只能在被负离子或者碱脱掉质子不和酸交换或交换速度比反应速度本身 慢得多的情况下适用。 类型2:在酸和反应物之间形成复合物,然后进行决定反应速度的复合物的分解 S+HA兰(S(SHA)度SH+A(反应速度r=SH1=S]H 对于类型2的反应,在复合物形成过程中没有一级同位素效应。但在速度决定步骤必须 发生质子转移,导致常规同位素效应,ko州koo>1。 37 1994-2009 China Academic Joural Electronic Publishing House.All righis reserved.http://www.cnki.net
图 5 重原子同位素效应例 2 碳的一级同位素效应 : kcat / km = 1. 032 ±0. 008 氘的β二级同位素效应 : kcat / km = 1. 060 ±0. 008 化 ,这种效应称为溶剂同位素效应 (Solvent Isotope Effect) 。溶剂同位素效应的研究多是比较 H2O、D2O 中或者它们作为混合溶剂时反应的速率常数变化情况 ,被研究的体系大多数是酸碱 催化反应。观察到的同位素效应时常是一级和二级同位素效应加合在一起。引起溶剂同位素 效应的原因有[10 ] : ①溶剂可能是反应物 ,若溶剂的 O —H(D) 键断裂是反应的速度决定步骤 , 观察到的是一级同位素效应 ;如果涉及的是 D2O(H2O) 或 D3O + (H3O + ) ,并且 O —H(D) 键不断 裂 ,发生的是二级同位素效应。②反应底物通过迅速的 H 交换可用氘标记 ,于是 D 参与的化 学键断裂 ;如果是速度决定步骤 ,也是一级同位素效应。③溶剂2溶质相互作用的强度因溶剂 不同而引起过渡态能量的差异 ,从而影响整个反应的速率 ,并体现为二级同位素效应。 ④ D3O +的酸性比 H3O +的酸性强 ,而且 OD - 的碱性比 OH - 的碱性强。溶剂同位素效应的数值一 般在 0. 5~6. 0 之间 ,最常见的范围是 1. 5~2. 8。 图 6 是一个溶剂同位素效应的例子[13 ] 。 图 6 溶剂同位素效应例 溶剂同位素效应 : kcat / km = 1. 3 ±0. 2 (室温 ,pD = 7. 5) 溶剂同位素效应可以用来区别以下两类酸催化反应[2 ] 。 类型 1 :反应速度依赖于亲 离子(Lyonium Ion) 的浓度和存在的未离解的酸的浓度。最简 单的一种情况可以表示如下 : S + HA 慢 k SH + + A SH + 产物 (反应速度 v = k [ S][ HA]) 对于这种类型反应 ,由于 D3O + 的酸性比 H3O + 强 ,反应物的共轭酸(SH +或者 SD + ) 的浓度 在 D2O 中比在 H2O 中大 3 倍。由于第二步没有同位素效应 ,因而 kHOH/ kDOD应该小于 1 ,这种 逆反同位素效应结果只能在被负离子或者碱脱掉质子不和酸交换或交换速度比反应速度本身 慢得多的情况下适用。 类型 2 :在酸和反应物之间形成复合物 ,然后进行决定反应速度的复合物的分解 : S + HA k1 (SHA) (SHA) k2 慢 SH + A (反应速度 v = k2 [ (SHA) ] = k1 k2 [ S][ HA]) 对于类型 2 的反应 ,在复合物形成过程中没有一级同位素效应。但在速度决定步骤必须 发生质子转移 ,导致常规同位素效应 , kHOH/ kDOD > 1。 37

5酶同位素效应 酶同位素效应(Enzyme Isotope BTect)指涉及到酶催化反应的同位素效应。酶同位素效应 一般都要联系辅酶的反应,通常是脱氢或加氧反应。涉及的同位素效应也相应的是H的一级 同位素效应。但在酶催化反应中,同位素效应显示出不同于经典同位素效应的特性,这类反应 己成为近年来的研究热点。图7和图851是两个酶同位素效应的实例。 HH CH 、CH CH Fe=0 Fe-OH 图7酶同位素效应例1 =47 1730 C.pH=7) 所用的南是人的15肤氧化南(hmn1Se%9gme)和亚油酸Limleie Ncid) 2机坏血殿盐 2半脱水抗坏血酸盐+H,0 Cu(II) NH CH,PHM NH 图8酶同位素效应例2 k/k=10.4如.337 PM是一种生物酶,全称是peptidy纱cinehydroylating moy 从上面两个例子可以看出,在酶催化反应中,同位素效应的数值比较大(一个是47,一个 是10.4)远远超过了经典同位素效应的最大值(一般为7),这种较大数值的同位素效应提示 存在一种对称性过渡态。较大的同位素效应和经典的H转移理论不一致,这种现象在酶催化 反应中很常见,如今已被H的隧穿效应(lydrogen Tuneling)很好地证实6。这类问题的研究 是实现对酶催化反应中存在的涉及CH活化的动力学转移的观测和研究的很好途径5)。 6同位素效应中的一些计算规则 /.2 k/=4.0 6.1几何方法规则 几何方法规则(The Rule of Geometric Mean,RGM)例见 CONH, 图9。当4位碳上的H为H时,如果H。的同位素效应 kko=1.2;且当H为H,H的同位素效应为k1kD =4.0,那么全是氘相对于全是氢时的同位素效应kl如0 km/kD=12×40=48 =1.24.0=4.8。 图9几何方法规则何 6.2 Swain-Schaad规则 另外一种计算同位素效应的方法是SwairSchaad规则,1958年,Sain通过精确的实验 得出结论,未知同位素效应可以通过已知相关的同位素效应计算得到: 38 C 1994-2009 China Academic fournal electronic Publishing House.all rights reserved. http://www.cnki.ne
5 酶同位素效应 酶同位素效应(Enzyme Isotope Effect) 指涉及到酶催化反应的同位素效应。酶同位素效应 一般都要联系辅酶的反应 ,通常是脱氢或加氧反应。涉及的同位素效应也相应的是 H 的一级 同位素效应。但在酶催化反应中 ,同位素效应显示出不同于经典同位素效应的特性 ,这类反应 已成为近年来的研究热点。图 7 [14 ]和图 8 [15 ]是两个酶同位素效应的实例。 图 7 酶同位素效应例 1 kcat / km = 47 ±7 (30 ℃,pH = 7) 所用的酶是人的 152脂肪氧化酶(Human 152lipoxygenase) 和亚油酸(Linoleic Acid) 图 8 酶同位素效应例 2 kcat/ km = 10. 4 ±0. 3 (37 ℃) PHM 是一种生物酶 ,全称是 peptidylglycine α2hydroxylating monooxygenase 从上面两个例子可以看出 ,在酶催化反应中 ,同位素效应的数值比较大 (一个是 47 ,一个 是 10. 4) ,远远超过了经典同位素效应的最大值 (一般为 7) ,这种较大数值的同位素效应提示 存在一种对称性过渡态。较大的同位素效应和经典的 H 转移理论不一致 ,这种现象在酶催化 反应中很常见 ,如今已被 H 的隧穿效应 (Hydrogen Tuneling) 很好地证实[16 ] 。这类问题的研究 是实现对酶催化反应中存在的涉及 C —H 活化的动力学转移的观测和研究的很好途径[15 ] 。 图 9 几何方法规则例 6 同位素效应中的一些计算规则 6. 1 几何方法规则 几何方法规则 (The Rule of Geometric Mean ,RGM) 例见 图 9。当 4 位碳上的 Ha 为 H 时 ,如果 Hb 的同位素效应 kHH/ kDH = 1. 2 ;且当 Hb 为 H ,Ha 的同位素效应为 kHH/ kHD = 4. 0 ,那么全是氘相对于全是氢时的同位素效应 kHH/ kDD = 1. 2 ×4. 0 = 4. 8。 6. 2 Swain2Schaad 规则 另外一种计算同位素效应的方法是 Swain2Schaad 规则[17 ] ,1958 年 ,Swain 通过精确的实验 得出结论 ,未知同位素效应可以通过已知相关的同位素效应计算得到 : 38

kk灯=(kk知)l4 (5) 其中指数1.442被称为Swair Schaad指数,推导过程如下 ”=eDrD=en≈A 是.e华亩wB叫:e5点=4贴话 1 、 KT 根据Swair-Schaad规则可以直接通过kk知计算kkr的数值为L.23,与实验报道数据 1.26基本一致1。 碳元素的SwairSchaad指数为l.9,即 1.9 k"a 几何方法规则(RGM经常和Swain-Schaad规则一起使用。 7结束语 同位素效应正在越来越为科学工作者所青睐,有效合理地利用同位素效应对于推导化学 反应机理探索化学动力学以及进行生物酶催化等诸多方面能起到事半功倍的效果。本文按 照类别逐一介绍一些同位素效应,但在实际工作中,不同种类的同位素效应可能同时出现,有 时也专门将多种同位素效应结合起来研究以全面透彻地探究问题的实质。我们相信,随着科 技的发展,同位素效应必将发挥越来越大的作用。 参考文献 1周公度,大学化学词典.北京:化学工业出版社,192 2高振衡.物理有机化学.北京:高等教育出版社,1982 3荣国城高等有机化学基础,上海:华东理工大学出版杜,北京:化学工业出版社201 4 6 Shiner VJ Jr .Rapp M W.Pinnick H R.et af.JAm Chem Soc,1970,92(1):232 7 do Amral L Bull H GJAm Chem Sor.1972 94(21):7579 8张永敏物理有机化学.上海:上海科学技术出版社200】 9 Zheng Yaju 97,19(35:8137 chJ.高等有机化学- 一反应、机理和结构.陶慎熹赵景译北京:人民教育出版社,1981 11 Pulav A Fry A.Tetruledron Letters,198627(42):5055 125najB/a元2000.39·5902 13 Bhrlich J 1.Hang CC.Cook PF.a.Jm Chem So.():666 Lewis ER Johansen E.HmnTR.m Chom S.(6) 16 Cha Y.Muray CJ,KinmunJ P.Sclene.1989,243(48%6):1325 17 Swain C G.Stivers E C.Reuwer J F.er al.J Am Chem Soc.1958 80:5885 39 1994-2009 China Academie Joural Electronic Publishing House.All rights reserved.http://www.enki.net
kH/ kT = ( kH/ kD) 1. 442 (5) 其中指数 1. 442 被称为 Swain2Schaad 指数 ,推导过程如下 : kH kD = e E « H - E « D RT = e h 2 RT ( ∑v H - ∑v D ) = e (1 - 1 2 ) ∑ v H 414cm - 1 ≈ A 1 - 1 2 H kH kT = e E « H - E « T RT = e h 2 RT ( ∑v H - ∑v T ) = e (1 - 1 3 ) ∑ v H 414cm - 1 ≈ A 1 - 1 3 H kH kT = kH kD 1 - 1 3 1 - 1 2 ≈ kH kD 1. 442 根据 Swain2Schaad 规则可以直接通过 kH/ kD 计算 kH/ kT 的数值为 1. 23 ,与实验报道数据 1. 26 基本一致[17 ] 。 碳元素的 Swain2Schaad 指数为 1. 9 ,即 : k ( 12 C) k ( 14 C) = k ( 12 C) k ( 13 C) 1. 9 几何方法规则(RGM) 经常和 Swain2Schaad 规则一起使用。 7 结束语 同位素效应正在越来越为科学工作者所青睐 ,有效合理地利用同位素效应对于推导化学 反应机理、探索化学动力学以及进行生物酶催化等诸多方面能起到事半功倍的效果。本文按 照类别逐一介绍一些同位素效应 ,但在实际工作中 ,不同种类的同位素效应可能同时出现 ,有 时也专门将多种同位素效应结合起来研究以全面透彻地探究问题的实质。我们相信 ,随着科 技的发展 ,同位素效应必将发挥越来越大的作用。 参 考 文 献 1 周公度. 大学化学词典. 北京 :化学工业出版社 ,1992 2 高振衡. 物理有机化学. 北京 :高等教育出版社 ,1982 3 荣国斌. 高等有机化学基础. 上海 :华东理工大学出版社 ,北京 :化学工业出版社 ,2001 4 Saunders W H Jr ,Ashe T A. J Am Chem Soc ,1969 ,91 (16) :4473 5 Carey F A ,Sundberg R J. Advanced Organic Chemistry. 2nd ed. New York :Plenum Press ,1983 6 Shiner V J Jr ,Rapp M W ,Pinnick H R , et al. J Am Chem Soc ,1970 ,92 (1) :232 7 do Amaral L ,Bull H G. J Am Chem Soc ,1972 ,94 (21) :7579 8 张永敏. 物理有机化学. 上海 :上海科学技术出版社 ,2001 9 Zheng Yajun ,Bruice T C. J Am Chem Soc ,1997 ,119 (35) :8137 10 March J. 高等有机化学 ———反应、机理和结构. 陶慎熹 ,赵景 译. 北京 :人民教育出版社 ,1981 11 Pulay A ,Fry A. Tetrahedron Letters ,1986 ,27 (42) :5055 12 Yang J. Biochemistry ,2000 ,39 :5902 13 Ehrlich J I ,Hwang C C ,Cook P F , et al. J Am Chem Soc ,1999 ,121 (29) :6966 14 Lewis E R ,Johansen E ,Holman T R. J Am Chem Soc ,1999 ,121 (6) :1395 15 Francisco W A ,Knapp N J ,Blackburn N J , et al. J Am Chem Soc ,2002 ,124 (28) :8194 16 Cha Y,Murray C J ,Klinman J P. Science ,1989 ,243 (4896) :1325 17 Swain C G,Stivers E C ,Reuwer J F , et al. J Am Chem Soc ,1958 ,80 :5885 39