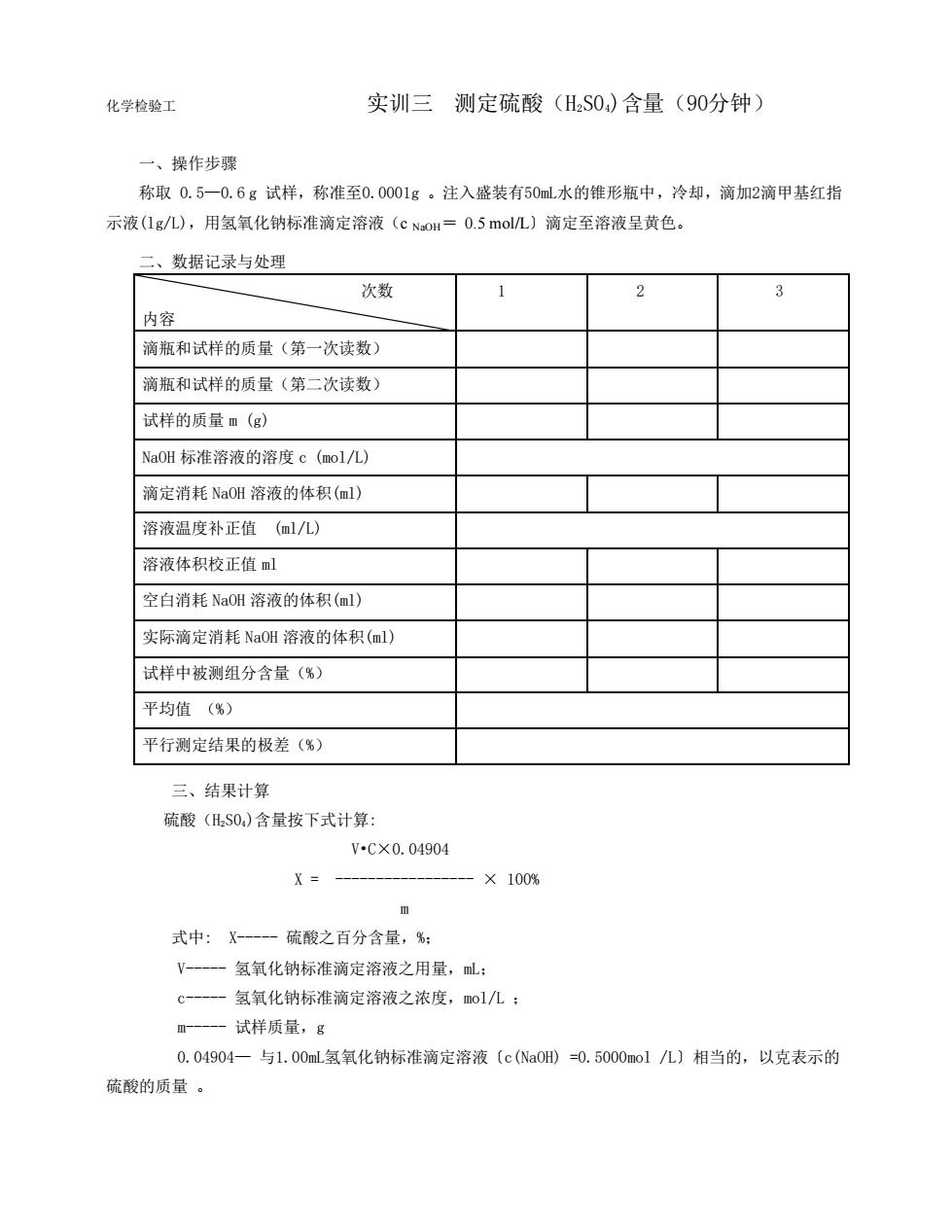
化学检验工 实训三测定硫酸(HS0)含量(90分钟) 一、操作步骤 称取0.5一0.6g试样,称准至0.0001g。注入盛装有50mL水的锥形瓶中,冷却,滴加2滴甲基红指 示液(1g/L),用氢氧化钠标准滴定溶液(C NaoH=0.5mol/L)滴定至溶液呈黄色。 、数据记录与处理 次数 1 2 3 内容 滴瓶和试样的质量(第一次读数) 滴瓶和试样的质量(第二次读数) 试样的质量m(g) NaOH标准溶液的溶度c(mol/L) 滴定消耗NaOH溶液的体积(ml) 溶液温度补正值(ml几) 溶液体积校正值ml 空白消耗NaOH溶液的体积(ml) 实际滴定消耗NaOH溶液的体积(ml) 试样中被测组分含量(%) 平均值(%) 平行测定结果的极差(%) 三、结果计算 硫酸(HS0)含量按下式计算: V-C×0.04904 X=- ×100% m 式中:X-硫酸之百分含量,%: V-一一氢氧化钠标准滴定溶液之用量,mL: c-一-氢氧化钠标准滴定溶液之浓度,mol/L: m-一一试样质量,g 0.04904一与1.00mL氢氧化钠标准滴定溶液(c(Na0H)=0.5000mol/L)相当的,以克表示的 硫酸的质量
化学检验工 实训三 测定硫酸(H2S04)含量(90分钟) 一、操作步骤 称取 0.5—0.6 g 试样,称准至0.0001g 。注入盛装有50mL水的锥形瓶中,冷却,滴加2滴甲基红指 示液(lg/L),用氢氧化钠标准滴定溶液(c NaOH= 0.5 mol/L〕滴定至溶液呈黄色。 二、数据记录与处理 次数 内容 1 2 3 滴瓶和试样的质量(第一次读数) 滴瓶和试样的质量(第二次读数) 试样的质量 m (g) NaOH 标准溶液的溶度 c (mol/L) 滴定消耗 NaOH 溶液的体积(ml) 溶液温度补正值 (ml/L) 溶液体积校正值 ml 空白消耗 NaOH 溶液的体积(ml) 实际滴定消耗 NaOH 溶液的体积(ml) 试样中被测组分含量(%) 平均值 (%) 平行测定结果的极差(%) 三、结果计算 硫酸(H2S04)含量按下式计算: V•C×0.04904 X = - × 100% m 式中: X- 硫酸之百分含量,%; V- 氢氧化钠标准滴定溶液之用量,mL; c- 氢氧化钠标准滴定溶液之浓度,mol/L ; m- 试样质量,g 0.04904— 与1.00mL氢氧化钠标准滴定溶液〔c(NaOH) =0.5000mol /L〕相当的,以克表示的 硫酸的质量