
摩尔气体常数的测定 无机化学实验教学团队
摩尔气体常数的测定 无机化学实验教学团队

实验目的 1.了解置换法测定摩尔气体常数的原理和方法 2.掌握理想气体方程式和气体分压定律的有关 计算 3.联系测量气体体积的操作以及分析天平,气 压计的使用
1.了解置换法测定摩尔气体常数的原理和方法 2.掌握理想气体方程式和气体分压定律的有关 计算 3.联系测量气体体积的操作以及分析天平,气 压计的使用 一、实验目的

二、实验原理 在一定温度(①下,由实验测定一定物质的量 (m)的某气体(看作理想气体)的p、V, 应用理想气体状态方程式:pV=RT,即可求得摩尔 气体常数R。 本实验是由 Mg+H,SO4(过量)=MgSO4+H2个 PH2V=nH2RT 得 R=
在一定温度(T)下,由实验测定一定物质的量 (n)的某气体(看作理想气体)的p、V, 应用理想气体状态方程式 :pV = nRT,即可求得摩尔 气体常数R。 本实验是由 得 pH2V = nH2RT H2 H2 p V R n T = Mg H SO ( ) MgSO H + = + 2 4 4 2 过量 二、实验原理

8+H2SO4=MgSO4+H2↑ 反应生成的氢气的体积V可以通过实验测定; 生成的氢气的物质的量(H,)可以根据反 应的化学计量关系,由反应的镁条质量求 得; 实验时的温度T和压力D可以分别由温度计和 压力计测得; 由于氢气是从水溶液中溢出,所以量气管上 方的氢气中还混有饱和水蒸气
反应生成的氢气的体积V 可以通过实验测定; 生成的氢气的物质的量n(H2)可以根据反 应的化学计量关系,由反应的镁条质量求 得; 实验时的温度T和压力p可以分别由温度计和 压力计测得; 由于氢气是从水溶液中溢出,所以量气管上 方的氢气中还混有饱和水蒸气。 Mg + H2 SO4 = MgSO4 + H2

查出该温度下水的饱和蒸汽压(见附录P159) 根据理想气体分压定律可知: 氢气的分压应由实验时的大气压减去该温度 下水的饱和蒸汽压 即:pH)=p-p(H2O)
查出该温度下水的饱和蒸汽压(见附录 P159) 根据理想气体分压定律可知: 氢气的分压应由实验时的大气压减去该温度 下水的饱和蒸汽压 即: p(H2 )=p - p(H2O)
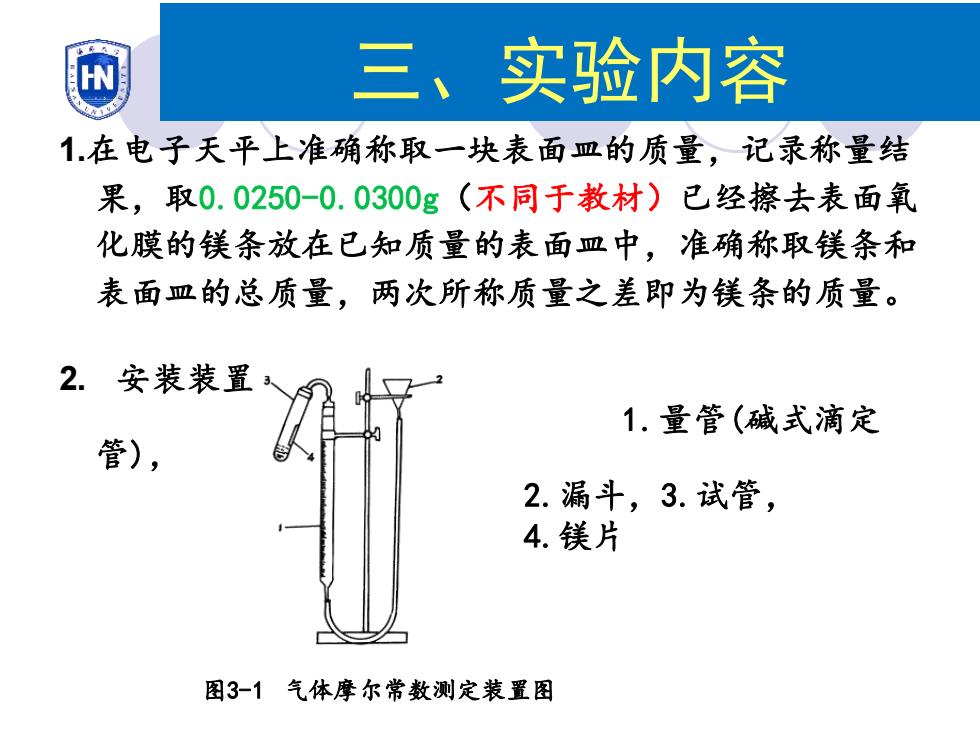
HN 三、实验内容 1在电子天平上准确称取一块表面皿的质量,记录称量结 果,取0.0250-0.0300g(不同于教材)已经擦去表面氧 化膜的镁条放在已知质量的表面皿中,准确称取镁条和 表面皿的总质量,两次所称质量之差即为镁条的质量。 2.安装装置 1.量管(碱式滴定 管), 2.漏斗,3.试管, 4.镁片 图3-1气体摩尔常数测定装置图
1.在电子天平上准确称取一块表面皿的质量,记录称量结 果,取0.0250-0.0300g(不同于教材)已经擦去表面氧 化膜的镁条放在已知质量的表面皿中,准确称取镁条和 表面皿的总质量,两次所称质量之差即为镁条的质量。 2. 安装装置 1.量管(碱式滴定 管), 2.漏斗,3.试管, 4.镁片 图3-1 气体摩尔常数测定装置图 三、实验内容

3.按图3-1连接好装置后,取下试管塞,移动漏斗, 使量器管中的水面略低于刻度,最后固定好漏斗 的位置。 4.初步检查仪器是否漏气,检查方法如下,塞紧装 置中所有橡皮塞后,将漏斗向下移动一段距离, 使漏斗内液面与量气管内液面维持一定的液面差, 再固定漏斗位置。如果量气管内的液面位置能恒 定,说明仪器不漏气
3.按图3-1连接好装置后,取下试管塞,移动漏斗, 使量器管中的水面略低于刻度,最后固定好漏斗 的位置。 4.初步检查仪器是否漏气,检查方法如下,塞紧装 置中所有橡皮塞后,将漏斗向下移动一段距离, 使漏斗内液面与量气管内液面维持一定的液面差, 再固定漏斗位置。如果量气管内的液面位置能恒 定,说明仪器不漏气

5.取下试管,用漏斗往里面加入3mL3M疏酸(不要 沾壁),将镁条蘸少量水,附着在试管壁上(不要接 触酸),塞紧试管,按步骤4再次检查气密性。 6如果装置不漏气,调整漏斗位置,使量气管液面 和漏斗液面在同一水平面上(?),然后准确读出 量气管内水的凹面最低点的读数V1。 7轻轻摇动试管,使镁条落入硫酸中,镁片立即与 硫酸反应放出氢气,反应产生的氢气进入量气管内, 此时量气管内液面开始下降。漏斗必须跟随下降
5.取下试管,用漏斗往里面加入 3mL 3M 硫酸(不要 沾壁),将镁条蘸少量水,附着在试管壁上(不要接 触酸),塞紧试管,按步骤4再次检查气密性。 6.如果装置不漏气,调整漏斗位置,使量气管液面 和漏斗液面在同一水平面上(?),然后准确读出 量气管内水的凹面最低点的读数V1。 7.轻轻摇动试管,使镁条落入硫酸中,镁片立即与 硫酸反应放出氢气,反应产生的氢气进入量气管内, 此时量气管内液面开始下降。漏斗必须跟随下降

●8、反应结束,待反应管冷至室温,调两液 面水平一致,读取量气管数值,1-2min 后,再次读取量气管数值,直至两次读数 一致(相差不超过0.05ml),记下读数 (V2) ●9、 记录实验时的温度T和大气压p ●10、要求至少做两次平行测量
⚫8、反应结束,待反应管冷至室温,调两液 面水平一致,读取量气管数值,1-2min 后,再次读取量气管数值,直至两次读数 一致(相差不超过0.05 ml),记下读数 (V2 )。 ⚫9、记录实验时的温度T和大气压p ⚫10、要求至少做两次平行测量
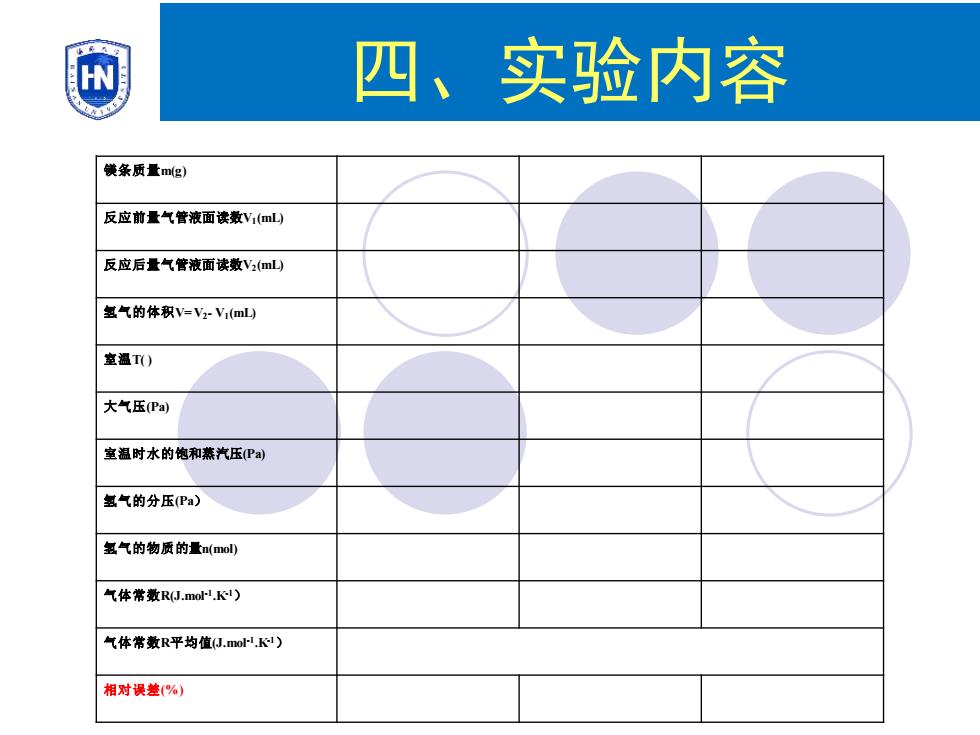
四、实验内容 饑条质量m(g) 反应前量气管液面读数V1(mL) 反应后量气管液面读数V2(mL) 氢气的体积V=Vz-V(mL山 室温T) 大气压Pa) 室温时水的饱和燕汽压Pa) 氢气的分压Pa) 氢气的物质的量amol) 气体常数RJ.moK) 气体常数R平均值J.mol.) 相对误差(%)
镁条质量m(g) 反应前量气管液面读数V1(mL) 反应后量气管液面读数V2(mL) 氢气的体积V=V2- V1(mL) 室温T( ) 大气压(Pa) 室温时水的饱和蒸汽压(Pa) 氢气的分压(Pa) 氢气的物质的量n(mol) 气体常数R(J.mol-1 .K-1) 气体常数R平均值(J.mol-1 .K-1) 相对误差(%) 四、实验内容