
无机化学实验 困 硫酸铜晶体的制备 海南大学理学院 2020-10-09
无机化学实验 硫酸铜晶体的制备 海南大学理学院 2020-10-09

实验目的 ●1.进一步熟悉学习加热、溶解、蒸发、过滤、重结晶、 抽滤等基本操作。 ·2.通过氧化、水解等反应,了解重结晶提纯硫酸铜的 方法和原理
实验目的 ●1. 进一步熟悉学习加热、溶解、蒸发、过滤、重结晶、 抽滤等基本操作。 ●2. 通过氧化、水解等反应,了解重结晶提纯硫酸铜的 方法和原理

实验原理 硫酸铜晶体(CuS04·5H20)俗称胆矾或蓝矾,它是一种蓝 色三斜晶体,易溶于水,难溶于无水乙醇。在干燥空气中会缓 慢风化,150℃以上失去5个结晶水,成为白色的硫酸铜粉末。 无水硫酸铜有极强的吸水性,吸收后变蓝色,因此常用来检验 某些有机液体中是否残留有水分,也可以作为干燥剂。硫酸铜 用途广泛,是制备其他铜化合物的重要原料,常用作印染工业 的媒染剂、农业的杀虫剂、水的杀菌剂、木材的防腐剂,并且 是电镀铜的主要原料。 ● 纯铜是不活泼金属,不能溶于非氧化性的酸中。但其氧化 物稀酸中却极易溶解。因此在工业上制备胆矾时,先将铜在空 气中煅烧成氧化铜,然后与适当浓度的硫酸作用生成硫酸铜。 本实验直接以粗Cu0粉末与稀H2S04反应制备,反应方程式如下: Cu0+H2S04=CuS04 H20
实验原理 ● 硫酸铜晶体(CuSO4·5H2O)俗称胆矾或蓝矾,它是一种蓝 色三斜晶体,易溶于水,难溶于无水乙醇。在干燥空气中会缓 慢风化,150℃以上失去5个结晶水,成为白色的硫酸铜粉末。 无水硫酸铜有极强的吸水性,吸收后变蓝色,因此常用来检验 某些有机液体中是否残留有水分,也可以作为干燥剂。硫酸铜 用途广泛,是制备其他铜化合物的重要原料,常用作印染工业 的媒染剂、农业的杀虫剂、水的杀菌剂、木材的防腐剂,并且 是电镀铜的主要原料。 ● 纯铜是不活泼金属,不能溶于非氧化性的酸中。但其氧化 物稀酸中却极易溶解。因此在工业上制备胆矾时,先将铜在空 气中煅烧成氧化铜,然后与适当浓度的硫酸作用生成硫酸铜。 本实验直接以粗CuO粉末与稀H2SO4反应制备,反应方程式如下: ● CuO+H2SO4 = CuSO4 + H2O

实验原理 ● 所得CuS04粗品中还含有不溶性和可溶性杂质FeS04、Fe2(S04)3。 不溶性杂质可用溶解、过滤法除去。Fe2+离子需用氧化剂H202或 Br2氧化成Fe3+离子,然后调节溶液的pH值至3.5~4.0(注意: 不能使pH≥4,否则会析出浅蓝色碱式硫酸铜沉淀,影响产品的 质量和产率),再加热煮沸,使Fe3+离子水解为Fe(OH)3沉淀, 再过滤除去。反应式如下: ●2Fe2++H202+2H+=2Fe3++2H20 ·Fe3++3H20=Fe(0H)3↓+3H+ ● 除去杂质后的CuS04溶液,再加热蒸发,浓缩至出现晶膜,冷 却,结晶,减压抽滤除去其他微量的可溶性杂质,即可得到较纯 的蓝色CuS04·5H2,0晶体
实验原理 ● 所得CuSO4粗品中还含有不溶性和可溶性杂质FeSO4、Fe2(SO4)3。 不溶性杂质可用溶解、过滤法除去。Fe2+ 离子需用氧化剂H2O2或 Br2氧化成Fe3+ 离子,然后调节溶液的pH值至3.5~4.0(注意: 不能使pH≥4,否则会析出浅蓝色碱式硫酸铜沉淀,影响产品的 质量和产率),再加热煮沸,使Fe3+ 离子水解为Fe(OH)3 沉淀, 再过滤除去。反应式如下: ● 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O ● Fe3+ + 3H2O=Fe(OH)3↓ +3H+ ● 除去杂质后的CuSO4溶液,再加热蒸发,浓缩至出现晶膜,冷 却,结晶,减压抽滤除去其他微量的可溶性杂质,即可得到较纯 的蓝色CuSO4· 5H2O晶体
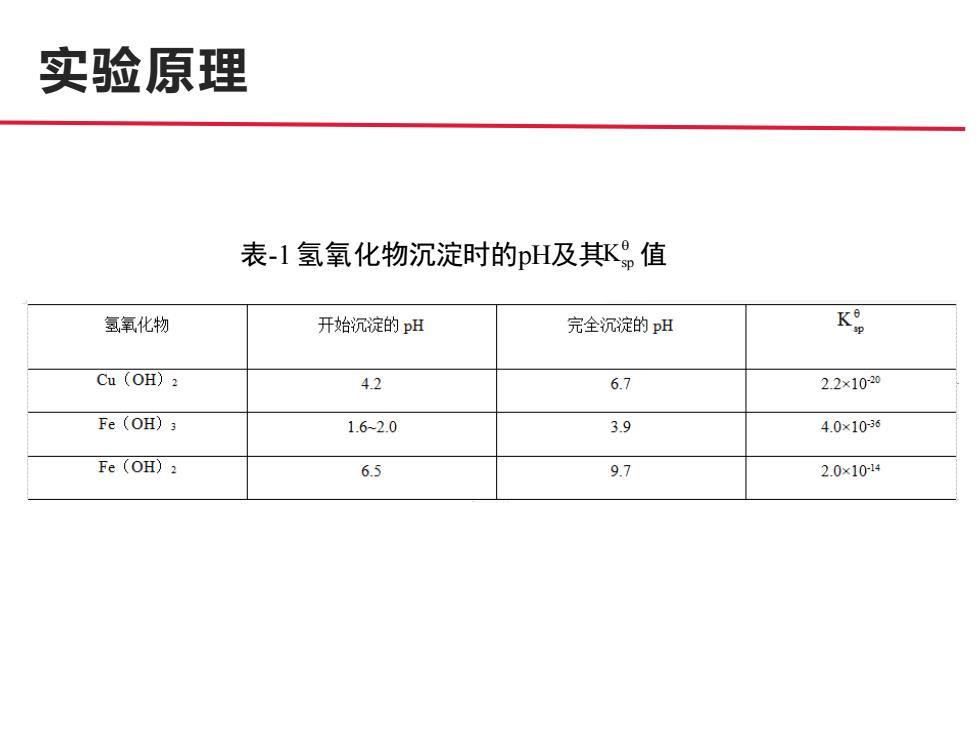
实验原理 表-1氢氧化物沉淀时的pH及其值 氢,氧化物 开始沉淀的pH 完全沉淀的pH K Cu (OH)2 4.2 6.7 2.2×1020 Fe(OH)3 1.6-2.0 3.9 4.0×10-36 Fe (OH)2 6.5 9.7 2.0×1014
实验原理 表-1 氢氧化物沉淀时的pH及其 Ksp 值

仪器和试剂 ●仪器:台秤(0.1g),循环水式真空泵,封闭电炉, 体式显微镜,烧杯(200L),布氏漏斗,抽滤瓶, 蒸发皿,量筒(10mL,50mL各1个),表面皿,漏 斗,水浴锅。 ●试剂:CuO(s,工业级),NH3H2O(2moL1), H2O2(3%),HCI (2 mol.L-1),H2SO4 (1 mol-L-1, 3molL1),CuSO45H2O晶种,pH试纸,滤纸,超 细丝线
仪器和试剂 ●仪器:台秤(0.1 g),循环水式真空泵,封闭电炉, 体式显微镜,烧杯(200 mL),布氏漏斗,抽滤瓶, 蒸发皿,量筒(10 mL,50 mL各1个),表面皿,漏 斗,水浴锅。 ●试剂:CuO(s,工业级), NH3·H2O (2 mol·L-1), H2O2(3%),HCl(2 mol·L-1),H2SO4(1 mol·L-1 , 3 mol·L-1),CuSO4·5H2O晶种,pH试纸,滤纸,超 细丝线

实验步骤 ●1.硫酸铜的制备 称取粗CuO约5g,放于200mL的小烧杯中,向其 中滴加20mL3moL1H2S04溶液,用小火加热,边加 热边搅拌,5min后,加入25mL纯水,继续加热20min, 其间可适当加少量纯水使溶液体积保持在55L左右。 趁热减压抽滤,将滤液转移到蒸发皿中,盖上表面皿, 水浴加热、蒸发浓缩至溶液表面出现晶膜,冷却结晶、 抽滤,称重,计算产率
实验步骤 ●1. 硫酸铜的制备 ● 称取粗 CuO约5 g,放于200mL的小烧杯中,向其 中滴加20mL 3 mol·L-1 H2SO4溶液,用小火加热,边加 热边搅拌,5 min后,加入25 mL纯水,继续加热20 min, 其间可适当加少量纯水使溶液体积保持在55 mL左右。 趁热减压抽滤,将滤液转移到蒸发皿中,盖上表面皿, 水浴加热、蒸发浓缩至溶液表面出现晶膜,冷却结晶、 抽滤,称重,计算产率

实验步骤 ·2.硫酸铜的提纯 称取粗硫酸铜8g,加入50mL纯水,加热溶解。将 溶液冷却至约40℃,搅拌滴加5mL3%H,O,继续搅拌 加热3~5min后,逐滴加入2mol:L-1NH3H2O至溶液的 pH3.5~4.0。继续加热10min,趁热抽滤,将滤液转入 干净的蒸发皿中,用1moL1H2SO4溶液调节溶液的pH 至1~2,盖上表面皿,然后水浴加热、蒸发浓缩至溶液表 面刚出现晶膜为止,冷却结晶、抽滤、取出晶体,用滤纸 将其表面的水分吸干,称重,计算产率
实验步骤 ●2. 硫酸铜的提纯 ● 称取粗硫酸铜8 g,加入50 mL纯水,加热溶解。将 溶液冷却至约40℃,搅拌滴加5 mL 3%H2O2,继续搅拌 加热3~5 min后,逐滴加入2 mol·L-1 NH3·H2O 至溶液的 pH 3.5~4.0。继续加热10 min,趁热抽滤,将滤液转入 干净的蒸发皿中,用1 mol·L-1 H2SO4溶液调节溶液的pH 至1~2,盖上表面皿,然后水浴加热、蒸发浓缩至溶液表 面刚出现晶膜为止,冷却结晶、抽滤、取出晶体,用滤纸 将其表面的水分吸干,称重,计算产率
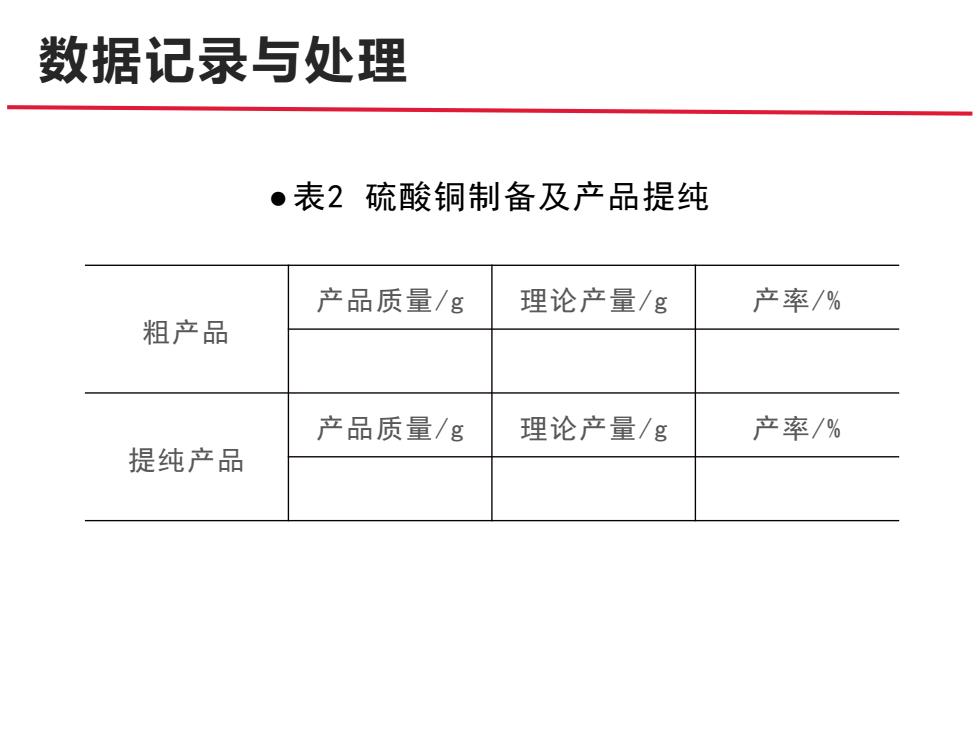
数据记录与处理 ●表2硫酸铜制备及产品提纯 产品质量/g 理论产量/g 产率/% 粗产品 产品质量/g 理论产量/g 产率/% 提纯产品
数据记录与处理 ●表2 硫酸铜制备及产品提纯 粗产品 产品质量/g 理论产量/g 产率/% 提纯产品 产品质量/g 理论产量/g 产率/%

思考题 ●1.硫酸铜提纯实验中为什么要将Fe2+氧化为Fe3+,其 他氧化剂,如KMnO4、K2Cr2O7、Br2等都能将Fe2+氧 化为Fe3+,为什么本实验采用H,O,作氧化剂? 2.除去时,溶液的pH调节为pH3.5~4.0,若pH太大或 太小有什么影响? ●3.为何要将除去Fe3+后的滤液的pH调节至1~2,再进 行蒸发浓缩?
思考题 ●1. 硫酸铜提纯实验中为什么要将Fe2+氧化为Fe3+,其 他氧化剂,如KMnO4、K2Cr2O7、Br2等都能将Fe2+氧 化为Fe3+,为什么本实验采用H2O2作氧化剂? ●2. 除去时,溶液的pH调节为pH 3.5~4.0,若pH太大或 太小有什么影响? ●3. 为何要将除去Fe3+后的滤液的pH调节至1~2,再进 行蒸发浓缩?