
第一章糖类 1.1蒽酮比色法测定总糖 一、目的:学习慈酮比色法测定总糖的原理。 葸酮可与其他一些糖类发生反应,但显现的颜色不同。当样品中存有含较多色氨酸的蛋 白质时,反应不稳定,呈现红色。对于以上特定的糖类,反应较稳定。 木法多用于测定糖原含量,亦可用于测定葡萄糖含量。 三、实验材料和仪器 无蛋白滤液或其他生物材料。 吸管5ml(×1lmL(×2)、0.5mL(×2)0.2mL(×1)0.1mL(×1) 试管1.5×15cm(×7). 721型(或722型)分光光度计。 水浴锅 冰浴银 试剂 1.蒽酮试剂:取2g蒽酮溶于1000mL80%()硫酸中,当日配制使用。 3.标准糖原溶液(0memL):100mg糖原,用蒸馏水定容至1000mL(可滴加几滴甲米 作防腐剂)。 四、操作 1.制作标准曲线:取干试管6支,按下表操作: 步 1 2 3 45 标准糖溶液(mL) 0 010030405 蒸馏水 10.90.8070.60.5 置冰水浴中5分钟 随酮试剂 沸水浴中准确煮沸10分钟,自来水冷却,室温放置10分钟,比色 2.样品含糖量测定 吸取 浸于冰浴中冷却,再加入 ml 1mL无蛋白糖类溶液 相同,测的光密度值由标准曲线查 出 ▣巴 做标 生曲 品液的糖含量。 3.计算:糖含量%=100×A×CW A:为样品稀释后的体积。 C:为标准曲线查出的糖含量mg/ml W:为样品的质量
第一章 糖类 1.1 蒽酮比色法测定总糖 一、目的:学习蒽酮比色法测定总糖的原理。 二、原理:蒽酮比色法是一个快速而简便的定糖方法。蒽酮可以和游离的己糖或多糖中的己 糖基,戊醛糖及己糖醛酸起反应,反应后溶液呈蓝绿色,在 620nm 处有最大吸收。 蒽酮可与其他一些糖类发生反应,但显现的颜色不同。当样品中存有含较多色氨酸的蛋 白质时,反应不稳定,呈现红色。对于以上特定的糖类,反应较稳定。 木法多用于测定糖原含量,亦可用于测定葡萄糖含量。 三、实验材料和仪器 无蛋白滤液或其他生物材料。 吸管 5m1(×1)、lmL(×2)、0.5 mL(×2)、0.2mL(×1)、0.1mL(×1) 试管 1.5×15cm(×7)。 721 型(或 722 型)分光光度计。 水浴锅 冰浴锅 试剂 1.蒽酮试剂:取 2g 蒽酮溶于 1 000 mL 80%(V/V)硫酸中,当日配制使用。 2.标准葡萄糖溶液(0.lmg/mL):100mg 葡萄糖用蒸馏水定容至 1000m1(可滴加几滴甲 苯作防腐剂)。 3.标准糖原溶液(0.lmg/mL):100mg 糖原,用蒸馏水定容至 1 000mL(可滴加几滴甲苯 作防腐剂)。 四、操作 1. 制作标准曲线:取干试管 6 支,按下表操作: 步骤 管号 0 1 2 3 4 5 标准糖溶液(mL) 0 0.1 0.2 0.3 0.4 0.5 蒸馏水 1 0.9 0.8 0.7 0.6 0.5 置冰水浴中 5 分钟 蒽酮试剂 4 4 4 4 4 4 沸水浴中准确煮沸 10 分钟,自来水冷却,室温放置 10 分钟,比色 O.D620nm 2. 样品含糖量测定:吸取 1 mL 无蛋白糖类溶液置试管中,浸于冰浴中冷却,再加入 4 mL 蒽酮试剂,沸水浴中煮沸 10 分钟,取出后自来水冷却后比色,其他条件与做标准曲线 相同,测得的光密度值由标准曲线查算出样品液的糖含量。 3.计算:糖含量%=100×A×C/W A:为样品稀释后的体积。 C:为标准曲线查出的糖含量 mg/mL. W:为样品的质量

1.2还原糖和总糖的测定—一3,5-二硝基水杨酸比色法 一、目的 原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光 二、原理 还原糖的测定是糖定量测定的基本方法。还原糖是指含有自由醛基或酮基的糖类,单糖 都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还 原糖。利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还 原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中 还原糖和总糖的含量(还原糖以葡萄糖含量计)。 还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5二硝基水杨酸则被还原为棕红 色的3-氨基5-硝基水杨酸。 在 定范围内,还原糖的量与棕红色物质颜色的深浅成正比关 系,利用分光光度计,在540m波长下测定光密度值,查对标准曲线并计算,便可求出样 品中还原糖和总糖的含量。由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所 以在计算多糖含量时应乘以0.9。 OH NO2 OH NH2 HOOC- +原塘 NO2 NO2 (DNS) (3-氨基-5-墓水杨酸)? 三、实验材料、主要仪器和试剂 1.实验材料 小麦面粉:精密pH试纸。 2.主要仪器 (1)具塞玻璃刻度试管:20mL×11 (2)大离心管:50mL×2 (3)烧杯:100mX1 1mL×1:2mL×2:10mL×1 浴锅 (8)沸水溶 (9)离心机 (10)天平 (1)分光光度计 3.试剂 (1)1mgmL葡萄糖标准液 准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后, 转移到00:用意 定容至100mL,混匀,4℃冰箱中保存备用。 (2 DNS 5g亚硫酸钠,搅于 溶解 (3)碘-碘化钾溶液:称取5g碘和10g碘化钾,溶于100mL蒸馏水中。 (4)酚酞指示剂:称取0.1g酚酞,溶于250mL70%乙醇中。 (5)6mol/LHC1和6 mol/L NaOH各100mL
1.2 还原糖和总糖的测定——3,5-二硝基水杨酸比色法 一、目的 掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的 使用。 二、原理 还原糖的测定是糖定量测定的基本方法。还原糖是指含有自由醛基或酮基的糖类,单糖 都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还 原糖。利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还 原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中 还原糖和总糖的含量(还原糖以葡萄糖含量计)。 还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红 色的 3-氨基-5-硝基水杨酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关 系,利用分光光度计,在 540nm 波长下测定光密度值,查对标准曲线并计算,便可求出样 品中还原糖和总糖的含量。由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所 以在计算多糖含量时应乘以 0.9。 HOOC NO OH NO2 2 + 还原糖 NO OH NH2 2 (DNS) (3-氨基-5-硝基水 杨酸 ) ? HOOC 三、实验材料、主要仪器和试剂 1. 实验材料 小麦面粉;精密 pH 试纸。 2. 主要仪器 (1)具塞玻璃刻度试管:20mL×11 (2)大离心管:50mL×2 (3)烧杯:100mL×1 (4)三角瓶:100mL×1 (5)容量瓶:100mL×3 (6)刻度吸管:1mL×1;2mL×2;10mL×1 (7)恒温水浴锅 (8)沸水浴 (9)离心机 (10)天平 (11)分光光度计 3. 试剂 (1)1mg/mL 葡萄糖标准液 准确称取 80℃烘至恒重的分析纯葡萄糖 100mg,置于小烧杯中,加少量蒸馏水溶解后, 转移到 100mL 容量瓶中,用蒸馏水定容至 100mL,混匀,4℃冰箱中保存备用。 (2)3,5-二硝基水杨酸(DNS)试剂 将 6.3g DNS 和 262mL 2mol/L NaOH 溶液,加到 500mL 含有 185g 酒石酸钾钠的热水溶 液中,再加 5g 结晶酚和 5g 亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至 1000mL,贮于棕 色瓶中备用。 (3)碘-碘化钾溶液:称取 5g 碘和 10g 碘化钾,溶于 100mL 蒸馏水中。 (4)酚酞指示剂:称取 0.1g 酚酞,溶于 250mL 70%乙醇中。 (5)6 mol/L HCl 和 6 mol/L NaOH 各 100mL

四、操作步骤 1。制作葡萄糖标准曲线 取7支20mL具塞刻度试管编号,按表1分别加入浓度为1mgmL的葡萄糖标准液、蒸 馏水和3,5二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。 表1萄萄糖标准由 线制作 管号1mg/mL.萄萄糖标准液(ml)蒸馏水(mL)DNS(mL)葡萄糖含量(mg)O.D.s40m 16 0.6 1.4 15 0.6 0.8 12 0.8 0.8 将各管摇匀,在沸水浴中准确加热5min,取出,冷却至室温,用蒸馏水定容至20mL 加塞后颠倒混匀,在分光光度计上进行比色。调波长540加m,用0号管调零点,测出1~6 号管的光密度值。以光密度值为纵坐标,葡萄糖含量(mg)为横坐标,在坐标纸上绘出标 准曲线。 2.样品中还原糖和总糖的测定 (1)还原糖的提取 准确称取3O0g食用面粉,放入100mL烧杯中,先用少量蒸馏水调成糊状,然后加入 50mL恭馏水,授匀,置于50℃恒温水浴中保温20mim,使还原糖浸出。将浸出液(含沉淀】 转移到50mL离心管中,于4O00rmn下离心5mim,沉淀可用20mL蒸馏水洗一次,再离心 将二次离心的上清液收集在100mL容量瓶中,用蒸馏水定容至刻度,混匀,作为还原糖待 测液。 (2)总糖的水解和提取 ,加15mL蒸馏水及10mL6 mol/L HCI 元 中 中的水 定容后的水解液过滤,取滤液 容,混 匀,作为总糖待测液。 (3)显色和比色 取4支20mL具塞刻度试管,编号,按表2所示分别加入待测液和显色剂,空白调零可 使用制作标准曲线的0号管。加热、定容和比色等其余操作与制作标准曲线相同。 表2祥品还原糖测定 管号 还原特测液 DNS 查曲线萄萄糖量 (OD: (me) 05 15 15 0.5 1.5 1.5 1.5 L10 五、结果与计算 .竹出 8号管光密度值的平均值和9、10管光密度值的平均值,在标准曲线上分别 查出相应的还原糖毫克数,按下式计算出样品中还原糖和总糖的百分含量。 提取液总体积 查曲线所得简萄糖毫克数× 还原塘(%) 测定时取用体积 -X100 样品毫克数 总糖(%)= 查曲线所得水解后还原糖毫克数×稀释倍数 样品毫克数 ×0.9×100
四、操作步骤 1. 制作葡萄糖标准曲线 取 7 支 20mL 具塞刻度试管编号,按表 1 分别加入浓度为 1mg/mL 的葡萄糖标准液、蒸 馏水和 3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。 表 1 葡萄糖标准曲线制作 管号 1mg/mL 葡萄糖标准液(mL) 蒸馏水(mL) DNS(mL) 葡萄糖含量(mg) O.D.540nm 0 0 2 1.5 0 1 0.2 1.8 1.5 0.2 2 0.4 1.6 1.5 0.4 3 0.6 1.4 1.5 0.6 4 0.8 1.2 1.5 0.8 5 1.0 1.0 1.5 1.0 6 1.2 0.8 1.5 1.2 将各管摇匀,在沸水浴中准确加热 5min,取出,冷却至室温,用蒸馏水定容至 20mL, 加塞后颠倒混匀,在分光光度计上进行比色。调波长 540nm,用 0 号管调零点,测出 1~6 号管的光密度值。以光密度值为纵坐标,葡萄糖含量(mg)为横坐标,在坐标纸上绘出标 准曲线。 2. 样品中还原糖和总糖的测定 (1)还原糖的提取 准确称取 3.00g 食用面粉,放入 100mL 烧杯中,先用少量蒸馏水调成糊状,然后加入 50mL 蒸馏水,搅匀,置于 50℃恒温水浴中保温 20min,使还原糖浸出。将浸出液(含沉淀) 转移到 50mL 离心管中,于 4 000r/min 下离心 5min,沉淀可用 20mL 蒸馏水洗一次,再离心, 将二次离心的上清液收集在 100mL 容量瓶中,用蒸馏水定容至刻度,混匀,作为还原糖待 测液。 (2)总糖的水解和提取 准确称取 1.00g 食用面粉,放入 100mL 三角瓶中,加 15mL 蒸馏水及 10mL 6mol/L HCl, 置沸水浴中加热水解 30min(水解是否完全可用碘-碘化钾溶液检查)。待三角瓶中的水解液 冷却后,加入 1 滴酚酞指示剂,用 6mol/LNaOH 中和至微红色,用蒸馏水定容在 100mL 容 量瓶中,混匀。将定容后的水解液过滤,取滤液 10mL,移入另一 100mL 容量瓶中定容,混 匀,作为总糖待测液。 (3)显色和比色 取 4 支 20mL 具塞刻度试管,编号,按表 2 所示分别加入待测液和显色剂,空白调零可 使用制作标准曲线的 0 号管。加热、定容和比色等其余操作与制作标准曲线相同。 表 2 样品还原糖测定 管 号 还原糖待测液 (mL) 总糖待测液 (mL) 蒸馏水 (mL) DNS (mL) 光密度值 (OD540nm) 查曲线葡萄糖量 (mg) 7 0.5 1.5 1.5 8 0.5 1.5 1.5 9 1 1 1.5 10 1 1 1.5 五、结果与计算: 计算出 7、8 号管光密度值的平均值和 9、10 管光密度值的平均值,在标准曲线上分别 查出相应的还原糖毫克数,按下式计算出样品中还原糖和总糖的百分含量。 还原糖(%)= 查曲线所得葡萄糖毫克数× 提取液总体积 测定时取用体积 ×100 样品毫克数 总糖(%)= 查曲线所得水解后还原糖毫克数×稀释倍数 ×0.9×100 样品毫克数

大、注意事项 L.离心时对称位置的离心管必须配平。 2.标准曲线制作与样品测定应同时进行显色,并使用同一空白调零点和比色。 3.面粉中还原糖含量较少,计算总糖时可将其合并入多糖一起考虑。 七、思考题 1.3,5二硝基水杨酸比色法是如何对总糖进行测定的? 2.如何正确绘制和使用标准曲线? 参考答案 1。植物中的总糖包括单糖、寡糖和多糖,单糖是还原糖,可直接测定。而没有还原性的 浓度的酸在加热的条件下水解成有还原性的单糖,还原糖在碱性条件 酸及 对标准曲线 由于多糖水解为单糖时,每断裂 求出 个糖苷键需要加 一分子水,所 金量时应乘 以0.9. 2.标准曲线应在坐标纸上绘制,横坐标轴距坐标纸底边1.5~2cm,标示出刻度和葡萄糖的 毫克数:纵坐标轴距坐标纸左边1.5~2cm,标示刻度和光密度值:曲线为过原点的直线,测 定点均匀分布在直线的两侧:标准曲线只能在测试条件完全相同的情况下,用于确定样品中 的物质含量。对于重复的测定,应取吸光度的平均值查标准曲线:测定数据不应记在标准曲 线上
六、注意事项 1. 离心时对称位置的离心管必须配平。 2. 标准曲线制作与样品测定应同时进行显色,并使用同一空白调零点和比色。 3. 面粉中还原糖含量较少,计算总糖时可将其合并入多糖一起考虑。 七、思考题 1.3,5-二硝基水杨酸比色法是如何对总糖进行测定的? 2.如何正确绘制和使用标准曲线? 参考答案 1.植物中的总糖包括单糖、寡糖和多糖,单糖是还原糖,可直接测定。而没有还原性的 寡糖和多糖,需用高浓度的酸在加热的条件下水解成有还原性的单糖,还原糖在碱性条件下 加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的 3-氨基-5-硝基水杨 酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成一定比例关系,利用分光光度计, 在 540nm 波长下测定光密度值,查对标准曲线并计算,可求出样品中还原糖和总糖的含量。 由于多糖水解为单糖时,每断裂一个糖苷键需要加入一分子水,所以在计算多糖含量时应乘 以 0.9。 2.标准曲线应在坐标纸上绘制,横坐标轴距坐标纸底边 1.5~2cm,标示出刻度和葡萄糖的 毫克数;纵坐标轴距坐标纸左边 1.5~2cm,标示刻度和光密度值;曲线为过原点的直线,测 定点均匀分布在直线的两侧;标准曲线只能在测试条件完全相同的情况下,用于确定样品中 的物质含量。对于重复的测定,应取吸光度的平均值查标准曲线;测定数据不应记在标准曲 线上

1.3总糖和还原糖的测定一斐林氏法 总糖和还原糖测定方法较多,如3,5一二硝基水杨酸法、碱性铜试剂法、葱酮比色法、 斐林氏法等。这里只介绍斐林氏法。 一、目的 学习堂挥生产实践中常用的快速定糖方法 二、原理 还原糖在碱性溶液中能将Ag Hg C(CNs等金属离子还原 而糖本身则氧 进行 化 中血)。当甲乙两液 、 化钠 COONa COONa H-C-OH +C2*一 H-6O Cu +H:O H-C-OH H-CO 酒石酸络的()钾钠盐 酒石酸络铜(Ⅱ)钾钠盐在与还原糖共热时,二价铜离子即被还原成一价的氧化亚铜红 色沉淀。 COONa H-CuCH-OH(CHOH)CHO H-C-0 和甸裙 Cook CH2OH(CHOH)4COOH Cu2O 葡萄糖酸 氧化亚铜 此氧化亚铜与试剂中亚铁氰化钾反应生成可溶性的亚铁氯酸络铜(【)钾盐。 CuO+K4Fe(CN)6+3 H2O- K2CuzFe(CN)+2 KOH+2 H2O 亚铁氯化钾 亚铁氰酸络铜(1)钾盐 斐林试剂中二价铜的还原力比次甲基蓝强,因此所滴入的标准葡萄糖溶液首先使二价铜 还原,只有当二价铜被还原完毕后,才能使次甲基蓝(甲烯蓝)还原为无色,测定中以此作 为滴定终点。 一对照管(不加样品),用标准葡萄糖滴定求 定体积斐林试 剂中二价 消耗斐林试剂中 二价铜 的量再用标 标准葡萄 量(B)。将(A)减去(B)就可求得样品中还原糖量。 三、器材及试剂: 1.器材: ①淀粉 ②广范试纸pH1~12。 ③吸管5毫升(×4),10毫升(×2) ④容量瓶100毫升(×3) ⑤烧杯150毫升(×1),100毫升(×1) ©三角烧瓶250毫升(×6) ⑦滴定管25毫升(×1) ®双孔橡皮寒
1.3 总糖和还原糖的测定——斐林氏法 总糖和还原糖测定方法较多,如 3,5—二硝基水杨酸法、碱性铜试剂法、蒽酮比色法、 斐林氏法等。这里只介绍斐林氏法。 一、目的 学习掌握生产实践中常用的快速定糖方法。 二、原理 还原糖在碱性溶液中能将 Ag +,Hg +,Cu 2+,Fe(CN)6 3-等金属离子还原,而糖本身则氧 化成各种羟酸,利用这一特性可以对还原糖进行定量测定。本实验采用斐林试剂热滴定法, 氧化剂是斐林试剂,它是由甲乙两种溶液组成,甲液中含有硫酸铜、次甲基蓝;乙液中含有 氢氧化钠、酒石酸钾钠和亚铁氰化钾(黄血盐)。当甲乙两液混合时,硫酸铜和氢氧化钠作 用形成氢氧化铜沉淀,由于溶液中存在酒石酸钾钠,它和氢氧化铜形成了可溶性络合物。 COONa COONa 酒石酸络铜(Ⅱ)钾钠盐在与还原糖共热时,二价铜离子即被还原成一价的氧化亚铜红 色沉淀。 COONa 葡萄糖酸 氧化亚铜 此氧化亚铜与试剂中亚铁氰化钾反应生成可溶性的亚铁氰酸络铜(Ⅰ)钾盐。 Cu2O + K4Fe(CN)6 + 3 H2O K2Cu2Fe(CN)6 + 2 KOH + 2 H2O 亚铁氰化钾 亚铁氰酸络铜(Ⅰ)钾盐 斐林试剂中二价铜的还原力比次甲基蓝强,因此所滴入的标准葡萄糖溶液首先使二价铜 还原,只有当二价铜被还原完毕后,才能使次甲基蓝(甲烯蓝)还原为无色,测定中以此作 为滴定终点。 在测定时先做一对照管(不加样品),用标准葡萄糖滴定求知一定体积斐林试剂中二价 铜和次甲基蓝的量,即测定对照管消耗的标准葡萄糖量(A)。再做样品管,样品中还原糖 消耗斐林试剂中一部分二价铜,剩余的量再用标准葡萄糖来滴定,即样品消耗的标准葡萄糖 量(B)。将(A)减去(B)就可求得样品中还原糖量。 三、器材及试剂: 1.器材: ①淀粉 ②广范试纸 pH1~12。 ③吸管 5 毫升(×4),10 毫升(×2) ④容量瓶 100 毫升(×3) ⑤烧杯 150 毫升(×1),100 毫升(×1) ⑥三角烧瓶 250 毫升(×6) ⑦滴定管 25 毫升(×1) ⑧双孔橡皮塞 H—C—OH — — H——C—OH COOK + Cu 2+ — H——C—O H——C—O COOK Cu +H2O 酒石酸钾钠 酒石酸络铜(Ⅱ)钾钠盐 — H—C—O H—C—O — — COOK Cu + CH2OH(CHOH)4CHO 葡萄糖 CH2OH(CHOH)4COOH + Cu2O↓
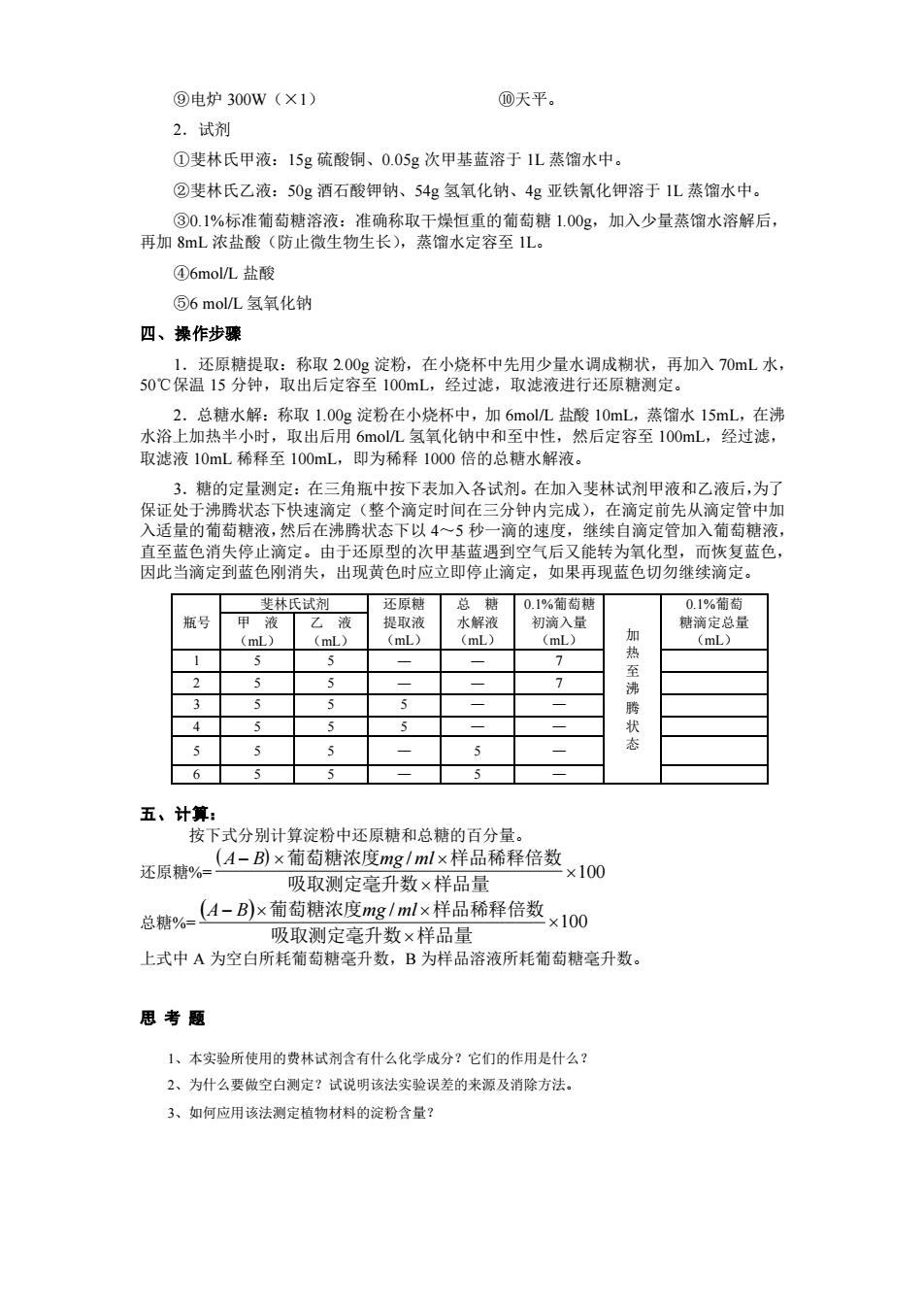
⑨电炉300w(×1) ⑩天平。 2.试剂 ①斐林氏甲液:15g硫酸铜、0.05g次甲基蓝溶于1L蒸馏水中 ②斐林氏乙液:50g酒石酸钾钠、54g氢氧化钠、4g亚铁氰化钾溶于1L蒸馏水中。 ③0.1%标准葡萄糖溶液:准确称取干燥恒重的葡萄糖1.00g,加入少量蒸馏水溶解后, 再加8L浓盐酸(防止微生物生长),蒸酒水定容至1L。 ④6molL盐酸 ⑤6mol/L氢氧化钠 四、操作步骤 0心你分程:格是袋在中先用人0水 2.总糖水解:称取1.00g淀粉在小烧杯中,加6molL盐酸10mL,蒸馏水15mL,在沸 水浴上加热半小时,取出后用 5mol/L氢氧化钠中和至中性,然后定容至1O0mL,经过滤, 取滤液10mL稀释至100mL,即为稀释1000倍的总糖水解液。 3.糖的定量测定:在三角瓶中按下表加入各试剂。在加入斐林试剂甲液和乙液后,为了 保证处于沸腾状态下快速滴定(整个滴定时间在三分钟内完成),在滴定前先从滴定管中加 入适量的葡萄糖液,然后在沸腾状态下以4 形一调的速度, 目调定官加入和萄裙液 而恢复蓝色, 瓶号 乙液 水解液 初滴入量 糖滴定总量 (mL 热 全沸 腾 3 6 五、计算: 按下式分别计算淀静中还原糖和总糖的百分量。 吸取测定毫升数×样品量 总糖%-1-B)x萄萄糖浓度mg/mlx样品稀释倍数×1O0 吸取定亮升粉×样品最 上式中A为空白所耗葡萄糖毫升数,B为样品溶液所耗葡萄糖毫升数 思考题 1、本实验所使用的费林试剂含有什么化学成分?它们的作用是什么 2、为什么要做空白测定?试说明该法实验误差的来源及消除方法 3、如何应用该法测定植物材料的淀粉含量?
⑨电炉 300W(×1) ⑩天平。 2.试剂 ①斐林氏甲液:15g 硫酸铜、0.05g 次甲基蓝溶于 1L 蒸馏水中。 ②斐林氏乙液:50g 酒石酸钾钠、54g 氢氧化钠、4g 亚铁氰化钾溶于 1L 蒸馏水中。 ③0.1%标准葡萄糖溶液:准确称取干燥恒重的葡萄糖 1.00g,加入少量蒸馏水溶解后, 再加 8mL 浓盐酸(防止微生物生长),蒸馏水定容至 1L。 ④6mol/L 盐酸 ⑤6 mol/L 氢氧化钠 四、操作步骤 1.还原糖提取:称取 2.00g 淀粉,在小烧杯中先用少量水调成糊状,再加入 70mL 水, 50℃保温 15 分钟,取出后定容至 100mL,经过滤,取滤液进行还原糖测定。 2.总糖水解:称取 1.00g 淀粉在小烧杯中,加 6mol/L 盐酸 10mL,蒸馏水 15mL,在沸 水浴上加热半小时,取出后用 6mol/L 氢氧化钠中和至中性,然后定容至 100mL,经过滤, 取滤液 10mL 稀释至 100mL,即为稀释 1000 倍的总糖水解液。 3.糖的定量测定:在三角瓶中按下表加入各试剂。在加入斐林试剂甲液和乙液后,为了 保证处于沸腾状态下快速滴定(整个滴定时间在三分钟内完成),在滴定前先从滴定管中加 入适量的葡萄糖液,然后在沸腾状态下以 4~5 秒一滴的速度,继续自滴定管加入葡萄糖液, 直至蓝色消失停止滴定。由于还原型的次甲基蓝遇到空气后又能转为氧化型,而恢复蓝色, 因此当滴定到蓝色刚消失,出现黄色时应立即停止滴定,如果再现蓝色切勿继续滴定。 瓶号 斐林氏试剂 还原糖 提取液 (mL) 总 糖 水解液 (mL) 0.1%葡萄糖 初滴入量 (mL) 加 热 至 沸 腾 状 态 0.1%葡萄 糖滴定总量 (mL) 甲 液 (mL) 乙 液 (mL) 1 5 5 — — 7 2 5 5 — — 7 3 5 5 5 — — 4 5 5 5 — — 5 5 5 — 5 — 6 5 5 — 5 — 五、计算: 按下式分别计算淀粉中还原糖和总糖的百分量。 还原糖%= ( ) 100 / − 吸取测定毫升数 样品量 A B 葡萄糖浓度mg ml 样品稀释倍数 总糖%= ( ) 100 / − 吸取测定毫升数 样品量 A B 葡萄糖浓度mg ml 样品稀释倍数 上式中 A 为空白所耗葡萄糖毫升数,B 为样品溶液所耗葡萄糖毫升数。 思 考 题 1、本实验所使用的费林试剂含有什么化学成分?它们的作用是什么? 2、为什么要做空白测定?试说明该法实验误差的来源及消除方法。 3、如何应用该法测定植物材料的淀粉含量?

第二章脂肪 2.1脂肪的提取和定量测定一索氏提取法 一、目的: 氏提取法测定粗脂肪含量的原理及方法。 二、原理 所谓粗脂肪,是脂肪、游离脂肪酸、蜡、磷脂、周醇及色素等脂溶性物质的总称。 索氏(soxhlet)脂肪提取器为一回馏装置(图),由浸提管、小烧瓶及冷凝管三者连接 而成。浸提管两侧分别有虹吸管及通气管,盛有样品的滤纸包放在浸提管内。溶剂(乙醚) 盛于小烧瓶中,加热后,溶剂蒸汽经通气管至冷凝管,冷凝之溶剂滴入浸提管,浸提样品。 浸提管内溶剂愈积愈多,当液面达到一定高度,溶剂及溶于溶剂中的粗脂肪即经虹吸管流入 小烧瓶。流入小烧瓶的溶剂由于受热而气化,气体至冷凝管又冷凝而滴入浸提管内,如此反 复提取回馏,即将样品中的粗脂肪提尽并带到小烧瓶中。最后,将小烧瓶中的溶剂蒸去,烘 干,小烧瓶增加之重量,即样品中粗脂肪含量。 三、器材及试剂: 1.器材: ①麦麸以及其他动、植物材料。 ②波纸。 ③索氏提取器(一套)。 ④分析天平。 ⑤恒温水浴锅 ⑥干燥器。 ⑦铁架台 ⑧橡皮管。 ⑨万能夹。 ⑩干燥箱 ①电吹风 2.试剂: 无水乙醚:市售无水乙醚往往仍有水分,需处理后使用, 图4臻氏幽肪提取器 处理方法如下: 】.汉规没·2.通气施 ①含水较多的乙醚,可先于乙醚中投入无水氯化钙(约 3.虹吸答4。小烧租5.冷凝按 为总体积13),1一2天后,过滤,水浴蒸馏,收集36℃馏出液。于此馏出液中加适量金属 钠(需用压钠机压成钠条或用刀切成薄片),1一2天后蒸馏,收集36℃馏出液,即得无水 乙醚。 ②水分较少的乙醚,可于每500g乙酷中加入30g一50g无水硫酸钠或金属钠,1一2天 后蒸馏,收集36℃馏出液。 四、操作步骤: 1.将洗净的索氏提取器小烧瓶用铅笔在磨口处编号,103一105℃烘2小时,取出, 置干燥器内冷却。分析天平称重,并记录之。 2.用分析天平称取干样约2g(准确至小数点后4位。样品需研碎,通过40目筛孔) 用滤纸包好,放入浸提管内。 3.于已称重的小烧瓶内倒入12一23体积的无水乙醚。连接索氏提取器各部分,恒温 水浴锅加热回馏2一4小时(样品含脂量高的,应适当延长时间)⑧。控制水浴温度,每小时
第二章 脂肪 2.1 脂肪的提取和定量测定——索氏提取法 一、目的: 学习索氏提取法测定粗脂肪含量的原理及方法。 二、原理: 所谓粗脂肪,是脂肪、游离脂肪酸、蜡、磷脂、固醇及色素等脂溶性物质的总称。 索氏(soxhlet)脂肪提取器为一回馏装置(图),由浸提管、小烧瓶及冷凝管三者连接 而成。浸提管两侧分别有虹吸管及通气管,盛有样品的滤纸包放在浸提管内。溶剂(乙醚) 盛于小烧瓶中,加热后,溶剂蒸汽经通气管至冷凝管,冷凝之溶剂滴入浸提管,浸提样品。 浸提管内溶剂愈积愈多,当液面达到一定高度,溶剂及溶于溶剂中的粗脂肪即经虹吸管流入 小烧瓶。流入小烧瓶的溶剂由于受热而气化,气体至冷凝管又冷凝而滴入浸提管内,如此反 复提取回馏,即将样品中的粗脂肪提尽并带到小烧瓶中。最后,将小烧瓶中的溶剂蒸去,烘 干,小烧瓶增加之重量,即样品中粗脂肪含量。 三、器材及试剂: 1.器材: ①麦麸以及其他动、植物材料。 ②滤纸。 ③索氏提取器(一套)。 ④分析天平。 ⑤恒温水浴锅 ⑥干燥器。 ⑦铁架台。 ⑧橡皮管。 ⑨万能夹。 ⑩干燥箱。 ○11 电吹风。 2.试剂: 无水乙醚:市售无水乙醚往往仍有水分,需处理后使用, 处理方法如下: ①含水较多的乙醚,可先于乙醚中投入无水氯化钙(约 为总体积 1/3),1—2 天后,过滤,水浴蒸馏,收集 36℃馏出液。于此馏出液中加适量金属 钠①(需用压钠机压成钠条或用刀切成薄片),1—2 天后蒸馏,收集 36℃馏出液,即得无水 乙醚。 ②水分较少的乙醚,可于每 500g 乙醚中加入 30g—50g 无水硫酸钠或金属钠,1—2 天 后蒸馏,收集 36℃馏出液。 四、操作步骤: 1.将洗净的索氏提取器小烧瓶用铅笔在磨口处编号,103—105℃烘 2 小时②,取出, 置干燥器内冷却。分析天平称重,并记录之。 2.用分析天平称取干样约 2g(准确至小数点后 4 位。样品需研碎,通过 40 目筛孔), 用滤纸包好③,放入浸提管内。 3.于已称重的小烧瓶内倒入 1/2—2/3④体积的无水乙醚。连接索氏提取器各部分,恒温 水浴锅加热回馏 2—4 小时(样品含脂量高的,应适当延长时间)⑤。控制水浴温度,每小时

回馏3一5次较宜。 4.提取完毕,待乙醚完全流入小烧瓶时,取出滤纸包,再回馏一次以洗涤浸提管。继 续加热,待浸提管内乙醚液面接近虹吸管上端而未流入小烧瓶前,倒出浸提管中之乙醚。如 果小烧瓶中尚留有乙醚,则继续加热蒸发,直到小烧瓶中溶剂基本蒸尽,停止加热,取下小 烧瓶,用吹风机将瓶中残留乙醚吹尽”,再置103一105℃烘箱中烘半小时,取出置干燥器中 冷至室温,称重,由小烧瓶增加之重量可计算出样品的脂肪含量。 按同法,用不包样品的滤纸包做空白测定。 测定脂肪后,小烧瓶需先用2%氢氧化钠酒精浸泡,再用肥皂洗净烘干保存。 注意:进行本实验时应切实注意防火,乙醚为易燃品,切忌明火加热,同时要注意提取 器各连接处是否漏气,以及冷凝管冷凝效果是否良好,以免大量乙醚蒸气外逸。 附:水分测定 取扁形称量瓶2只,洗净,用铅笔在磨口处作好记号,置103一105℃烘箱中烘2小时, 移入干燥器内,冷至室温(约10一15分钟),称重(准确于小数点后第4位,下同)。用称 过重量的称量瓶,各称取粉碎样品(麦麸)2g,同时于103一105℃烘2小时,取出置干燥 器中冷却,称重。如此重复烘烤,直至恒重,按下式计算样品的含水量。 水分%-烘烤前样品净重-状烤后样品净重×100 烘烤前样品净重 注意 1.烘烤样品时,必须将称量瓶盖子打开,斜放在称量瓶口上,以免水分不能蒸发,但 也不必将盖子取下,否则容易养脏弄错。 2。冷却和称重时,应将称量瓶盖子盖好,称重要迅速,干燥器中的吸水剂需新鲜,否 则将因样品吸收水分,甚至重量反而增加。 3、在整个操作过程中,应保持称量瓶清洁,不能用手直接拿取。 思考题 意哪些事项 相等为样品未成干金么实中将料相脂防套与滤纸包内容物之和是香与所样品重 物质,列华不能用手直接拿取:用后之金属销条(片可用二甲去外层黄色 ② 空索氏提取器小烧瓶(以及空称量瓶)经103一105℃烘烤2小时即恒重。 包必 ,最好用特制的滤纸斗,斗口塞以脱棉。样品包(斗) 装入乙之量,应以在回馏过程中小烧内有适量乙醚存在为准,如发现小烧瓶中脂肪颜色变深 净,再烘烤称重」 用之 需清洁(用蒸馏水),提取完毕后,如小烧瓶外部沾有污渍,应洗刷干 令间回馏速度不宜太士小有关,本实验所用样品量及提取时间仅适于测定麦林。 中我 国如用高型称量瓶,样品水分不易烤干应经常翻拌样品,为此可置一小玻棒于瓶内,一并烘烤与称 过10mg,即可
回馏 3—5 次较宜⑥。 4.提取完毕,待乙醚完全流入小烧瓶时,取出滤纸包,再回馏一次以洗涤浸提管。继 续加热,待浸提管内乙醚液面接近虹吸管上端而未流入小烧瓶前,倒出浸提管中之乙醚。如 果小烧瓶中尚留有乙醚,则继续加热蒸发,直到小烧瓶中溶剂基本蒸尽,停止加热,取下小 烧瓶,用吹风机将瓶中残留乙醚吹尽⑦,再置 103—105℃烘箱中烘半小时,取出置干燥器中 冷至室温,称重,由小烧瓶增加之重量可计算出样品的脂肪含量。 按同法,用不包样品的滤纸包做空白测定。 测定脂肪后,小烧瓶需先用 2%氢氧化钠酒精浸泡,再用肥皂洗净烘干保存。 注意:进行本实验时应切实注意防火,乙醚为易燃品,切忌明火加热,同时要注意提取 器各连接处是否漏气,以及冷凝管冷凝效果是否良好,以免大量乙醚蒸气外逸。 附:水 分 测 定 取扁形称量瓶⑧ 2 只,洗净,用铅笔在磨口处作好记号,置 103—105℃烘箱中烘 2 小时, 移入干燥器内,冷至室温(约 10—15 分钟),称重(准确于小数点后第 4 位,下同)。用称 过重量的称量瓶,各称取粉碎样品(麦麸)2g,同时于 103—105℃烘 2 小时,取出置干燥 器中冷却,称重。如此重复烘烤,直至恒重⑨,按下式计算样品的含水量。 水分%= 100 − 烘烤前样品净重 烘烤前样品净重 烘烤后样品净重 注意: 1.烘烤样品时,必须将称量瓶盖子打开,斜放在称量瓶口上,以免水分不能蒸发,但 也不必将盖子取下,否则容易弄脏弄错。 2.冷却和称重时,应将称量瓶盖子盖好,称重要迅速,干燥器中的吸水剂需新鲜,否 则将因样品吸收水分,甚至重量反而增加。 3、在整个操作过程中,应保持称量瓶清洁,不能用手直接拿取。 思 考 题 1.本法提取的为何是粗脂肪? 2.做好本实验应注意哪些事项? 3.如果所取样品未烘干至恒重,那么实验中称得粗脂肪重与滤纸包内容物重之和是否与所取样品重量 相等?为什么? ① 金属钠遇水爆炸,应注意。不能用手直接拿取!用后之金属钠条(片),可用二甲苯洗去外层黄色 物质,再浸入煤油中并贮于密封容器。 ② 空索氏提取器小烧瓶(以及空称量瓶)经 103—105℃烘烤 2 小时即恒重。 ③ 滤纸包必须用丝线扎好,保证样品不漏散,最好用特制的滤纸斗,斗口塞以脱脂棉。样品包(斗) 放入浸提管后,其高度不能超过乙醚面的最高高度。 ④ 装入乙醚之量,应以在回馏过程中小烧瓶内有适量乙醚存在为准,如发现小烧瓶中脂肪颜色变深 (似烧焦状),系溶剂太少或温度太高。 ⑤用水浴锅加热,但所用之水需清洁(用蒸馏水),提取完毕后,如小烧瓶外部沾有污渍,应洗刷干 净,再烘烤称重。 ⑥ 回馏速度不宜太快,否则样品中脂肪不易浸提完全。太慢则时间不经济。至于提取时间的多寡, 与样品用量、脂肪含量及颗粒大小有关,本实验所用样品量及提取时间仅适于测定麦麸。 ⑦ 必须将小烧瓶中残留之少量乙醚在通风处赶尽,然后再放入烘箱,否则易发生事故。 ⑧ 如用高型称量瓶,样品水分不易烤干应经常翻拌样品,为此可置一小玻棒于瓶内,一并烘烤与称 重。用扁型称量瓶时,样品也应薄薄地平铺于瓶底,不宜过多。 ⑨ 衡量是否恒重的标准,应根据各个实验的有效数字而定,本实验以前后两次重量之差不 超过 10mg,即可

2.2脂肪酸价的测定 一目的 习脂肪酸价的测定测定的方法 二原 价是指中和1g油脂的游离脂肪酸所需KOH的mg数。酸价表示脂肪酸败程度 实验材料与仪器 豆油等均可)」 分析天平(万分之一)】 碱式滴定管25mL(×1)。 锥形瓶(三角烧瓶)100m山×3). 量筒50mL山×1)。 水浴锅。 试剂 夜中和至红色 1%酚酞拢 1 mol/L KOH标准溶液 90%乙醇配制 四操作 准确称取油脂1一5.000g于100mL三角烧瓶中,另取一个三角烧瓶不加油脂作空白 在两个瓶中加入混合溶液50mL,振摇溶解(固体脂肪需水浴溶化再加入混合溶液)或40℃ 水浴溶化透明。加入酚酞指示剂1一2滴,用0.1 mol/L KOH标准液滴定至淡红色,1分钟不 褪色为终点。记录0.1mol/LKOH用量。 五计算 酸价= CVXV)×56.1 C,标准KO浓度 56.1:1mol/LKOH1mL所含KOH mg数, W:样品重量(g)
2.2 脂肪酸价的测定 一 目的 学习脂肪酸价的测定测定的方法 二 原理 酸价是指中和 1g 油脂的游离脂肪酸所需 KOH 的 mg 数。酸价表示脂肪酸败程度。 油脂中的游离脂肪酸与 KOH 发生中和反应,从 KOH 标准溶液消耗量可计算出游离脂 肪酸的量。反应式如下:RCOOH+KOH→RCOOK+H2O 三 实验材料与仪器 油脂(动物油、豆油等均可)。 分析天平(万分之一)。 碱式滴定管 25mL(×1)。 锥形瓶(三角烧瓶)100 mL(×3)。 量筒 50 mL(×1)。 水浴锅。 试剂 1. 中性醇醚混合液:取 95%乙醇(C.P.)和乙醚(C.P.)按 1:1 等体积混合;或苯醇 混合液:取苯(C.P.)和 95%乙醇(C.P.)等体积混合;上述混合液加入酚酞指示剂数滴, 用 0.1mol/L KOH 溶液中和至红色。 2. 1%酚酞指示剂:用 70%-90%乙醇配制。 3. 0.1mol/L KOH 标准溶液。 四 操作 准确称取油脂 1-5.000g 于 100mL 三角烧瓶中,另取一个三角烧瓶不加油脂作空白, 在两个瓶中加入混合溶液 50mL,振摇溶解(固体脂肪需水浴溶化再加入混合溶液)或 40℃ 水浴溶化透明。加入酚酞指示剂 1-2 滴,用 0.1mol/L KOH 标准液滴定至淡红色,1 分钟不 褪色为终点。记录 0.1mol/L KOH 用量。 五 计算 酸价= C(V2×V1)×56.1 W C:标准 KOH 浓度, V1:样品消耗 KOH mL 数, V2:空白所用 KOH mL 数, 56.1:1 mol/L KOH 1mL 所含 KOH mg 数, W:样品重量(g)
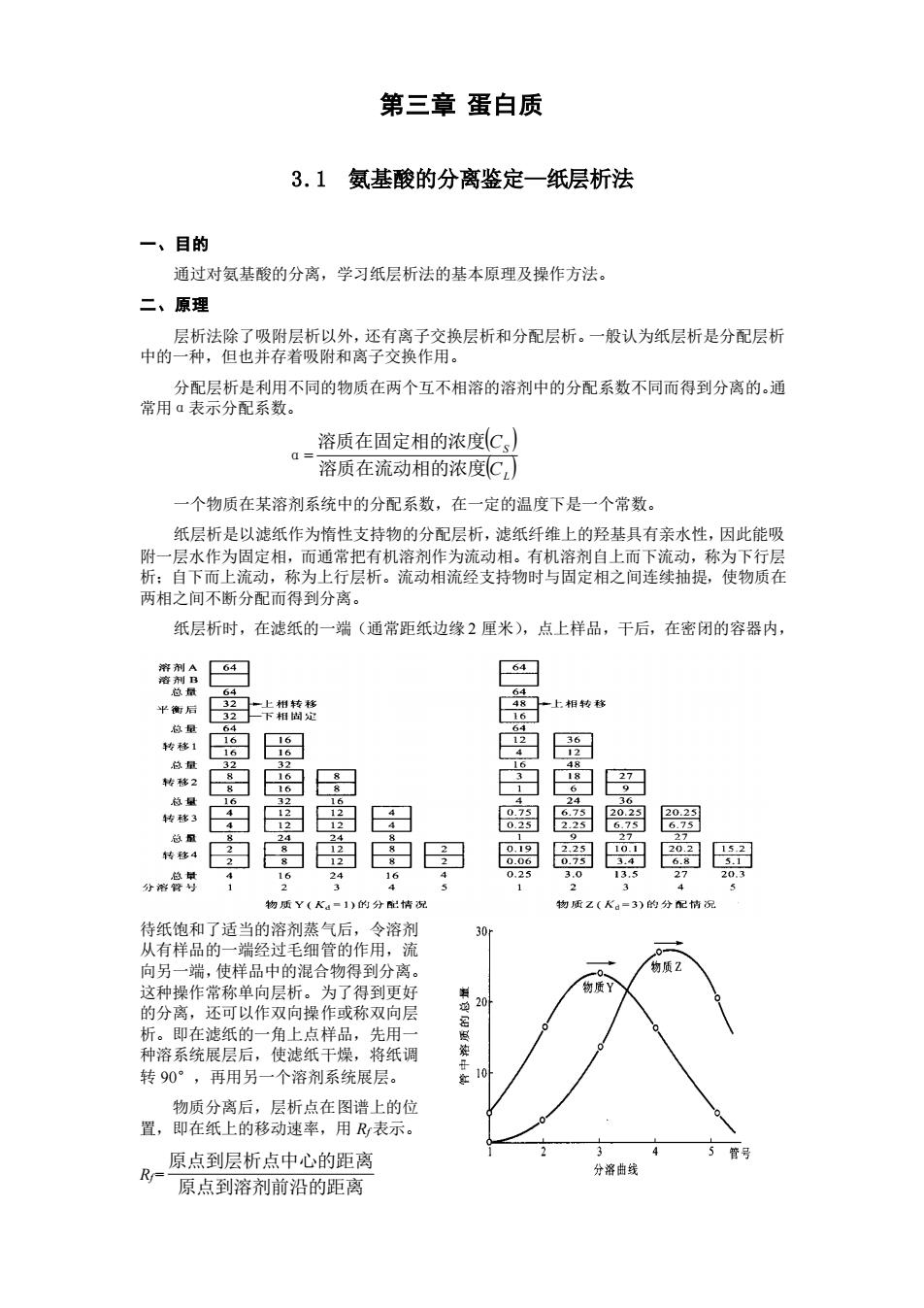
第三章蛋白质 3.1氨基酸的分离鉴定一纸层析法 一、目的 通过对氨基酸的分离,学习纸层析法的基本原理及操作方法, 二、原理 层析法除了吸附层析以外,还有离子交换层析和分配层析。一般认为纸层析是分配层析 中的一种,但也并存着吸附和离子交换作用。 分配层析是利用不同的物质在两个互不相溶的溶剂中的分配系数不同而得到分离的,通 常用Q表示分配系数。 溶质在固定相的浓度C、】 a一溶质在流动相的浓度C 一个物质在某溶剂系统中的分配系数,在一定的温度下是一个常数 纸层析是以滤纸作为惰性支持物的分配层析,滤纸纤维上的羟基具有亲水性,因此能吸 附一层水作为固定相,而通常把有机溶剂作为流动相。有机溶剂自上而下流动,称为下行层 析:自下而上流动,称为上行层析。流动相流经支持物时与固定相之间连续抽提,使物质在 两相之间不断分配而得到分离。 纸层析时,在滤纸的一端(通常距纸边缘2厘米),点上样品,干后,在密闭的容器内, 里 白岛哥 密岛离 南百离由田密离曾粤圜 物质Y(Ka-1)的分情 物腰z(K。=3)的分 有样品的 物质 的分离,还可以作双向操作或称双向层 析。即在滤纸的一角上点样品,先用 种溶系统展层后,使滤纸干燥,将纸调 转90°,再用另一个溶剂系统展层。 家10 物质分离后,层析点在图谱上的位 置,即在纸上的移动速率,用R表示。 R原点到层析点中心的距离 原点到溶剂前沿的距离
第三章 蛋白质 3.1 氨基酸的分离鉴定—纸层析法 一、目的 通过对氨基酸的分离,学习纸层析法的基本原理及操作方法。 二、原理 层析法除了吸附层析以外,还有离子交换层析和分配层析。一般认为纸层析是分配层析 中的一种,但也并存着吸附和离子交换作用。 分配层析是利用不同的物质在两个互不相溶的溶剂中的分配系数不同而得到分离的。通 常用α表示分配系数。 α= ( ) ( ) L S C C 溶质在流动相的浓度 溶质在固定相的浓度 一个物质在某溶剂系统中的分配系数,在一定的温度下是一个常数。 纸层析是以滤纸作为惰性支持物的分配层析,滤纸纤维上的羟基具有亲水性,因此能吸 附一层水作为固定相,而通常把有机溶剂作为流动相。有机溶剂自上而下流动,称为下行层 析;自下而上流动,称为上行层析。流动相流经支持物时与固定相之间连续抽提,使物质在 两相之间不断分配而得到分离。 纸层析时,在滤纸的一端(通常距纸边缘 2 厘米),点上样品,干后,在密闭的容器内, 待纸饱和了适当的溶剂蒸气后,令溶剂 从有样品的一端经过毛细管的作用,流 向另一端,使样品中的混合物得到分离。 这种操作常称单向层析。为了得到更好 的分离,还可以作双向操作或称双向层 析。即在滤纸的一角上点样品,先用一 种溶系统展层后,使滤纸干燥,将纸调 转 90°,再用另一个溶剂系统展层。 物质分离后,层析点在图谱上的位 置,即在纸上的移动速率,用 Rf 表示。 Rf= 原点到溶剂前沿的距离 原点到层析点中心的距离