
物理化学教案 新疆大学化学化工学院物理化学教研室刘月娥 第二章热力学第一定律 2.1热力学概论 一、热力学的基本内容 1.研究热、功和其他形式能量之间的相互转换及其转换过程中所遵循的规律(热力学第一定 律): 2.研究各种物理变化和化学变化过程中所发生的能量效应; :(热力学第三定律) 5热力学第零定律 一为温度建立了严格的科学定义。 二、热力学的方法和局限性 1、热力学方法 ()研究对象是大数量分子的集合体,研究宏观性质,所得结论具有统计意义 (2)只考虑变化前后的净结果,不考虑物质的微观结构和反应机理。 (3)能判断变化能否发生以及进行到什么程度,但不考虑变化所需要的时间。 2、局限性 不知道反应的机理、速率和微观性质,只讲可能性,不讲现实性。 2.2热平衡和热力学第零定律 一、温度的概念 “温度”一词在日常生活中是经常遇到的,但要给它一个很确切的定义,似乎又并不容易。 在历史上,“温度”和“热”这两个不同的概念曾一度被混淆过。第一个明确区分的是 J.Bla©k。温度的概念起源于人们对冷热的感觉,它代表物体冷热的程度(现在知道这就是 组成物质的大量粒子的无规则运 强弱程度)。 在热力学中,我们从热平衡来定义温度: 当两个体系彼此处于热平衡时,它们必定有一个共同的热力学性质,这个决定体系热平衡 的热力学性质被定义为温度。 则A和B之间也必定彼此处于热平衡。这是一个客观存在的经验,称为热平衡定律。由 于它的重要性,并因它是热力学第一和第二定律之后确立的,但在逻辑上却应放在这两个 定律之前,故R.H.Fowler称之为热力学第零定律。 三、热力学第零定律的实质 指出温度这个状态函数的存在,它非但给出温度的概念,而且给出了比较温度的方法。 在比较各个物体的温度时,不需要将各物体直接接触,只需将一个作为标准的第三系统分 别与各个物体相接触达到热平衡,这个作为标准的第三系统就是温度计
1 物 理 化 学 教 案 新疆大学化学化工学院物理化学教研室 刘月娥 第二章 热力学第一定律 2.1 热力学概论 一、热力学的基本内容 1.研究热、功和其他形式能量之间的相互转换及其转换过程中所遵循的规律(热力学第一定 律); 2.研究各种物理变化和化学变化过程中所发生的能量效应; 3.研究化学变化的方向和限度(热力学第二定律); 4.研究低温现象,阐明规定熵的数值(热力学第三定律) ; 5.热力学第零定律——为温度建立了严格的科学定义。 二、热力学的方法和局限性 1、热力学方法 (1)研究对象是大数量分子的集合体,研究宏观性质,所得结论具有统计意义。 (2)只考虑变化前后的净结果,不考虑物质的微观结构和反应机理。 (3)能判断变化能否发生以及进行到什么程度,但不考虑变化所需要的时间。 2、局限性 不知道反应的机理、速率和微观性质,只讲可能性,不讲现实性。 2.2 热平衡和热力学第零定律 一、温度的概念 “温度”一词在日常生活中是经常遇到的,但要给它一个很确切的定义,似乎又并不容易。 在历史上,“温度”和“热”这两个不同的概念曾一度被混淆过。第一个明确区分的是 J.Black。温度的概念起源于人们对冷热的感觉,它代表物体冷热的程度(现在知道这就是 组成物质的大量粒子的无规则运动的强弱程度)。 在热力学中,我们从热平衡来定义温度: 当两个体系彼此处于热平衡时,它们必定有一个共同的热力学性质,这个决定体系热平衡 的热力学性质被定义为温度。 二、热平衡定律与热力学第零定律 测量温度的依据是热平衡定律。当两个物体 A 和 B 分别与第三个物体 C 处于热平衡时, 则 A 和 B 之间也必定彼此处于热平衡。这是一个客观存在的经验,称为热平衡定律。由 于它的重要性,并因它是热力学第一和第二定律之后确立的,但在逻辑上却应放在这两个 定律之前,故 R.H.Fowler 称之为热力学第零定律。 三、热力学第零定律的实质 指出温度这个状态函数的存在,它非但给出温度的概念,而且给出了比较温度的方法。 在比较各个物体的温度时,不需要将各物体直接接触,只需将一个作为标准的第三系统分 别与各个物体相接触达到热平衡,这个作为标准的第三系统就是温度计
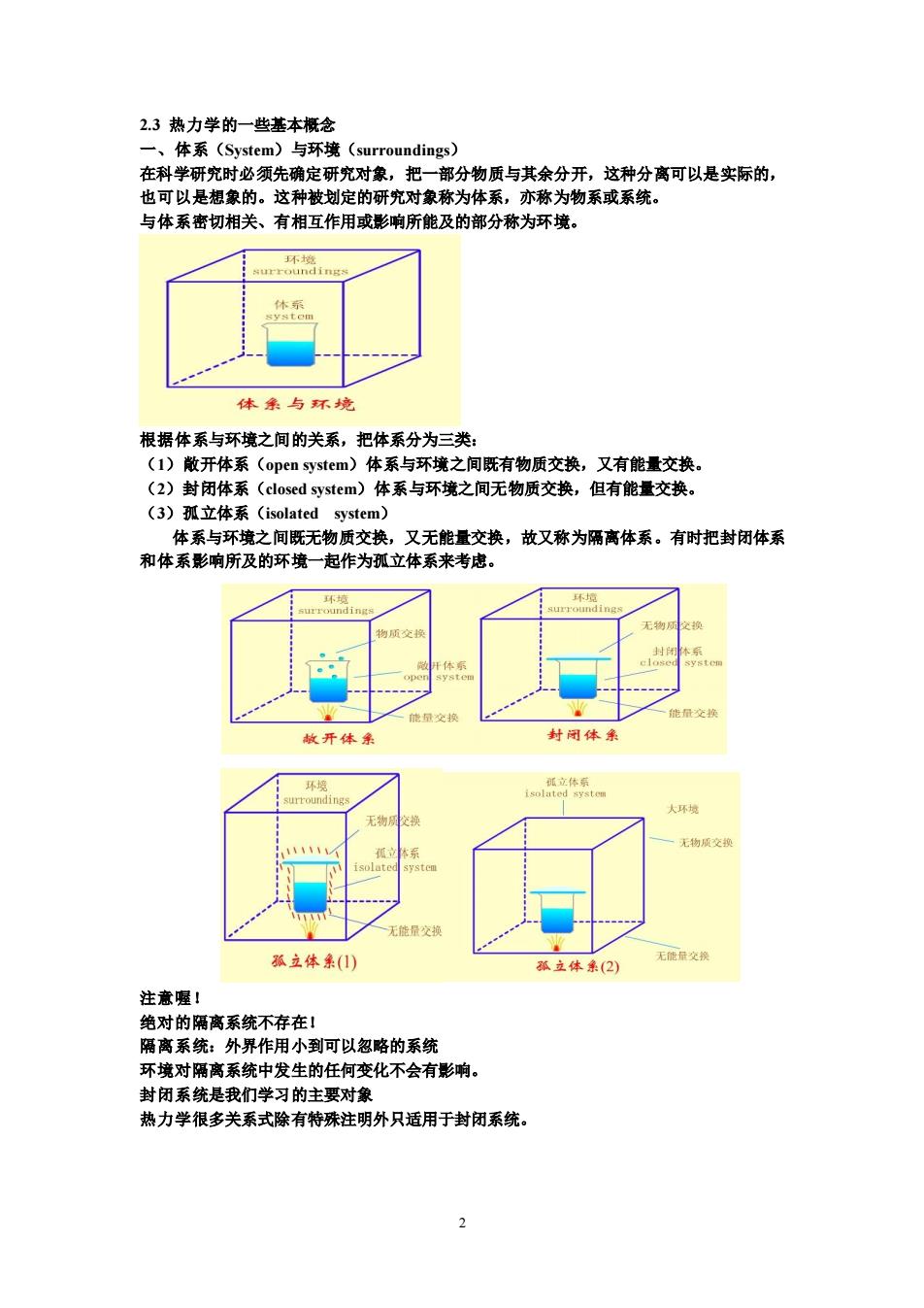
2.3热力学的一些基本概念 一、体系(System)与环境(surroundings)? 在科学研究时必须先确定研究对象,把一部分物质与其余分开,这种分高可以是实际的, 也可以是想象的。这种被划定的研究对象称为体系,亦称为物系或系统。 与体系德切相关、有相互作用或影响所能及的部分称为环境。 体条与环墙 根据体系与环境之间的关系,把体系分为三类 (1)散开体系(open system)体系与环境之间既有物质交换,又有能量交换。 (2)封闭体系(closed system)体系与环境之间无物质交换,但有能量交换。 (3)孤立体系(isolated system) 体系与环 之间物质衣 ,又无能量交换,故又称为隔高体系。有时把封闭体系 和体系影响所及的环境一起作为 孤立体系来考忠 传得 敏开体 村闭体象 环填 无物交 无能量交 孤立体() 孤立体米(2) 注意喔! 绝对的隔离系统不存在! 隔离系统:外界作用小到可以忽略的系统 环境对隔离系统中发生的任何变化不会有影响。 封闭系统是我们学习的主要对象 热力学很多关系式除有特殊注明外只适用于封闭系统
2 2.3 热力学的一些基本概念 一、体系(System)与环境(surroundings) 在科学研究时必须先确定研究对象,把一部分物质与其余分开,这种分离可以是实际的, 也可以是想象的。这种被划定的研究对象称为体系,亦称为物系或系统。 与体系密切相关、有相互作用或影响所能及的部分称为环境。 根据体系与环境之间的关系,把体系分为三类: (1)敞开体系(open system)体系与环境之间既有物质交换,又有能量交换。 (2)封闭体系(closed system)体系与环境之间无物质交换,但有能量交换。 (3)孤立体系(isolated system) 体系与环境之间既无物质交换,又无能量交换,故又称为隔离体系。有时把封闭体系 和体系影响所及的环境一起作为孤立体系来考虑。 注意喔! 绝对的隔离系统不存在! 隔离系统:外界作用小到可以忽略的系统 环境对隔离系统中发生的任何变化不会有影响。 封闭系统是我们学习的主要对象 热力学很多关系式除有特殊注明外只适用于封闭系统

二、系统的性质 用宏观可测性质来描述体系的热力学状态,故这些性质又称为热力学变量。可分为两类: 广度性质 (extensive 又称为容量性质, ,它的嫩体裹的物质的成正比,如体积、质香、等,这种性质有 加和性,在数学上是一次齐函数。 2.强度性质(intensive properties). 它的数值取决于体系自身的特点,与体系的数量无关,不具有加和性,如洱度、乐力等 它在数学上是零次齐函数。指定了物质的量的容量性质即成为强度性质,如摩尔热容 热力学 平衡态 当体系的诸性质不随时间而改变,则体系就处于热力学平衡态,它包括下列几个平衡: l.热平衡(thermal equilibrium)体系各部分温度相等。 2.力学平衡(mechanical equilibrium)体系各部的压力都相等,边界不再移动。如有刚壁存 在,虽双方压力不等,但也能保持力学平衡 ph 多 ,各相的组成和数量不随时间而改变 4.化学平衡(chemical equilibrium)反应体系中各物的数量不再随时间而改变。 四、状态函数 体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关:它的变化值仅 取决于体系的始态和终态,而与变化的途径无关。具有这种特性的物理量称为状态函数 (state fune 状态函数的特性可描述为:异途同归,值变相等周而复始,数值还原 状态函数在数学上具有全徽分的性质。 五、状态方程(state equation) 体系状态函数之间的定量关系式称为状态方程(stae uation)。 对 一定量的单组分均匀体系,状态函数TV之间有一定量的联系。经验证明,只有两 具轴立的 们的函数关系可表示为:Tf(p,) p=f (TV) (n,T) 例如,理想气体的状态方程可表示为:p=mR1 六、过程与途径 1.过程(procedure) 系统发生的变化 如一定量气体加热后发生如下变化 (p,1 p2,I)为一过 2.途径(ah)系统由始态变化到终态所经历的过程的总和。如图: a C 由问态 b 2 一定量的气体状态变化:始态(1)→终态(2)可通过两个途径。途径1:过程( 途径2:过程a+过程b
3 二、系统的性质 用宏观可测性质来描述体系的热力学状态,故这些性质又称为热力学变量。可分为两类: 1.广度性质(extensive properties) 又称为容量性质,它的数值与体系的物质的量成正比,如体积、质量、熵等。这种性质有 加和性,在数学上是一次齐函数。 2.强度性质(intensive properties) 它的数值取决于体系自身的特点,与体系的数量无关,不具有加和性,如温度、压力等。 它在数学上是零次齐函数。指定了物质的量的容量性质即成为强度性质,如摩尔热容。 三、热力学平衡态 当体系的诸性质不随时间而改变,则体系就处于热力学平衡态,它包括下列几个平衡: 1.热平衡(thermal equilibrium)体系各部分温度相等。 2.力学平衡(mechanical equilibrium)体系各部的压力都相等,边界不再移动。如有刚壁存 在,虽双方压力不等,但也能保持力学平衡。 3.相平衡(phase equilibrium) 多相共存时,各相的组成和数量不随时间而改变。 4.化学平衡(chemical equilibrium )反应体系中各物的数量不再随时间而改变。 四、状态函数 体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关;它的变化值仅 取决于体系的始态和终态,而与变化的途径无关。具有这种特性的物理量称为状态函数 (state function)。 状态函数的特性可描述为:异途同归,值变相等;周而复始,数值还原。 状态函数在数学上具有全微分的性质。 五、状态方程(state equation ) 体系状态函数之间的定量关系式称为状态方程(state equation )。 对于一定量的单组分均匀体系,状态函数 T,p,V 之间有一定量的联系。经验证明,只有两 个是独立的,它们的函数关系可表示为:T=f(p,V) p=f(T,V) V=f(p,T) 例如,理想气体的状态方程可表示为:pV=nRT 六、 过程与途径 1.过程( procedure ) 系统发生的变化 如一定量气体加热后发生如下变化 : ( p1,V1,T1 ) ( p2,V2,T2 ) 为一过程 2. 途径(path)系统由始态变化到终态所经历的过程的总和。如图: 一定量的气体状态变化: 始态(1)→终态(2)可通过两个途径。途径 1 :过程 c 途径 2 :过程 a + 过程 b 1 2 c 中间态 a b

3过程的分类 (1)恒温过程即dT=0:整个过程中,系统的温度保持恒定 等(定)温过程:始态温度( 终态温度(2)一环境温度(Tex) 即T1-T=Tc,过程中温度可不恒定 (2)恒压过程即dp=0整个过程中,系统的压力保持恒定。 等(定)压过程:始、终态与环境压力相等,即p1=p2=p心x (3)恒容过程即dΨ=0整个过程中,系统体积保特不变, (4)绝热过程 即 do- 系统与环境无热交换。对那些变化极快的过程,如爆炸,快速燃烧,体系与环境来不及 发生热交换,那个瞬间可近似作为绝热过程处理。 (5)循环过程系统经历一系列变化后又回到始态的过程。 A=0X:任意状杰函数系统经历一循环过程后会部状态函数的改变值均为零。 (6)恒外压过程: P 系统在体积膨胀的过程中所反抗的环境压力是一常数 (⑦)向真空膨胀过程(自由膨胀):P=0 若选气体为系统,膨胀时环境压力为零。 七、热和功 热 体系与环境之间因温差而传递的能量称为 热,用符号Q表示。Q的取号: 体系吸热,0:体系放热,<0· 2功:体系与环境之间传递的除热以外的其它能量都称为功,用符号W表示。 功可分为彭胀功和非膨胀功两大类。W的取号: 环墙对体系作功50体系对环墙作功,0 Q和W都不是状态函数, 变化途径有关 2.4热力学第一定律 一、热功当量 焦耳(Joule)和迈耶(Mayer)自1840年起,历经20多年,用各种实验求证热和功的 转换关系,得到的结果是一致的。即:1cal一4.1840J 这就是著名的热功当量,为能量守恒原理提供了科学的实验证明。 二、能量守恒定斜 到1850年,科学界公认能量守恒定律是自然界的普遍规律之一。能量守恒与转化定律可表 述为:自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另 种形式,但在转化过程中,能量的总值不变。 三、热力学能 热力学能(山 energy)以前称为内能(internal energy),它是指体系内部能 量的总和,包括分子运动的平动能、分子内的转动能、振动能、电子能、核能以及各种粒 子之间的相互作用位能等。 热力学能是状态函数,用符号U表示,它的绝对值无法测定,只能求出它的变化值 四、热力学第一定律文字表示 是能量守恒与转化定律在热现象领域内所具有的特殊形式,说明热力学能、热和功之间可 以相互转化,但总的能量不变 也可以表述为:第一类永动机是不可能制成的。第一定律是人类经验的总结。 第一类永动机(first kind of perpetual motion mechine) 一种既不靠外界提供能量,本身也不减少能量,却可以不断对外作功的机器称为第一类永 4
4 3.过程的分类 (1)恒温过程 即 dT = 0;整个过程中,系统的温度保持恒定 等(定)温过程: 始态温度(T1)= 终态温度(T2)= 环境温度(Tex) 即 T1=T2=Tex,过程中温度可不恒定 (2)恒压过程 即 dp = 0 整个过程中,系统的压力保持恒定。 等(定)压过程: 始、终态与环境压力相等,即 p1 = p2 = pex (3)恒容过程 即 dV = 0 整个过程中,系统体积保持不变。 (4)绝热过程 即: dQ=0 系统与环境无热交换。对那些变化极快的过程,如爆炸,快速燃烧,体系与环境来不及 发生热交换,那个瞬间可近似作为绝热过程处理。 (5)循环过程 系统经历一系列变化后又回到始态的过程。 ΔX=0 X : 任意状态函数 系统经历一循环过程后全部状态函数的改变值均为零。 (6)恒外压过程:p 外=常数 系统在体积膨胀的过程中所反抗的环境压力是一常数。 (7) 向真空膨胀过程(自由膨胀):p 外=0 若选气体为系统,膨胀时环境压力为零。 七、热和功 1.热:体系与环境之间因温差而传递的能量称为 热,用符号 Q 表示。 Q 的取号: 体系吸热,Q>0;体系放热,Q0;体系对环境作功,W<0 。 Q 和 W 都不是状态函数,其数值与变化途径有关。 2.4 热力学第一定律 一、热功当量 焦耳(Joule)和迈耶(Mayer)自 1840 年起,历经 20 多年,用各种实验求证热和功的 转换关系,得到的结果是一致的。即: 1 cal = 4.1840 J 这就是著名的热功当量,为能量守恒原理提供了科学的实验证明。 二、能量守恒定律 到 1850 年,科学界公认能量守恒定律是自然界的普遍规律之一。能量守恒与转化定律可表 述为:自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一 种形式,但在转化过程中,能量的总值不变。 三、热力学能 热力学能(thermodynamic energy)以前称为内能(internal energy),它是指体系内部能 量的总和,包括分子运动的平动能、分子内的转动能、振动能、电子能、核能以及各种粒 子之间的相互作用位能等。 热力学能是状态函数,用符号 U 表示,它的绝对值无法测定,只能求出它的变化值。 四、热力学第一定律文字表示 是能量守恒与转化定律在热现象领域内所具有的特殊形式,说明热力学能、热和功之间可 以相互转化,但总的能量不变。 也可以表述为:第一类永动机是不可能制成的。第一定律是人类经验的总结。 第一类永动机(first kind of perpetual motion mechine) 一种既不靠外界提供能量,本身也不减少能量,却可以不断对外作功的机器称为第一类永
动机,它显然与能量守恒定律矛盾。 历史上曾一度热衷于制造这种机器,均以失败告终,也就证明了能量守恒定律的正确性。 五 热力学第一定律数学表示三 AU-0+W 对微小变化:dU=60+8W 因为热力学能是状态函数,数学上具有全微分性质,微小变化可用U表示:Q和W不是 状态函数,徽小变化用8表示,以示区别。 以前也用A .W表 两 麦达式完全等效,只是W的取号不同。用该式表示的W 的取号为:环境对体系作功, 0。 2.5准静态过程与可逆过程 一、功与过程 (一)膨胀过程设在定温下,一定量理想气体在活塞筒中克服外压,经4种不同途轻, 体积从八膨胀到2所作的功 ,自由胀(free expansion) 6W:=-p.dp=0 2.等外压膨胀(e保持不变) W2=-p.%2-) 体系所作的功如阴影面积所示, p.v A 图1.3.1等外压膨胀 3.多次等外压膨胀 ()克服外压为P',体积从膨胀到V (2)克服外压为p”,体积从V'膨胀到V: (③)克服外压为P乃,体积从V"影胀到。 W=-pW-)-p"W"-V)-p,心-V") 所作的功等于3次作功的加和。可见,外压差距越小,膨胀次数越多,做的功也越多 图1.3.2 多次等外压膨账
5 动机,它显然与能量守恒定律矛盾。 历史上曾一度热衷于制造这种机器,均以失败告终,也就证明了能量守恒定律的正确性。 五、热力学第一定律数学表示式 U = Q + W 对微小变化: dU =Q +W 因为热力学能是状态函数,数学上具有全微分性质,微小变化可用 dU 表示;Q 和 W 不是 状态函数,微小变化用 表示,以示区别。 以前也用 U = Q - W 表示,两种表达式完全等效,只是 W 的取号不同。用该式表示的 W 的取号为:环境对体系作功, W0 。 2.5 准静态过程与可逆过程 一、功与过程 (一)膨胀过程 设在定温下,一定量理想气体在活塞筒中克服外压 ,经 4 种不同途径, 体积从 V1 膨胀到 V2 所作的功。 1.自由膨胀(free expansion) 2.等外压膨胀(pe 保持不变) 体系所作的功如阴影面积所示。 3.多次等外压膨胀 (1)克服外压为 ,体积从 膨胀到 ; (2)克服外压为 ,体积从 膨胀到 ; (3)克服外压为 ,体积从 膨胀到 。 所作的功等于 3 次作功的加和。可见,外压差距越小,膨胀次数越多,做的功也越多 δ d 0 W p V e,1 e = − = e,2 e 2 1 W p V V = − − ( ) p ' V1 V ' p " V ' V " 2 p V " V2 e,3 1 W p V V = − − '( ' ) − − p V V "( " ') 2 2 − − p V V ( ")
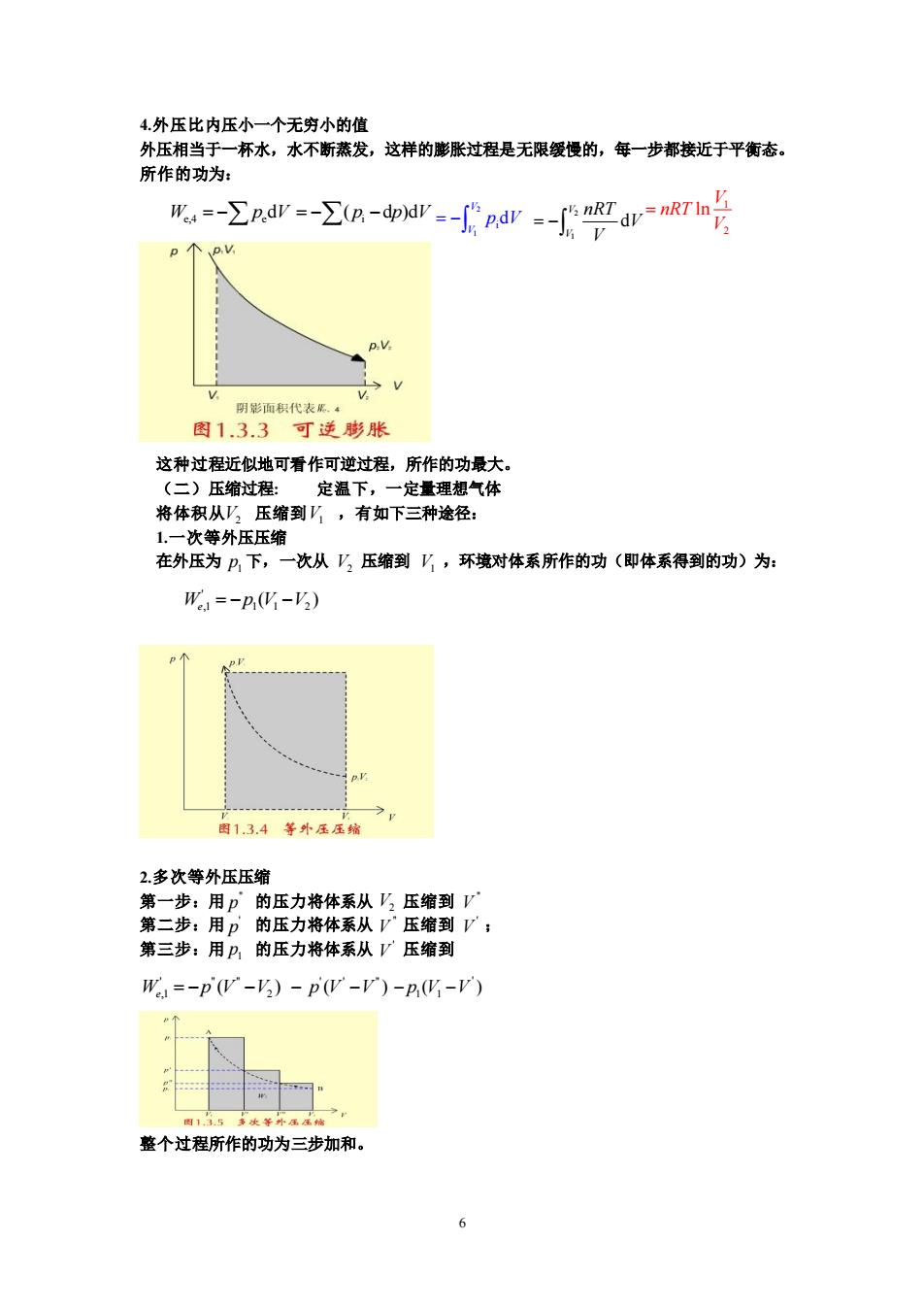
4.外压比内压小一个无穷小的值 外压相当于一杯水,水不断蒸发,这样的膨胀过程是无限缓慢的,每一步都接近于平衡态 所作的功为: Σdr-a-r:-nr-fgan号 个0 面积代表网 图1.3.3可逆膨胀 这种过程近似地可看作可逆过程,所作的功最大。 (一)压缩过程: 定温下,一定量理想气体 将体积从压缩到八,有如下三种途径: 1,一次等外压压缩 在外压为户下,一次从乃压缩到,环境对体系所作的功(即体系得到的功)为: W=-p,(化-) 图13.4等外压压% 2.多次等外压压缩 第一步:用p的压力将体系从压缩到y 第二步:用 的压力将体系从V压缩到V; 第三步:用户的压力将体系从压缩到 W=-pV-2)-pW-V)-p化-V 画5淡等本堡之 整个过程所作的功为三步加和。 6
6 4.外压比内压小一个无穷小的值 外压相当于一杯水,水不断蒸发,这样的膨胀过程是无限缓慢的,每一步都接近于平衡态。 所作的功为: 这种过程近似地可看作可逆过程,所作的功最大。 (二)压缩过程: 定温下,一定量理想气体 将体积从 压缩到 ,有如下三种途径: 1.一次等外压压缩 在外压为 下,一次从 压缩到 ,环境对体系所作的功(即体系得到的功)为: 2.多次等外压压缩 第一步:用 的压力将体系从 压缩到 第二步:用 的压力将体系从 压缩到 ; 第三步:用 的压力将体系从 压缩到 整个过程所作的功为三步加和。 W p V e,4 e = − d i = − − ( d )d p p V 2 1 id V V = − p V 2 1 d V V nRT V V = − 1 2 ln V nRT V = V2 V1 1 p V2 V1 ' ,1 1 1 2 ( ) W p V V e = − − " p V2 " V ' p " V ' V 1 p ' V ' " " ,1 2 ( ) W p V V e = − − ' ' " ( ) − − p V V ' 1 1 − − p V V ( )
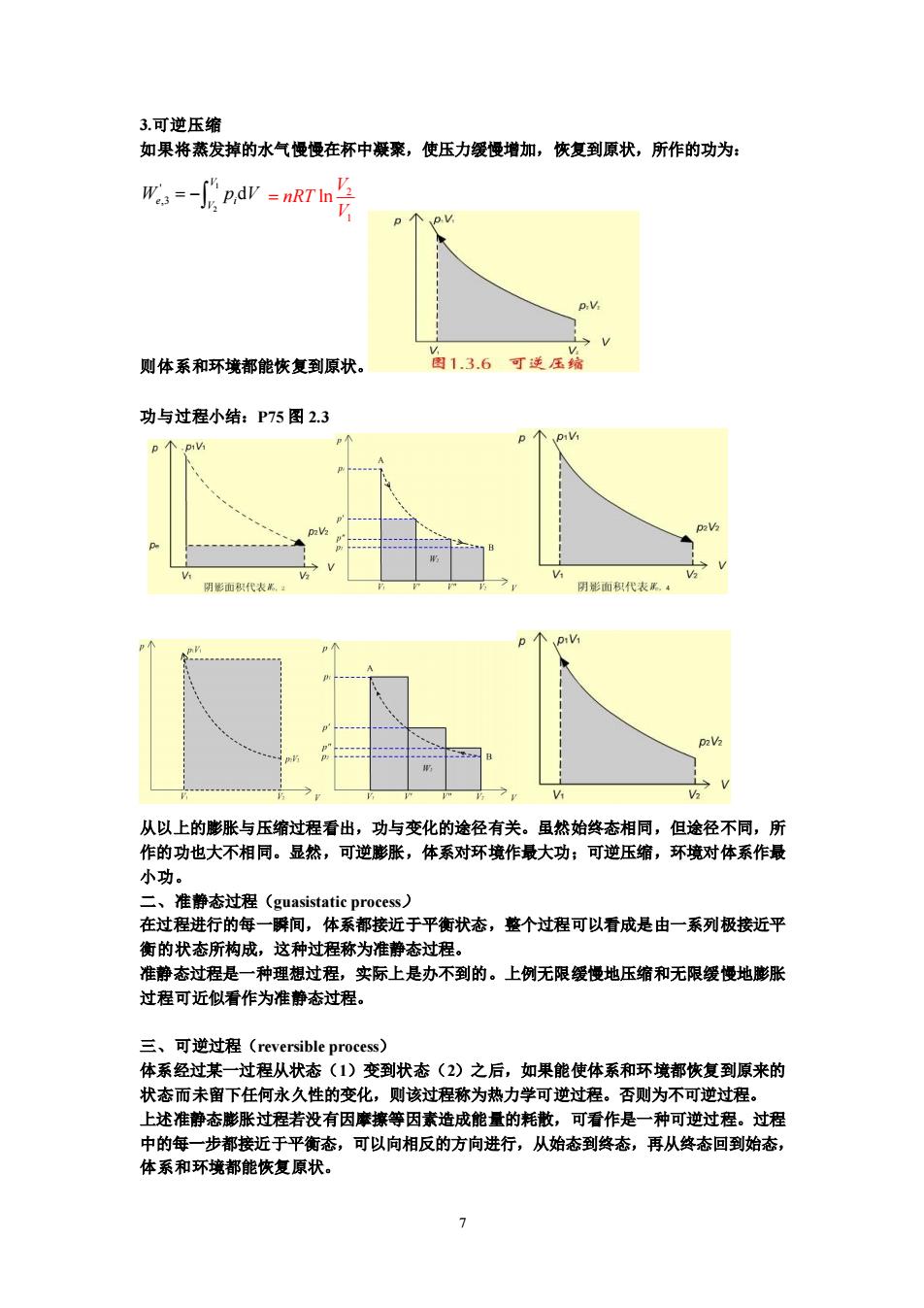
3.可逆压缩 如果将蒸发掉的水气慢慢在杯中凝聚,使压力缓慢增加,恢复到原状,所作的功为: ges=-fpdr=nRrn点 则体系和环境都能恢复到原状。 图1.3.6可逆压 功与过程小结:P75图2.3 p个p的 阴面积代表 从以上的膨胀与压缩过程看出,功与变化的途径有关。虽然始终态相同,但途径不同,所 作的功也大不相同。显然,可逆膨胀,体系对环境作最大功;可逆压缩,环境对体系作最 小功。 二、准静态过程(guasistatic process) 在过程进行的每一瞬间,体系都接近于平衡状态,整个过程可以看成是由一系列极接近平 衡的状态所构成,这种过程称为准静态过程 准静态过程是一种理想过程,实际上是办不到的。上例无限缓慢地压缩和无限缓慢地膨胀 过程可近似看作为准静态过程。 三、可逆过程(reversible process)? 体系经过其 过程从状态(1)变到状态(2)之后,如果能使体系和环境都恢复到原来的 状态而未留下任何水久性的变化,则该过程称为热力学可逆过程。否则为不可逆过程 上述准静态膨胀过程若没有因摩赛等因素造成能量的耗散,可看作是一种可逆过程。过程 中的每一步都接近于平衡态,可以向相反的方向进行,从始态到终态,再从终态回到始态, 体系和环境都能恢复原状
7 3.可逆压缩 如果将蒸发掉的水气慢慢在杯中凝聚,使压力缓慢增加,恢复到原状,所作的功为: 则体系和环境都能恢复到原状。 功与过程小结:P75 图 2.3 从以上的膨胀与压缩过程看出,功与变化的途径有关。虽然始终态相同,但途径不同,所 作的功也大不相同。显然,可逆膨胀,体系对环境作最大功;可逆压缩,环境对体系作最 小功。 二、准静态过程(guasistatic process) 在过程进行的每一瞬间,体系都接近于平衡状态,整个过程可以看成是由一系列极接近平 衡的状态所构成,这种过程称为准静态过程。 准静态过程是一种理想过程,实际上是办不到的。上例无限缓慢地压缩和无限缓慢地膨胀 过程可近似看作为准静态过程。 三、可逆过程(reversible process) 体系经过某一过程从状态(1)变到状态(2)之后,如果能使体系和环境都恢复到原来的 状态而未留下任何永久性的变化,则该过程称为热力学可逆过程。否则为不可逆过程。 上述准静态膨胀过程若没有因摩擦等因素造成能量的耗散,可看作是一种可逆过程。过程 中的每一步都接近于平衡态,可以向相反的方向进行,从始态到终态,再从终态回到始态, 体系和环境都能恢复原状。 1 2 ' ,3 d V e i V W p V = − 2 1 ln V nRT V =

2.6格(enthalpy) 1.焙的定义式 H=U+pV 2为什么要定义格? 为了使用方便,因为在等压、不作非膨胀功的条件下,培变等于等压热效应。容 易测定,从而可求其它热力学函数的变化值 即Q-DH (封闭系统 等压,W'=0) 3焙是状态函数定义式中培由状态函数组成。 4注意:培不是能量虽然具有能量的单位,但不遵守能量守恒定律。 2.7热容(heat capacity) 对于组成不变的均相封闭体系,不考虑非膨张功,设体系吸热,温度从1升高到 2,则: 1.平均热容 定义 T;-T 单位 J.K-1 C=0O (温度变化很 2.比热容: 规定物质的数量为1g(或1kg)的热容。 它的单位是JK1.g或JK-1kg 3.摩尔热容Cm 规定物质的数量为1m0l的热容。 单位为:J.K-.mol- 4等压热帝C,9=(册。 dT △H=Qp=[CdT 海#海aG品-( 6.热容与温度的关系: 热容与温度的函数关系因物质、物态和温度区间的不同而有不同的形式。例如,气体的等压 摩尔热容与T的关系有如下经验式:
8 2.6 焓 (enthalpy) 1.焓的定义式: H = U + pV 2.为什么要定义焓? 为了使用方便,因为在等压、不作非膨胀功的条件下,焓变等于等压热效应 。 容 易测定,从而可求其它热力学函数的变化值 即 Qp=DH 或 dQp=dH (封闭系统,等压,W ' = 0) 3.焓是状态函数 定义式中焓由状态函数组成。 4.注意: 焓不是能量 虽然具有能量的单位,但不遵守能量守恒定律。 2.7 热容 (heat capacity) 对于组成不变的均相封闭体系,不考虑非膨胀功,设体系吸热 Q,温度从 T1 升高到 T2,则: 1.平均热容 定义 单位 (温度变化很小) 2.比热容: 规定物质的数量为 1 g(或 1 kg)的热容。 它的单位是 或 。 3.摩尔热容 Cm: 规定物质的数量为 1 mol 的热容。 单位为: 4.等压热容 Cp: 5.等容热容 Cv: 6.热容与温度的关系: 热容与温度的函数关系因物质、物态和温度区间的不同而有不同的形式。例如,气体的等压 摩尔热容与 T 的关系有如下经验式: T2 T1 Q C − = 1 J K − d Q C T = 1 1 J K g − − 1 1 J K kg − − 1 1 J K mol − − ( ) d p p p Q H C T T = = = = H Q C T p pd ( ) d V V V Q U C T T = = ( ) d V V V Q U C T T = =

Cp.m=a+bT+cT2+.或 Cpm=a'+b'T+c'T+. 式中a,b,ca是经验常数,由各种物质本身的特性决定,可从热力学数据表中查找。 2.8热力学第一定律对理想气体的应用 本节主婴介绍以下3个问 1盖昌萨克一焦耳实验(理 想气体的U和HD 2理想气体的印与C之差 3绝热过程方程式和过程的功 c-Joule实验(理想气体的U和H) 焦耳在184 别做了如下实验 将两个容量相等的容器,放在水浴中,左球充满气体,右球为真空(如图所示)。 打开活塞,气体由左球冲入右球,达平衡(如图所示) 水浴温度没有变化,即Q=0:由于体系的体积取两个球的总和,所以体系没有对外做功, W=0:根据热力学第一定律得该过程的△U=0 气达到平 盖.吕萨克-焦耳实脸(1) 盖昌蓝克-焦耳卖给(2》 Gay-Lussac-Joule实验一结论 前述:对于定量的纯物质,热力学能U由P,V,T中的任意两个独立变量来确定: 设热力学能可写成0f(T,) 微分 -()V( 焦耳实验结果:d7=0,dU=0,d≠0 dT-0,d≠0 0 同理,若内能写成 0=f(T,p) 9
9 或 式中 a,b,c,a’,. 是经验常数,由各种物质本身的特性决定,可从热力学数据表中查找。 2.8 热力学第一定律对理想气体的应用 本节主要介绍以下 3 个问题: 1.盖•吕萨克—焦耳实验(理想气体的 U 和 H) 2.理想气体的 Cp 与 Cv 之差 3.绝热过程方程式和过程的功 1. Gay-Lussac-Joule 实验(理想气体的 U 和 H) 盖•吕萨克 1807 年,焦耳在 1843 年分别做了如下实验: 将两个容量相等的容器,放在水浴中,左球充满气体,右球为真空(如图所示)。 打开活塞,气体由左球冲入右球,达平衡(如图所示) 水浴温度没有变化,即 Q=0;由于体系的体积取两个球的总和,所以体系没有对外做功, W=0;根据热力学第一定律得该过程的 。 Gay-Lussac-Joule 实验—结论 前述:对于定量的纯物质,热力学能 U 由 P,V,T 中的任意两个独立变量来确定: 设热力学能可写成 U=f(T,V) 微分 焦耳实验结果:dT=0,dU=0,dV≠0 dT=0,dV≠0 同理,若内能写成 U = f(T,p) 2 C a bT cT p,m = + + + 1 2 ,m ' ' ' C a b T c T p − − = + + + T V U U dU = ( ) dV + ( ) dT V T T V U U 0= ( ) dV + ( ) dT V T T U ( ) =0 V T U ( ) =0 P = U 0

常温常压时的气体可视为理想气体 故:理想气体的内能仅是温度的函数,与体积或压力无关,即可(T) 对于理想气体,在等温条件下PV-常数,即PV)0,所以根据格的定义可证理想气体的 枯也仅为温度的函数。 即 H=H(T) 0,=0学-0 周为G=C,=欲。 故:理想气体的Cy,C也仅为温度的函数。 本节小结:从盖吕萨克一焦耳实验得到理想气体的热力学能和烙仅是温度的函数,用数学 表示为: 0-0(0-0U=tm (0,=00=0H=im 即:在恒温时,改变体积或压力,理想气体的热力学能和培保持不变。且理想气体的C,Cp 也仅为温度的函数。 2.理想气体的Cp与Cv之差 气体的C印恒大于C: 因为等容过程中,升高温度,体系所吸的热全部用来增加热力学能:而等压过程中,所吸 的热除增加热力学能外,还要多吸一点热量用来对外做影胀功,所以气体的C印恒大于C,。 对于理想气体:Cp-Cy=nR Cpm-Cym=R(下面证明) 一般封闭体系Cp与Cv之差 C,-=0,- -aP),-(代入院义式) T =,+,a 下面需要证明 书P454附录:根据复合函数的偏微商公式可证 证明设:
10 常温常压时的气体可视为理想气体 故:理想气体的内能仅是温度的函数,与体积或压力无关,即 U=f(T) 对于理想气体,在等温条件下 PV=常数,即 d(PV)=0,所以根据焓的定义可证理想气体的 焓也仅为温度的函数。 即 又因为 故:理想气体的 Cv,Cp 也仅为温度的函数。 本节小结:从盖•吕萨克—焦耳实验得到理想气体的热力学能和焓仅是温度的函数,用数学 表示为: 即:在恒温时,改变体积或压力,理想气体的热力学能和焓保持不变。且理想气体的 Cv,Cp 也仅为温度的函数。 2. 理想气体的 Cp 与 Cv 之差 气体的 Cp 恒大于 Cv: 因为等容过程中,升高温度,体系所吸的热全部用来增加热力学能;而等压过程中,所吸 的热除增加热力学能外,还要多吸一点热量用来对外做膨胀功,所以气体的 Cp 恒大于 Cv 。 对于理想气体: (下面证明) 一般封闭体系 Cp 与 Cv 之差 (1 式) 下面需要证明 书 P454 附录:根据复合函数的偏微商公式可证 证明 设: H H T = ( ) ( ) 0 T H V = ( ) 0 T H p = ( ) V V U C T = ( ) p p H C T = ( ) 0 T U V = ( ) 0 T U p = U U T = ( ) ( ) 0 T H V = ( ) 0 T H p = H H T = ( ) C C nR p V − = C C R p,m V,m − = ( ) ( ) p p V V H U C C T T − = − ( ) ( ) ( ) p V U PV U H T T + = − (代入 定义式) ( ) ( ) ( ) p p V V U p T U T T = + − ( ) ? p U T =