
物理化学教案 新疆大学化学化工学院物理化学教研室刘月娥 第三章热力学第二定律 3.1自发变化的共同特征一不可逆性 一旦发生就无需借助外力,可以自动进行,这种变化称为自发 变化。 自发变化的共同特征一不可逆性任何自发变化的逆过程是不能自动进行的。例如: 1) 焦耳热功当量中功自动转变成热: 在焦耳的热功当量实 它的逆过程 的温度 物下隆酒样毒热器中的水技拉动从面使水温上开 自动降低而 起不可能自动实现 (2)气体向真空膨胀: 逆过程气体的压缩过程不会自动进行 (3)热量从高温物体传入低温物体: (4浓度不的溶液混合均匀 (⑤)锌片与硫酸铜的置换反 它们的逆过程都不能自动进行。当借助外力,体系恢复原状后,会给环境留下不可磨灭的 影响。 3.2热力学第二定律的表述 克劳修新(Clausius)的说法:“不可能把热从低温物体传到高温物体,而不引起其它变化。” 开尔文(Kn)的说法:“不可能从单一热源取出热使之完全变为功,而不发生其它的变 后来被奥斯特瓦德(Ostward)表述为 二类永动机是不可能造成的”。 第二类永动机:从单一热源吸热使之完全变为功而不留下任何影响。 各种说法完全等价,是人类经验的总结。 注意: (山)并非热不能从低温物体传给高温物体,而是不产生其它变化,如致冷机需要消耗电能。 (2)不能简单理解开尔文说法为 部分 热 功 会部 如理想气体等温膨胀,DU=0,-Q=W,即热全部变为功但气体体积变大了。不引起其它 变化的条件下,热不能全部转化为功 3)第 永动机: 一种能够从 一热源吸热,并将所吸收的热全部变为功而无其它影响的 机器,那是不可能造成的。 热 第三类永动机 功 33卡诺定理 卡诺定理:所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆
1 物 理 化 学 教 案 新疆大学化学化工学院物理化学教研室 刘月娥 第三章 热力学第二定律 3.1 自发变化的共同特征—不可逆性 自发变化? 某种变化有自动发生的趋势,一旦发生就无需借助外力,可以自动进行,这种变化称为自发 变化。 自发变化的共同特征—不可逆性 任何自发变化的逆过程是不能自动进行的。例如: (1) 焦耳热功当量中功自动转变成热; 在焦耳的热功当量实验中,重物下降带动搅拌器,量热器中的水被搅动,从而使水温上升。 它的逆过程即水的温度自动降低而重物自动举起不可能自动实现 (2) 气体向真空膨胀; 逆过程气体的压缩过程不会自动进行 (3) 热量从高温物体传入低温物体; (4) 浓度不等的溶液混合均匀; (5) 锌片与硫酸铜的置换反应等, 它们的逆过程都不能自动进行。当借助外力,体系恢复原状后,会给环境留下不可磨灭的 影响。 3.2 热力学第二定律的表述 克劳修斯(Clausius)的说法:“不可能把热从低温物体传到高温物体,而不引起其它变化。” 开尔文(Kelvin)的说法:“不可能从单一热源取出热使之完全变为功,而不发生其它的变 化。” 后来被奥斯特瓦德(Ostward)表述为:“第二类永动机是不可能造成的”。 第二类永动机:从单一热源吸热使之完全变为功而不留下任何影响。 各种说法完全等价,是人类经验的总结。 注 意: (1) 并非热不能从低温物体传给高温物体,而是不产生其它变化,如致冷机需要消耗电能。 (2) 不能简单理解开尔文说法为: 部分 热 功 全部 如理想气体等温膨胀,DU = 0,-Q = W,即热全部变为功但气体体积变大了。不引起其它 变化的条件下,热不能全部转化为功。 (3) 第二类永动机:一种能够从单一热源吸热,并将所吸收的热全部变为功而无其它影响的 机器,那是不可能造成的。 3.3 卡诺定理 卡诺定理:所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆

机的效率最大。 卡诺定理推论:所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相等,即与热 机的工作物质无关 卡诺定理的意义:(1)引入了一个不等号原则上解决了化学反应的方向问题:(2)解决 了热机效率的极限值问题。 卡诺定理的证明 证明:设两热源间有可逆热机®)和在意机热机,如右图。调节两热机所作的功相等, 可逆机从高温热源吸热Q,作功,放热(Q-,其效率=-W1Q, 高温热源T 热机 g←形 g 低温热源 不可逆机从高温热源吸Q',作功,放热('-,其效率1=-W/ 反证法:假设川>R 得-W10'>-W12 因W1/Q 可得 01>0 若把两机联合操作,并把卡诺机逆转,所需的功由不可逆机供给。 循环一周后: 从低温热源吸热: (01-0-(01'-0=01-O1'>0 高温热源得热: 体而没发生其它变化,违反热力号 第二定律。所以原假设1>R不成立;只能R≥ 卡诺定理推论的证明 所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相等,即与热机的工作物 质无 证明:假设有两个不同的卡诺热机A和B,若A为可逆机,按卡诺定理A≥川:但B也 是可逆机,所以B≥:因此只有一种可能A=加 表明:只要两个热源温度一定,不论工作介质是什么物质,也不论其中是pT变化或相变 化、化学变化以及其它任意的变化,它们的热机效率是一样的 3.4的念 摘=(热)火十(热温Q/T商 1,从卡诺循环得到的结论
2 机的效率最大。 卡诺定理推论:所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相等,即与热 机的工作物质无关。 卡诺定理的意义:(1)引入了一个不等号原则上解决了化学反应的方向问题;(2)解决 了热机效率的极限值问题。 卡诺定理的证明 证明:设两热源间有可逆热机(R)和任意机热机(I),如右图。调节两热机所作的功相等, 可逆机从高温热源吸热 Q1,作功 W,放热 (Q1-W) ,其效率 ηR = -W / Q1 不可逆机从高温热源吸 Q1' ,作功 W,放热 (Q1' - W) ,其效率 ηI = -W / Q1' 反证法: 假设 ηI >ηR 得 -W / Q1 ' > -W / Q1 因 W 1/ Q1 可得 Q1 > Q1' 若把两机联合操作,并把卡诺机逆转,所需的功由不可逆机供给。 循环一周后: 从低温热源吸热 : (Q1 - W) - (Q1' - W) = Q1 - Q1' > 0 高温热源得热 : Q1 -Q1 ' 总结果:热从低温物体传到高温物 体而没发生其它变化,违反热力学 第二定律。所以原假设 ηI >ηR 不成立;只能 ηR≥ηI 卡诺定理推论的证明 所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相等,即与热机的工作物 质无关。 证明:假设有两个不同的卡诺热机 A 和 B,若 A 为可逆机,按卡诺定理 ηA ≥η B;但 B 也 是可逆机,所以 ηB≥ηA;因此只有一种可能 ηA = ηB 表明: 只要两个热源温度一定,不论工作介质是什么物质,也不论其中是 pVT 变化或相变 化、化学变化以及其它任意的变化,它们的热机效率是一样的 3.4 熵的概念 熵 = (热) 火+(热温 Q/T)商 1.从卡诺循环得到的结论
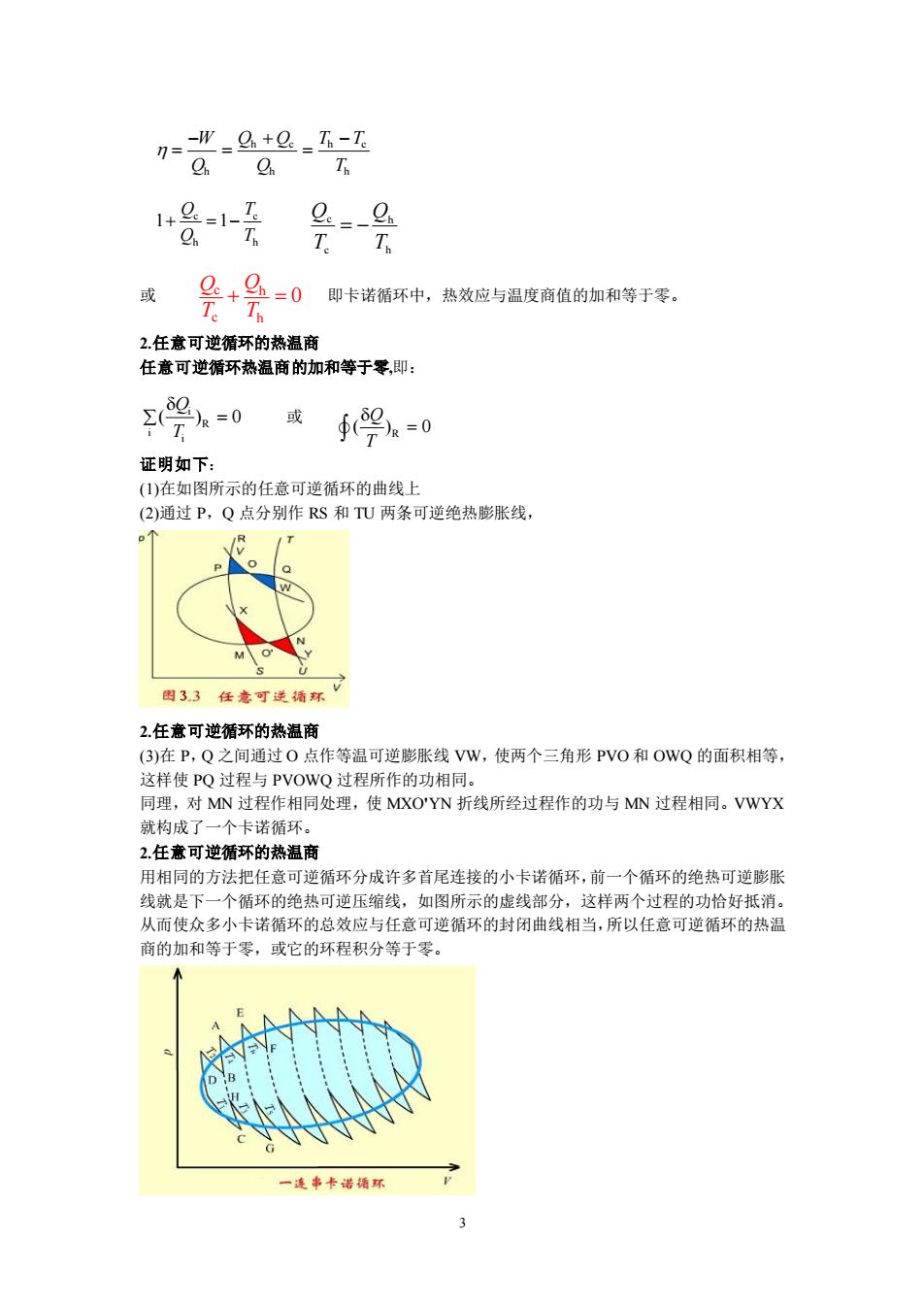
-W_G+e_T-T T 或 +马=0即卡诺循环中,热效应与温度商值的加和等于零 Te Th 2.任意可逆循环的热温商 任意可逆循环热温商的加和等于零,即: =0 或 ∮9n=0 证明如下: (1)在如图所示的任意可逆循环的曲线上 (2)通过P,Q点分别作RS和TU两条可逆绝热膨张线, 33任意可环可 2.任意可逆循环的热温商 (3)在P,Q之间通过O点作等温可逆膨胀线VW,使两个三角形PVO和OWQ的面积相等, 这样使PQ过程与PVOWQ过程所作的功相同。 同理,对MN过程作相同处理,使MXO'YN折线所经过程作的功与MN过程相同。VWYX 就构成了一个卡诺循 2.任意可逆循环的热温商 用相同的方法把任意可逆循环分成许多首尾连接的小卡诺循环,前一个循环的绝热可逆膨胀 线就是下一个循环的绝热可逆压缩线,如图所示的虚线部分,这样两个过程的功恰好抵消。 从而使众多小卡诺循环的总效应与任意可逆循环的封闭曲线相当,所以任意可逆循环的热温 商的加和等于零,或它的环程积分等于零
3 或 即卡诺循环中,热效应与温度商值的加和等于零。 2.任意可逆循环的热温商 任意可逆循环热温商的加和等于零,即: 或 证明如下: (1)在如图所示的任意可逆循环的曲线上 (2)通过 P,Q 点分别作 RS 和 TU 两条可逆绝热膨胀线, 2.任意可逆循环的热温商 (3)在 P,Q 之间通过 O 点作等温可逆膨胀线 VW,使两个三角形 PVO 和 OWQ 的面积相等, 这样使 PQ 过程与 PVOWQ 过程所作的功相同。 同理,对 MN 过程作相同处理,使 MXO'YN 折线所经过程作的功与 MN 过程相同。VWYX 就构成了一个卡诺循环。 2.任意可逆循环的热温商 用相同的方法把任意可逆循环分成许多首尾连接的小卡诺循环,前一个循环的绝热可逆膨胀 线就是下一个循环的绝热可逆压缩线,如图所示的虚线部分,这样两个过程的功恰好抵消。 从而使众多小卡诺循环的总效应与任意可逆循环的封闭曲线相当,所以任意可逆循环的热温 商的加和等于零,或它的环程积分等于零。 或: h c h c h h h W Q Q T T Q Q T − + − = = = c c h h 1 1 Q T Q T + = − h h c c T Q T Q = − c h c h 0 Q Q T T + = i R i i ( ) 0 Q T = R ( ) 0 Q T =

3.熵的引出 用一闭合曲线代表任意可逆循环。 在曲线上任意取A,B两点,把循环分成A,B和BA两个可逆过程。 根据任意可逆循环热温商的公式: f9a=0 可分成两项的加和 a+9=0 3 任意可逆循环 移项得: 9。=9a 说明任意可逆过程的热温商的值决定于始终状态,而与可逆途径无关,这个热温商具有状态 函数的性质。 4.熵的定义 Clausius根据可逆过程的热温商值决定于始终态而与可逆过程无关这一事实定义了“熵 (entropy)这个函数,用符号S表示,单位为J,K 设始、终态A,B的熵分别为和,则: 8-5=A5=9。度4A=号 △5-Σ学。=0对微小安化5=学 几个变的计算式习惯上称为熵的定义式,即嫡的变化值可用可逆过程的热温商值来衡 量 3.5 Clausius不等式与摘增加原理 1.Clausius不等式 设温度相同的两个高、低温热源间有一个可逆机和一个不可逆机。 n-g+2=1+g . 根据卡诺定理: +9<0 T。I
4 3.熵的引出 用一闭合曲线代表任意可逆循环。 在曲线上任意取 A,B 两点,把循环分成 A→B 和 B→A 两个可逆过程。 根据任意可逆循环热温商的公式: 可分成两项的加和 移项得: 说明任意可逆过程的热温商的值决定于始终状态,而与可逆途径无关,这个热温商具有状态 函数的性质。 4.熵的定义 Clausius 根据可逆过程的热温商值决定于始终态而与可逆过程无关这一事实定义了“熵” (entropy)这个函数,用符号“S”表示,单位为 设始、终态 A,B 的熵分别为 和 ,则: 或 对微小变化 这几个熵变的计算式习惯上称为熵的定义式,即熵的变化值可用可逆过程的热温商值来衡 量。 3.5 Clausius 不等式与熵增加原理 1.Clausius 不等式 设温度相同的两个高、低温热源间有一个可逆机和一个不可逆机。 则: 根据卡诺定理: R ( ) 0 Q T = 1 2 B A R R A B ( ) ( ) 0 Q Q T T + = 1 2 B B R R A A ( ) ( ) Q Q T T = B B A R A ( ) Q S S S T − = = R ( )i i i Q S T = R ( ) 0 i i i Q S T − = d ( )R Q S T = h c h h c IR 1 Q Q Q Q Q = + + = h c c R h h 1 T T T T T − = = − c h c h 0 Q Q T T + 1 J K−

R②9 或△SB-∑号An>0 IR B 不可逆循环 如A→B为可逆过程 A.-9=0 将两式合并得Clausius不等式: AS-(∑9.n≥0 δQ是实际过程的热效应,T是环境温度。若是不可逆过程,用>”号,可逆过程用=” 号,这时环境与体系温度相同。 对于微小变化: ds-90或ds82 这些都称为Clausius不等式,也可作为热力学第二定律的数学表达式。 2,熵增加原理 对于绝热体系,δQ=0,所以Clausius不等式为 等号表示绝热可逆过程,不等号表示绝热不可逆过程。熵增加原理可表述为:在绝热条件 下,趋向于平衡的过程使体系的熵增加。或者说在绝热条件下,不可能发生熵减少的过程。 如果是一个孤立体系,环境与体系间既无热的交换,又无功的交换,则熵增加原理可表 述为: 一个孤立体系的熵永不减少 3.Clausius不等式的意义 C1 susius不等式引进的不等号,在热力学上可以作为变化方向与限度的判据。 5
5 则 推广为与多个热源接触的任意不可逆过程得: 设有一个循环, 为不可逆过程, 为可逆过程,整个循环为不可逆循环。 则有 或 如 A→B 为可逆过程 将两式合并得 Clausius 不等式: 是实际过程的热效应,T 是环境温度。若是不可逆过程,用“>”号,可逆过程用“=” 号,这时环境与体系温度相同。 对于微小变化: 或 这些都称为 Clausius 不等式,也可作为热力学第二定律的数学表达式。 2.熵增加原理 对于绝热体系, ,所以 Clausius 不等式为 等号表示绝热可逆过程,不等号表示绝热不可逆过程。熵增加原理可表述为:在绝热条件 下,趋向于平衡的过程使体系的熵增加。或者说在绝热条件下,不可能发生熵减少的过程。 如果是一个孤立体系,环境与体系间既无热的交换,又无功的交换,则熵增加原理可表 述为:一个孤立体系的熵永不减少。 3.Clausius 不等式的意义 Clsusius 不等式引进的不等号,在热力学上可以作为变化方向与限度的判据。 IR R i IR i i ( ) 0 Q T A IR,A B R B i ( ) ( ) 0 Q Q T T → + A R A B B ( ) Q S S T = − B A IR,A B i ( ) Q S S T → − A B IR,A B i ( ) 0 Q S T → → − A B R,A B i ( ) 0 Q S T → → − = A B A B i ( ) 0 Q S T → → − Q d 0 Q S T − d Q S T = Q 0 d 0 S A B → B A →

d5≥82”号为不可逆过程 号为可逆过程 d5≥0一号为自发过程 =”号为处于平衡状态 因为隔离体系中一且发生一个不可逆过程,则一定是自发过程。有时把与体系密切相 关的环境也包括在一起,用来判断过程的自发性,即: △S。=△S(体系)+△S(环境)20 >”号为自发过程 “=”号为可逆过程 世界直有末日吗? 熵增原理 dS隔≥0或4S隔≥0 自发 平衡 热寂论:字宙是隔高系统,其过程总是自发的,因此痛总是增加,朝无序发展,最终达到 极限一热力学绝对平衡,即高度无序,温度完全一致,任何事物都不会变了! 这不是很好吗?不再受热、挨冻,人人公平!这就修了1世界不会变了,值得可爱吗? 你们都不要太高兴或太悲哀1谁说宇 宙是隔高系统 热力学定律是在有限的空 间中总结出的规律,应用到无限的空间中时,请问是否保证成立? 3.6热力学基本方程与TS图 一、热力学基本方程一热力学第一和第二定律的联合公式 系统在可逆过程中所吸收的热为δQR 此过程中的熵变为 a5-8g 根据热力学第一定律 dU=60+6W dU =TdS-pdv 这是热力学第一与第二定律的联合公式,适用于组成恒定、不作非膨胀功的封闭体系。 注意: 虽然用到了80e=TdS 的公式,但适用于任何可逆或不可逆过程,因为式中的物理量 皆是状态函数,其变化值仅决定于始、终态。但只有在可逆过程中TS才代表δQ -pd业才代表δW Tds=dU pdv ds=7d0+号dr S=U,) 比较(1)(2)得: ()片度T() 6
6 “>” 号为不可逆过程 “=” 号为可逆过程 “>” 号为自发过程 “=” 号为处于平衡状态 因为隔离体系中一旦发生一个不可逆过程,则一定是自发过程。有时把与体系密切相 关的环境也包括在一起,用来判断过程的自发性,即: “>” 号为自发过程 “=” 号为可逆过程 世界真有末日吗? 熵增原理: dS 隔 ≥ 0 或 ΔS 隔 ≥ 0 自发 平衡 热寂论: 宇宙是隔离系统,其过程总是自发的,因此熵总是增加,朝无序发展,最终达到 极限——热力学绝对平衡,即高度无序,温度完全一致,任何事物都不会变了! 这不是很好吗?不再受热、挨冻,人人公平!这就惨了!世界不会变了,值得可爱吗? 你们都不要太高兴或太悲哀!谁说宇宙是隔离系统? 热力学定律是在有限的空间中总结出的规律,应用到无限的空间中时,请问是否保证成立? 3.6 热力学基本方程与 T-S 图 一、热力学基本方程——热力学第一和第二定律的联合公式 系统在可逆过程中所吸收的热为 QR 此过程中的熵变为 根据热力学第一定律 dU =Q +W 这是热力学第一与第二定律的联合公式,适用于组成恒定、不作非膨胀功的封闭体系。 注 意: 虽然用到了 的公式,但适用于任何可逆或不可逆过程,因为式中的物理量 皆是状态函数,其变化值仅决定于始、终态。但只有在可逆过程中 才代表 , 才代表 。 (1) S=S(U,V) (2) 比较(1)(2)得: 或 d Q T S R = d Q S T iso d 0 S iso = + S S S ( ( 0 体系) 环境) QR dS T = d d d U T S p V = − T Sd QR − p Vd We T S U p V d d d = + 1 d d d P S U V T T = + ( ) ( ) V U S S dS dU dV U V = + 1 V S U T = V U T S =
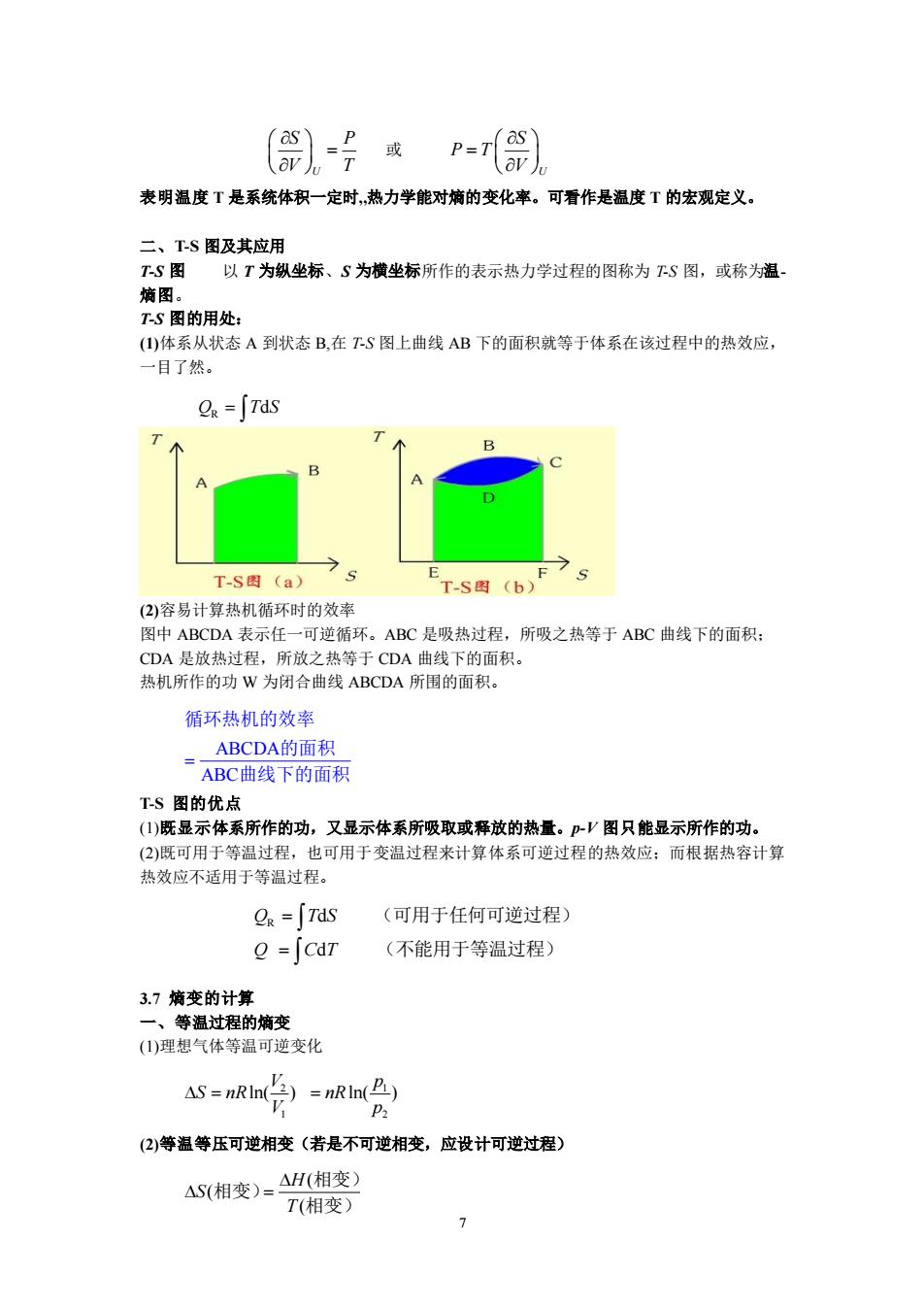
表明温度T是系统体积一定时,热力学能对熵的变化率。可看作是温度T的宏观定义。 二、TS图及其应用 T灯图 以T为纵坐标、S为横坐标所作的表示热力学过程的图称为下S图,或称为温 下S图的用处 ()体系从状态A到状态B,在TS图上曲线AB下的面积就等于体系在该过程中的热效应, 一目了然。 g=∫Tds 75 7 T.S图(a) T-S图(b) (2)容易计算热机循环时的效率 图中ABCDA表示任一可逆循环。ABC是吸热过程,所吸之热等于ABC曲线下的面积: CDA是放热过程,所放之热等于CDA曲线下的面积。 热机所作的功W为闭合曲线ABCDA所围的面积。 循环热机的效率 ABCDA的面积 ABC曲线下的面积 TS图的优点 ()既显示体系所作的功,又显示体系所吸取或释放的热量。p-V图只能显示所作的功, (2)既可用于等温过程,也可用于变温过程来计算体系可逆过程的热效应:而根据热容计算 热效应不适用于等温过程。 g=∫Tds (可用于任何可逆过程)》 2=[caT (不能用于等温过程) 3.7摘变的计算 一、等温过程的嫡变 ()理想气体等温可逆变化 AS=nRin=nRnA (2)等温等压可逆相变(若是不可逆相变,应设计可逆过程) AS(相变)=4H(相变) T(相变)
7 或 表明温度 T 是系统体积一定时,热力学能对熵的变化率。可看作是温度 T 的宏观定义。 二、T-S 图及其应用 T-S 图 以 T 为纵坐标、S 为横坐标所作的表示热力学过程的图称为 T-S 图,或称为温- 熵图。 T-S 图的用处: (1)体系从状态 A 到状态 B,在 T-S 图上曲线 AB 下的面积就等于体系在该过程中的热效应, 一目了然。 (2)容易计算热机循环时的效率 图中 ABCDA 表示任一可逆循环。ABC 是吸热过程,所吸之热等于 ABC 曲线下的面积; CDA 是放热过程,所放之热等于 CDA 曲线下的面积。 热机所作的功 W 为闭合曲线 ABCDA 所围的面积。 T-S 图的优点 (1)既显示体系所作的功,又显示体系所吸取或释放的热量。p-V 图只能显示所作的功。 (2)既可用于等温过程,也可用于变温过程来计算体系可逆过程的热效应;而根据热容计算 热效应不适用于等温过程。 3.7 熵变的计算 一、等温过程的熵变 (1)理想气体等温可逆变化 (2)等温等压可逆相变(若是不可逆相变,应设计可逆过程) U S P V T = U S P T V = R Q T S = d ABCDA ABC = 循环热机的效率 的面积 曲线下的面积 R d d Q T S Q C T = = (可用于任何可逆过程) (不能用于等温过程) 2 1 ln( ) V S nR V = 1 2 ln( ) p nR p = ( ( ( H S T = 相变) 相变) 相变)

(③)理想气体(或理想溶液)的等温等压混合过程,并符合分体积定律,即 △S=-R∑nInxp 例题 例1:1mol理想气体在等温下通过:()可逆膨胀(2)真空膨胀,体积增加到10倍,分别求 其熵变 解:(1)可逆膨胀 △体系)-号。-=nRn 2=nRln10=19.14J-K- △S(隔离)=△S(体系)+△S(环境)=0 (1)为可逆过程。 (2)真空膨胀 熵是状态函数,始终态相同,体系嫡变也相同,所以: △S(体系)=19.14J-K 但环境没有熵变,则: △S(隔离)=△S(体系)=19.14J.K1>0 (2)为不可逆过程 例2:求下述过程熵变。已知H20(1)的汽化热为40.620kJ·mol H,01mol,lp,373.15K)=H,01mol,gp,373.15K) 解: △体系)=(号。=△,=40620:mo=1089J-K.m0r T 373.15K 如果是不可逆相变,可以设计可逆相变求△S值。 例3:在273K时,将一个22.4dm3的盒子用隔板一分为二,一边放0.5molO2(g),另 -边放0.5molN2(g) 解法1: ASo,)=nRn2=05Rn号器 AS(N,)=0.5RIn 22.4 2.2 22Rn2 224 AiS=AS(O2)+AS(N2 )RIn 解法2:AmS=-R∑ng In xa
8 (3)理想气体(或理想溶液)的等温等压混合过程,并符合分体积定律,即 例 题 例 1:1mol 理想气体在等温下通过:(1)可逆膨胀 (2)真空膨胀,体积增加到 10 倍,分别求 其熵变。 解:(1)可逆膨胀 (1)为可逆过程。 (2)真空膨胀 熵是状态函数,始终态相同,体系熵变也相同,所以: 但环境没有熵变,则: (2)为不可逆过程 例 2:求下述过程熵变。已知 H2O(l)的汽化热为 解: 如果是不可逆相变,可以设计可逆相变求 值。 例 3:在 273 K 时,将一个 的盒子用隔板一分为二,一边放 ,另 一边放 解法 1: 解法 2: mix B B B = − S R n x ln B B V x V = max R ( ( ) Q W S T T − = = 体系) 2 1 ln V nR V = 1 nRln10 19.14 J K− = = = + = S S S (隔离) (体系) (环境) 0 1 S 19.14 J K− = (体系) 1 S S 19.14 J K 0 − = = (隔离) (体系) -1 40.620 kJ mol H O(1 mol,l, ,373.15 K) H O(1 mol,g, ,373.15 2 2 p p K) $ $ R Q S T = (体系)( ) vap m b H T = 1 40.620 kJ mol 373.15 K − = 1 1 108.9 J K mol − − = S 3 22.4 dm 0.5 mol O (g) 2 0.5 mol N (g) 2 2 2 1 (O ) ln V S nR V = 22.4 0.5 ln 12.2 = R 2 22.4 (N 0.5 ln 12.2 = S R ) mix 2 2 = + S S S (O ) (N ) 22.4 ln ln 2 12.2 = = R R mix B B B = − S R n x ln

二、变温过程的熵变 (口)物质的量一定的等容变温过程 A心=," (2)物质的量一定的等压变温过程 A8=C, 1.先等温后等容 AS =nRIn +小," 2.先等温后等压 T *3.先等压后等容 AS-nC)+Crn) 例 例10 molAg()s在等容下由273K加热到303K,求过程的变。已知,在该温度区间内 Ag(s)的C.m为24.48JK-1mol-1。 解: AS-fnCd -=nC.n In =1.molx24.mo 303 =2.55J.K- 例220mal理想气体从300K加热到600K,体积25dm3变为100dm3,计算该过程的熵变, 已知该气体的Cv.m为19.5).K-1·mol-l。 解:这是一个p,VT都发生变化的反应,因知道始终态的温度和体积,采用先等温后等容的 途径。 AS =AS +AS;=nRIn =2nax83w-Kmor×n罗+195-Kmor×n 25 例3在268.2K和100Pa压力下,1.0mol液态苯凝固,放热9874J,求苯凝固过程的熵变 已知苯培点为278.7K,标准摩尔熔化热为9916·mol-1 Cpm(-126.8J-K-1mol1;Cpm(S=122.8-k-1mo- 解:过冷液体的凝固是不可逆过程,需要在相同始终态间设计一个可逆过程来计算熵变。 设计的可逆过程为:
9 二、变温过程的熵变 (1)物质的量一定的等容变温过程 (2)物质的量一定的等压变温过程 (3)物质的量一定从 到 的过程。这种情况一步无法计算,要分两步计算, 有三种分步方法: 1. 先等温后等容 2. 先等温后等压 * 3. 先等压后等容 例 题 例 1: 1.0 molAg(s)在等容下由 273K 加热到 303K,求过程的熵变。已知,在该温度区间内 Ag(s)的 Cv.m 为 24.48J•K-1 •mol-1。 解: 例 2 2.0mol 理想气体从 300K 加热到 600K,体积 25dm3 变为 100dm3,计算该过程的熵变, 已知该气体的 Cv.m 为 19.5J • K -1 • mol-1。 解:这是一个 p,V,T 都发生变化的反应,因知道始终态的温度和体积,采用先等温后等容的 途径。 例 3 在 268.2K 和 100kPa 压力下,1.0mol 液态苯凝固,放热 9874J,求苯凝固过程的熵变。 已知苯熔点为 278.7K,标准摩尔熔化热为 9916J • mol-1 , Cp.m (1)=126.8J·K -1·mol-1 ; Cp.m (S)=122.8J·K -1·mol-1 解:过冷液体的凝固是不可逆过程,需要在相同始终态间设计一个可逆过程来计算熵变。 设计的可逆过程为: 2 2 1 1 (O )ln (N )ln 2 2 R n n = − + 1 ln 2 = −R = Rln 2 2 1 ,m T d V T nC T S T = 2 1 ,m T d p T nC T S T = 1 1 1 p V T , , 2 2 2 p V T , , 2 1 2 ,m 1 d ln( ) T V T V nC T S nR V T = + 2 1 1 ,m 2 d ln( ) T p T p nC T S nR p T = + 2 2 ,m ,m 1 1 ln( ) ln( ) p V V p S nC nC V p = + 2 1 ,m 2 , 1 d ln T V v m T nC T T S nC T T = = 1 1 1 303 1.0 24.48 ln 2.55 273 mol J K mol J K − − − = = 2 2 1 2 , 1 1 ln ln V m V T S S S nR nC V T = + = + 1 1 1 1 100 600 2 (8.314 ln 19.5 ln ) 25 300 mol J K mol J K mol − − − − = +

C,H.0268.23 _sC,H,s,268.2K △ 加热 △S2 CH,0,2787K CH,(s278.7 可逆过程 AS=48+A8+A8-",0m4+58n =1.0x1268xln278.7/2682+-9916/2787+1.01226in268.2/278.7=-354J/K 为了计算环境的箱变,可令苯与2682水的大热储器接触,在2682K苯凝圈时,所放出的热 量全部由热储器吸收,由于热储器很大,其温度不变,吸热过程均可看作是可逆的,所以 AS=-A426820-9874=368J1K 268.2K 2682 △S>0 3.8熵和能量退降 能量“退降”(energy degradation) 自然界所进行的实际过程都是不可逆过程。热力学第一定律表示一个实际过程发生后,其能 量的总值保持不变,而热力学第二定律则表明在不可逆过程中熵的总值增加了。能量的总 虽然不变,但由于熵值增加,系统中能量的一部分却丧失了作功的能力,这就是能量“退降 退降的程度与熵的增加成正比。证明:P153 注意 全部变为功,从 热和功“不等价”,功的质量”高于热。 同样,高温热源的热和低温热源的热也“不等价”,同样数量的热Q,放在高温热源可以 多做功,放在低温热源就少做功,同是能量也有高级能量和低级能量之分。 在生产过程中从高级能量“贬值”为低级能量的现象普遍存在,如常见的热传导过程,高 温蒸气贬值为低温蒸气,后者的做功能力就大大降低。 因此,如何合理的利用能源,是实际生产中非常重要的问题 3.9热力学第二定律的本质和熵的统计意义 一、.热力学第二定律的本质 热力学第二定律指出,凡是自发的过程都是不可逆的,而一切不可逆过程都可以归结 为热转换为功的不可逆性 从以上几个不可逆过程的例子可以看出, 一切不可逆过程都是向混乱度增加的方向进 行,而嫡函数可以作为体系混乱度的一种量度,这就是热力学第二定律所阐明的不可逆过 程的本质。 二、.热力学概率和数学概率
10 =1.0x126.8xln278.7/268.2+(-9916/278.7)+ 1.0x122.6xln268.2/278.7=-35.4J/K 为了计算环境的熵变,可令苯与 268.2K 的大热储器接触,在 268.2K 苯凝固时,所放出的热 量全部由热储器吸收,由于热储器很大,其温度不变,吸热过程均可看作是可逆的,所以: 这个结果是在意料之中的,因为上述过程是可以自动发生的不可逆过程。 3.8 熵和能量退降 能量“退降”(energy degradation) 自然界所进行的实际过程都是不可逆过程。热力学第一定律表示一个实际过程发生后,其能 量的总值保持不变; 而热力学第二定律则表明在不可逆过程中熵的总值增加了。能量的总值 虽然不变,但由于熵值增加,系统中能量的一部分却丧失了作功的能力,这就是能量“退降”, 退降的程度与熵的增加成正比。证明:P153 注 意 功和热都是被传递的能量,能量是守恒的。但功变为热是无条件的,而热不能无条件地 全部变为功,从一个热源吸热只能部分转变为功,另一部分热要转移到低温热源中去,所以 热和功“不等价”,功的“质量”高于热。 同样,高温热源的热和低温热源的热也“不等价”,同样数量的热 Q,放在高温热源可以 多做功,放在低温热源就少做功,同是能量也有高级能量和低级能量之分。 在生产过程中从高级能量“贬值”为低级能量的现象普遍存在,如常见的热传导过程,高 温蒸气贬值为低温蒸气,后者的做功能力就大大降低。 因此,如何合理的利用能源,是实际生产中非常重要的问题。 3.9 热力学第二定律的本质和熵的统计意义 一、.热力学第二定律的本质 热力学第二定律指出,凡是自发的过程都是不可逆的,而一切不可逆过程都可以归结 为热转换为功的不可逆性。 从以上几个不可逆过程的例子可以看出,一切不可逆过程都是向混乱度增加的方向进 行,而熵函数可以作为体系混乱度的一种量度,这就是热力学第二定律所阐明的不可逆过 程的本质。 二、.热力学概率和数学概率 1 2 3 = + + S S S S 2 1 1 2 , , T T ( ) ( ) p m p m T T nC l nC s H dT dT T T T = + + 相变 相变 (268.2 ) 9874 36.8 / 268.2 268.2 sur H K S J K K − = = = 35.4 36.8 1.40 / iso sys sur = + = − + = S S S J K 0 iso S