
第一章热力学第一定律及其应用复习题及参考答案 1=n+(,由于(=C,故前式可写作=C,n+(0,又因 C,T=0,故前式又可写作dU=0+(,将这个公式与dU=0-r比较,则应有 ,=-p,这个结论是错误的,试说明间以是错误的。 卷:U=naU=r+.=C,CT+品w=0,+r与 U=0-哪=0-P相t,风0,0-R 2理想气体经等温可逆变化,AU=0.∴Q=W=nRT1n宁,。这里热Q和功W 、(可逆 的值决定于始终态的体积,所以Q和W也具有状态函数的性质,这说法对吗?为 什么? 答:不对。热和功都是被传递的能量,都不是状态函数与途径有关。尽管在理想气体等温可逆变化 过程中。AW=0Q=W=mRT台,而对于其他过程中,上式不成立。故Q和w仍为过程决定的 量。 3.任一气体从同一始态出发,经一等温可逆过程和一等温不可逆过程到达同一终态,⊙W。>WR题给, ∴Q。>Qm,这结论对不对?为什么? 答:AUR=QR-WR,△UR-W始终态相同。QR-WR=WR-W∴Q-Q=WR-WR>0 (⊙W>Wm题给)。∴Q>Qm因此,结论正确。 4.当热由体系传给环境时,体系的焓是否一定减少? 答:日△H=△U+△(PV)=Q-W+△(PV,当热由体系传给环境。Q<0但△H不一定小于零。因 为后面还有两项 5.某山脚下的大气压力为p°,而在山顶上的压力下降12,能否在山腰上架一风车用压力差来推动做 功?为什么?
第一章 热力学第一定律及其应用 复习题及参考答案 1. dV V U V dT T ) ( ) T U dU ( ,由于 V CV T U ( ) ,故前式可写作 dV V U CV dT T dU ( ) 。又因 CV dT Q ,故前式又可写作 dV V U Q T dU ( ) ,将这个公式与 dU Q pdV 比较,则应有 p V U T ( ) ,这个结论是错误的,试说明何以是错误的。 答:令 dV V U dV Q V U C C dT T U dV V U U f T V dT T V V V T V T ) ( ) ( ) ( ) ( ) T U ( V).dU ( 、 与 dU Q W Q PdV 相比。 ( ) P. V U Q QV T 2. 理想气体经等温可逆变化, 0. ln( ), 1 2 V V U Q W nRT 这里热 Q 和功 W 的值决定于始终态的体积,所以 Q 和 W 也具有状态函数的性质,这说法对吗?为 什么? 答:不对。热和功都是被传递的能量,都不是状态函数与途径有关。尽管在理想气体等温可逆变化 过程中。 0. ln( ), 1 2 V V U Q W nRT 而对于其他过程中,上式不成立。故 Q 和 W 仍为过程决定的 量。 3. 任一气体从同一 始态出发,经一等温可逆过程和一等温不可逆过程到达同一终态, WR WIR 题给, QR QIR ,这结论对不对?为什么? 答:UR QR WR UIR WIR , 始终态相同。QR WR WR WIR 0 QR QIR WR WIR ( WR WIR 题给)。 . QR QIR 因此,结论正确。 4. 当热由体系传给环境时,体系的焓是否一定减少? 答: H U (PV) Q W (PV),当热由体系传给环境。Q 0 .但 ΔH 不一定小于零。因 为后面还有两项 5. 某山脚下的大气压力为 p ,而在山顶上的压力下降 1/2,能否在山腰上架一风车用压力差来推动做 功?为什么? A B 2R R(可逆 )

答:分两种情况来讨论。 (1)若山下、山上的压差只是由于空气在重力场中自然分布时,即由高度不同而引起的压差,则在 任一高度处附近其压差仍为零。处于稳定状态。故在风车周围无定向的风流,只有气体分子的无规 则运动,风车不转,不能做功 (2)若山不很高,此压差不是由于高度引起的,而是其它原因引起的,此压差能造成气流(风), 则风车可转动,而能做功。 6.某一化学反应在烧杯终进行,放热Q1,焓变为△H,若按排成可逆电池,使始终态相同,这是放热 Q2,焓变为△H,则△H,和△H2是否相等? B 答:因为焓是状态函数,只要始终态一样,△H就会 -a a 定相同。 (s)y 0) 7.下列P-V图中,A→B是等温可逆过程,A→C是绝热可逆过程,若从A点出发: (a)经绝热不可逆过程同样到达V2,则终点D在C点之上还是在C点之下? (b)经绝热不可逆过程同样到达2,则终点D在C点之左还是在C点之右?为什么? 答:)D点在C点之下,因为曲线下的面积为所做的功。绝热不可逆过程的功小于绝热可逆过程的 功(始态相同,而终态不同。) W能R<W能R ∴D点在C点之下。 b)D点在C点之左。原因同(a)。 8.在一个玻璃瓶中发生如下的反应:H,(g)+C1,(g)h2HC1(g)反应前后T、p、V均未发生变化,设 所有气体都可看作理想气体,因为理想气体的U=f(T),所以该反应的△H=0,这样的判断错在那里? 答:U=∫(T).只适用于无化学反应体系(恒组分)。而这是发生化学反应应考虑化学变化时U的影响。 9.有一装有绝热壁的房间,容积是100m3,室温是273K。今欲将室温提高10K,保持室内压力仍为P°, 问需供给多少热量?设空气为理想气体其Cm=30K-1,mo。 答Q=CAT-得cA7.1034025x0x10=134072U 8.314×273 10.判断下列过程中Q、W、△U、△H各量是正、零还是负值:
答:分两种情况来讨论。 (1)若山下、山上的压差只是由于空气在重力场中自然分布时,即由高度不同而引起的压差,则在 任一高度处附近其压差仍为零。处于稳定状态。故在风车周围无定向的风流,只有气体分子的无规 则运动,风车不转,不能做功 (2)若山不很高,此压差不是由于高度引起的,而是其它原因引起的,此压差能造成气流(风), 则风车可转动,而能做功。 6.某一化学反应在烧杯终进行,放热 Q1,焓变为H1 ,若按排成可逆电池,使始终态相同,这是放热 Q2,焓变为H2 则H1和H2 是否相等? 答:因为焓是状态函数,只要始终态一样,ΔH 就会一 定相同。 7.下列 p V 图中,A B是等温可逆过程,A C 是绝热可逆过程,若从 A 点出发: (a) 经绝热不可逆过程同样到达 V2,则终点 D 在 C 点之上还是在 C 点之下? (b)经绝热不可逆过程同样到达 p2,则终点 D 在 C 点之左还是在 C 点之右?为什么? 答:a)D 点在 C 点之下,因为曲线下的面积为所做的功。绝热不可逆过程的功小于绝热可逆过程的 功(始态相同, 而终态不同。) W 绝IR<W 绝R ∴ D 点在 C 点之下。 b) D 点在 C 点之左。原因同(a)。 8.在一个玻璃瓶中发生如下的反应: ( ) ( ) 2 ( ) H2 g Cl2 g h HCl g 反应前后 T、p、V 均未发生变化,设 所有气体都可看作理想气体,因为理想气体的U f (T) ,所以该反应的H 0,这样的判断错在那里? 答:U f (T) .只适用于无化学反应体系(恒组分)。而这是发生化学反应应考虑化学变化时 U 的影响。 9.有一装有绝热壁的房间,容积是 100m3 ,室温是 273K。今欲将室温提高 10 K,保持室内压力仍为 P , 问需供给多少热量?设空气为理想气体其 1 1 30 C J K mol p m 。 答: KJ m Pa C T RT PV Q nCp m T p m 30 10 1340.72 8.314 273 100 101325 3 . . 10.判断下列过程中 Q、W、U 、H 各量是正、零还是负值:
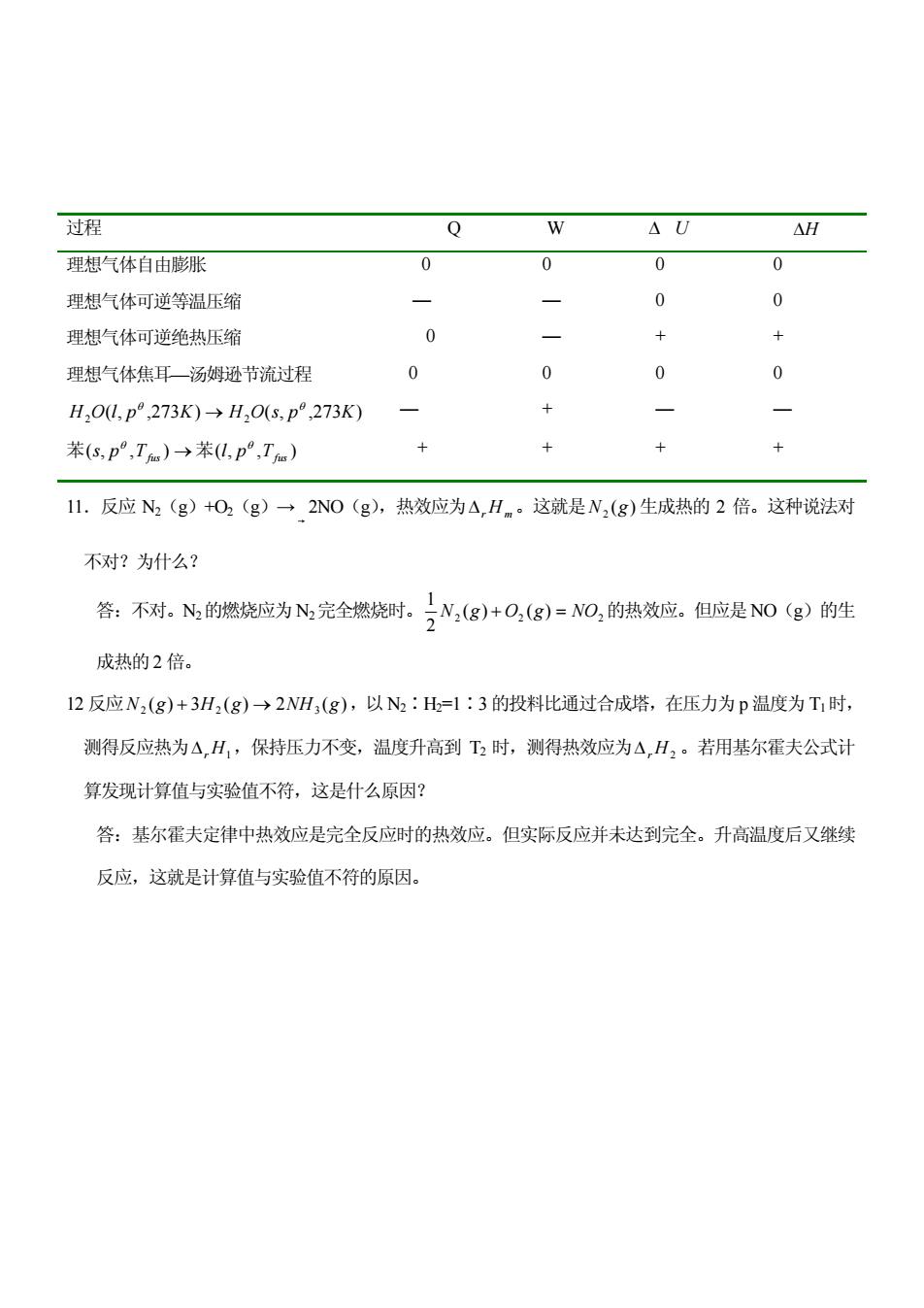
过程 Q W △U △H 理想气体自由膨胀 0 0 0 0 理想气体可逆等温压缩 0 0 理想气体可逆绝热压缩 0 + + 理想气体焦耳一汤姆逊节流过程 0 0 0 0 H,OU,p°,273K)→H,O(s,p°,273K) 苯(s,p°,T)→苯(l,p°,T) × 11.反应N2(g)+O2(g)→2NO(g),热效应为△,Hm。这就是N,(g)生成热的2倍。这种说法对 不对?为什么? 答:不对。N的燃烧应为N完全燃烧时。 (g)+O,(g)=ANO,的热效应。但应是N0g)的胜 成热的2倍。 12反应N2(g)+3H2(g)→2NH,(g),以N2:H=1:3的投料比通过合成塔,在压力为p温度为T时, 测得反应热为△H,保持压力不变,温度升高到T2时,测得热效应为△H,。若用基尔霍夫公式计 算发现计算值与实验值不符,这是什么原因? 答:基尔霍夫定律中热效应是完全反应时的热效应。但实际反应并未达到完全。升高温度后又继续 反应,这就是计算值与实验值不符的原因
11.反应 N2(g)+O2(g)→ 2NO(g),热效应为r Hm。这就是 ( ) 2 N g 生成热的 2 倍。这种说法对 不对?为什么? 答:不对。N2的燃烧应为 N2完全燃烧时。 2 2 2 ( ) ( ) 2 1 N g O g NO 的热效应。但应是 NO(g)的生 成热的 2 倍。 12 反应 ( ) 3 ( ) 2 ( ) N2 g H2 g NH3 g ,以 N2∶H2=1∶3 的投料比通过合成塔,在压力为 p 温度为 T1时, 测得反应热为r H1,保持压力不变,温度升高到 T2 时,测得热效应为r H2 。若用基尔霍夫公式计 算发现计算值与实验值不符,这是什么原因? 答:基尔霍夫定律中热效应是完全反应时的热效应。但实际反应并未达到完全。升高温度后又继续 反应,这就是计算值与实验值不符的原因。 过程 Q W U H 理想气体自由膨胀 0 0 0 0 理想气体可逆等温压缩 — — 0 0 理想气体可逆绝热压缩 0 — + + 理想气体焦耳—汤姆逊节流过程 0 0 0 0 ( , ,273 ) ( , ,273 ) H2O l p K H2O s p K — + — — 苯(s, p ,Tfus ) 苯( , , ) Tfus l p + + + +