
常见非金属阴离子的分离与鉴定 无机化学实验教学团队
常见非金属阴离子的分离与鉴定 无机化学实验教学团队

一 实验目的 1、熟悉常见阴离子的性质并掌握其鉴定反 ● 应。 ● 了解阴离子分离与鉴定的一般原则,掌 常见阴离子分离与鉴定的原理和方法
⚫1、熟悉常见阴离子的性质并掌握其鉴定反 应。 ⚫2、了解阴离子分离与鉴定的一般原则,掌 握 常见阴离子分离与鉴定的原理和方法。 一、实验目的

二 实验原理 ●许多非金属元素可以形成简单的或复杂的 阴离子,例如S2-、C、NO3和SO42-等, 许多金属元素也可以以复杂阴离子的形式 存在,例如VO3等。所以,阴离子的总数 很多。常见的重要阴离子有C、Br、CO32 等十几种,这里主要介绍它们的分离与鉴 定的一般方法
⚫许多非金属元素可以形成简单的或复杂的 阴离子,例如S2-、Cl-、NO3 -和SO4 2-等, 许多金属元素也可以以复杂阴离子的形式 存在,例如VO3 -等。所以,阴离子的总数 很多。常见的重要阴离子有Cl-、Br-、CO3 2 -等十几种,这里主要介绍它们的分离与鉴 定的一般方法。 二、实验原理

●许多阴离子只在碱性溶液中存在或共存, 旦溶液被酸化,它们就会分解或相互间发生 反应。酸性条件下易分解的有NO2、SO32 、S2032-、S2-、C032-; ● 酸性条件下氧化性离子(如NO3、NO2、 S032-)可与还原性离子(如、S032、 S2032、S2-)发生氧化还原反应。还有一 些离子容易被空气氧化,例如NO2、SO32 、 S2-分别被空气氧化成NO3、SO42-和S 等,分析不当很容易造成错误
⚫许多阴离子只在碱性溶液中存在或共存,一 旦溶液被酸化,它们就会分解或相互间发生 反应。酸性条件下易分解的有NO2 -、SO3 2- 、S2O3 2-、S2-、CO3 2-; ⚫ 酸性条件下氧化性离子(如NO3 -、NO2 -、 SO3 2-)可与还原性离子(如I-、SO3 2-、 S2O3 2-、S2-)发生氧化还原反应。还有一 些离子容易被空气氧化,例如NO2 -、SO3 2- 、S2-分别被空气氧化成NO3 -、SO4 2-和S 等,分析不当很容易造成错误

由于阴离子间的相互干扰较少,实际上许多 离子共存的机会也较少,因此大多数阴离子 分析一般都采用分别分析的方法,只有少数 相互有干扰的离子才采用系统分析法,如S2-、 S032-、S2032-;C-、Br-、I-等。 三、实验内容 ÷1.常见阴离子的鉴定
❖ 由于阴离子间的相互干扰较少,实际上许多 离子共存的机会也较少,因此大多数阴离子 分析一般都采用分别分析的方法,只有少数 相互有干扰的离子才采用系统分析法,如S2-、 SO3 2-、S2O3 2-;Cl-、Br-、I-等。 ❖ 1.常见阴离子的鉴定 三、实验内容

离子 操作、试验条件 现象 解释及判断 C032= CO2+Ba(OH)2=BaCO3+H2O 当存在S032、S2032-时先在溶液中 加入3%H2022滴,加热,然后 用上述方法鉴定C0,2。 NO3- N0+3Fe2+4H=N0+3Fe++2H,0 Fe+NO=IFe(NO) NO2- S042= 注意:BaSO4不溶于酸,如果有 Ag+、Hg22+存在必须用Ba(NO3)2 代替BaCl2 KMnO,溶液褪色,示有S032- s032-
操作、试验条件 现象 解释及判断 CO3 2- CO2+Ba(OH)2 =BaCO3↓+H2O 当存在SO3 2-、S2O3 2-时先在溶液中 加入 3% H2O2 2 滴,加热,然后 用上述方法鉴定CO3 2-。 NO3 - NO2- SO4 2- 注意:BaSO4不溶于酸,如果有 Ag+ 、Hg2 2+存在必须用Ba(NO3 )2 代替BaCl2 SO 3 2- KMnO4溶液褪色,示有SO3 2- 2 2 3 3 2 2 2 3 4 3 2 ( ) NO Fe H NO Fe H O Fe NO Fe NO − + + + + + + + = + + + =
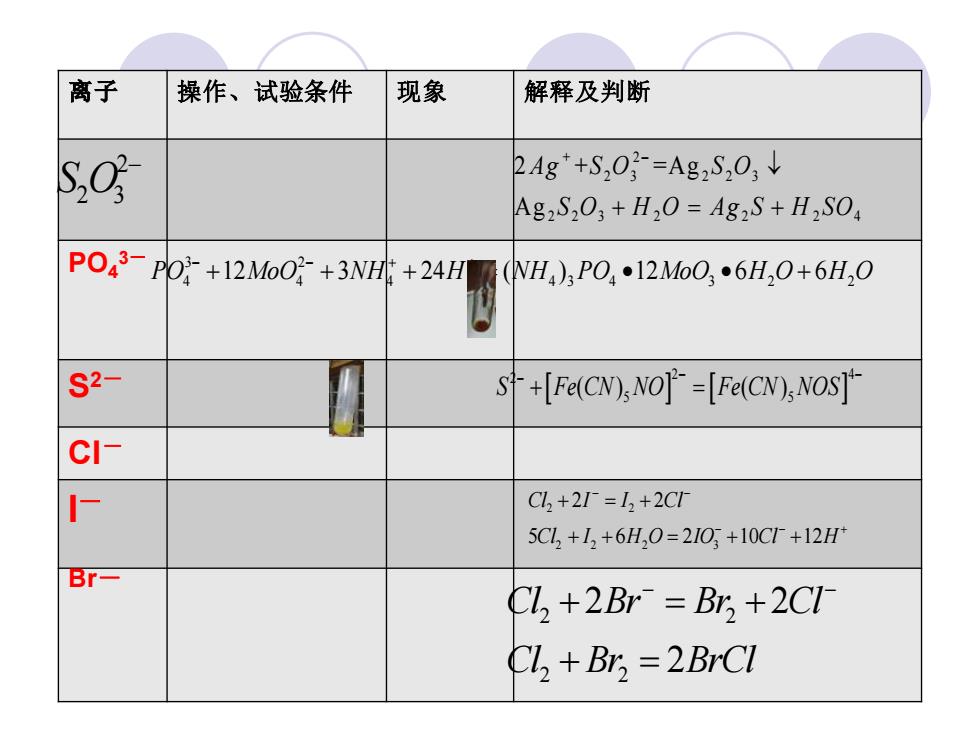
离子 操作、试验条件 现象 解释及判断 so 2Ag+S,03=Ag2S,03↓ Ag2S203+H2O=Ag2S+H2SO PO43=P'O+12M0+3Nl+24H(WH,),PO,12M60,6H,0+6H,0 S2- +[Fe(CN),NO]=[Fe(CN),NOS] CI- 厂 Cl2+2=12+2C1 5C1,+L+6H,0=21O,+10CT+12H Br- Cl,+2Br=Br +2CI Ch +Br,=2BrCI
操作、试验条件 现象 解释及判断 PO4 3- S2- Cl- I- Br- 2 2 3 S O − + 2 2 3 2 2 3 2 2 3 2 2 2 4 2 + =Ag A g Ag S O S O S O H O Ag S H SO − + = + 3 2 4 4 4 4 3 4 3 2 2 PO MoO NH H NH PO MoO H O H O 12 3 24 ( ) 12 6 6 − − + + + + + = • • + 2 4 2 5 5 S Fe CN NO Fe CN NOS ( ) ( ) − − − + = 2 2 2 2 2 3 2 2 5 6 2 10 12 Cl I I Cl Cl I H O IO Cl H − − − − + + = + + + = + + 2 2 2 2 2 2 2 Cl Br Br Cl Cl Br BrCl − − + = + + =

2.常见干扰性阴离子共存时的分离与鉴定 (1)S2、S032-、S2032 S2S032,S2032 一部分 另 部分 角生像0】 2mol/L NaOH Na[Fe(CN):NO] Na4[Fe(CN)sNOS] S032,$2032 cds 红紫色 示有$2 ZnS04(饱和) Na2[Fe(CN)3NO] AgNO3(过量) Ka[Fe(CN)6] 红色沉淀 沉淀·黄→棕→黑 示有S02 示有S2032
2.常见干扰性阴离子共存时的分离与鉴定 (1) S2 -、SO3 2-、S2O3 2-
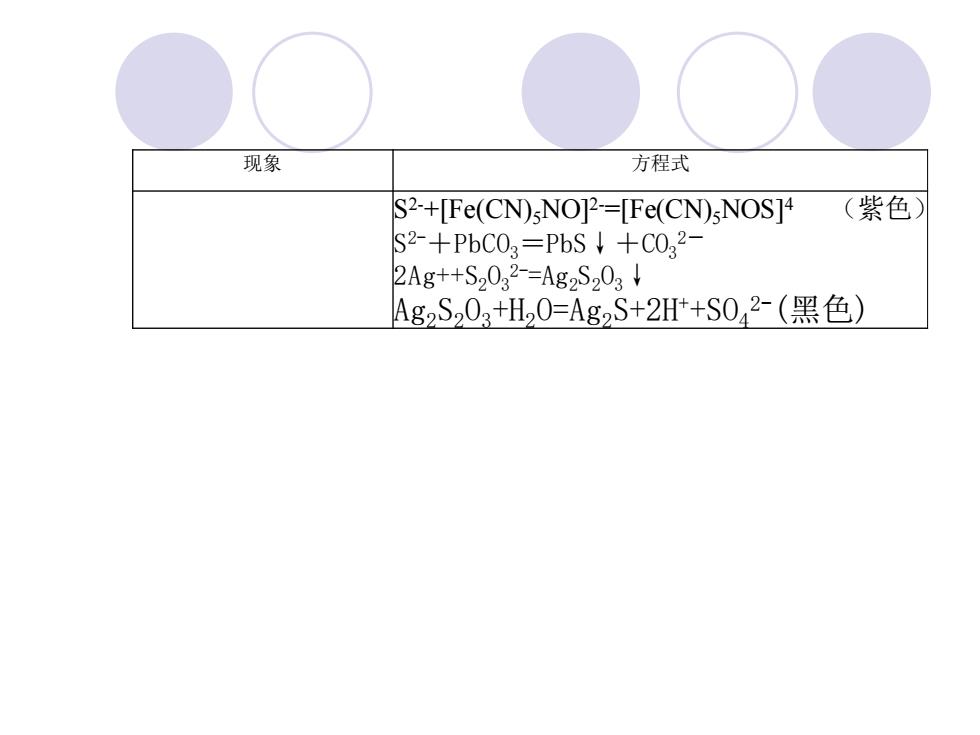
现象 方程式 S2-+[Fe(CN)sNO]2-=[Fe(CN)sNOS]4 (紫色) S2-+PbC02=PbS+C022- 2Ag+S2032-=Ag2S203↓ Ag2S203+H20=Ag2S+2Ht+S042-(黑色)
现象 方程式 S 2-+[Fe(CN)5NO]2-=[Fe(CN)5NOS]4 (紫色) S 2-+PbCO3=PbS↓+CO3 2- 2Ag++S2O3 2-=Ag2S2O3↓ Ag2S2O3+H2O=Ag2S+2H++SO4 2-(黑色)
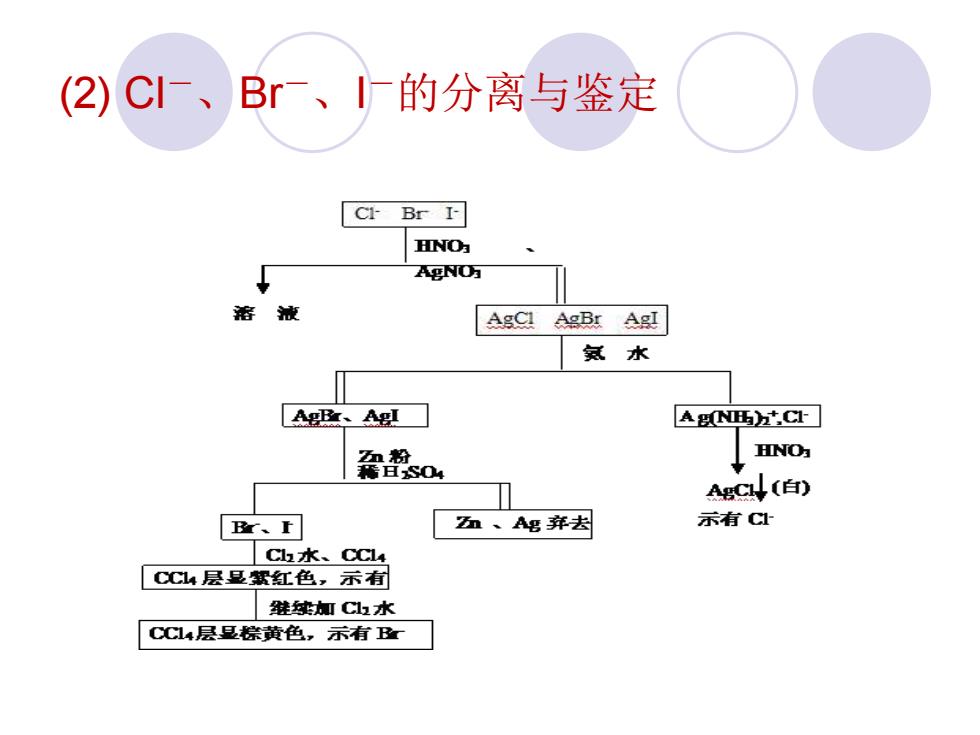
(2)CI-、Br、I厂的分离与鉴定 Cl-Br I- HINO为 gNO万 溶液 AgCl AgBr AgI 氨水 Ag、Ag A西CI 霜so HINO方 gC↓(白) B、r 、Ag并去 示有CI Ch水、CCl4 CC4层显絮红色,示有 维续加Ch水 CCl4层旦崇黄色,示有B
(2) Cl-、Br-、I-的分离与鉴定