
乙酸标准解离常数和解离度的测定 无机化学实验教学团队
乙酸标准解离常数和解离度的测定 无机化学实验教学团队

实验目的 1、测定乙酸的标准解离常数和解离度,正确使用pH计; 2、巩固移液管的基本操作,学习容量瓶的使用; 3、初步掌握滴定管的使用及标定原理
一 实验目的 1、测定乙酸的标准解离常数和解离度,正确使用pH计; 2、巩固移液管的基本操作,学习容量瓶的使用; 3、初步掌握滴定管的使用及标定原理

实验安排 ■一人一组 ■下一个实验
实验安排 ◼ 一人一组 ◼ 下一个实验
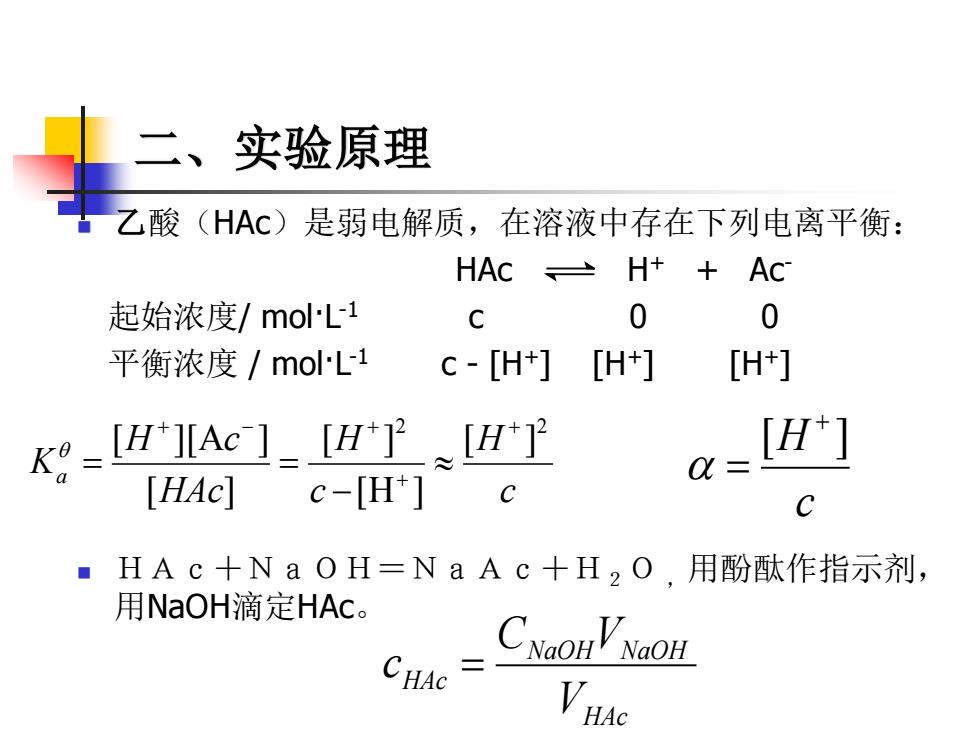
二、实验原理 乙酸(HAc)是弱电解质, 在溶液中存在下列电离平衡: HAC≌ H++ Ac 起始浓度/molL1 C 0 0 平衡浓度/molL1 c-[H+] [H+] [H+] K?=IHIIAe ]-IHP [H] Q= [HAc]c-[H*]c C HAc+NaOH=NaAc十H2O,用酚酞作指示剂, 用NaOH滴定HAc。 CNaOHVNGOH CHAC
二、实验原理 ◼ 乙酸(HAc)是弱电解质,在溶液中存在下列电离平衡: HAc H+ + Ac- 起始浓度/ mol·L -1 c 0 0 平衡浓度 / mol·L -1 c - [H+] [H+] [H+] ◼ HAc+NaOH=NaAc+H2O ,用酚酞作指示剂, 用NaOH滴定HAc。 c H c H HAc H c Ka 2 2 [ ] [H ] [ ] [ ] [ ][A ] + + + − + − = = c [H ] + = HAc NaOH NaOH HAc V C V c =

三仪器和试剂 仪器:pH计,常规玻璃仪器; 试剂:HAc溶液,NaOH标准溶液,标准缓冲溶液, 酚酞溶液
三 仪器和试剂 仪器:pH计,常规玻璃仪器; 试剂:HAc溶液,NaOH标准溶液,标准缓冲溶液, 酚酞溶液

四实验步骤 ■1乙酸溶液浓度的标定 移取25.00 ml HAc溶液于锥形瓶中,加2滴酚酞,用NaOH标 准溶液滴至浅红色,记录消耗的体积。平行测定3次。 。 2配制不同浓度的乙酸溶液 移取HAc溶液5.00ml、10.00m、25.00ml分别于50.00ml 容量瓶中,定容至刻度,摇匀。另取未稀释的HAc标准溶液 30ml倒入烧杯中。分别编号1-4 ■3不同浓度的乙酸溶液PH值的测定 取4种不同浓度的HAc溶液30ml于50ml小烧杯中,按浓度 从稀到浓依次编号1,2,3,4(未稀释),用pH计测定它们的 pH值,记录数据
四 实验步骤 ◼ 1 乙酸溶液浓度的标定 移取25.00ml HAc溶液于锥形瓶中,加2滴酚酞,用NaOH标 准溶液滴至浅红色,记录消耗的体积。平行测定3次。 ◼ 2 配制不同浓度的乙酸溶液 移取HAc溶液5.00ml、10.00ml、25.00ml分别于50.00ml 容量瓶中,定容至刻度,摇匀。另取未稀释的HAc标准溶液 30 ml倒入烧杯中。分别编号1-4 ◼ 3 不同浓度的乙酸溶液 PH值的测定 取4种不同浓度的HAc溶液30ml于50ml小烧杯中,按浓度 从稀到浓依次编号1,2,3,4(未稀释),用pH计测定它们的 pH值,记录数据

提示 HAc准确浓度的测定与pH的测定可交错 进行
提示 ◼ HAc准确浓度的测定与pH的测定可交错 进行
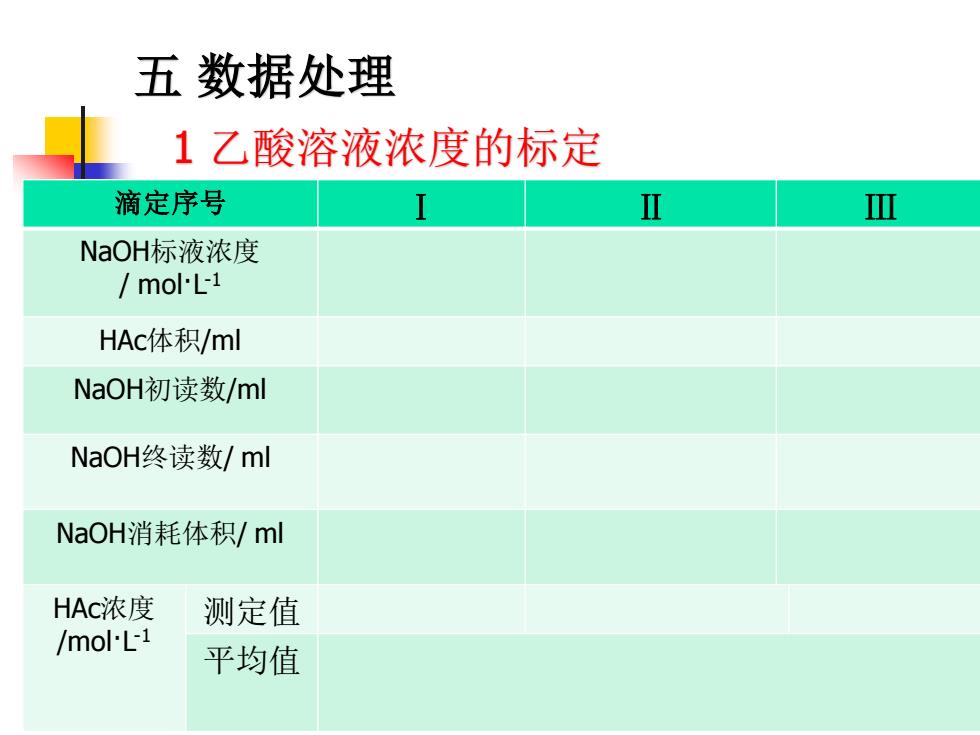
五数据处理 1乙酸溶液浓度的标定 滴定序号 Ⅲ NaOH标液浓度 molL1 HAc体积/ml NaOH初读数/ml NaOH终读数/ml NaOH消耗体积/ml HAc浓度 测定值 /mol.L1 平均值
五 数据处理 1 乙酸溶液浓度的标定 滴定序号 Ⅰ Ⅱ Ⅲ NaOH标液浓度 / mol·L -1 HAc体积/ml NaOH初读数/ml NaOH终读数/ ml NaOH消耗体积/ ml HAc浓度 /mol·L -1 测定值 平均值
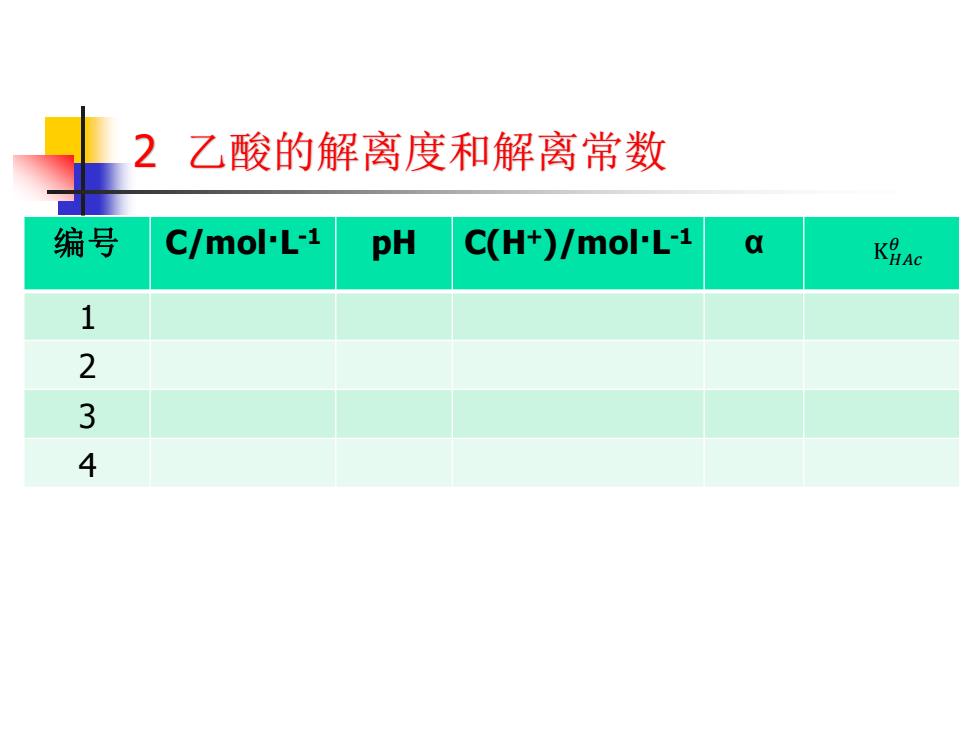
2乙酸的解离度和解离常数 编号 c/mo小L-1 pH C(H+)/mol-L-1 a K号Ac 1 2 3 4
2 乙酸的解离度和解离常数 编号 C/mol·L -1 pH C(H+)/mol·L -1 α 1 2 3 4 K𝐻𝐴𝑐 𝜃

3.实验误差 序号 1 2 3 4 pH DK唱Ac实验 pK唱Ac平均 △i S
3.实验误差 序号 1 2 3 4 pH pK𝐻𝐴𝑐 𝜃 实验 pK𝐻𝐴𝑐 𝜃 平均 ∆i s