
1 第1章 定量分析化学概论 Introduction to Quantitative Analysis
1 第1章 定量分析化学概论 Introduction to Quantitative Analysis

2 1.1 定量分析过程及结果表示 1.1.1 定量分析过程 1、取样: 固体、液体、气体样品各有不同 的取样方法。 重要的是应使分析试样具有代表性
2 1.1 定量分析过程及结果表示 1.1.1 定量分析过程 1、取样: 固体、液体、气体样品各有不同 的取样方法。 重要的是应使分析试样具有代表性

3 1、取样 为使取样具有代表性,所取样品的 最低量应取决于下列因素: (1)样品的颗粒大小, (2)样品的均匀程度, (3)分析的准确度
3 1、取样 为使取样具有代表性,所取样品的 最低量应取决于下列因素: (1)样品的颗粒大小, (2)样品的均匀程度, (3)分析的准确度
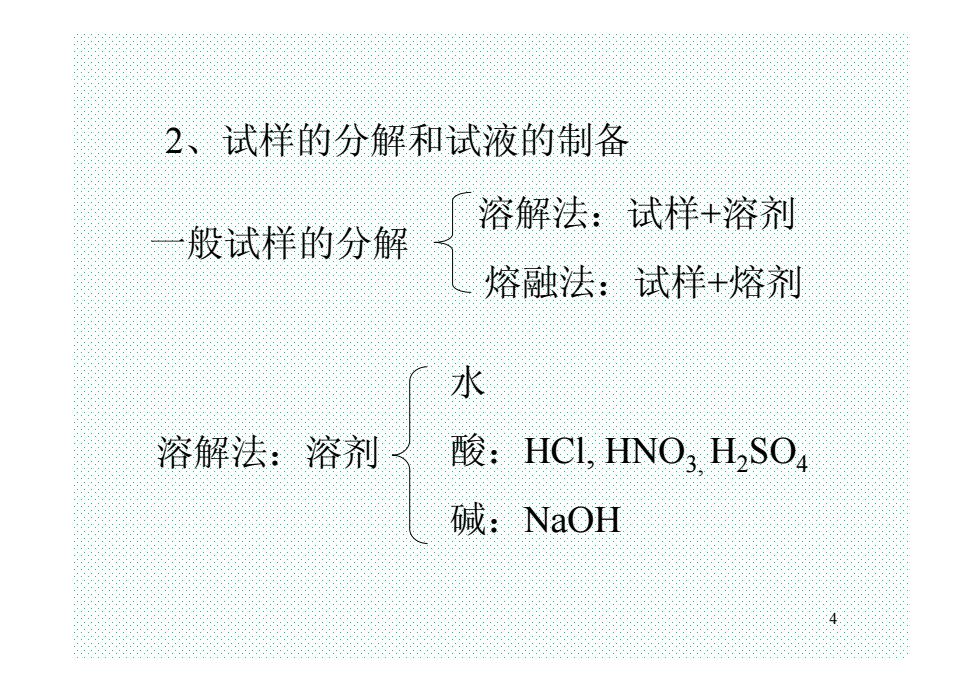
4 2、试样的分解和试液的制备 一般试样的分解 溶解法:试样+溶剂 熔融法:试样+熔剂 溶解法:溶剂 水 酸:HCl, HNO3, H2SO4 碱:NaOH
4 2、试样的分解和试液的制备 一般试样的分解 溶解法:试样+溶剂 熔融法:试样+熔剂 溶解法:溶剂 水 酸:HCl, HNO3, H2SO4 碱:NaOH
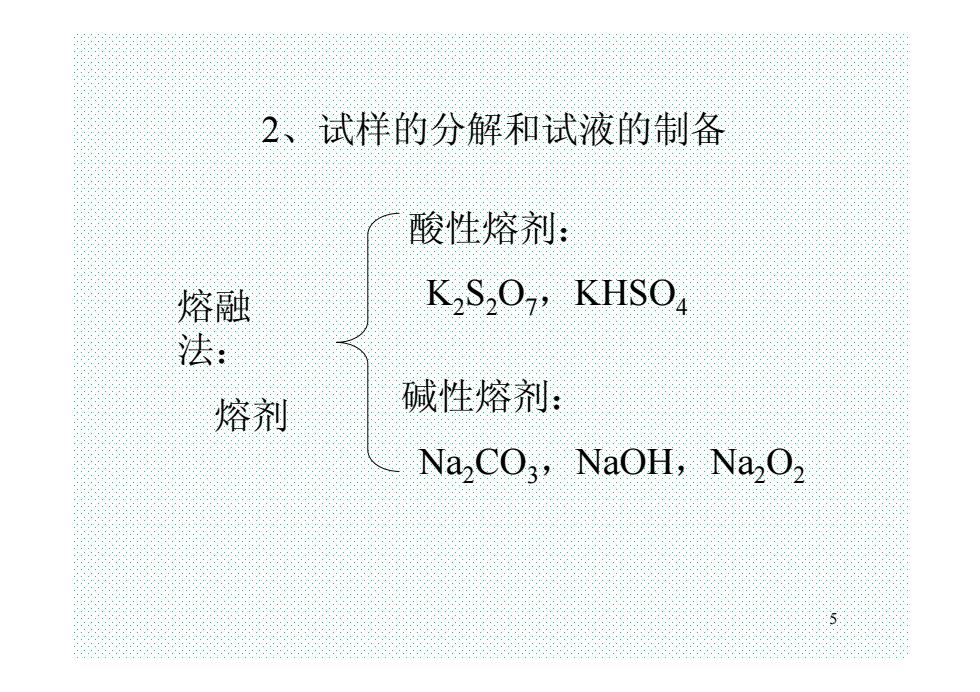
5 2、试样的分解和试液的制备 熔融 法: 熔剂 酸性熔剂: K2S2O7,KHSO4 碱性熔剂: Na2CO3,NaOH,Na2O2
5 2、试样的分解和试液的制备 熔融 法: 熔剂 酸性熔剂: K2S2O7,KHSO4 碱性熔剂: Na2CO3,NaOH,Na2O2

6 有机试样 的分解 将试样置于马弗炉中加高温 (400—700℃)灰化分解 后,残留的无机残渣用酸提 取制备成分析试样。 使用硝酸和硫酸的混合液作 为溶剂与试样一起加热煮 解。 干式灰化 法: 湿式消化法:
6 有机试样 的分解 将试样置于马弗炉中加高温 (400—700℃)灰化分解 后,残留的无机残渣用酸提 取制备成分析试样。 使用硝酸和硫酸的混合液作 为溶剂与试样一起加热煮 解。 干式灰化 法: 湿式消化法:

7 3、分离及测定 分离:是消除干扰的一种方法。 常用的分离方法: 沉淀分离法、 挥发和蒸馏分离法、 液 – 液萃取分离法、 离子交换分离法、 色谱分离法、 毛细管电泳分离法等
7 3、分离及测定 分离:是消除干扰的一种方法。 常用的分离方法: 沉淀分离法、 挥发和蒸馏分离法、 液 – 液萃取分离法、 离子交换分离法、 色谱分离法、 毛细管电泳分离法等

8 3、分离及测定 测定: 对于高含量组分的测定,一般采用滴 定分析法和重量分析法; 对于低含量组分的测定,一般采用灵 敏度较高的仪器分析法。 4、分析结果的计算及评价
8 3、分离及测定 测定: 对于高含量组分的测定,一般采用滴 定分析法和重量分析法; 对于低含量组分的测定,一般采用灵 敏度较高的仪器分析法。 4、分析结果的计算及评价

9 1.1.2 定量分析结果的表示 1、待测组分的化学表示形式 在试样中实际存在形式: 如试样中氮的实际存在形式, 可用 NH3、NO3-,N2O5等表示 元素形式: 在金属材料和有机分析中,用Fe, Cu, Mo 和 C、H、O、S 等表示
9 1.1.2 定量分析结果的表示 1、待测组分的化学表示形式 在试样中实际存在形式: 如试样中氮的实际存在形式, 可用 NH3、NO3-,N2O5等表示 元素形式: 在金属材料和有机分析中,用Fe, Cu, Mo 和 C、H、O、S 等表示

10 氧化物形式: 如矿石分析中常以K2O,CaO,MgO, SiO2等表示。 离子: 如电解质溶液中,常以K+, Na+, SO42-,Cl-等表示
10 氧化物形式: 如矿石分析中常以K2O,CaO,MgO, SiO2等表示。 离子: 如电解质溶液中,常以K+, Na+, SO42-,Cl-等表示