
第二章酶学 第一节通论 一。 什么是酶酶是由活细胞产生的,能在体内和体外起 同样催化作用的一类具有活性中心和特殊构象的生物 大分子。酶是生物催化剂。 二. 酶除一般催化剂的特点如:加快反应速度、反应前后 无变化、不改变反应的平衡点等特征外,作为生物催 化剂具有自身的催化特点: 1.催化效率高:107一103 2.酶活性易受环境变化的影响 3.在体内,酶活性受调节和控制 4.酶的催化作用具高度专一性 (1)结构专一性A.绝对专一性 脲酶 B.相对专一性磷酸二酯酶 (2)立体异构专一性 (3)对酶催化专一性的几种假说 A.锁钥学说(1894,Emil Fisher) B.诱导契合学说(1958,Koshland)
第二章 酶学 第一节 通论 一. 什么是酶 酶是由活细胞产生的,能在体内和体外起 同样催化作用的一类具有活性中心和特殊构象的生物 大分子。酶是生物催化剂。 二. 酶除一般催化剂的特点如:加快反应速度、反应前后 无变化、不改变反应的平衡点等特征外,作为生物催 化剂具有自身的催化特点: 1.催化效率高: 107 —1013 2.酶活性易受环境变化的影响 3.在体内,酶活性受调节和控制 4.酶的催化作用具高度专一性 (1) 结构专一性 A. 绝对专一性 脲酶 B. 相对专一性 磷酸二酯酶 (2)立体异构专一性 (3)对酶催化专一性的几种假说 A . 锁钥学说(1894, Emil Fisher) B.诱导契合学说(1958, Koshland) 1

C.三点附着学说(A.Ogster) 第二节酶的分类和命名 一.酶的命名 为了研究和使用的方便,1961年国际生物化学学会酶学委员 会在对自然界中存在的酶进行了广泛研究的基础上,对每 种酶都给出了一个习惯名称和系统名称 1习惯命名法 (1)根据催化的底物名称命名:淀粉酶、蛋白酶、脂肪酶 (2) 根据催化反应的性质命名:转氨酶、脱氢酶、脱羧酶 有的以所催化的底物和性质命名:乳酸脱氢酶、琥珀酸脱 氢酶,有的以酶的来源或其它特征命名:碱性磷酸酶 2.国际系统命名法 谷丙转氨酶:L-丙氨酸:ā一酮戊二酸氨基转移酶
C . 三点附着学说(A. Ogster) 第二节 酶的分类和命名 一. 酶的命名 为了研究和使用的方便,1961 年国际生物化学学会酶学委员 会在对自然界中存在的酶进行了广泛研究的基础上,对每一 种酶都给出了一个习惯名称和系统名称。 1 习惯命名法 (1) 根据催化的底物名称命名:淀粉酶、蛋白酶、脂肪酶 (2) 根据催化反应的性质命名:转氨酶、脱氢酶、脱羧酶 有的以所催化的底物和性质命名:乳酸脱氢酶、琥珀酸脱 氢酶,有的以酶的来源或其它特征命名:碱性磷酸酶 2.国际系统命名法 谷丙转氨酶: L-丙氨酸:α—酮戊二酸氨基转移酶 2

草酸氧化酶:草酸:氧氧化酶 乙酰辅酶A水解酶:乙酰辅酶A:水解酶 二,酶的国际系统分类法 把酶分为6大类,即氧化还原酶类、转移酶类、水解酶类、裂 合酶类、异构酶类和连接酶类。分别用1、2、3、4、5、6、来表示。 再根据被作用的基团或键的特点将每一大类分为若干个亚类,每一 个亚类又按顺序编成1、2、3、4、.等数字。 第三节.酶催化作用的分子基础 一、酶分子的结构特征 1.酶的活性部位(活性中心):酶分子中与底物结合并催化 底物生成产物的部位。 2.酶活性部位(中心)的特点: 3.必需基团:在酶分子中有些基团并不位于活性中心,也不 与底物直接作用,但它参与维持酶分子的空间构象,是酶 表现活性所必需的部位。 溶菌酶催化的反应:
草酸氧化酶: 草酸:氧氧化酶 乙酰辅酶 A 水解酶: 乙酰辅酶 A:水解酶 二 . 酶的国际系统分类法 把酶分为 6 大类,即氧化还原酶类、转移酶类、水解酶类、裂 合酶类、异构酶类和连接酶类。分别用 1、2、3、4、5、6、来表示。 再根据被作用的基团或键的特点将每一大类分为若干个亚类,每一 个亚类又按顺序编成 1、2、3、4、.等数字。 第三节.酶催化作用的分子基础 一. 酶分子的结构特征 1. 酶的活性部位(活性中心):酶分子中与底物结合并催化 底物生成产物的部位。 2. 酶活性部位(中心)的特点: 3. 必需基团:在酶分子中有些基团并不位于活性中心,也不 与底物直接作用,但它参与维持酶分子的空间构象,是酶 表现活性所必需的部位。 溶菌酶催化的反应: 3

NAG:N-乙酰氨基葡萄糖NAM:N-乙酰氨基葡萄糖乳酸 溶菌酶的活性中心:Glu35,Asp52 4.证明酶活性中心存在的方法 (1)切除法 (2)X射线衍射分析 (3) 化学修饰法(共价标记) 二.酶原的激活 1.什么是酶原的激活
NAG: N-乙酰氨基葡萄糖 NAM: N-乙酰氨基葡萄糖乳酸 溶菌酶的活性中心:Glu 35 , Asp 52 4.证明酶活性中心存在的方法 (1) 切除法 (2) X-射线衍射分析 (3) 化学修饰法(共价标记) 二. 酶原的激活 1. 什么是酶原的激活 4
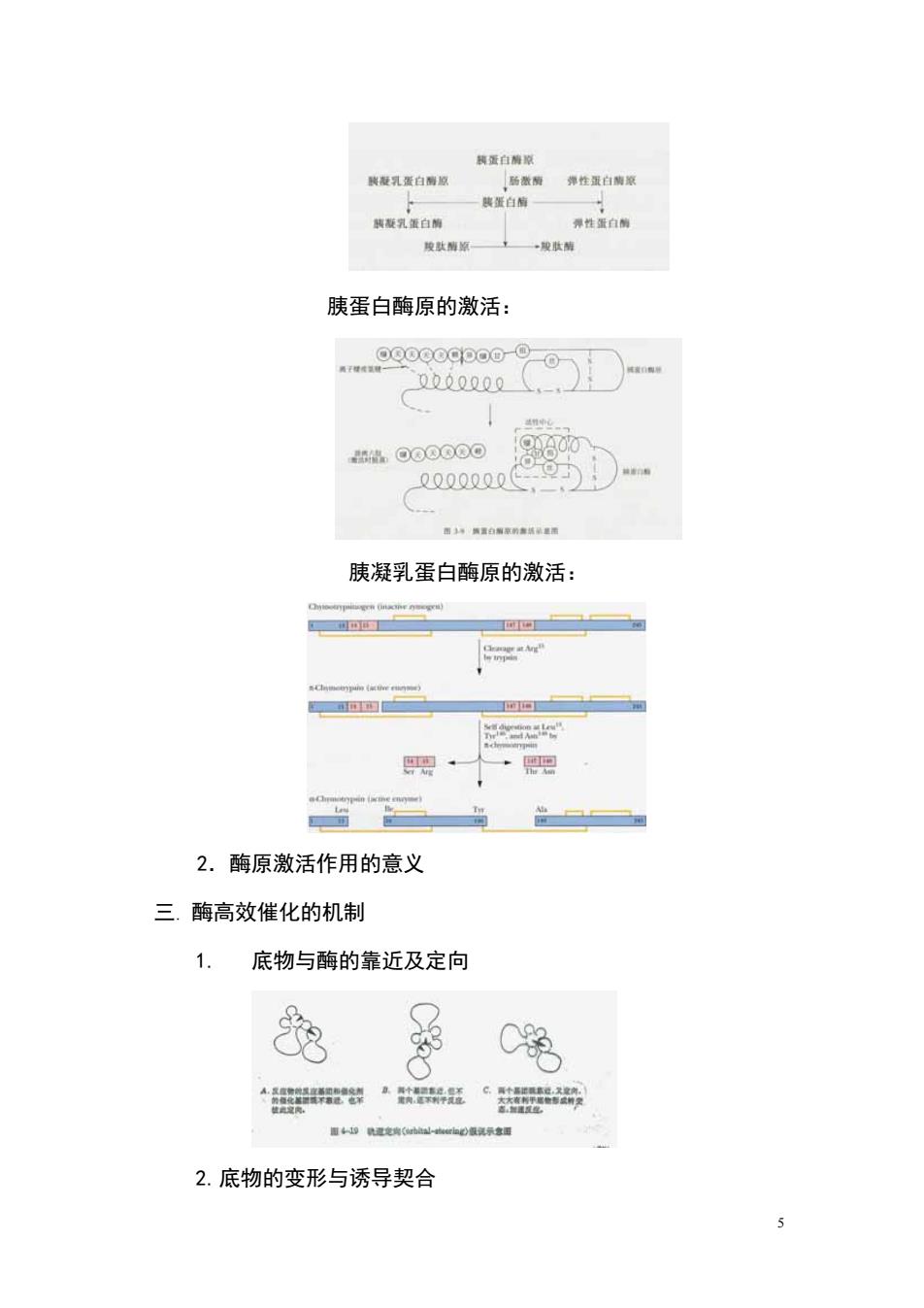
凝乳蛋白 弹性蛋白家 蛋白 钠板究蛋白期 弹性蛋白前 胰蛋白酶原的激活: O00000 胰凝乳蛋白酶原的激活: r · 2.酶原激活作用的意义 三.酶高效催化的机制 1. 底物与酶的靠近及定向 挖 C洗 器·瑞品←器 2.底物的变形与诱导契合
胰蛋白酶原的激活: 胰凝乳蛋白酶原的激活: 2.酶原激活作用的意义 三. 酶高效催化的机制 1. 底物与酶的靠近及定向 2.底物的变形与诱导契合 5
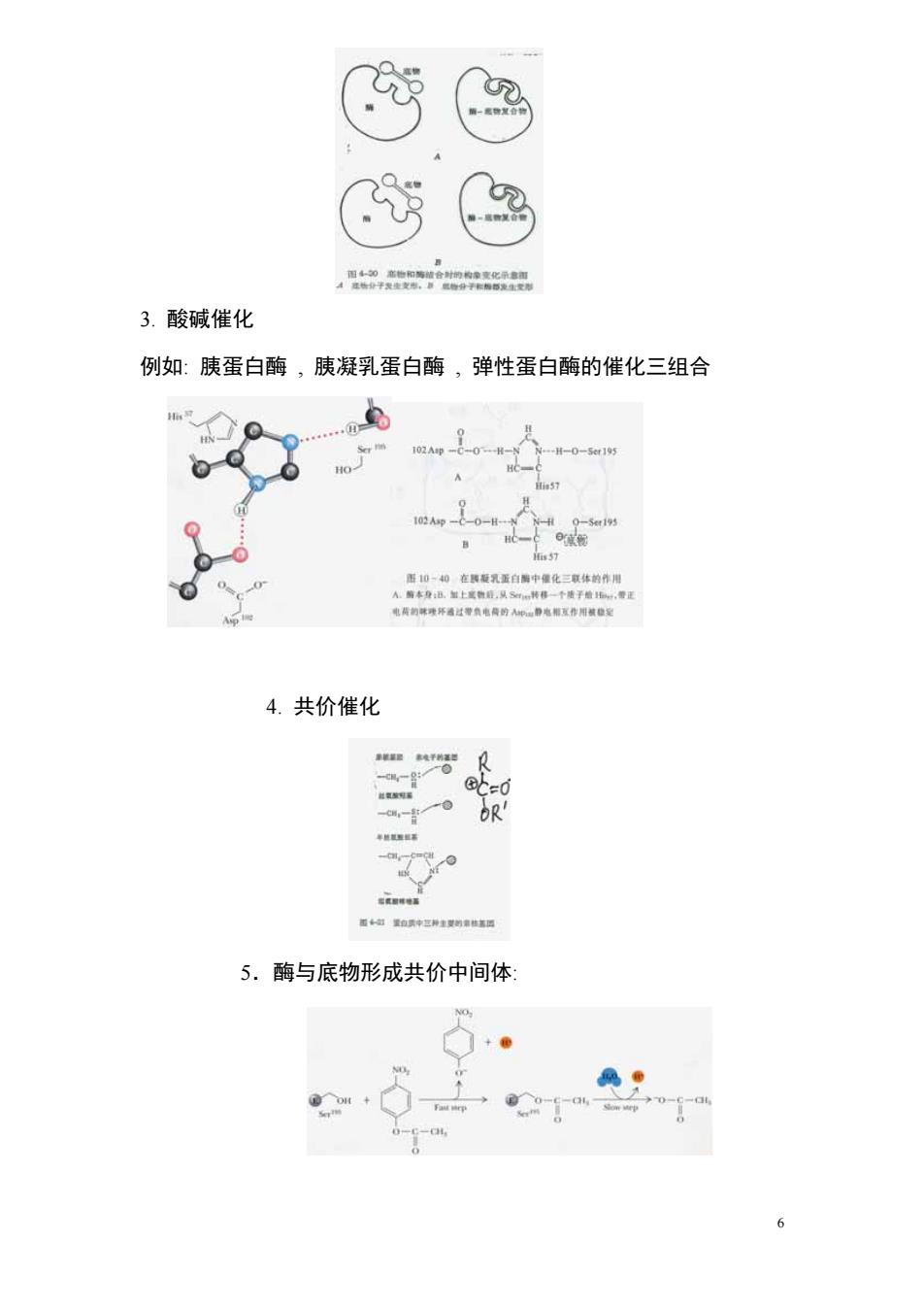
4,a 3.酸碱催化 例如:胰蛋白酶,胰凝乳蛋白酶,弹性蛋白酶的催化三组合 H-0-1 A 在乳蛋合中量化三体的用 4.共价催化 看超n种区种生物 5.酶与底物形成共价中间体 -a
3. 酸碱催化 例如: 胰蛋白酶 , 胰凝乳蛋白酶 , 弹性蛋白酶的催化三组合 4. 共价催化 5.酶与底物形成共价中间体: 6

6.活性部位微环境的影响 图 何>回 7.中间产物学说:S+E→ES+E+P 第四节酶促反应动力学 酶促反应动力学是研究酶促反应的速度规律及各种因素对 酶促反应速度的影响 初速度(w):在酶促反应过程中,初始底物浓度消耗在5%以 内的速度 一.酶浓度的影响(在最适条件下,底物浓度足够大) v=k[E)k:反应速度常数 二.底物浓度对反应速度的影响 1.米氏公式的推导 2.米氏常数的意义 (1)Km值是酶的特征常数,当v=Vmax/2时[S]=Km(摩尔/升)
6.活性部位微环境的影响 7.中间产物学说: S + E → ES → E + P 第四节 酶促反应动力学 酶促反应动力学是研究酶促反应的速度规律及各种因素对 酶促反应速度的影响 初速度(v): 在酶促反应过程中,初始底物浓度消耗在 5% 以 内的速度 一. 酶浓度的影响 (在最适条件下 , 底物浓度足够大) v = k[E] k: 反应速度常数 二. 底物浓度对反应速度的影响 1. 米氏公式的推导 2. 米氏常数的意义 (1).Km值是酶的特征常数,当v = Vmax / 2 时[S]=Km(摩尔/升) 7
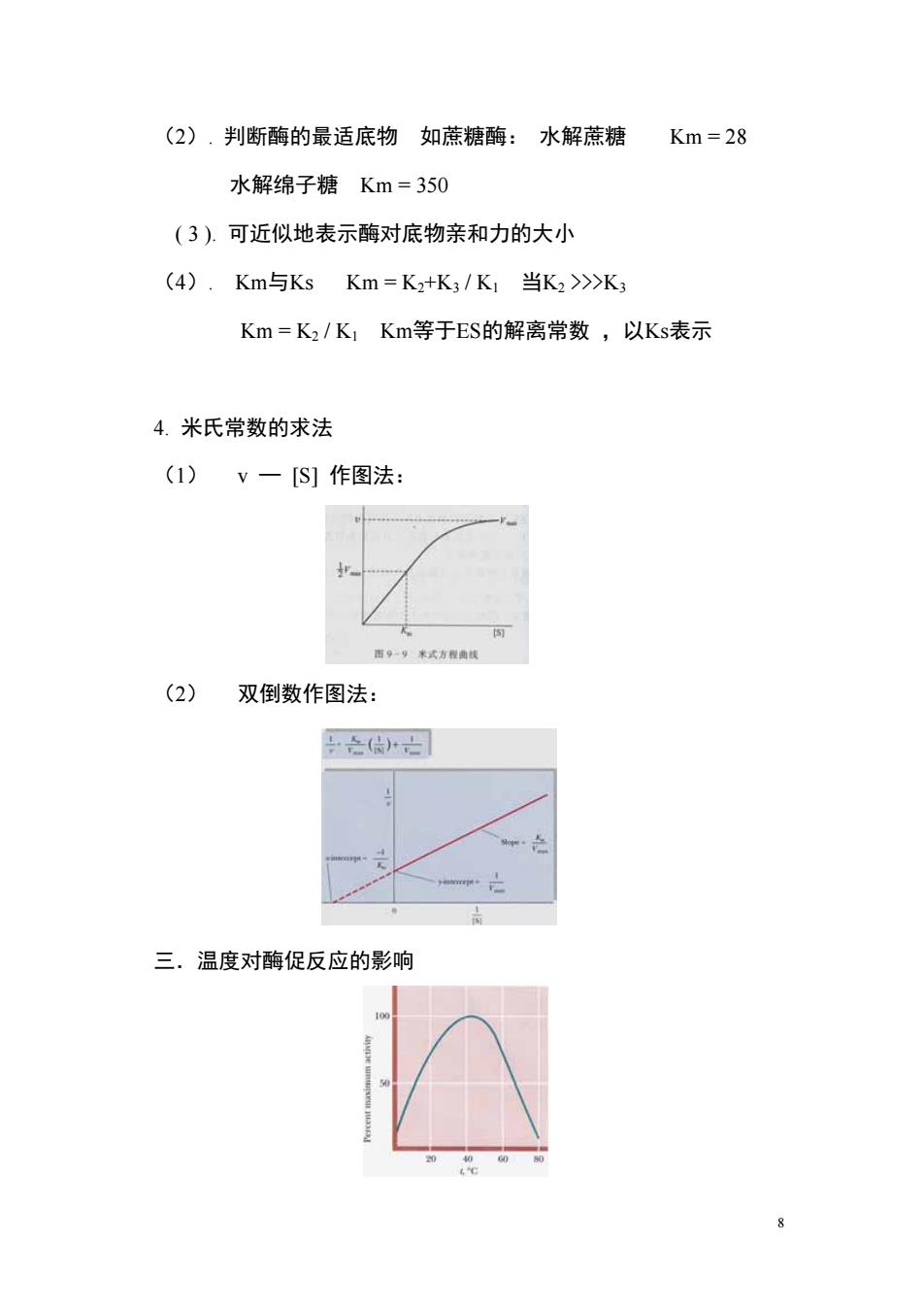
(2).判断酶的最适底物如蔗糖酶:水解蔗糖Km=28 水解绵子糖Km=350 (3).可近似地表示酶对底物亲和力的大小 (4).Km与KsKm=K2+K3/K1当K2>>K3 Km=K2/K1Km等于ES的解离常数,以Ks表示 4.米氏常数的求法 (1)V一[S]作图法: 面9一号来式方程典线 (2)双倒数作图法 合()亡 三.温度对酶促反应的影响
(2). 判断酶的最适底物 如蔗糖酶: 水解蔗糖 Km = 28 水解绵子糖 Km = 350 ( 3 ). 可近似地表示酶对底物亲和力的大小 (4). Km与Ks Km = K2+K3 / K1 当K2 >>>K3 Km = K2 / K1 Km等于ES的解离常数 ,以Ks表示 4. 米氏常数的求法 (1) v — [S] 作图法: (2) 双倒数作图法: 三.温度对酶促反应的影响 8

四.pH对酶促反应的影响 五.激活剂的影响:凡能提高酶活性,加速酶促反应速度的物质都 称为该酶的激活剂。激活剂分为以下几类: 1.金属离子:K、Na、Mg、Zn”Fe、Ca”、Mn 2.无机离子:C1·、Br、PO4、I、 3.小分子有机物:抗坏血酸、还原型谷胱甘肽、半胱氨酸等 4.生物大分子:蛋白酶、钙调素等 六.抑制剂的影响 1,什么是酶的抑制作用:抑制作用是指某些物质能与酶分子上某 些基团,主要是活性中心的某些基团结合,使酶活性中心的结 构和性质发生改变,从而引起酶活力的下降或丧失,这种作用 称为酶的抑制作用。抑制剂不同于变性剂。 2.抑制作用的类型 (1)不可逆抑制作用:抑制剂与酶分子上的某些基团以共价 键的方式结合,导致酶的活性下降或丧失,且不能用透 析的方法除去抑制剂而使酶的活性恢复的作用称为不可 逆抑制作用。 (2).可逆抑制作用:抑制剂与酶以非共价键方式结合引起酶活 性降低或丧失,但可用透析的方法除去抑制剂使酶活性恢
四.pH 对酶促反应的影响 五.激活剂的影响: 凡能提高酶活性,加速酶促反应速度的物质都 称为该酶的激活剂。激活剂分为以下几类: 1. 金属离子:K + 、Na+ 、Mg2+ 、Zn2+ Fe2+ 、Ca2+ 、Mn2+ 2.无机离子:Cl - 、Br - 、 PO4、I - 、 3.小分子有机物: 抗坏血酸、还原型谷胱甘肽、半胱氨酸等 4. 生物大分子: 蛋白酶、钙调素等 六.抑制剂的影响 1. 什么是酶的抑制作用:抑制作用是指某些物质能与酶分子上某 些基团,主要是活性中心的某些基团结合,使酶活性中心的结 构和性质发生改变,从而引起酶活力的下降或丧失,这种作用 称为酶的抑制作用。抑制剂不同于变性剂。 2. 抑制作用的类型 (1) 不可逆抑制作用: 抑制剂与酶分子上的某些基团以共价 键的方式结合,导致酶的活性下降或丧失,且不能用透 析的方法除去抑制剂而使酶的活性恢复的作用称为不可 逆抑制作用。 (2). 可逆抑制作用:抑制剂与酶以非共价键方式结合引起酶活 性降低或丧失,但可用透析的方法除去抑制剂使酶活性恢 9

复。这种抑制作用为可逆抑制作用。 A. 竞争性抑制:抑制剂是底物的结构类似物 E+S→ES →X B.非竟争抑制:抑制剂与底物可同时与酶结合 E+S→ES →无产物生成 C.反竞争性抑制:抑制剂只与酶一底物复合物结合 E+S—ES→E+P 的, ESI-X 七.双底物酶促反应机制 1.顺序机制 (1) 有序顺序机制 E+A+B→AEB→PEQE+P+Q (2) 随机顺序机制
复。这种抑制作用为可逆抑制作用。 A. 竞争性抑制:抑制剂是底物的结构类似物 B. 非竟争抑制:抑制剂与底物可同时与酶结合 C. 反竞争性抑制 :抑制剂只与酶—底物复合物结合 七.双底物酶促反应机制 1. 顺序机制 (1) 有序顺序机制 (2) 随机顺序机制 10