
有机化学电子教案 第十一章醚 11101 10100011 101100010 CH CH exit
第十一章 醚 exit

本章提纲 第一节 醚的结构、命名和物理性质 第二节 醚的反应 第三节 醚的制法 第四节 环醚 第五节 醚的来源和用途
本章提纲 ❖ 第一节 醚的结构、命名和物理性质 ❖ 第二节 醚的反应 ❖ 第三节 醚的制法 ❖ 第四节 环醚 ❖ 第五节 醚的来源和用途

§11.1 醚的结构、命名和物理性质 醚(ethers)可以看作是水分子中的两个氢原子被烃基 取代而生成的化合物,通式为:ROR' 11.1.1 醚的结构 H H R R 碳-氧-碳键角与 水的氢-氧氢键 <HOH=1050 <C0H=108.90<C0C= 角相当。 111.70 R-O-R R=R- 简单醚 R年R' 混合醚 C一O一C-醚键
醚(ethers)可以看作是水分子中的两个氢原子被烃基 取代而生成的化合物,通式为:ROR' §11.1 醚的结构、命名和物理性质 11.1.1 醚的结构 O H3 C H3 C sp 3 碳-氧-碳键角与 水的氢-氧-氢键 角相当。 R—O—R′ C—O—C -醚键 R = R′—— 简单醚 R = R′—— 混合醚 O H H O R R O R R ' <HOH =1050 < COH = 108.90 < COC = 111.70
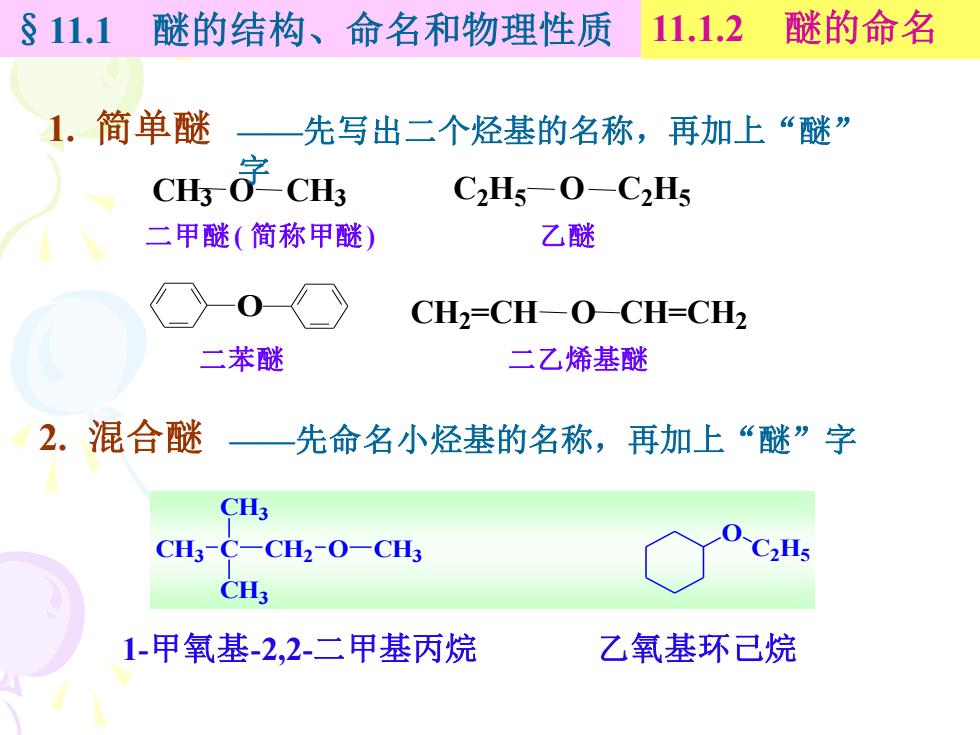
§11.1 醚的结构、命名和物理性质 11.1.2 醚的命名 1.简单醚 先写出二个烃基的名称,再加上“醚” CH字cH C2H5-0-C2H5 二甲醚(简称甲醚) 乙醚 CH2=CH-OCH=CH2 二苯醚 二乙烯基醚 2.混合醚一先命名小烃基的名称,再加上“醚”字 CH3 CH3-C-CH2-O-CH3 CH3 1-甲氧基-2,2-二甲基丙烷 乙氧基环己烷
§11.1 醚的结构、命名和物理性质 11.1.2 醚的命名 1. 简单醚 CH3 O CH3 C2H5 O C2H5 O CH2=CH O CH=CH2 二甲醚( 简称甲醚) 二苯醚 二乙烯基醚 乙醚 ——先写出二个烃基的名称,再加上“醚” 字 2. 混合醚 ——先命名小烃基的名称,再加上“醚”字 CH3 C CH3 CH3 CH2 O CH3 O C2H5 1-甲氧基-2,2-二甲基丙烷 乙氧基环己烷

§11.1 醚的结构、命名和物理性质 11.1.2 醚的命名 3.环醚 一如醚氧原子是环的一部分,则称为环醚。 CH 1,2-环氧丙烷 1,4-环氧丁烷 1,4-二氧六环(二噁烷) 4. 结构复杂的醚 可以看作是烃的衍生物来命名,将较大的烃 基作母体,剩下的RO-部分看作取代基。 RO- 烷氧基 3 2 CHsO-CH2CH-CH2 OCH3 3-甲氧基-1-丙烯 (甲基烯丙基醚) 6 54 3 2 CH=CH-CH3 CH3CH2CH2CHCH2CH3 O-CH2CH3 对甲氧基丙烯基苯 3-乙氧基已烷
§11.1 醚的结构、命名和物理性质 CH3 H C CH2 O O O O 3. 环醚 —如醚氧原子是环的一部分,则称为环醚。 1,2-环氧丙烷 1,4-环氧丁烷 1,4-二氧六环(二噁烷) 11.1.2 醚的命名 RO- —— 烷氧基 CH3CH2CH2CHCH2CH3 O CH2CH3 CH3O CH2 CH=CH2 OCH3 2 1 CH=CH CH3 6 5 4 3 对甲氧基丙烯基苯 3- 甲氧基- 1- 丙烯 (甲基烯丙基醚) 3 2 1 可以看作是烃的衍生物来命名,将较大的烃 基作母体,剩下的RO- 部分看作取代基。 4. 结构复杂的醚 3- 乙氧基已烷

§11.1 醚的结构、命名和物理性质 11.1.3 醚的物理性质 由于烃基对氧的遮盖,不能形成H键。因此: 不溶于水,沸点低,易挥发,良溶剂(从水中萃取 有机物)。 环醚的O裸露,可与水形成H键,因此,四氢呋喃, 二噁烷与水混溶。 光谱特征:(参见第八章)
光谱特征:(参见第八章) §11.1 醚的结构、命名和物理性质 11.1.3 醚的物理性质 由于烃基对氧的遮盖,不能形成H-键。因此: 不溶于水,沸点低,易挥发,良溶剂(从水中萃取 有机物)。 环醚的O裸露,可与水形成H-键,因此,四氢呋喃, 二噁烷与水混溶

§11.2 醚的反应 醚是一类不活泼的化合物,它对碱、稀酸、金属钠、 还原剂、氧化剂等都是稳定的。但分子中氧原子上的孤对 电子体现一些化学活性。 11.2.1 碱性 醚氧原子上有孤电子对,可以作为电子给予体, 接受强酸中的质子生成盐。 通HCI气 CH:CH2OCH,CH CH.CH.OCH CH.Cr 或无水HCI溶液 H 提供无水的HCI溶液
§11.2 醚的反应 醚是一类不活泼的化合物,它对碱、稀酸、金属钠、 还原剂、氧化剂等都是稳定的。但分子中氧原子上的孤对 电子体现一些化学活性。 11.2.1 碱性 醚氧原子上有孤电子对,可以作为电子给予体, 接受强酸中的质子生成盐。 CH3CH2OCH2CH3 通 HCl气 或无水HCl溶液 CH3CH2OCH2CH3Cl- + H 提供无水的HCl溶液
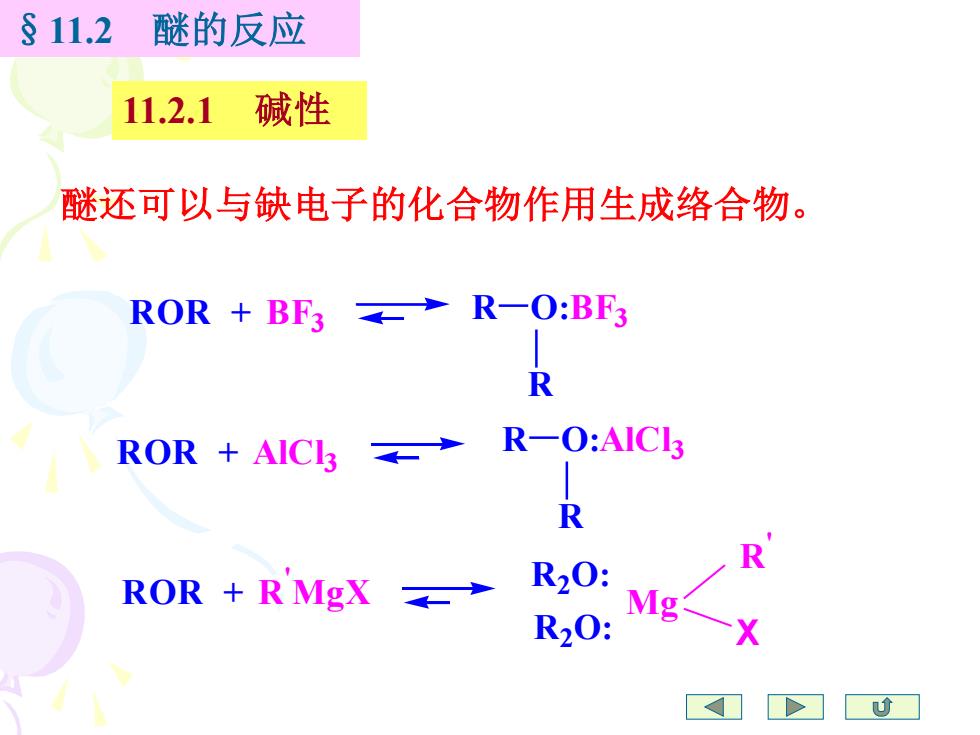
§11.2 醚的反应 11.2.1碱性 醚还可以与缺电子的化合物作用生成络合物。 ROR+BF3→R-O:BF3 R ROR+AICL3→ R-0:AICI3 R R ROR +R MgX R20: Mg R20: D
醚还可以与缺电子的化合物作用生成络合物。 ROR + BF3 R R ROR + AlCl 3 ROR + R ' MgX R R O:BF3 R2 O: R2 O: Mg X R ' O:AlCl 3 §11.2 醚的反应 11.2.1 碱性
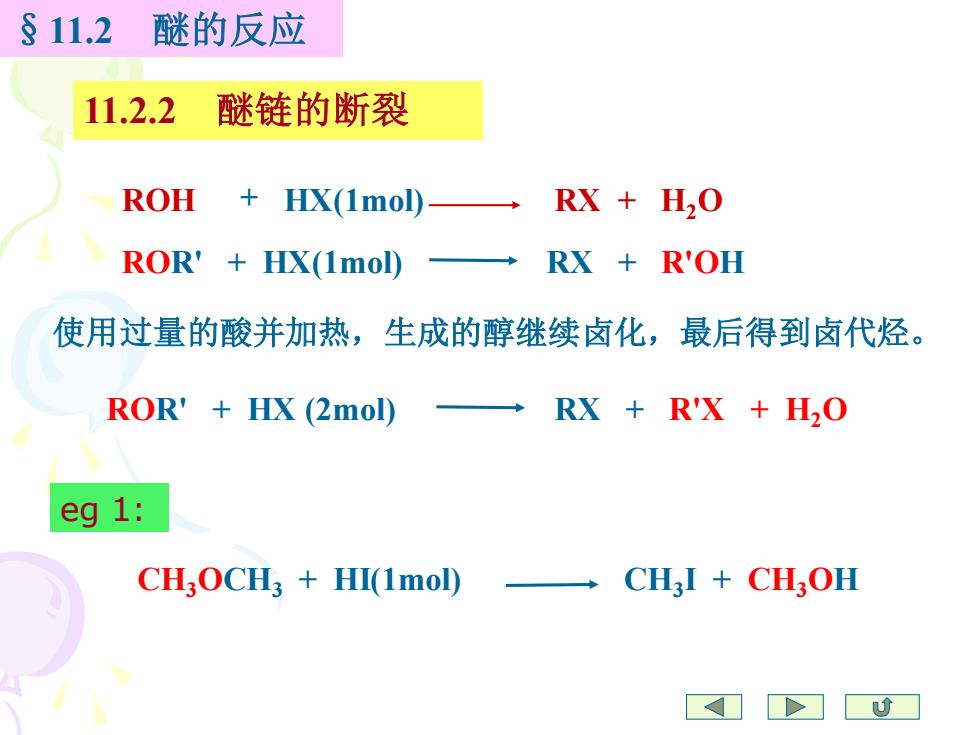
§11.2 醚的反应 11.2.2 醚链的断裂 ROH HX(1mol) RX H,O ROR'HX(1mol) RX R'OH 使用过量的酸并加热,生成的醇继续卤化,最后得到卤代烃。 ROR'HX (2mol) RX R'X H2O eg 1: CH,OCH3+HI(1mol)→ CHI CHOH
ROR' + HX(1mol) RX + R'OH ROH HX(1mol) RX + H2O §11.2 醚的反应 11.2.2 醚链的断裂 + 使用过量的酸并加热,生成的醇继续卤化,最后得到卤代烃。 ROR' + HX (2mol) RX + R'X + H2O CH3OCH3 + HI(1mol) CH3 I + CH3OH eg 1:
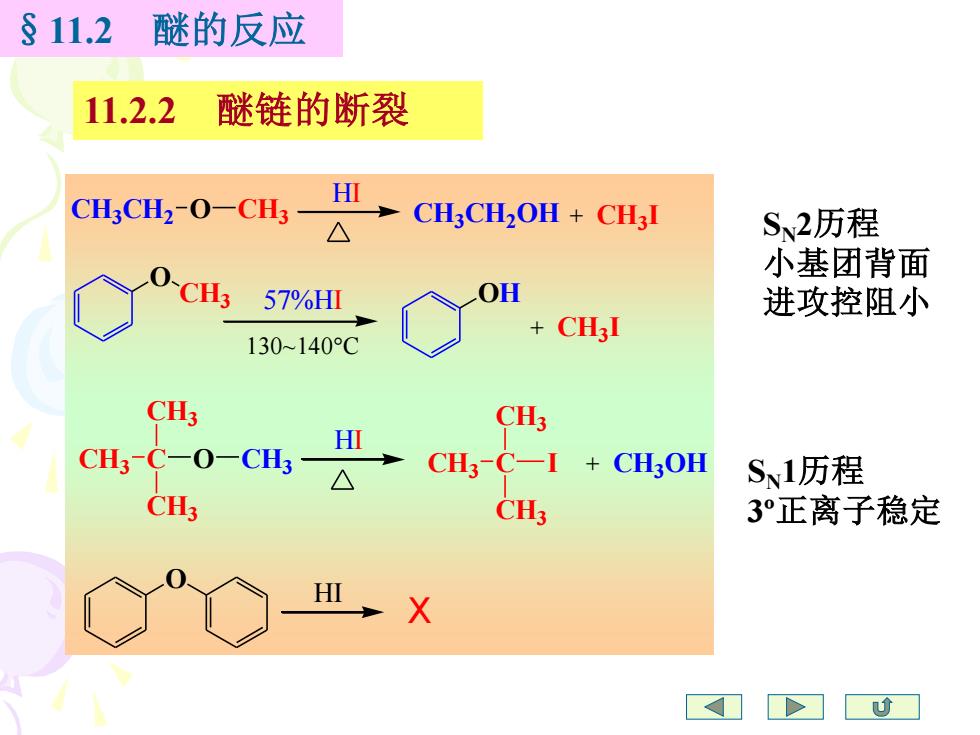
§11.2 醚的反应 11.2.2 醚链的断裂 CHsCHz-O-CH;- HI △ CH3CH2OH CH3I S、2历程 小基团背面 CH3 57%HΠ OH 进攻控阻小 + 130~140C CH3I CH3 CH3 CH3-C-O-CH3- HI CH3-C-I +CH3OH S、1历程 CH3 CH3 3正离子稳定 X
§11.2 醚的反应 11.2.2 醚链的断裂 CH3 CH2 O CH3 HI CH3 CH2 OH CH3 + I O CH3 57%HI 130~140C OH CH3 + I CH3 C CH3 CH3 O CH3 HI CH3 C CH3 CH3 I + CH3 OH O HI X SN2历程 小基团背面 进攻控阻小 SN1历程 3º正离子稳定