
病人潔 章 和

第二十章酸和碱 §20.1 Bronsted 酸 1923年Bronsted J Ni和Lowry T M各自独立提出了酸 和碱的定义:酸是质子给予体,碱是质子受体。 20.1.1酸的强度 酸的强度一般在水溶液中测定。酸(HA)在 水溶液中达成电离平衡: HA H20 H30+A 平衡常数为 [H3O][A] Kas [HA] 作为溶剂水的浓度基本不变,因此Ka是近似值
1923年BrØnsted J N和Lowry T M 各自独立提出了酸 和碱的定义:酸是质子给予体,碱是质子受体。 HA + H2O H3O + A + _ 第二十章 酸和碱 §20.1 BrØnsted 酸 20.1.1 酸的强度 酸的强度一般在水溶液中测定。酸(HA)在 水溶液中达成电离平衡: 平衡常数为 [H3 O + ][A - ] [HA] Ka≈ 作为溶剂水的浓度基本不变,因此Ka是近似值

第二十章 §20.1 Bronsted酸 20.1.1酸的强度 由于结构不同的酸的酸度可以相差几个数量级, 一般把Ka换算成pKa(=-lgKa);pKa的数值越小 酸性越强。 水是溶剂,又是酸也是碱。水的pa=15.74。 H20+H20=H30+0H pKa<16的酸不能在水中测定强度,却可以在碱性比水更 强的溶剂中测定。例如: 溶剂: 甲醇 pKa=14~20 DMSO pKa=13~18 环己胺 pKa=18~32
H2O + H2O H3O + OH + _ 第二十章 §20.1 BrØnsted 酸 20.1.1 酸的强度 由于结构不同的酸的酸度可以相差几个数量级, 一般把Ka换算成pKa(=-lgKa); pKa 的数值越小 酸性越强。 水是溶剂,又是酸也是碱。水的pKa=15.74。 pKa<16的酸不能在水中测定强度,却可以在碱性比水更 强的溶剂中测定。例如: 溶剂: 甲醇 pKa=14~20 DMSO pKa=13~18 环己胺 pKa=18~32
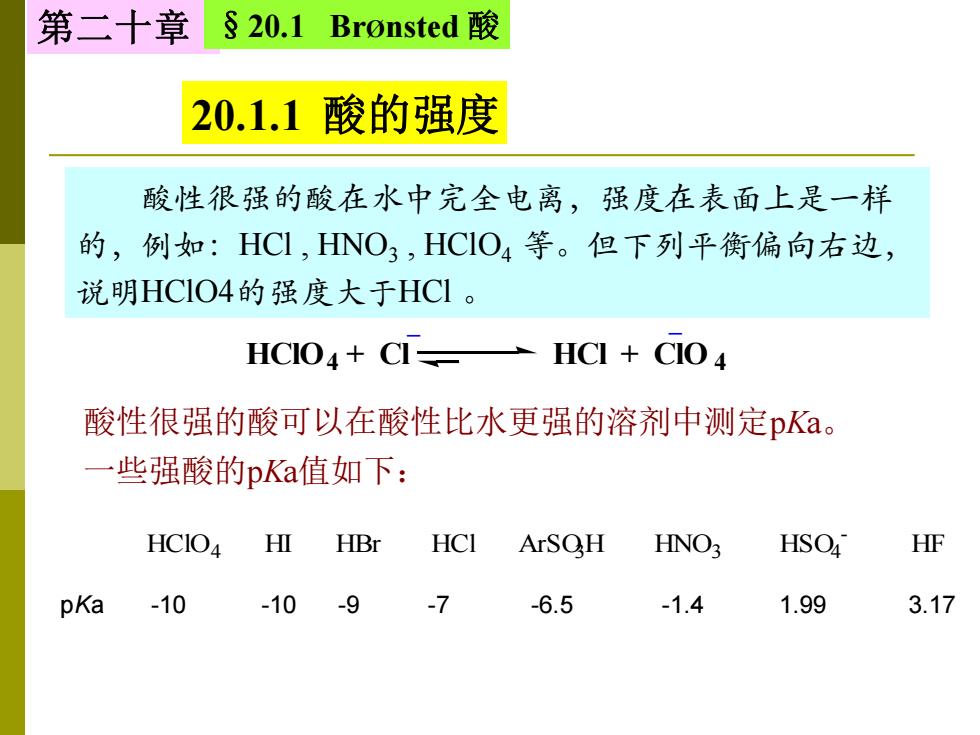
第二十章 S20.1 Bronsted酸 20.1.1酸的强度 酸性很强的酸在水中完全电离,强度在表面上是一样 的,例如:HCI,HNO3,HCIO4等。但下列平衡偏向右边, 说明HCIO4的强度大于HCl。 HCIO4+CI=— HCI CIO 酸性很强的酸可以在酸性比水更强的溶剂中测定pKa。 一些强酸的pKa值如下: HCIO HI HBr HCI ArSOH HNO HSO HF pKa -10 -10 -9 -7 -6.5 -1.4 1.99 3.17
HClO4 + Cl HCl + ClO 4 _ _ 第二十章 §20.1 BrØnsted 酸 20.1.1 酸的强度 酸性很强的酸在水中完全电离,强度在表面上是一样 的,例如:HCl , HNO3 , HClO4 等。但下列平衡偏向右边, 说明HClO4的强度大于HCl 。 酸性很强的酸可以在酸性比水更强的溶剂中测定pKa。 一些强酸的pKa值如下: pKa -10 -10 -9 -7 -6.5 -1.4 1.99 3.17 HClO4 HI HBr HCl ArSO3H HNO3 HSO4 - HF

第二十章 §20.1 Bronsted酸 20.1.2碱的强度 每一个酸(HA)在电离时都生成一个碱(A)成为它 的共轭碱;每一个碱接受质子后都变成它的共轭酸。碱的 强度一般用它的共轭酸的pKa来表示,pKa值越大,碱性越 强,pKa值越小,碱性越弱。例如: NH4" ArNH RC+-OH pKa 9.24 3~5 -7 温度对碱性强弱也有影响。例如: >50℃时 BuOH H2O>Bu2O 1~50℃时 BuOH Bu2O>H2O 对于中性分 BuOH H2O 于电离
第二十章 §20.1 BrØnsted 酸 20.1.2 碱的强度 每一个酸(HA)在电离时都生成一个碱(A-)成为它 的共轭碱;每一个碱接受质子后都变成它的共轭酸。碱的 强度一般用它的共轭酸的pKa来表示, pKa值越大,碱性越 强, pKa值越小,碱性越弱。例如: pKa 9.24 3~5 -7 NH4 + ArNH3 + R2 C + =OH 温度对碱性强弱也有影响。例如: >50℃时 BuOH > H2O > Bu2O 1~50 ℃时 BuOH > Bu2O > H2O <1℃时 Bu2O > BuOH > H2O 对于中性分 子压力有利 于电离
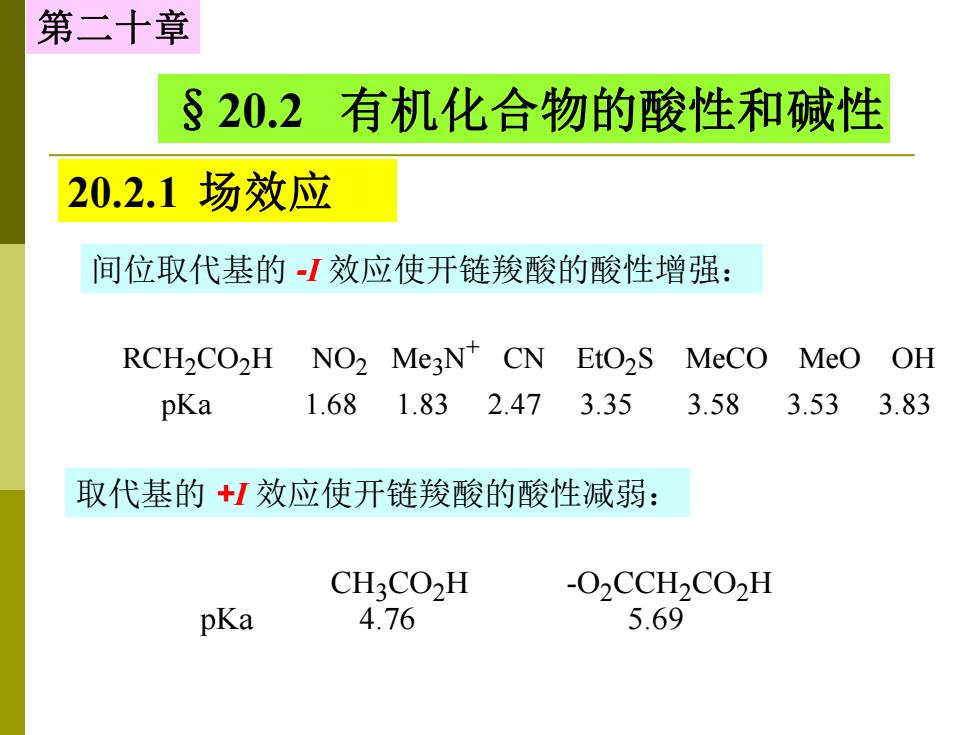
第二十章 §20.2 有机化合物的酸性和碱性 20.2.1场效应 间位取代基的1效应使开链羧酸的酸性增强: RCH2CO2H NO2 MeaN CN EtO2S MeCO MeO OH pKa 1.681.832.473.35 3.58 3.53 3.83 取代基的+1效应使开链羧酸的酸性减弱: CH3CO2H -O2CCH2CO2H pKa 4.76 5.69
第二十章 §20.2 有机化合物的酸性和碱性 20.2.1 场效应 间位取代基的 -I 效应使开链羧酸的酸性增强: RCH2CO2H NO2 Me3N + CN EtO2 S MeCO MeO OH pKa 1.68 1.83 2.47 3.35 3.58 3.53 3.83 取代基的 +I 效应使开链羧酸的酸性减弱: CH3CO2H -O2CCH2CO2H pKa 4.76 5.69
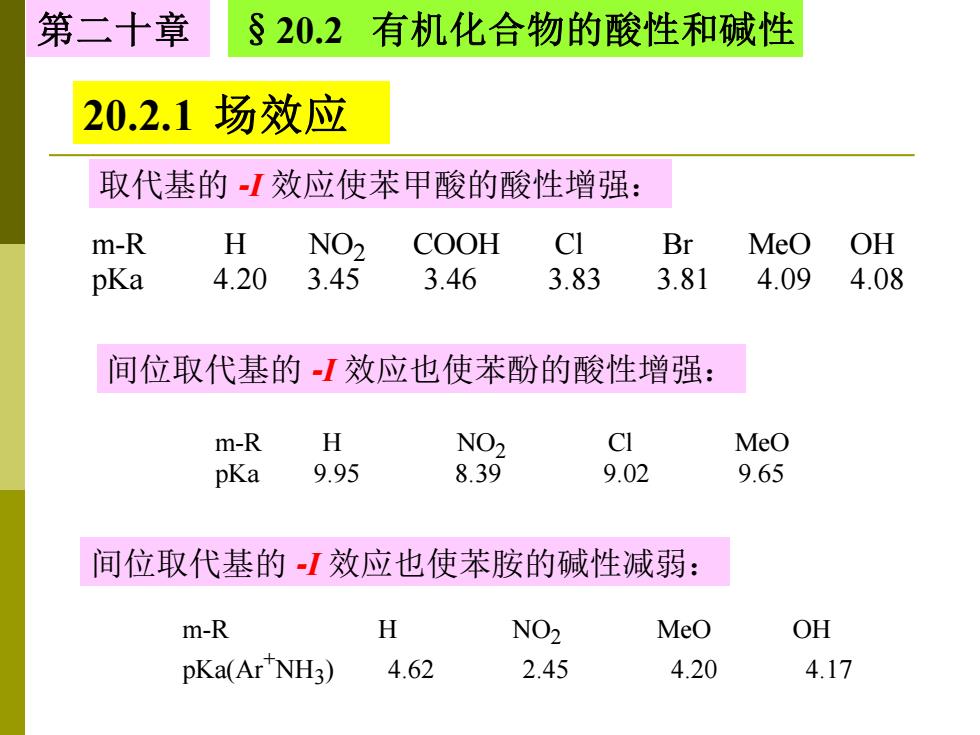
第二十章 §20.2 有机化合物的酸性和碱性 20.2.1场效应 取代基的I效应使苯甲酸的酸性增强: m-R H NO2 COOH CI Br MeO OH pKa 4.20 3.45 3.46 3.83 3.81 4.09 4.08 间位取代基的I效应也使苯酚的酸性增强: m-R H NO2 CI MeO pKa 9.95 8.39 9.02 9.65 间位取代基的I效应也使苯胺的碱性减弱: m-R H NO2 MeO OH pKa(Ar NH3) 4.62 2.45 4.20 4.17
第二十章 §20.2 有机化合物的酸性和碱性 20.2.1 场效应 取代基的 -I 效应使苯甲酸的酸性增强: m-R H NO2 COOH Cl Br MeO OH pKa 4.20 3.45 3.46 3.83 3.81 4.09 4.08 间位取代基的 -I 效应也使苯酚的酸性增强: m-R H NO2 Cl MeO pKa 9.95 8.39 9.02 9.65 间位取代基的 -I 效应也使苯胺的碱性减弱: m-R H NO2 MeO OH pKa(Ar +NH3 ) 4.62 2.45 4.20 4.17

第二十章 §20.2有机化合物的酸性和碱性 20.2.2共振效应(M) 些取代基的共振效应见表: 表20.1一些取代基的共振效应 +M -M 01 SR NOz CHO SH CN COR NR2(NHR,NH2) Br CO2H SOR NHCOR COzR S02(0R OR ci CONH2 NO OH F CONHR Ar OCOR R CONR2 Ar 取代基只有在它与不饱和体系直接相连时才显示出共振效应。 般场效应和共振效应不能区分开来,因此,常统称为电效应
第二十章 §20.2 有机化合物的酸性和碱性 20.2.2 共振效应(M) 一些取代基的共振效应见表: 取代基只有在它与不饱和体系直接相连时才显示出共振效应。 一般场效应和共振效应不能区分开来,因此,常统称为电效应

第二十章 §20.2酸性和碱性 20.2.2共振效应 20.2.2.1共振效应对羧酸酸性的影响 取代基的-M效应使苯甲酸的酸性增强。一些对位取代 苯甲酸的pKa为: p-R H NO2 CI Br MeO OH pKa 4.20 3.43 3.99 4.00 4.47 4.58 对硝基苯甲酸的酸性比间硝基苯甲 酸强,除了小影外,还有酸根上 的负电荷分
第二十章 §20.2 酸性和碱性 20.2.2 共振效应 20.2.2.1 共振效应对羧酸酸性的影响 取代基的-M效应使苯甲酸的酸性增强。一些对位取代 苯甲酸的pKa为: p-R H NO2 Cl Br MeO OH pKa 4.20 3.43 3.99 4.00 4.47 4.58 C N O O -O + O - - 对硝基苯甲酸的酸性比间硝基苯甲 酸强,除了-I小影外,还有酸根上 的负电荷分散
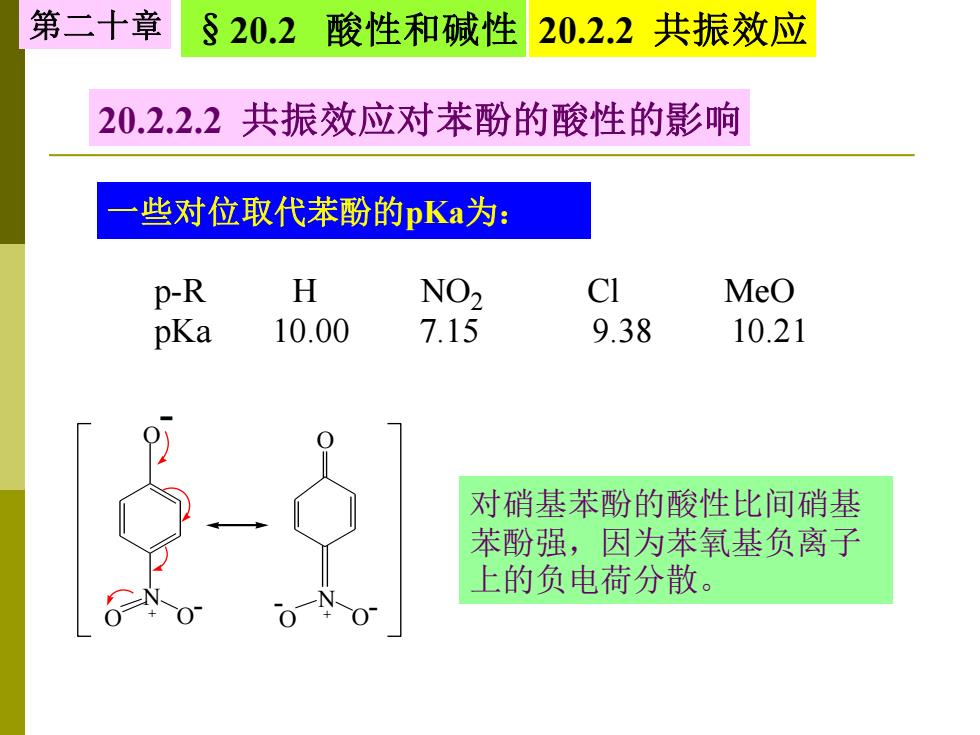
第二十章 §20.2酸性和碱性 20.2.2共振效应 20.2.2.2共振效应对苯酚的酸性的影响 些对位取代苯酚的pKa为: p-R H NO2 CI MeO pKa 10.00 7.15 9.38 10.21 对硝基苯酚的酸性比间硝基 苯酚强,因为苯氧基负离子 上的负电荷分散
20.2.2.2 共振效应对苯酚的酸性的影响 一些对位取代苯酚的pKa为: p-R H NO2 Cl MeO pKa 10.00 7.15 9.38 10.21 N O O + O - - N O O + O - - 对硝基苯酚的酸性比间硝基 苯酚强,因为苯氧基负离子 上的负电荷分散。 第二十章 §20.2 酸性和碱性 20.2.2 共振效应