
有机化学电子教案 第八章 苯和芳香烃 11101 011 10 CH CH exit
第八章 苯和芳香烃 exit

本章提纲 第一节苯的结构 第二节苯衍生物的异构、命名及物理性质 第三节苯环上的亲电取代反应 第四节苯环上亲电取代反应的定位规律 第五节烷基苯的反应 第六节单环芳香烃的来源和用途 第七节稠环芳烃 第八节卤代芳烃
本章提纲 第一节 苯的结构 第二节 苯衍生物的异构、命名及物理性质 第三节 苯环上的亲电取代反应 第四节 苯环上亲电取代反应的定位规律 第五节 烷基苯的反应 第六节 单环芳香烃的来源和用途 第七节 稠环芳烃 第八节 卤代芳烃

芳香性的概念和芳香化合物的定义 第一阶段:从植物胶中取得的具有芳香 气味的物质称为芳香化和物。 第二阶段:将苯和含有苯环的化合物称 为芳香化合物。 第三阶段:将具有芳香特性的化合物称 为芳香化合物
芳香性的概念和芳香化合物的定义 第一阶段:从植物胶中取得的具有芳香 气味的物质称为芳香化和物。 第二阶段:将苯和含有苯环的化合物称 为芳香化合物。 第三阶段:将具有芳香特性的化合物称 为芳香化合物

芳香性的概念 1. CH的比例高。 2.具有平面和接近平面的环状结构。 3.键长接近平均化。 4.在核磁共振谱中,环外氢的化学位移明显移向低 场,环内氢的化学位移明显移向高场。 5.化学性质稳定,易发生亲电取代而不易发生加成
芳香性的概念 1. C/H的比例高。 2. 具有平面和接近平面的环状结构。 3. 键长接近平均化。 4. 在核磁共振谱中,环外氢的化学位移明显移向低 场, 环内氢的化学位移明显移向高场。 5. 化学性质稳定,易发生亲电取代而不易发生加成
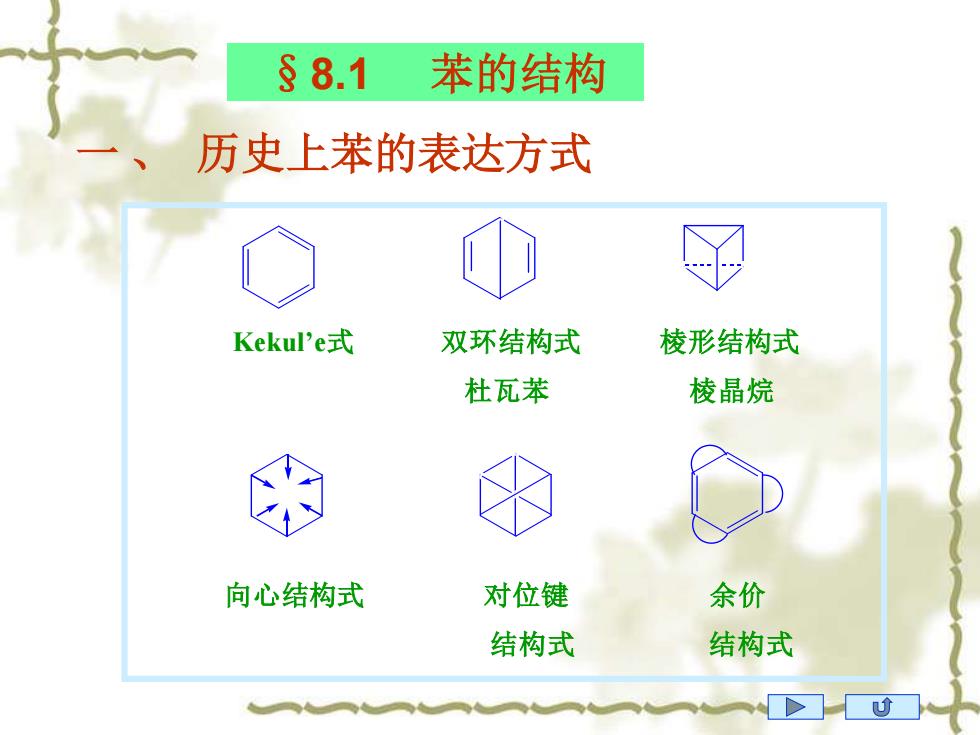
§8.1 苯的结构 历史上苯的表达方式 Keku'e式 双环结构式 棱形结构式 杜瓦苯 棱晶烷 向心结构式 对位键 余价 结构式 结构式
§8.1 苯的结构 一 、 历史上苯的表达方式 Kekul’e式 双环结构式 棱形结构式 杜瓦苯 棱晶烷 向心结构式 对位键 余价 结构式 结构式
§8.1 苯的结构 8.1.1 Kekule'式 1825年法拉第发现了苯。 1857年 凯库勒提出碳四价。 1858年凯库勒提出苯分子具有环状结构。 1865年提出摆动双键学说
8.1.1 Kekule’式 1825年 法拉第发现了苯。 1857年 凯库勒提出碳四价。 1858年 凯库勒提出苯分子具有环状结构。 1865年 提出摆动双键学说。 §8.1 苯的结构
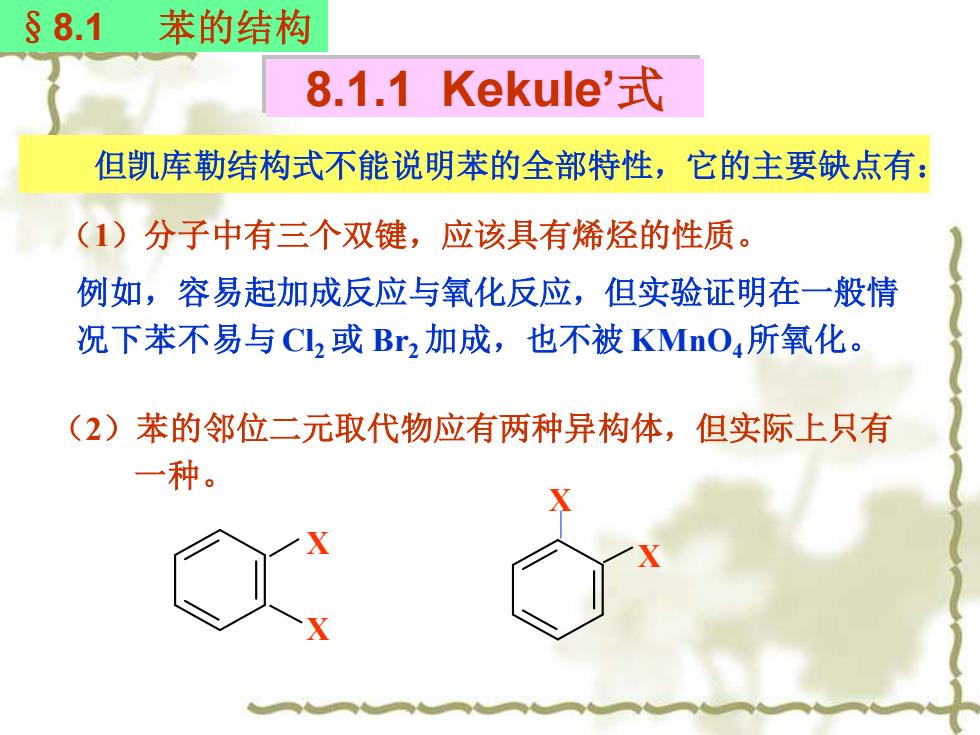
§8.1 苯的结构 8.1.1 Kekule'式 但凯库勒结构式不能说明苯的全部特性,它的主要缺点有: (1)分子中有三个双键,应该具有烯烃的性质。 例如,容易起加成反应与氧化反应,但实验证明在一般情 况下苯不易与Cl,或Br,加成,也不被KMnO所氧化。 (2)苯的邻位二元取代物应有两种异构体,但实际上只有 一种
但凯库勒结构式不能说明苯的全部特性,它的主要缺点有: (1)分子中有三个双键,应该具有烯烃的性质。 例如,容易起加成反应与氧化反应,但实验证明在一般情 况下苯不易与Cl2 或 Br2 加成,也不被 KMnO4 所氧化。 8.1.1 Kekule’式 §8.1 苯的结构 (2)苯的邻位二元取代物应有两种异构体,但实际上只有 一种。 X X X X
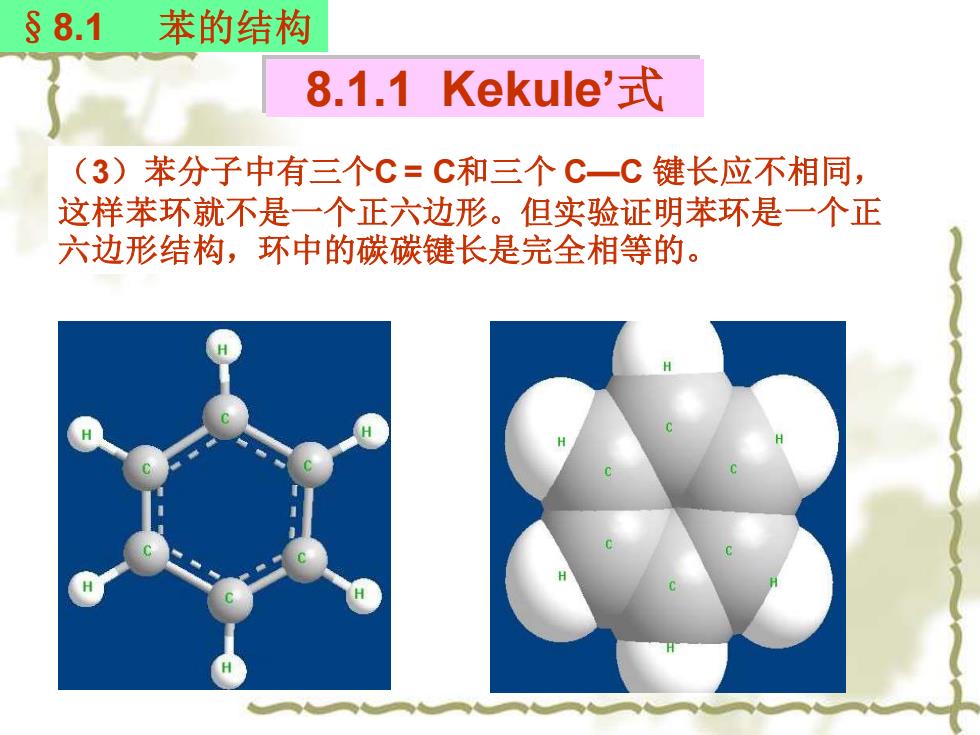
§8.1 苯的结构 8.1.1 Kekule'式 (3)苯分子中有三个C=C和三个C一C键长应不相同, 这样苯环就不是一个正六边形。但实验证明苯环是一个正 六边形结构,环中的碳碳键长是完全相等的
8.1.1 Kekule’式 §8.1 苯的结构 (3)苯分子中有三个C = C和三个 C—C 键长应不相同, 这样苯环就不是一个正六边形。但实验证明苯环是一个正 六边形结构,环中的碳碳键长是完全相等的
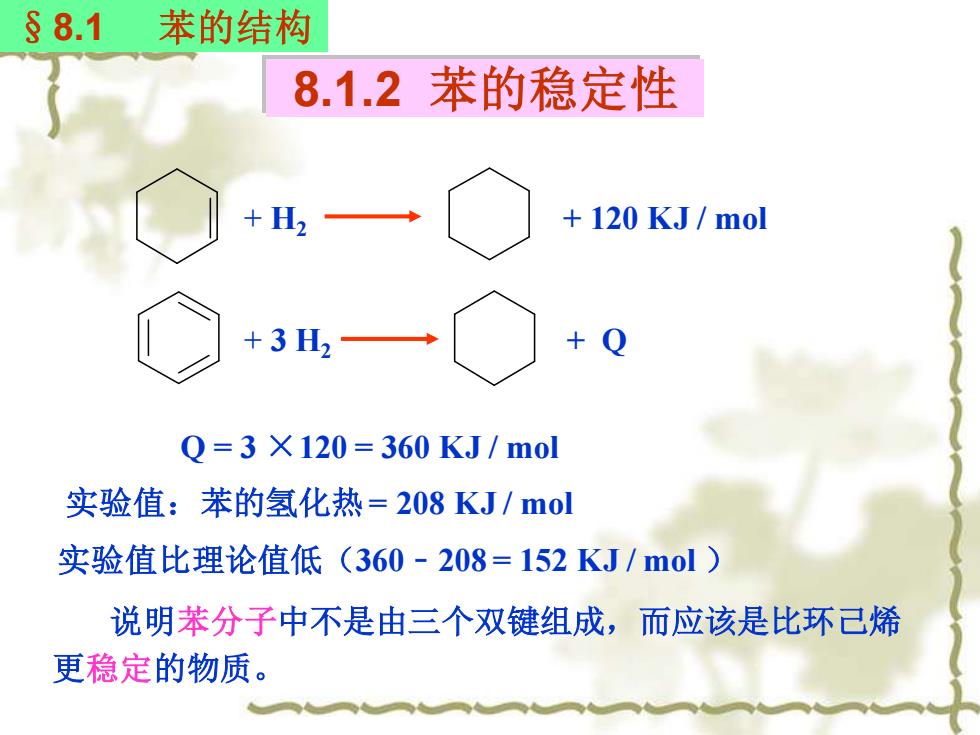
§8.1 苯的结构 8.1.2 苯的稳定性 +H2 120 KJ/mol +3H2 0=3×120=360KJ/mol 实验值:苯的氢化热=208KJ/mol 实验值比理论值低(360-208=152KJ/mol) 说明苯分子中不是由三个双键组成,而应该是比环己烯 更稳定的物质
+ H2 + 120 KJ / mol + 3 H2 + Q Q = 3 ×120 = 360 KJ / mol 实验值:苯的氢化热= 208 KJ / mol 实验值比理论值低(360﹣208 = 152 KJ / mol ) 说明苯分子中不是由三个双键组成,而应该是比环己烯 更稳定的物质。 8.1.2 苯的稳定性 §8.1 苯的结构
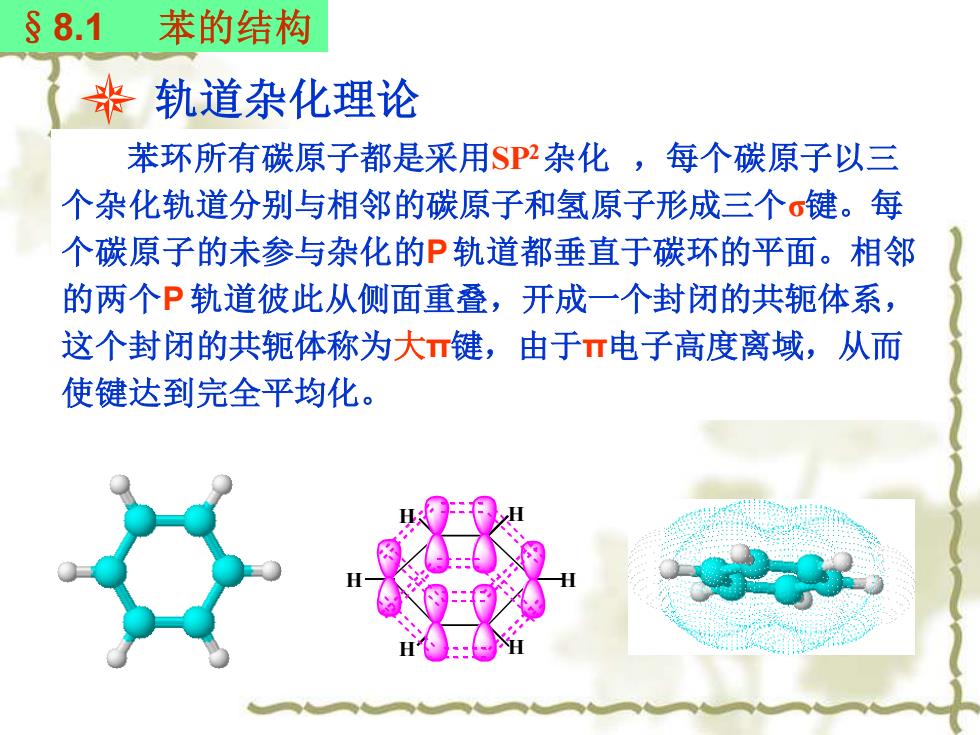
§8.1 苯的结构 丧轨道杂化理论 苯环所有碳原子都是采用$P2杂化,每个碳原子以三 个杂化轨道分别与相邻的碳原子和氢原子形成三个σ键。每 个碳原子的未参与杂化的P轨道都垂直于碳环的平面。相邻 的两个P轨道彼此从侧面重叠,开成一个封闭的共轭体系, 这个封闭的共轭体称为大π键,由于π电子高度离域,从而 使键达到完全平均化
轨道杂化理论 苯环所有碳原子都是采用SP2 杂化 ,每个碳原子以三 个杂化轨道分别与相邻的碳原子和氢原子形成三个σ键。每 个碳原子的未参与杂化的P 轨道都垂直于碳环的平面。相邻 的两个P 轨道彼此从侧面重叠,开成一个封闭的共轭体系, 这个封闭的共轭体称为大π键,由于π电子高度离域,从而 使键达到完全平均化。 §8.1 苯的结构 H H H H H H