
石河子大学化学化工学院 教案 开课单位:化学化工学院 课程名称:分析化学(二) 专业年级:药学、中药专业 任课教师:赵芳 教材名称:分析化学 学年第学期
石河子大学化学化工学院 教 案 开课单位:化学化工学院 课程名称:分析化学(二) 专业年级:药学、中药专业 任课教师: 赵 芳 教材名称: 分析化学 学年第 学期

授课 内容 光学分析导论 课时安排2学时 以光分析为主线,逐步阐述各光学分析的基本原理和特点,使学生了解 光学分析方法的特征和分类。 要求 教 重点 教学重点:光学分析方法的特征和分类。 难点 教学难点:原子光谱和分子光谱及其特征 教学 方法 多媒体课件,以讲授为主,学生自主学习为辅 手段 教 学 容 电磁辐射的性质:电磁波谱:原子光谱和分子光谱 提 纲
2 授课 内容 光学分析导论 课时安排 2 学时 教学 目的 要求 以光分析为主线,逐步阐述各光学分析的基本原理和特点,使学生了解 光学分析方法的特征和分类。 教学 重点 难点 教学重点:光学分析方法的特征和分类。 教学难点:原子光谱和分子光谱及其特征。 教学 方法 手段 多媒体课件,以讲授为主,学生自主学习为辅 教 学 内 容 提 纲 电磁辐射的性质;电磁波谱;原子光谱和分子光谱

课外 学习 理解并掌握本章所讲内容,完成课后思考题1(1)、(2)、(4)、(7)。 要求 第二章光学分析法导论 第一节电磁辐射 1电磁辐射的性质 以电磁辐射为分析信号的分析方法在广义上都称为光学分析法。红外可见光紫外、X 射线等都是电磁辐射。 1.1波动性 按照经典物理学的观点,电磁辐射是在空间传播着的交变电磁场,称为电磁 波,可以用频率(v入、波长()和波数()等波参数表征。掌握频、波长、波 数的定义及之间的关系。 12微粒性 根据量子理论,电磁辐射是在空间高速运动的光量子(或称光子)流。 普朗克方程 (2-3) 该方程将电磁辐射的波动性和微粒性联系起来, 2电磁波谱 按照波长的大小顺序排列可得到电磁波谱,不同的波长属不同的波谱区,对 应有不同的光子能量和不同的能级跃迁。 表2-1电磁波谱区 波谱区 皮长范围 光子能量eV 能级跃迁类型 射线区 <0.005nm 52.5x105 原子核能级 X射线区 .005-10nm 2.5x105~12×102 内层电子能级 远紫外区 -200nm 1.2×102-6.2 近紫外区 -400nm 5.23.1 原子的电子能级或 00-780nm 可见光区 3.11.7 分子的成链电子能级 3
3 课外 学习 要求 理解并掌握本章所讲内容,完成课后思考题 1(1)、(2)、(4)、(7)。 教学 后记 第二章 光学分析法导论 第一节 电磁辐射 1 电磁辐射的性质 以电磁辐射为分析信号的分析方法在广义上都称为光学分析法。红外-可见光紫外、X 射线等都是电磁辐射。 1.1 波动性 按照经典物理学的观点,电磁辐射是在空间传播着的交变电磁场,称为电磁 波,可以用频率(υ)、波长(λ)和波数(δ)等波参数表征。掌握频、波长、波 数的定义及之间的关系。 1.2 微粒性 根据量子理论,电磁辐射是在空间高速运动的光量子(或称光子)流。 普朗克方程 hv E = (2-3) 该方程将电磁辐射的波动性和微粒性联系起来, 2 电磁波谱 按照波长的大小顺序排列可得到电磁波谱,不同的波长属不同的波谱区,对 应有不同的光子能量和不同的能级跃迁。 表 2-1 电磁波谱区 波谱区 波长范围 光子能量/eV 能级跃迁类型 射线区 X 射线区 远紫外区 近紫外区 可见光区 <0.005nm 0.005~10 nm 10~200 nm 200~400 nm 400~780 nm 2.5105 2.5105 ~1.2 102 1.2 102 ~6.2 6.2~3.1 3.1~1.7 原子核能级 内层电子能级 原子的电子能级或 分子的成键电子能级

匠红外区D.782.54m .7-0.5 份子振动能级 中红外风 .5-50um b.50.025 远红外区 50-1000μm 2.5×10-2-1.2×10-4 分子转动能级 微波区 .1~100cm 1.2×10-4-1.2×10-7 射频区 100m 2×10-6-1.2×10-9 电子自旋能级或核自旋能级 电磁波谱的分区: (1)高能辐射区:包括射线区和X射线区。 (2)中能辐射区:紫外区、可见光区和红外区。 由于对这部分辐射的研究和应用要使用一些共同的光学试验技术,例如 用透镜聚焦,用棱镜或光栅分光等,故又称此光谱区为光学光谱区 (3)低能辐射区:微波区和射频区。又称波谱区。 能用于光学分析的是中能辐射区,包括紫外、可见光区和红外区。 第二节原子光谱和分子光谱 1原子光谱 原子光谱产生于原子外层电子能级的跃迁。 1.1核外电子的运动状态 原子接到电子的运动状态可以用主量数n、角量子数12、磁量子数m和自 旋量子数s来描述 12光谱项 原子的能量状态需要用、L、S、J四个量子数为参数的光谱项来表征。 为主量子数,L一总轨道角量子数,S一总自旋量子数,J一内量子数 原子能级光谱项用 n2L表示 光谱支项用 nL表示 1.3原子能级图 把原子可能存在的光谱项及能级跃迁用图解的方式表示出来就得到原子能 级图。 谱线波长取决于两能级的能量差,不同能级之间跃迁产生的原子光谱是波长 确定,相互分隔的谱线,所以原子光谱是线状光谱。 4
4 近红外区 中红外区 远红外区 微波区 射频区 0.78~2.5 m 2.5~50 m 50~1000 m 0.1~100 cm 1~100 m 1.7~0.5 0.5~0.025 2.5 10-2 ~1.2 10-4 1.2 10-4 ~1.2 10-7 1.2 10-6 ~1.2 10-9 分子振动能级 分子转动能级 电子自旋能级或核自旋能级 电磁波谱的分区: (1)高能辐射区:包括 射线区和 X 射线区。 (2)中能辐射区:紫外区、可见光区和红外区。 由于对这部分辐射的研究和应用要使用一些共同的光学试验技术,例如, 用透镜聚焦,用棱镜或光栅分光等,故又称此光谱区为光学光谱区 (3)低能辐射区:微波区和射频区。又称波谱区。 能用于光学分析的是中能辐射区,包括紫外、可见光区和红外区。 第二节 原子光谱和分子光谱 1 原子光谱 原子光谱产生于原子外层电子能级的跃迁。 1.1 核外电子的运动状态 原子接到电子的运动状态可以用主量数 n、角量子数l2、磁量子数m和自 旋量子数s来描述。 1.2 光谱项 原子的能量状态需要用 n、L、S、J 四个量子数为参数的光谱项来表征。 n 为主量子数,L-总轨道角量子数,S-总自旋量子数,J-内量子数 原子能级光谱项用 n L 2s+1 表示 光谱支项用 J 2s 1 n L + 表示 1.3 原子能级图 把原子可能存在的光谱项及能级跃迁用图解的方式表示出来就得到原子能 级图。 谱线波长取决于两能级的能量差,不同能级之间跃迁产生的原子光谱是波长 确定,相互分隔的谱线,所以原子光谱是线状光谱
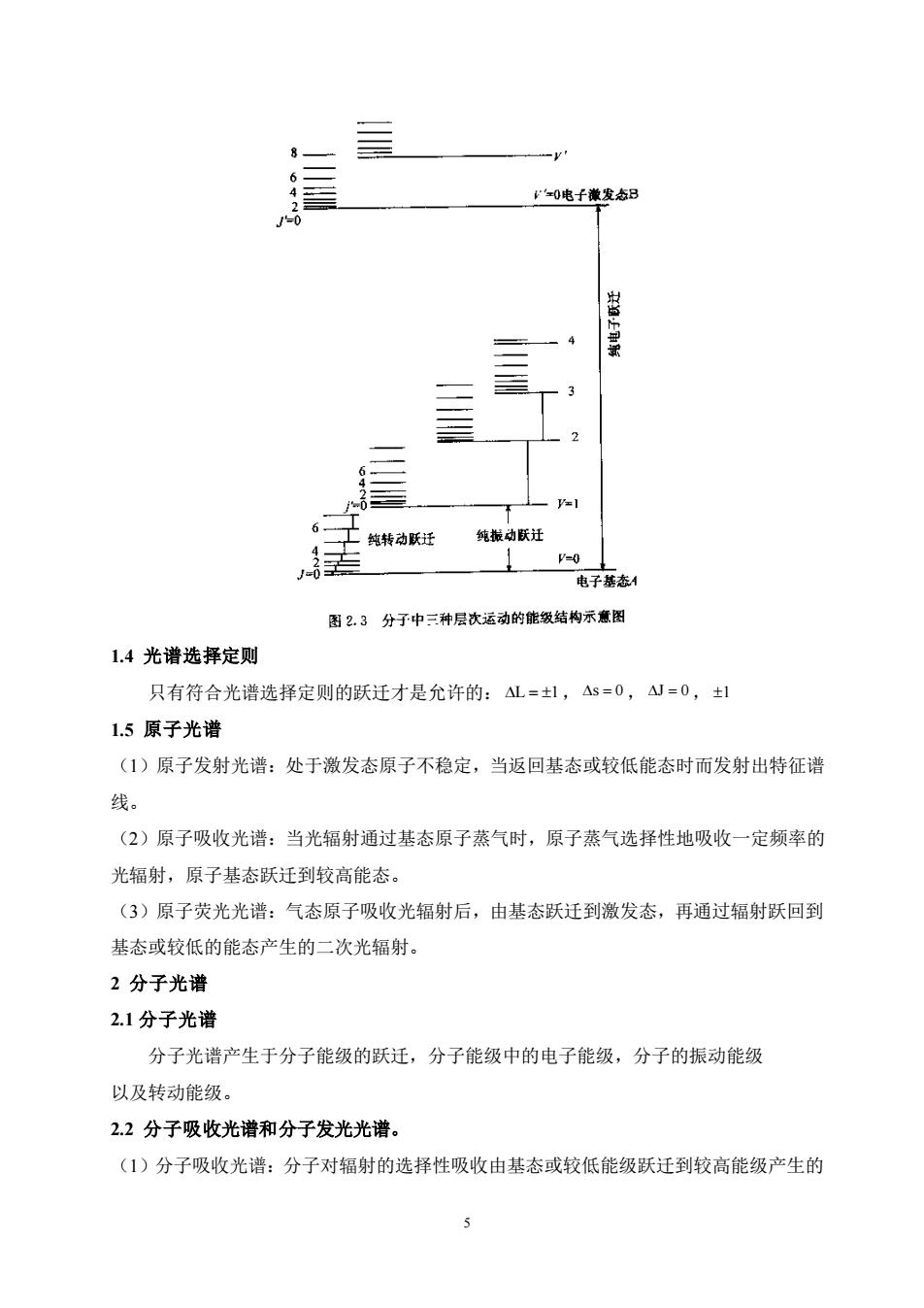
0电子澈发态三 6. 工纯转动联迁 纯拔动联迁 =0 电子落态 图2.3分子中三种层次运动的能级结构示意图 1.4光谱选择定则 只有符合光谱选择定则的跃迁才是允许的:4L=士1,4s=0,山=0,士1 1.5原子光谱 (1)原子发射光谱:处于激发态原子不稳定,当返回基态或较低能态时而发射出特征谱 线。 (2)原子吸收光谱:当光辐射通过基态原子蒸气时,原子蒸气选择性地吸收一定频率的 光辐射,原子基态跃迁到较高能态。 (3)原子荧光光谱:气态原子吸收光辐射后,由基态跃迁到激发态,再通过辐射跃回到 基态或较低的能态产生的二次光辐射。 2分子光谱 2.1分子光谱 分子光谱产生于分子能级的跃迁,分子能级中的电子能级,分子的振动能级 以及转动能级。 2.2分子吸收光谱和分子发光光谱。 (1)分子吸收光谱:分子对辐射的选择性吸收由基态或较低能级跃迁到较高能级产生的 5
5 1.4 光谱选择定则 只有符合光谱选择定则的跃迁才是允许的: L = 1,s = 0 ,J = 0,1 1.5 原子光谱 (1)原子发射光谱:处于激发态原子不稳定,当返回基态或较低能态时而发射出特征谱 线。 (2)原子吸收光谱:当光辐射通过基态原子蒸气时,原子蒸气选择性地吸收一定频率的 光辐射,原子基态跃迁到较高能态。 (3)原子荧光光谱:气态原子吸收光辐射后,由基态跃迁到激发态,再通过辐射跃回到 基态或较低的能态产生的二次光辐射。 2 分子光谱 2.1 分子光谱 分子光谱产生于分子能级的跃迁,分子能级中的电子能级,分子的振动能级 以及转动能级。 2.2 分子吸收光谱和分子发光光谱。 (1)分子吸收光谱:分子对辐射的选择性吸收由基态或较低能级跃迁到较高能级产生的

分子光谱。如紫外一可见吸收光谱,红外吸收光谱。 (2)分子发光光谱 光致发光:荧光、磷光 电致发光 化学发光 (3)拉曼光谱:入射光子与溶液中试样分子间的非弹性碰撞,发生能量交换,产生与入 射光频率不同的散射光。 6
6 分子光谱。如紫外——可见吸收光谱,红外吸收光谱。 (2)分子发光光谱 光致发光:荧光、磷光 电致发光 化学发光 (3)拉曼光谱:入射光子与溶液中试样分子间的非弹性碰撞,发生能量交换,产生与入 射光频率不同的散射光