
第四章酸碱滴定法
第四章 酸 碱 滴 定 法

酸碱滴定是依据酸碱反应来作分析,是 重要的、应用广泛的滴定分析法之一。此 外,酸度是影响溶液中各类化学反应定量 进行的重要因素,因此酸碱平衡的处理不 仅是酸碱滴定的基础,也是其他化学分析 图 所必需的(是研究和处理溶液中各类平衡 的基础)。因此学好这一章是掌握滴定分 晶析法有关原理的关键
▪ 酸碱滴定是依据酸碱反应来作分析,是 重要的、应用广泛的滴定分析法之一。此 外,酸度是影响溶液中各类化学反应定量 进行的重要因素,因此酸碱平衡的处理不 仅是酸碱滴定的基础,也是其他化学分析 所必需的(是研究和处理溶液中各类平衡 的基础)。因此学好这一章是掌握滴定分 析法有关原理的关键

§3.1酸碱溶液中H+1的计算 酸碱反应:酸碱质子理论 1. 酸碱定义:凡能给出质子(H+)的物质 是酸,凡能接受质子的是碱。 2. HB→H++B 酸 质子 碱 HB/B称为共轭酸碱对;HB是B的共轭酸, 圆 B是HB的共轭碱;这种得失质子的反应 称为酸碱半反应
§3.1酸碱溶液中[H+ ]的计算 一.酸碱反应:酸碱质子理论 1. 酸碱定义:凡能给出质子(H+)的物质 是酸,凡能接受质子的是碱。 2. HB H+ + B 酸 质子 碱 HB/B称为共轭酸碱对;HB是B的共轭酸, B是HB的共轭碱;这种得失质子的反应 称为酸碱半反应

4.酸碱反应的实质是质子的转移。酸(HB)要 转化为共轭碱(B),所给出的质子必须转 移到另一种能接受质子的物质上,即只可能 在一个共轭酸碱对的酸和另一个共轭酸碱对 的碱之间发生质子的转移,所以酸碱反应是 两个共轭酸碱对共同作用的结果,即由两个 酸碱半反应结合而成。 5.弱酸弱碱的离解反应、中和反应,水的质子自 递反应、盐的水解,实质上都是酸碱反应, 都是在水溶液中的质子转移反应
4.酸碱反应的实质是质子的转移。酸(HB)要 转化为共轭碱(B),所给出的质子必须转 移到另一种能接受质子的物质上,即只可能 在一个共轭酸碱对的酸和另一个共轭酸碱对 的碱之间发生质子的转移,所以酸碱反应是 两个共轭酸碱对共同作用的结果,即由两个 酸碱半反应结合而成。 5.弱酸弱碱的离解反应、中和反应,水的质子自 递反应、盐的水解,实质上都是酸碱反应, 都是在水溶液中的质子转移反应

2.共轭酸碱对Ka和Kb的关系 ①一元共轭酸碱对Ka和Kb的关系 Ka Kb=Kw (4-2) 或pKa+pKb=pKw
2.共轭酸碱对Ka和Kb的关系 ①一元共轭酸碱对Ka和Kb的关系 Ka Kb=KW (4-2) 或p Ka+p Kb=p KW
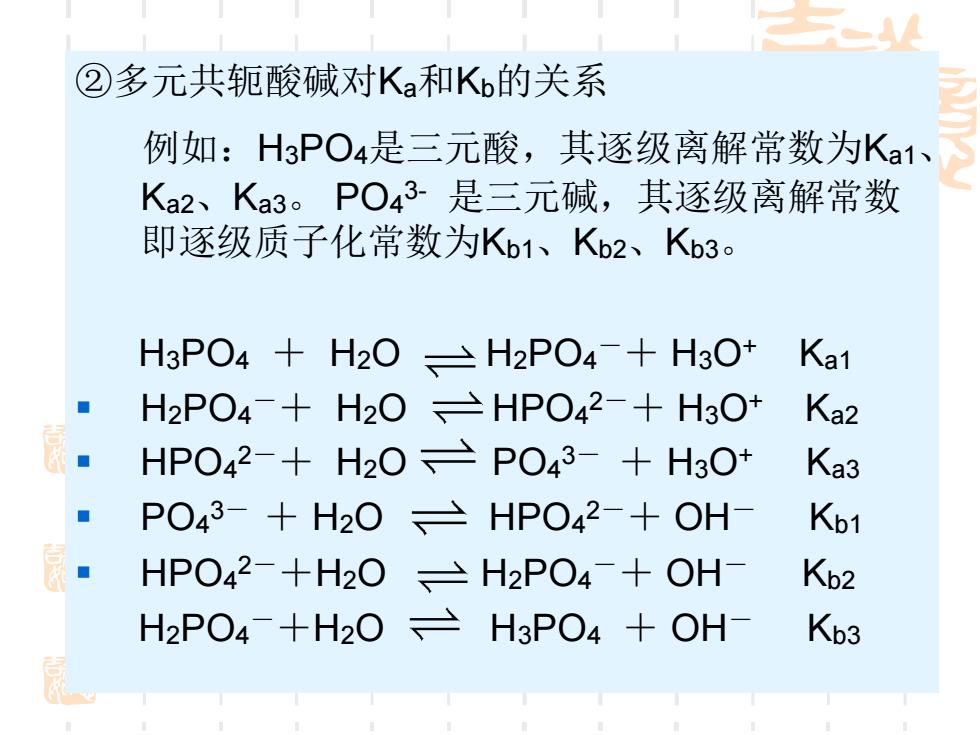
②多元共轭酸碱对Ka和Ko的关系 例如:H3PO4是三元酸,其逐级离解常数为Ka1、 Ka2、Ka3。PO43-是三元碱,其逐级离解常数 即逐级质子化常数为Kb1、K2、Kb3。 HPO4+H20、三H2PO4+H3O+ Ka1 ■ H2PO4-+H20HPO42-+H3O+ Ka2 HPO42-+H20PO43-+H3O+ Ka3 PO43-+H2OHPO42-+OH- Kb1 HPO42-+H2OH2PO4-+OH- Kb2 H2PO4-+H2O三H3PO4+OH Kb3
②多元共轭酸碱对Ka和Kb的关系 例如:H3PO4是三元酸,其逐级离解常数为Ka1、 Ka2、Ka3。 PO4 3- 是三元碱,其逐级离解常数 即逐级质子化常数为Kb1、Kb2、Kb3。 H3PO4 + H2O H2PO4 -+ H3O+ Ka1 ▪ H2PO4 -+ H2O HPO4 2-+ H3O+ Ka2 ▪ HPO4 2-+ H2O PO4 3- + H3O+ Ka3 ▪ PO4 3- + H2O HPO4 2-+ OH- Kb1 ▪ HPO4 2-+H2O H2PO4 -+ OH- Kb2 H2PO4 -+H2O H3PO4 + OH- Kb3

Ka1XKb3=Ka2XKb2=Ka3XKb1 =Kw (3-3) ■pKa1+pkb3=pkw k k2 Kw k a3 吉 由于Ka1>Ka2>Ka3所以Kb>Kb2>Kb3 ■(必须熟练掌握PKa与PKb间的关系)
Ka1×Kb3=Ka2×Kb2=Ka3×Kb1 =KW (3-3) ▪ pKa1+ pkb3= pkw 由于Ka1> Ka2> Ka3 所以 Kb1> Kb2> Kb3 ▪ (必须熟练掌握PKa与PKb间的关系) 3 w b1 a k k k = 2 w b2 a k k k = w b3 a1 k k k =

例:H2C2O4的pKa1=1.25,C2O42-的pKb1 =9.71,求HC2O4的pKa与pKb。 解:HC2O4一的pKa对应pKa2 pKa2=pKw-pKb1=14.00-9.71=4.29 ■HC2O4一的pKb对应,pKb2 pKb2=pKw-pKa1=14.00-1.25=12.75
例: H2C2O4的pKa1=1.25,C2O4 2-的pKb1 =9.71,求HC2O4 -的pKa与pKb。 解:HC2O4 -的pKa 对应 pKa2 ▪ pKa2=pKW-pKb1=14.00-9.71=4.29 ▪ HC2O4 -的pKb 对应 pKb2 ▪ pKb2=pKW-pKa1=14.00-1.25=12.75

酸碱溶液中[H+]的计算 1.计算H+]可采用代数法和图解法。若用代数 法精确求解,便会涉及到解高次方程,这就要借助于计算机(或计算 器)。 2.我们主要介绍代数法,方法从精确的数量关系出发, 根据具体条件分清主次,合理取舍,使其转化为易于计算的简易形式。 o 3.实际上计算[H+]一般要求不太高,况且常 数测定常有百分之几的误差 ·4.同时,一般忽略离子强度的影响,以活 度常数代替浓度常数作计算
酸碱溶液中[H+ ]的计算 ▪ 1. 计算[H+ ]可采用代数法和图解法。若用代数 法精确求解,便会涉及到解高次方程,这就要借助于计算机(或计算 器)。 ▪ 2.我们主要介绍代数法,方法从精确的数量关系出发, 根据具体条件分清主次,合理取舍,使其转化为易于计算的简易形式。 ▪ 3.实际上计算[H+ ]一般要求不太高,况且常 数测定常有百分之几的误差。 ▪ 4.同时,一般忽略离子强度的影响,以活 度常数代替浓度常数作计算

为计算溶液中的[H+]及其它型体的浓度,体系中 含有几个未知量就要引用几个方程式联合求解。这 类方程式包括平衡常数式和物量守恒式。物量守恒 式包括物料平衡式,电荷平衡式和质子平衡式。其 中最简便又常用的是质子条件式。 一.物量守恒式 1.物料平衡式(Mass Balance Equation,MBE) 在一个化学平衡体系中,某一给定物质的总浓 度(分析浓度)等于该物质各型体平衡浓度之和
为计算溶液中的[H+ ]及其它型体的浓度,体系中 含有几个未知量就要引用几个方程式联合求解。这 类方程式包括平衡常数式和物量守恒式。物量守恒 式包括物料平衡式,电荷平衡式和质子平衡式。其 中最简便又常用的是质子条件式。 一.物量守恒式 1.物料平衡式 (Mass Balance Equation,MBE) 在一个化学平衡体系中,某一给定物质的总浓 度(分析浓度)等于该物质各型体平衡浓度之和