
第七章 沉淀浦定 法和重量分析法
第七章 沉淀滴定 法和重量分析法

第一节沉淀滴定法 以生成沉淀反应为基础的滴定分析法。 应用最广的是银量法: Ag++=AgX↓(X=C、Br、I、CN、SCN) Ba2+与S042-,Hg2+与S2-等也能生成沉淀
第一节 沉淀滴定法 以生成沉淀反应为基础的滴定分析法。 应用最广的是银量法: Ag++X- AgX↓ (X-=Cl-、Br-、I -、CN-、SCN- ) ⚫Ba2+与SO4 2-,Hg2+与S 2-等也能生成沉淀

pCI 一、银量法的基本原理 (-lglcrp) 1.滴定曲线 0.1000 M AgNO3滴定 20.00mL0.1000MNaC 加入AgNO3百分数 ①滴定开始前[C]=0.1MpC=1 ②sp前,加入19.98 ml AgN03(-0.1%) 商 0.02×0.1000 [C1]= 20+19.98 =10-43M1 X=0.1pX=4.3] 附喝 思 [Ag"][CI-]=Ksp pAg+pCl=-1gKsp=9.74 .pAg=9.74-4.3=5.44
一、银量法的基本原理 1.滴定曲线 0.1000M AgNO3滴定 20.00mL 0.1000M NaCl ①滴定开始前[Cl- ]=0.1M pCl=1 ②sp前,加入19.98ml AgNO3(-0.1%)

③sp时 [Ag'][CI]=Ksp [CI]2=Ksp pAg-pCI=pKsp-4.87 ④sp后 加入20.02 mL AgN03 简算: [Ag]= 0.02×0.1 1043 唐 20.00+20.02 通 pAg=4.3 阔 pC1=9.74-4.3=5.44
③sp时 ④sp后 加入20.02mL AgNO3 简算:

讨论@:pAg+pC1=pKp9.74 用pC和pAg作纵坐标,两画线在sp时相交 完全对称 pAg pCI 突跃pC14.305.44 或pAg5.444.30 ②影响突跃因素 Cx↑和KspN,突跃越大△pX
讨论①∵ 用pCl和pAg作纵坐标,两曲线在sp时相交, 完全对称 ②影响突跃因素 Cx↑和Ksp↓,突跃越大 △pX
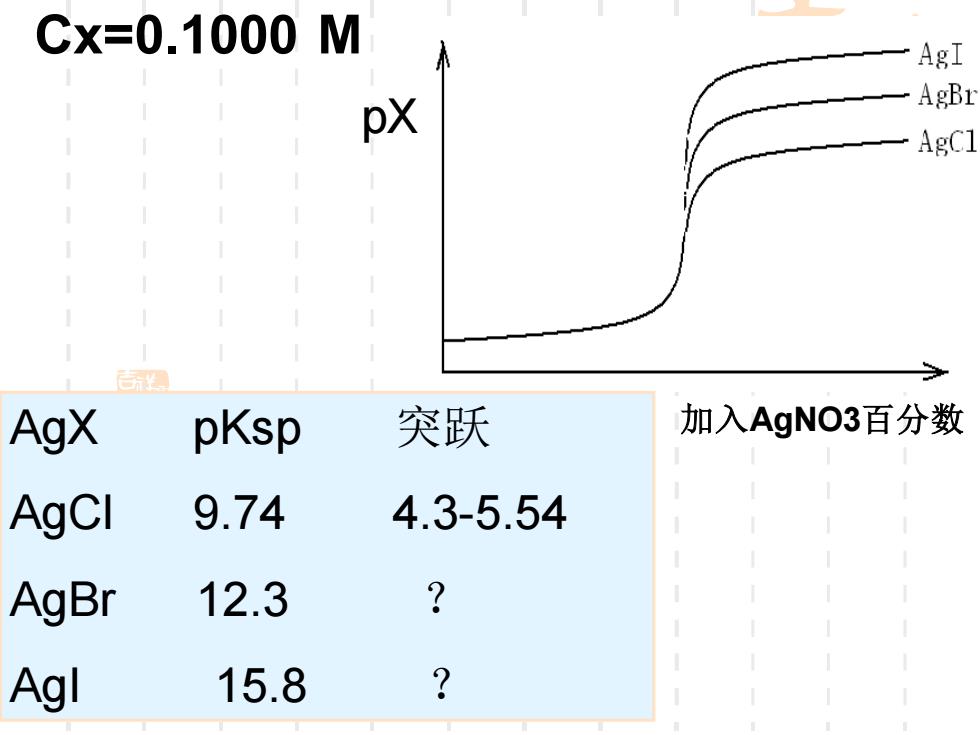
Cx=0.1000M AgI pX AgBr AgCl 国 AgX pKsp 突跃 加入AgNO3百分数 AgCI 9.74 4.3-5.54 AgBr 12.3 Agl 15.8 ?
AgX pKsp 突跃 AgCl 9.74 4.3-5.54 AgBr 12.3 ? AgI 15.8 ? pX Cx=0.1000 M 加入AgNO3百分数

③分步滴定 >理论上一般Ksp1/Kp2≥103可分步 滴定。 先滴定I,后滴定C。 虚 >由于沉淀AgX有吸附作用 和形成混晶,误差大
③分步滴定 ➢理论上一般Ksp1/Ksp2≥103 可分步 滴定。 ➢由于沉淀AgX有吸附作用 和形成混晶,误差大。 先滴定I -,后滴定Cl-

二、银量法指示终点方法(根据指示剂名称命名) (一)铬酸钾指示剂法(Mohr法) 用Ag+滴CI 1.原理: 图 终点前:Ag+CI→AgCI↓(白色) 终点:2Ag*+CrO}→Ag,CrO,↓(砖红色 函
二、银量法指示终点方法 ( 根据指示剂名称命名) (一)铬酸钾指示剂法(Mohr法) 用Ag+滴Cl- 2 4 2 4 2 ( Ag Cl AgCl Ag CrO Ag CrO + − + − + → + → 终点前: (白色) 终点: 砖红色) 1.原理:

KsAgC1=1.8×10-1o s2=1.8×10-10 KapAg2C104=1.2×1012 (2s)2s=1.2×10-12 哪种沉淀溶解度大?
哪种沉淀溶解度大?

2.K2Cr04加入量计算 K2CrO4消耗AgNO3,加的量合适,使误差在C 允许范围内 太大,终点提前,负误差 太小,终点拖后,正误差 设终点体积50mL, 过量0.05%AgNO3,需AgNO3体0×005 积 100 =0.01mL 0.01×0 1=2.0×10M 在溶液中AgNO3浓度:, 50
2. K2CrO4加入量计算 K2CrO4消耗 AgNO3 ,加的量合适,使误差在 允许范围内: 太大,终点提前,负误差 太小,终点拖后,正误差 设终点体积50mL, 过量0.05 %AgNO3,需AgNO3体 积: 在溶液中AgNO3浓度: