
西北农林科技大学 emistre 生物和,司 动物科技学院生物化学课程组 第六节酶的分离苑化 及其活性测定
生物 化学 动物科技学院生物化学课程组 西北农林科技大学 第六节 酶的分离纯化 及其活性测定

第之节醉的少高纯化及共活性测定 分离纯化 目的 目的 2 过程与方法 3 注意事顶 研究酶的理化性质,包括结构与功能、 2 舌性测定 生物学作用、对酶鉴定。纯酶作为生化 试剂及用作药物的酶(纯度高)等
生物 化学 第六节 酶的分离纯化及其活性测定 目的 研究酶的理化性质,包括结构与功能、 生物学作用、对酶鉴定。纯酶作为生化 试剂及用作药物的酶(纯度高)等。 分离纯化 活性测定 目的 过程与方法 注意事项 1 (1) (2) (3)

生物 化学 第之节醉的分膏纯化及共活性测突 分离纯化 过程与方法 目的 过程与方法 抽提 注意事顶 低温下,用水或低盐缓冲液抽提酶,含 活性测定 杂质多。 分离提纯 常用的方法:盐析、有机溶剂沉淀、层 析技术、电泳、超速离心等。 保存 将酶制品浓缩,结晶,以便保存
生物 化学 第六节 酶的分离纯化及其活性测定 过程与方法 选材: 动物、植物或微生物,要求含酶 量高,易分离,经济,取材方便 破碎细胞 分离纯化 活性测定 目的 过程与方法 注意事项 研磨 匀浆 捣碎机 超声波 溶菌酶 化学溶剂 (甲苯) 纤维 素酶 提取液 动物 细菌 植物 抽提 低温下,用水或低盐缓冲液抽提酶,含 杂质多。 分离提纯 常用的方法:盐析、有机溶剂沉淀、层 析技术、电泳、超速离心等。 保存 将酶制品浓缩,结晶,以便保存 1 (1) (2) (3)

第之节醉的分膏纯化及其活性测突 分离纯化 淮意事项 目的 尽量减少酶活性的损失;低温0~5℃,有机 2 过程与方法 溶剂:-15~-20℃;抽提液加入EDTA(络合 注意事项 金属);抽提液加入巯基乙醇(防止-SH氧化 活性测定 使酶失活);不能过度搅拌,以免产生大量泡 沫,使酶变性;测定酶的比活力,使比活力升 高。酶易失活,不可烘干。通常先透析出去小 分子,浓缩,结晶或冷冻干燥制成干粉保存于 冰箱。如果是酶液,与等体积甘油混合,并适 当加入竞争性抑制剂-20℃长期保存
生物 化学 第六节 酶的分离纯化及其活性测定 注意事项 尽量减少酶活性的损失;低温 0~5℃,有机 溶剂:-15~-20℃;抽提液加入EDTA(络合 金属);抽提液加入巯基乙醇(防止-SH氧化, 使酶失活);不能过度搅拌,以免产生大量泡 沫,使酶变性;测定酶的比活力,使比活力升 高。酶易失活,不可烘干。通常先透析出去小 分子,浓缩,结晶或冷冻干燥制成干粉保存于 冰箱。如果是酶液,与等体积甘油混合,并适 当加入竞争性抑制剂-20℃长期保存。 分离纯化 活性测定 目的 过程与方法 注意事项 1 (1) (2) (3)

生物 化学 第之节酵的分高纯化及其活性测定 分离纯化 酶活力 2 活性测定 指酶催化化学反应的能力。其 酶活力 衡量标准是酶促反应的速度。 所以酶活力测定就是酶促反应速 (2 反应初速度 度的测定 3 测定方法 酶促反应的速度:在适宜条件 4 活力单位 实例 下,单位时间内底物的消耗或产物 的生成量
生物 化学 第六节 酶的分离纯化及其活性测定 酶活力: 指酶催化化学反应的能力。其 衡量标准是酶促反应的速度。 所以酶活力测定就是酶促反应速 度的测定 酶促反应的速度:在适宜条件 下,单位时间内底物的消耗或产物 的生成量。 活性测定 分离纯化 酶活力 反应初速度 测定方法 活力单位 实例 1 (1) (2) (3) (4) (5)
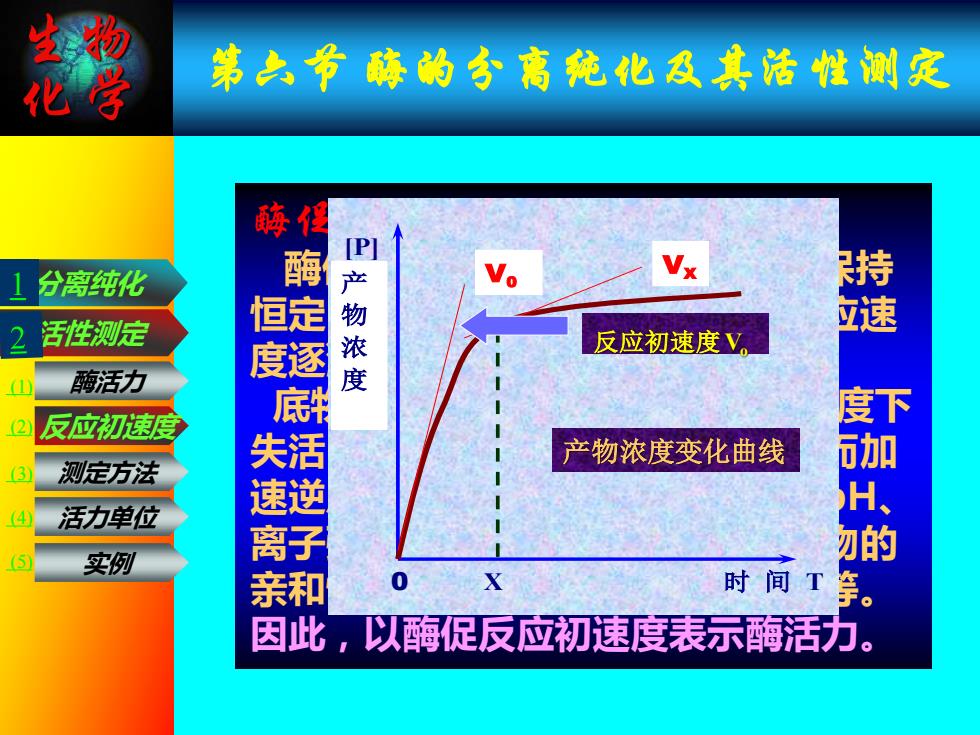
第之节醉的少高纯化及共活性测定 分离纯化 2 活性测定 P产物浓度 撞 反应初速度V 酶活力 2 反应初速度 产物浓度变化曲线 3 测定方法 活力单位 实例 时间 等。 因此 ,以酶促反应初速度表示酶活力
生物 化学 第六节 酶的分离纯化及其活性测定 酶促反应初速度 酶促反应速度在最初一段时间内保持 恒定,随着反应时间的延长,酶反应速 度逐渐下降。 其原因可能是: 底物浓度下降 ;酶在一定pH及温度下 失活;产物对酶的抑制,产物上升而加 速逆反应;反应体系中理化性质(pH、 离子强度)的改变,会影响酶与底物的 亲和性,以及辅助因子的可利用性等。 因此,以酶促反应初速度表示酶活力。 活性测定 分离纯化 酶活力 反应初速度 测定方法 活力单位 实例 [P] 0 X 时 间 T V0 产 VX 物 浓 度 产物浓度变化曲线 反应初速度Vo 1 (1) (2) (3) (4) (5)

生物 化学 第去节酵的分高纯化及其活性测定 测定方法 分离纯化 测定酶活力就是测定一定时间底物的 2 活性测定 消耗量或产物的生成量,主要根据底物 酶活力 和产物的物理化学性质来选择具体的测 2 反应初速度 定方法。通常是测定产物的生成量。 测定方法 常用的方法主要有:比色法,分光光 活力单位 度法,化学滴定法,电化学分析法,比 实例 旋光度,荧光测定,放射同位素法,气 体压测定,比浊法等
生物 化学 第六节 酶的分离纯化及其活性测定 测定方法 测定酶活力就是测定一定时间底物的 消耗量或产物的生成量,主要根据底物 和产物的物理化学性质来选择具体的测 定方法。通常是测定产物的生成量。 常用的方法主要有:比色法,分光光 度法,化学滴定法,电化学分析法,比 旋光度,荧光测定,放射同位素法,气 体压测定,比浊法等。 活性测定 分离纯化 酶活力 反应初速度 测定方法 活力单位 实例 1 (1) (2) (3) (4) (5)

第之节醉的分膏纯化及其活性测定 活力单位 1976年国际生化学会(IUB)酶学委员会规定: 分离纯化 在特定的条件下(温度为25℃,其他条件为最 活性测定 适),每分钟催化1umol底物转化为产物所需的酶 酶活力 量为一个国际单位(IU)。 (2 反应初速度 1979年规定: 在特定的条件下,每钞钟使1mol底物转化为产物 3 测定方法 所需的酶量为1催量(kat)。 活力单位 1IU=16.67×109kat 实例 单位质量酶产品中酶活力称比活力。 umg酶蛋白 u/ml酶蛋白
生物 化学 第六节 酶的分离纯化及其活性测定 活力单位 1976年国际生化学会(IUB)酶学委员会规定: 在特定的条件下(温度为25℃,其他条件为最 适),每分钟催化1mol底物转化为产物所需的酶 量为一个国际单位(IU)。 1979年规定: 在特定的条件下,每钞钟使1mol底物转化为产物 所需的酶量为1催量(kat)。 1 IU=16.67×10-9kat 单位质量酶产品中酶活力称比活力。 u/mg酶蛋白 u/ml酶蛋白 活性测定 分离纯化 酶活力 反应初速度 测定方法 活力单位 实例 1 (1) (2) (3) (4) (5)

生物 化学 第六节醉的分膏纯化及其活性测定 实例 脂肪 脂肪酶 甘油+脂肪酸 分离纯化 首先确定反应条件20℃、pH=7,底物浓度 6g1(过量),加入2mg固体脂肪酶 2 活性测定 第二确定活力单位如每小时催化1克底物 酶活力 lu=1g/h (2 反应初速度 第三测算反应初速度作产物甘油随时间增加 3 测定方法 的曲线,量出反应初速度值,换算为脂肪的消 4 活力单位 耗速度如8g/h 实例 第四换算活力 8g/h 1g/h=8u 第五计算比活 8u/2mg酶蛋白=4u/mg酶蛋白
生物 化学 第六节 酶的分离纯化及其活性测定 实例 首先 确定反应条件 20℃、pH=7,底物浓度 6g/l(过量),加入2mg固体脂肪酶 第二 确定活力单位 如每小时催化1克底物 1u= 1g/h 第三 测算反应初速度 作产物甘油随时间增加 的曲线,量出反应初速度值,换算为脂肪的消 耗速度 如 8g/h 第四 换算活力 8g/h / 1g/h=8u 第五 计算比活 8u/2mg酶蛋白=4u/mg酶蛋白 活性测定 分离纯化 酶活力 反应初速度 测定方法 活力单位 实例 脂肪 脂肪酶 甘油 + 脂肪酸 1 (1) (2) (3) (4) (5)