
概述 应用电化学的基本原理和实验技术,依据物质电化学 性质来测定物质组成及含量的分析方法称为电化学分析或 电分析化学。 简单地说,根据被测物质的电化学性质,选择适当电极组 成电化学电池。再根据该电池反映出来的某种电信号(电 压、电流、电阻、电量等)的强度或强度变化值以确定物 质组成及含量的一类方法
应用电化学的基本原理和实验技术,依据物质电化学 性质来测定物质组成及含量的分析方法称为电化学分析或 电分析化学。 简单地说,根据被测物质的电化学性质,选择适当电极组 成电化学电池。再根据该电池反映出来的某种电信号(电 压、电流、电阻、电量等)的强度或强度变化值以确定物 质组成及含量的一类方法。 概述

概述 依据测定电信号分别命名各种电化学分析方法: ①电位分析法: 测定电压参量 ②电导分析法: 测定电阻参量 ③电解分析法: 测定电量参量 ④库仑分析法: 测定电流-时间参量 ⑤极谱法和伏安:测定电流-电压参量
依据测定电信号分别命名各种电化学分析方法: ①电位分析法: 测定电压参量 ②电导分析法: 测定电阻参量 ③电解分析法: 测定电量参量 ④库仑分析法: 测定电流-时间参量 ⑤极谱法和伏安: 测定电流-电压参量 概述

概述 电位分析法是最重要的电化学分析方法之一,其 中的各种高选择性离子选择性电极、生物膜电极及微 电极的研究一直是分析化学中十分活跃的领域。 电位分析法主要应用于各种试样中的无机离子、 有机电活性物质及溶液的H的测定,也可以用来测定 酸碱的解离常数和配合物的稳定常数。随着各种新型 生物膜电极的出现,对药物、生物试样的分析也日益 增加
电位分析法是最重要的电化学分析方法之一,其 中的各种高选择性离子选择性电极、生物膜电极及微 电极的研究一直是分析化学中十分活跃的领域。 电位分析法主要应用于各种试样中的无机离子、 有机电活性物质及溶液的pH的测定,也可以用来测定 酸碱的解离常数和配合物的稳定常数。随着各种新型 生物膜电极的出现,对药物、生物试样的分析也日益 增加。 概述

第一节电位分析法Potentiometry 电位分析法基本原理 Fundamentals of potentiometry 参比电极 Reference electrodes 指示电极及离子选择电极 Indicator and ion selective electrodes 仪器及电动势测量 Instrumentation and measurement of cell electromotive force (e.m.f)
电位分析法基本原理 Fundamentals of potentiometry 参比电极 Reference electrodes 指示电极及离子选择电极 Indicator and ion selective electrodes 仪器及电动势测量 Instrumentation and measurement of cell electromotive force (e.m.f) 第一节 电位分析法 Potentiometry

引言 1958 电位分析法的实质是通过在零电流条件下测定 两电极间的电位差(即所构成原电池的电动势),进 行分析测定
电位分析法的实质是通过在零电流条件下测定 两电极间的电位差(即所构成原电池的电动势) ,进 行分析测定。 引言

一、化学电池Electrochemical cell 由一对电极、电解质和外电路三部分组成。 原电池(primary cell,Galvanic or voltaic cell)三 自发的将电池内部进行的化学反应所产生的能量转化成 电能的化学电池。 电解池(electrolytic cell): 实现电化学反应的能量由外电源供给的化学电池,将电 能转变为化学能。 溶液中的电流:正、负离子的移动
由一对电极、电解质和外电路三部分组成。 原电池(primary cell ,Galvanic or voltaic cell ): 自发的将电池内部进行的化学反应所产生的能量转化成 电能的化学电池。 电解池(electrolytic cell): 实现电化学反应的能量由外电源供给的化学电池,将电 能转变为化学能。 溶液中的电流:正、负离子的移动。 一、化学电池 Electrochemical cell

电池表达式 (白)电极a溶液(a‖溶液(a,电极b(⊕) 阳极 阴极 (-Zn ZnSO(a)Cuso(a2)Cu (+ 以」表示金属和溶液的两相界面,以‖表示 盐桥。习惯将阳极写在左边,阴极写在右边。 电池电动势:E=p。·p十P液接=P右P左+P液接 当E>O,自发进行电池反应,为原电池; 当E<0非自发进行电池反应,为电解池
电池表达式 (-) 电极a 溶液(a1 ) 溶液(a2 ) 电极b (+) 阳极 E 阴极 (-) Zn│ZnSO4(ɑ1)‖CuSO4(ɑ2)│Cu(+) 以 表示金属和溶液的两相界面,以 表示 盐桥。习惯将阳极写在左边,阴极写在右边。 电池电动势: E = c - a +液接 = 右 - 左+液接 当E>0,自发进行电池反应, 为原电池; 当E<0 非自发进行电池反应, 为电解池

二、电极电位electrode potential 1、电极电位的产生: 金属晶体是由金属离子和自由电子所构成。 将金属M插入含有该金属离子的溶液中时,金属离子有从 金属相进入溶液相的趋势,金属相留下过剩的电子,它们 与进入溶液的金属离子在金属表面形成双电层; 金属离子也有从溶液相进入金属相的趋势,溶液中留下过 剩的阴离子,它们与进入金属相的金属离子在金属表面形 成双电层
二、电极电位 electrode potential 1、电极电位的产生: 金属晶体是由金属离子和自由电子所构成。 将金属M插入含有该金属离子的溶液中时,金属离子有从 金属相进入溶液相的趋势,金属相留下过剩的电子,它们 与进入溶液的金属离子在金属表面形成双电层; 金属离子也有从溶液相进入金属相的趋势,溶液中留下过 剩的阴离子,它们与进入金属相的金属离子在金属表面形 成双电层

电极电位 双电层的形成,使两相界面处出现电位差。当金属离 子进出溶液的速度相等时,金属相与溶液相之间建立 起动态平衡,达到一个稳定的电位差值,叫做相界电 位 电极电位
双电层的形成,使两相界面处出现电位差。当金属离 子进出溶液的速度相等时,金属相与溶液相之间建立 起动态平衡,达到一个稳定的电位差值,叫做相界电 位 —— 电极电位。 电极电位
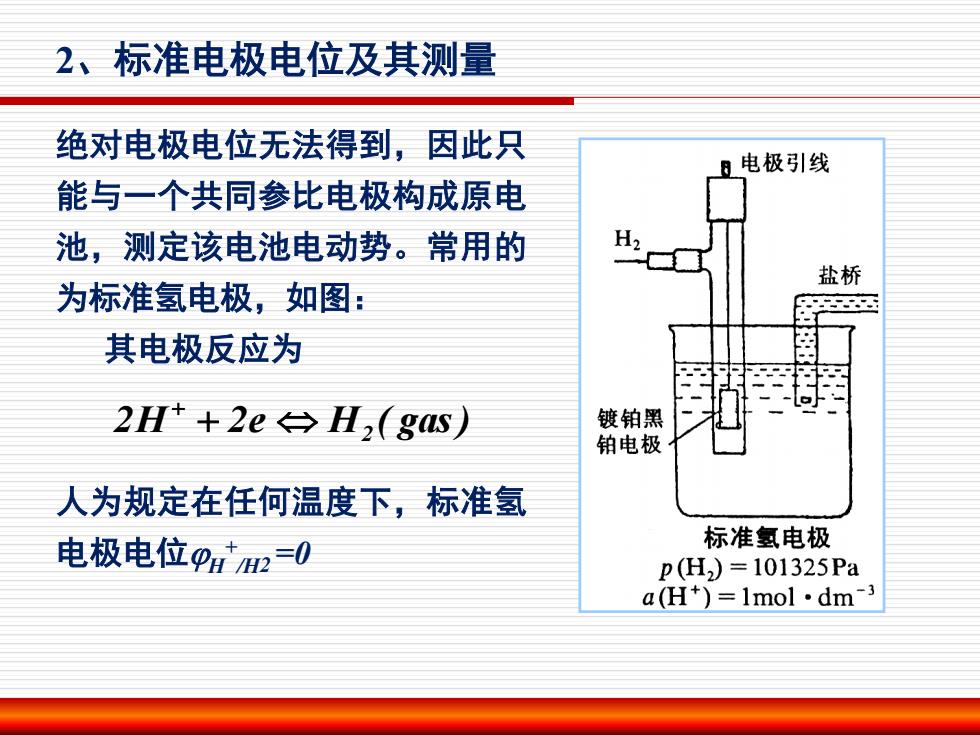
2、标准电极电位及其测量 绝对电极电位无法得到,因此只 日电极引线 能与一个共同参比电极构成原电 池,测定该电池电动势。常用的 H2 盐桥 为标准氢电极,如图: 其电极反应为 2H++2e→H,(gs) 镀铂黑 铂电极 人为规定在任何温度下,标准氢 电极电位pa2=0 标准氢电极 p(H2)=101325Pa a(H+)=1mol·dm-3
绝对电极电位无法得到,因此只 能与一个共同参比电极构成原电 池,测定该电池电动势。常用的 为标准氢电极,如图: 其电极反应为 人为规定在任何温度下,标准氢 电极电位H + /H2 =0 2H 2e H ( gas) 2 2、标准电极电位及其测量