
y of Che 主要内容 国 一、紫外可见吸收光谱 二、光的吸收定律 三、紫外可见分光光度计 四、紫外一可见分光光度法的应用
2 主要内容 一、紫外可见吸收光谱 二、光的吸收定律 三、紫外可见分光光度计 四、紫外-可见分光光度法的应用
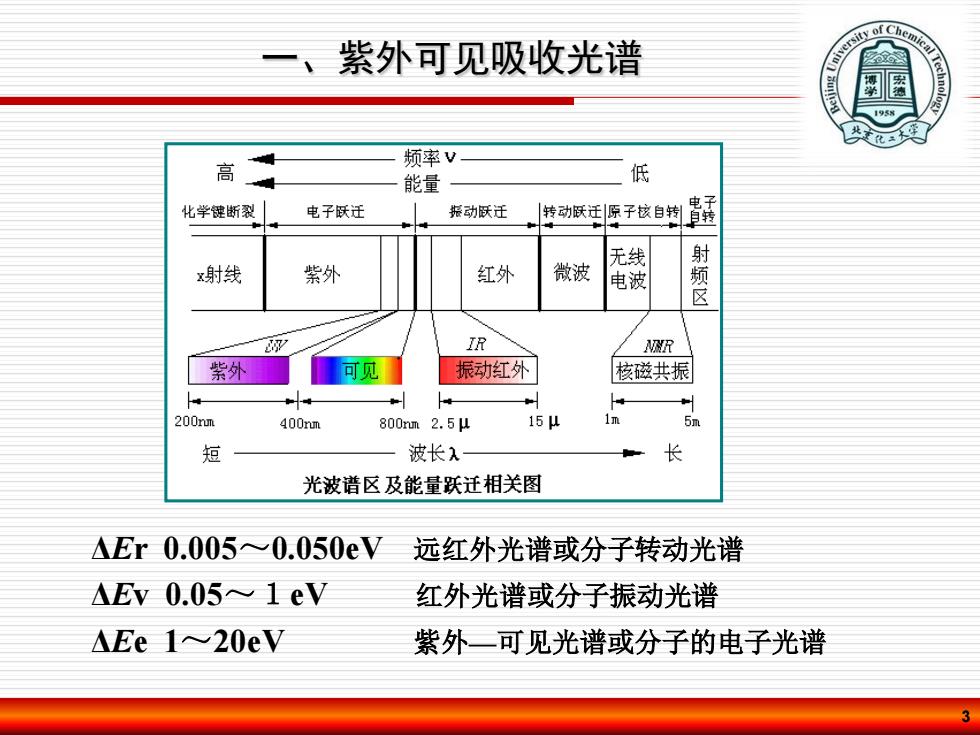
iy of Che 一、紫外可见吸收光谱 1958 高 频率V 能量 低 化学键断裂 电子跃迁 振动跃迁 转动跃廷原子核自钓青玉 无线 x射线 紫外 红外 微波 电波 区 IR R 紫外 可见 振动红外 核磁共振 200nm 400nm 800nm2.5u 15 5m 短 波长 长 光波谱区及能量跃迁相关图 Er0.005≈0.050eV 远红外光谱或分子转动光谱 Ev0.05~1eV 红外光谱或分子振动光谱 AEe 1~20eV 紫外一可见光谱或分子的电子光谱
3 ΔΕr 0.005~0.050eV 远红外光谱或分子转动光谱 ΔΕv 0.05~1eV 红外光谱或分子振动光谱 ΔΕe 1~20eV 紫外—可见光谱或分子的电子光谱 一、紫外可见吸收光谱

y of Che 一、 紫外可见吸收光谱 1.紫外吸收光谱:电子跃迁光谱 吸收光波长范围200~400nm(近紫外区), 可用于结构鉴定和定量分析。 2.可见吸收光谱:电子跃迁光谱 吸收光波长范围400~780nm,主要用于有色 物质的定量分析。 特点 灵敏度较高 选择性较好 准确度较好 通用性强 操作简单 价格低廉
4 一、紫外可见吸收光谱 2. 可见吸收光谱:电子跃迁光谱 吸收光波长范围400780 nm ,主要用于有色 物质的定量分析。 1. 紫外吸收光谱:电子跃迁光谱 吸收光波长范围200400 nm(近紫外区) , 可用于结构鉴定和定量分析。 特点 灵敏度较高 选择性较好 准确度较好 通用性强 操作简单 价格低廉
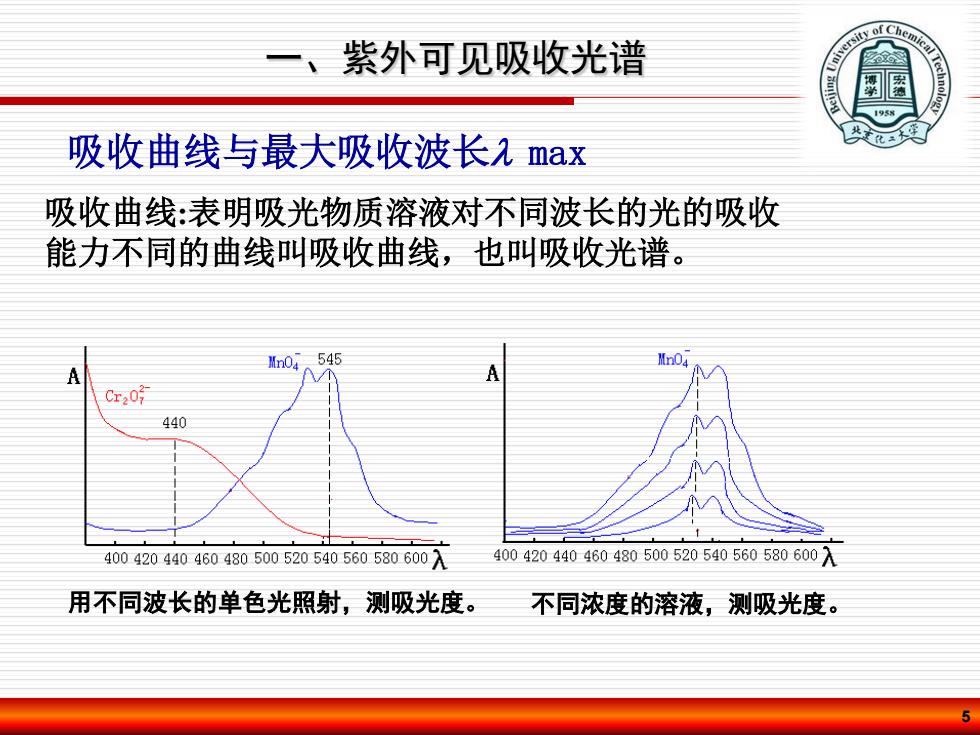
一、紫外可见吸收光谱 1958 吸收曲线与最大吸收波长2max 吸收曲线:表明吸光物质溶液对不同波长的光的吸收 能力不同的曲线叫吸收曲线,也叫吸收光谱。 Mn04.545 A/N Cra0 440 400420440460480500520540560580600入 400420440460480500520540560580600入 用不同波长的单色光照射,测吸光度。不同浓度的溶液,测吸光度
5 吸收曲线与最大吸收波长 max 用不同波长的单色光照射,测吸光度。 不同浓度的溶液,测吸光度。 一、紫外可见吸收光谱 吸收曲线:表明吸光物质溶液对不同波长的光的吸收 能力不同的曲线叫吸收曲线,也叫吸收光谱

一、 紫外可见吸收光谱 1.吸收光谱的波长分布是由产生谱带的跃迁能级 间的能量差所决定,反映了分子内部能级分布状 况,是物质定性的依据; 2.同一种物质对不同波长光的吸光度不同。吸光 度最大处对应的波长称为最大吸收波长孔max; 3.不同浓度的同一种物质,其吸收曲线形状相似 飞不变。而对于不同物质,它们的吸收曲线形 状和2ma则不同; 4.吸收谱带的强度与该物质分子吸收的光子数成 正比,定量分析的依据
6 2. 同一种物质对不同波长光的吸光度不同。吸光 度最大处对应的波长称为最大吸收波长max ; 3. 不同浓度的同一种物质,其吸收曲线形状相似 max不变。而对于不同物质,它们的吸收曲线形 状和 max则不同; 1. 吸收光谱的波长分布是由产生谱带的跃迁能级 间的能量差所决定,反映了分子内部能级分布状 况,是物质定性的依据; 4. 吸收谱带的强度与该物质分子吸收的光子数成 正比,定量分析的依据。 一、紫外可见吸收光谱

y of Che 一、紫外可见吸收光谱 国 1958 (一)有机化合物的紫外一可见吸收光谱 分子中外层价电子跃迁的结果(三种):0电子、 π电子、n电子. 可反键 分子轨道理论:一个成键轨道必 π*轨道 定有一个相应的反键轨道。通常 外层电子均处于分子轨道的基态, 菱 n非键轨道 π成键 即成键轨道或非键轨道上。 σ了轨道 电子能级跃迁示意图 当外层电子吸收紫外或可见辐射后,就从基态向激发态(反键 轨道)跃迁。主要有四种跃迁,所需能量△E大小顺序为: n→T*〈T→T*〈→0*〈0→0*
7 (一)有机化合物的紫外—可见吸收光谱 分子中外层价电子跃迁的结果(三种):σ 电子、 π 电子、n电子. 分子轨道理论:一个成键轨道必 定有一个相应的反键轨道。通常 外层电子均处于分子轨道的基态, 即成键轨道或非键轨道上。 当外层电子吸收紫外或可见辐射后,就从基态向激发态(反键 轨道)跃迁。主要有四种跃迁,所需能量Δ Ε 大小顺序为: n→π * < π →π * < n→σ * < σ →σ * 一、紫外可见吸收光谱

y of Che 1.σ)6*跃迁 国 Q能量很大 ●吸收光谱在真空紫外区 多为饱和烃 甲烷 125 nm 乙烷 135nm
8 能量很大 吸收光谱在真空紫外区 多为饱和烃 甲烷 125 nm 乙烷 135 nm 1. *跃迁
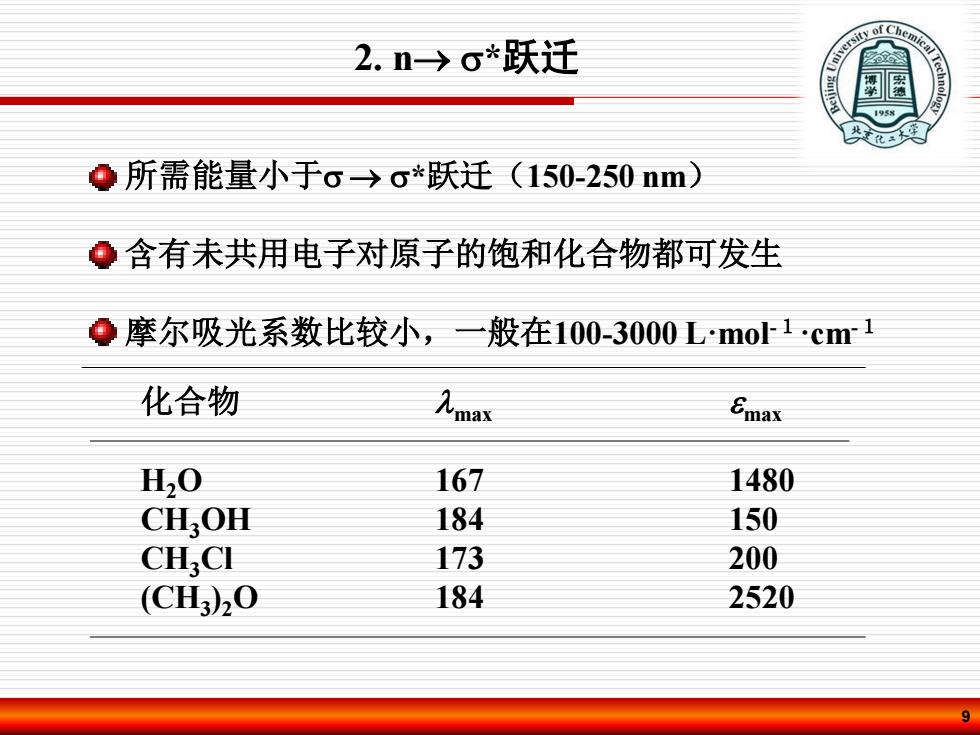
y of Chem 2.n→o*跃迁 1958 ●所需能量小于。→o*跃迁(150-250nm) ●含有未共用电子对原子的饱和化合物都可发生 Q摩尔吸光系数比较小,一般在100-3000Lmo1·cm1 化合物 九ma Emax H2O 167 1480 CH.OH 184 150 CH.CI 173 200 (CH)20 184 2520
9 所需能量小于 *跃迁(150-250 nm) 含有未共用电子对原子的饱和化合物都可发生 摩尔吸光系数比较小,一般在100-3000 L·mol-1·cm-1 化合物 max max H2O 167 1480 CH3OH 184 150 CH3Cl 173 200 (CH3 )2O 184 2520 2. n *跃迁

y of Che 3.元→元*和n→元*跃迁 国☒ 元→元*和n→元*跃迁能量低(○200nm) ●含有不饱和键的有机分子易发生这类跃迁 C=C;- C=C-;-N=NC=0 ●有机化合物的紫外-可见吸收光谱分析多以这两类 跃迁为基础 ●元元*比n→元*跃迁几率大100-1000倍 元→π*跃迁吸收强,£~104 n→元*跃迁吸收弱,<500 10
10 * 和 n * 跃迁能量低(>200 nm) 含有不饱和键的有机分子易发生这类跃迁 C=C; C=C ; N=N ; C=O 有机化合物的紫外-可见吸收光谱分析多以这两类 跃迁为基础 * 比 n * 跃迁几率大 100-1000 倍 *跃迁吸收强, ~ 104 n * 跃迁吸收弱, 500 3. * 和 n * 跃迁

紫外光谱中常用的术语 国 1958 生色团:分子中含有非键或π键的电子体系,能吸 收外来辐射时并引起-元*和元-元*跃迁,可产生此 类跃迁或吸收的结构单元,称为生色团。 Emax 生色团 入max(mm) (I/moL.cm) 跃迁类型 C=C 175 8000 元卡元* c=C 190 9000 π→π* 280 20 n→元π* >C=0 190 2000 n◆G* 160 π中π* -COOH 204 41 n→π* COOR 205 50 n→π* 500 10 n◆元* C=S 240 9000 N=N- 340 10 n→π* 240 n+π*
11 紫外光谱中常用的术语 生色团:分子中含有非键或键的电子体系,能吸 收外来辐射时并引起n- *和 - *跃迁,可产生此 类跃迁或吸收的结构单元,称为生色团。 生色团 max(nm) max (l/moL.cm) 跃迁类型 175 8000 * 190 9000 * 280 190 160 20 2000 n * n * * 204 41 n * 205 50 n * 500 240 10 9000 n * 340 240 10 n * n * C C C C C O COOH COOR C S N N