
实验1药物一般杂质检查 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 实验 1 药物一般杂质检查

Experimental purposes and requirements >1.通过对葡萄糖分析,了解药物的一般杂质检查 项目和意义。 >2.掌握葡萄糖分析中氯化物、硫酸盐、铁盐和重 金属限度检查的原理和方法。 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Experimental purposes and requirements 1. 通过对葡萄糖分析,了解药物的一般杂质检查 项目和意义。 2. 掌握葡萄糖分析中氯化物、硫酸盐、铁盐和重 金属限度检查的原理和方法

Experimental Principle 1.氯化物的检查 药物 CI+AgNO3- NO3,AgC1白色浑浊 对照 NaCl (c,V)+AgNO3 HNO3,AgCI白色浑浊 条件: 硝酸酸性条件(稀硝酸10mL) 反应试剂: 硝酸银试液1.0mL 杂质对照: 氯化钠溶液(10gC/mL) 定容体积: 50mL 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Experimental Principle 1.氯化物的检查 药物 对照 Cl - + AgNO3 HNO3 AgCl 白色浑浊 NaCl(c,V)+ AgNO3 HNO3 AgCl 白色浑浊 条件: 硝酸酸性条件(稀硝酸10mL) 反应试剂: 硝酸银试液 1.0 mL 杂质对照: 氯化钠溶液( 10 µg Cl- /mL) 定容体积: 50mL

Procedures and methods L.氯化物(Chloride)的检查 >样品:葡萄糖0.60g >标准:标准氯化钠溶液6.0mL(10gC/mL) 蒸馏水 稀硝酸 蒸馏水 硝酸银试液。 蒸馏水 溶解为25mL 10 mL 使成约40mL 1.0mL 使成50mL 摇匀,暗处放置5分钟,置黑色背景下,自上而下观察比色, 记录实验结果。 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Procedures and methods 1. 氯化物(Chloride)的检查 样品:葡萄糖 0.60 g 标准:标准氯化钠溶液 6.0 mL ( 10 µg Cl- /mL) 蒸馏水 溶解为25 mL 稀硝酸 10 mL 使成50 mL 硝酸银试液 1.0 mL 蒸馏水 使成约40 mL 蒸馏水 摇匀,暗处放置5分钟,置黑色背景下,自上而下观察比色, 记录实验结果

Experimental Principle 2.硫酸盐的检查 药物 SO2-+BaCl HCI BaSO4白色浑浊 对照 HCI K2SO4 (c,V)+BaCl BaSO4白色浑浊 条件: 盐酸溶液(稀盐酸2mL) 反应试剂: 25%氯化钡溶液5mL 杂质对照: 疏酸钾溶液(100μgS042mL) 定容体积: 50mL 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Experimental Principle 2.硫酸盐的检查 药物 对照 条件: 盐酸溶液(稀盐酸2mL) 反应试剂: 25%氯化钡溶液 5 mL 杂质对照: 硫酸钾溶液( 100 µg SO4 2- /mL ) 定容体积: 50mL K2 SO4(c,V) + BaCl 2 HCl BaSO4 白色浑浊 SO4 2- + BaCl 2 HCl BaSO4 白色浑浊

Procedures and methods 2.硫酸盐的检查 >样品:葡萄糖2.0g >标准:标准硫酸钾溶液(100ugS042mL)2.0mL 蒸馏水 稀盐酸 25%氯化钡溶液 蒸馏水 溶解成40mL 2 mL 5 mL 使成50mL 摇匀,暗处放置10分钟,置黑色背景下,自上而下观察比色, 记录实验结果。 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Procedures and methods 样品:葡萄糖 2.0g 标准:标准硫酸钾溶液( 100 µg SO4 2- /mL) 2.0 mL 蒸馏水 溶解成40mL 稀盐酸 2 mL 使成50 mL 摇匀,暗处放置10分钟,置黑色背景下,自上而下观察比色, 记录实验结果。 2. 硫酸盐的检查 25%氯化钡溶液 5 mL 蒸馏水

Experimental Principle 3.铁盐的检查 药物 Fer+6SCv浓酸一→Fe(SCN↓ 对照 FeNH(SOh(c,V)+6SCN 浓硝酸 一|Fe(SCN 条件: 浓硝酸(3滴) 反应试剂: 30%硫氰酸铵溶液3mL 杂质对照: 标准铁溶液(10ugFe3+/mL) 定容体积: 50mL 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Experimental Principle 3.铁盐的检查 药物 对照 条件: 浓硝酸(3滴) 反应试剂: 30%硫氰酸铵溶液 3 mL 杂质对照: 标准铁溶液( 10 µg Fe3+/mL ) 定容体积: 50mL Fe 3+ + 6SCN - 浓硝酸 Fe(SCN)6 3- FeNH4(SO4 )2(c,V) + 6SCN - 浓硝酸 Fe(SCN)6 3-

Procedures and methods 3.铁盐的检查 >样品:葡萄糖2.0g >标准:标准铁溶液2.0mL(10gFe3+/mL) 蒸馏水 浓硝酸 煮沸 蒸馏水 20mL溶解 3滴 5分钟,放冷 使至约45mL 疏氰酸铵溶液(30→100) 蒸馏水 摇匀,置白色背景下,自上而 3mL 至50mL 下观察比色,记录实验结果。 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Procedures and methods 样品:葡萄糖 2.0 g 标准:标准铁溶液 2.0 mL( 10 µg Fe3+/mL) 蒸馏水 20 mL溶解 浓硝酸 3 滴 使至约45 mL 3. 铁盐的检查 硫氰酸铵溶液(30 100) 3mL 煮沸 5分钟,放冷 蒸馏水 至50 mL 蒸馏水 摇匀,置白色背景下,自上而 下观察比色,记录实验结果

Experimental Principle 4.重金属的检查 药物 Pb2++CH3CSNH2(疏代乙酰胺) 醋酸盐缓冲液PbS} 对照 bNO3(c,V入+CH3CSNH2(硫代乙酰胺) 醋酸盐缓冲液 PbS Pb2 PbNO3(c,yy+CH3CSNH(硫代乙酰胺 、 醋酸盐缓冲液 PbS 条件: pH3.5醋酸盐缓冲液(2mL) 反应试剂: 硫代乙酰胺试液2mL 杂质对照: 硝酸铅溶液(10gPb2+/mL) 定容体积: 25+2mL 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Experimental Principle 药物 对照 条件: pH3.5 醋酸盐缓冲液(2mL) 反应试剂: 硫代乙酰胺试液 2 mL 杂质对照: 硝酸铅溶液( 10 µg Pb2+/mL ) 定容体积: 25+2mL 4.重金属的检查 Pb 2+ + CH3CSNH2(硫代乙酰胺) 醋酸盐缓冲液 PbS PbNO3(c,V) + CH3CSNH2(硫代乙酰胺) 醋酸盐缓冲液 PbS PbNO3(c,V) + CH3CSNH2(硫代乙酰胺) 醋酸盐缓冲液 PbS Pb 2+ +
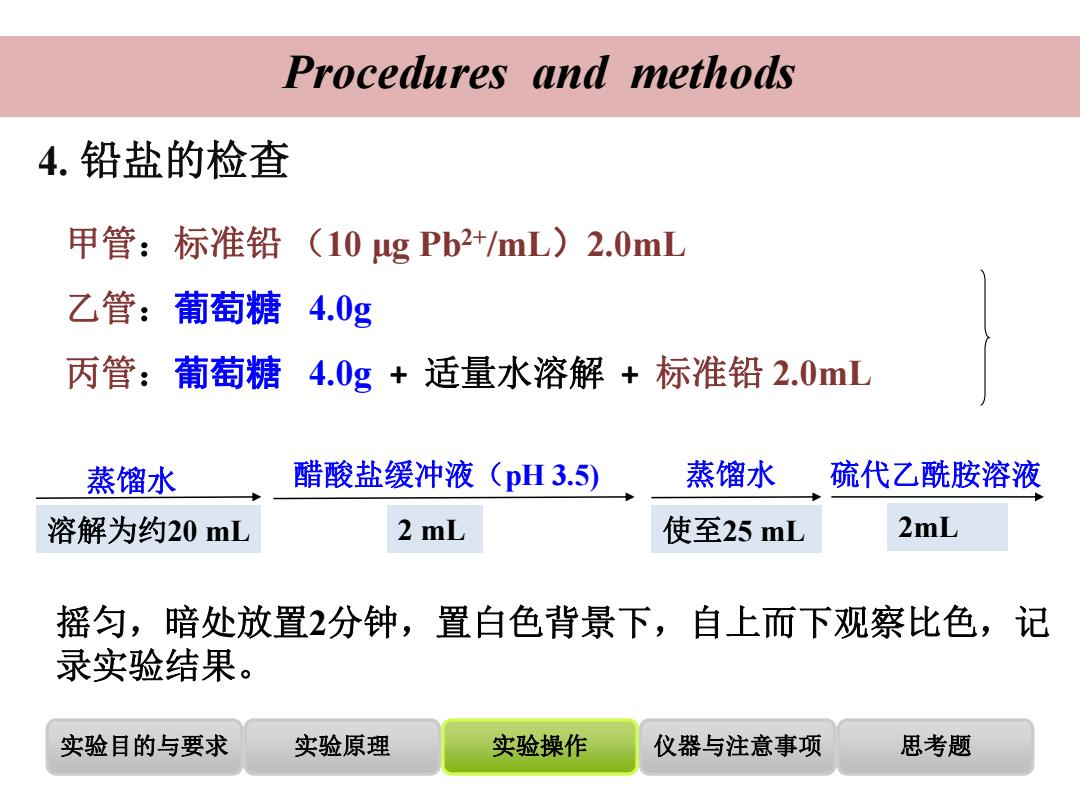
Procedures and methods 4.铅盐的检查 甲管:标准铅(10gPb2+/mL)2.0mL 乙管:葡萄糖4.0g 丙管:葡萄糖4.0g+适量水溶解+标准铅2.0mL 蒸馏水 醋酸盐缓冲液(pH3.5) 蒸馏水 硫代乙酰胺溶液 溶解为约20mL 2 mL 使至25mL 2mL 摇匀,暗处放置2分钟,置白色背景下,自上而下观察比色,记 录实验结果。 实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题
实验目的与要求 实验原理 实验操作 仪器与注意事项 思考题 Procedures and methods 蒸馏水 溶解为约20 mL 醋酸盐缓冲液(pH 3.5) 2 mL 2mL 摇匀,暗处放置2分钟,置白色背景下,自上而下观察比色,记 录实验结果。 4. 铅盐的检查 蒸馏水 使至25 mL 硫代乙酰胺溶液 甲管:标准铅 (10 µg Pb2+/mL)2.0mL 乙管:葡萄糖 4.0g 丙管:葡萄糖 4.0g + 适量水溶解 + 标准铅 2.0mL