
回川裳掌大学 生命科學婆院 生化与分子生物学系 Sichuan Agricultural University College of Life Science 基础生物化学实验 实验五 SDS-聚丙烯酰胺凝胶电泳法(SDS-PAGE) 测定蛋白质的相对分子质量
PPT模板下载:www.1ppt.com/moban/ 行业PPT模板:www.1ppt.com/hangye/ 节日PPT模板:www.1ppt.com/jieri/ PPT素材下载:www.1ppt.com/sucai/ PPT背景图片:www.1ppt.com/beijing/ PPT图表下载:www.1ppt.com/tubiao/ 优秀PPT下载:www.1ppt.com/xiazai/ PPT教程: www.1ppt.com/powerpoint/ Word教程: www.1ppt.com/word/ Excel教程:www.1ppt.com/excel/ 资料下载:www.1ppt.com/ziliao/ PPT课件下载:www.1ppt.com/kejian/ 范文下载:www.1ppt.com/fanwen/ 试卷下载:www.1ppt.com/shiti/ 教案下载:www.1ppt.com/jiaoan/ PPT论坛:www.1ppt.cn 实验五 SDS-聚丙烯酰胺凝胶电泳法(SDS-PAGE) 测定蛋白质的相对分子质量 基础生物化学实验 生化与分子生物学系
目录/Contents 回川黑掌大学 01 实验目的 实验原理 03 实验药品、仪器 04 实验操作步骤 05 结果分析 06 注意事项
目录/Contents 01 实验目的 02 实验原理 03 实验药品、仪器 04 实验操作步骤 05 结果分析 06 注意事项

>1.实验目的 ⑩明回川裳耄大学 Sichuan Agricultural Universit ●学习SDS聚丙烯酰胺凝胶电泳测定分子量的原理 ● 掌握垂直板电泳的操作方法 。学习考马斯亮蓝显色操作技术 了解标准曲线法测定蛋白质分子的方法
1.实验目的 l 学习SDS-聚丙烯酰胺凝胶电泳测定分子量的原理 l 掌握垂直板电泳的操作方法 l 学习考马斯亮蓝显色操作技术 l 了解标准曲线法测定蛋白质分子的方法

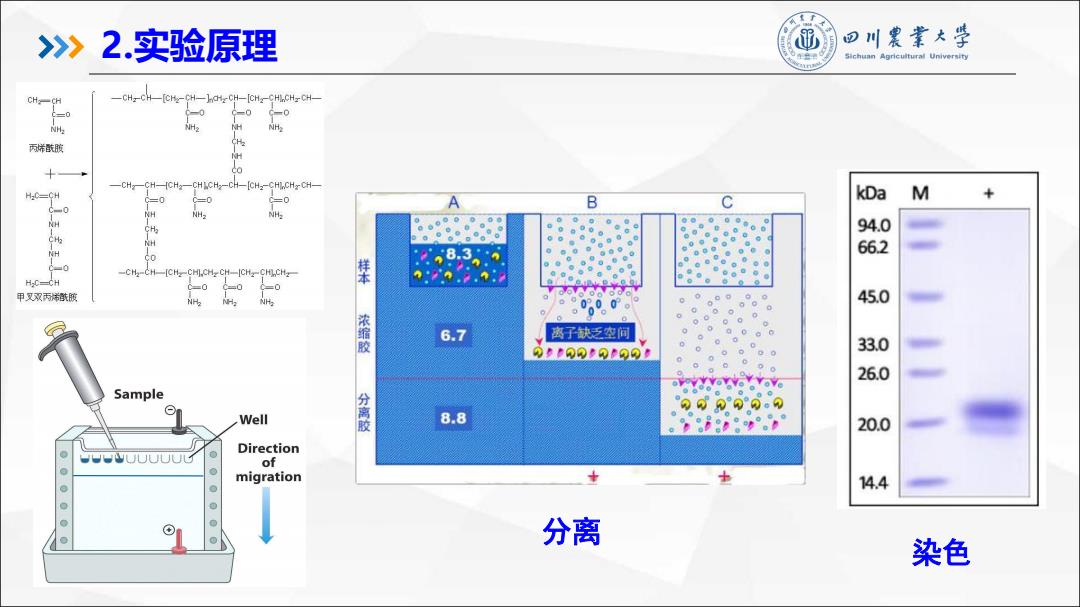
》2.实验原理 ⑩回川震業大学 Sichuan Agricuttu时aUn时w◆rt ·SDS(阴离子去污剂)可 以变性蛋白质,且高密度 地与蛋白质结合,从而降 低或消除各种蛋白质分子 SDS 之间天然的电荷差异。 SDS-蛋白质复合物带有 负电荷,具有均一的电荷 天然蛋白质 变性蛋白质 密度,以及相同的荷质比
l SDS(阴离子去污剂)可 以变性蛋白质,且高密度 地与蛋白质结合,从而降 低或消除各种蛋白质分子 之间天然的电荷差异。 SDS-蛋白质复合物带有 负电荷,具有均一的电荷 密度,以及相同的荷质比。 2.实验原理 天然蛋白质 变性蛋白质

》2.实验原理 ⑩D川袭素大学 在聚丙烯酰胺凝胶系统中加入SDS,能破坏蛋白质分子间的非共 价键,在强还原剂如巯基乙醇共用时,可打开蛋白质分子内的二硫键, SDS以其疏水基和蛋白质的疏水区相结合,形成牢固的带负电荷的蛋 白质-SDS复合物。 蛋白质分子的电泳迁移率则主要取决于它的分子质量,而与所带 电荷和形状无关。该方法主要用于测定蛋白质分子中各亚基的分子量
2.实验原理 在聚丙烯酰胺凝胶系统中加入SDS,能破坏蛋白质分子间的非共 价键,在强还原剂如巯基乙醇共用时,可打开蛋白质分子内的二硫键, SDS以其疏水基和蛋白质的疏水区相结合,形成牢固的带负电荷的蛋 白质-SDS 复合物。 蛋白质分子的电泳迁移率则主要取决于它的分子质量,而与所带 电荷和形状无关。该方法主要用于测定蛋白质分子中各亚基的分子量
>》2.实验原理 ⑩崩回川袭業大学 Sichuan Agricultural Universit -CH:-cH-[CH2-CH-]d+zCH-[CHz-CHlCH-CH- -0 NH. H H -CHz-CH-ICHz-CHLCHz-cH-[CHz-CHLCHzCH- kDa M 94.0 662 co -CH-CH-ICHCHI.CH-CH-ICH-CHCH 样本 6888 甲叉双丙猷腋 45.0 6.2 离子缺乏空间、 月000998 33.0 t6ooo0oo 26.0 Sample Well 分离胶 8808w°。 20.0 Direction of migration 14.4 分离 染色
2.实验原理 染色 分离
》2.实验原理 ⑩D川震掌大学 ●SDS-PAGE时,当蛋白质相对分子质量在11700~ Equstion y=a+b'x Ad1.R-squ098491 Value Stendard e 200000时,电泳迁移率与相对分子质量的对数呈直 50 ·兔碰酸化前B -Intercept 50935 0.03341 Slope 1143005321 48 牛血清白蛋白 线关系,符合以下方程式: 兔肌动蛋白 。牛秩酸酐酶 是胰蛋白两抑制剂 IgMw =bmg +K 42 ,鸡蛋清溶菌酶 0.0 02 0.4 05 0.8 式中,Mv为蛋白质相对分子质量;b为斜率;m为电泳 相对迁移率 相对迁移率;K为截距。在一定条件下,K和b均为常数
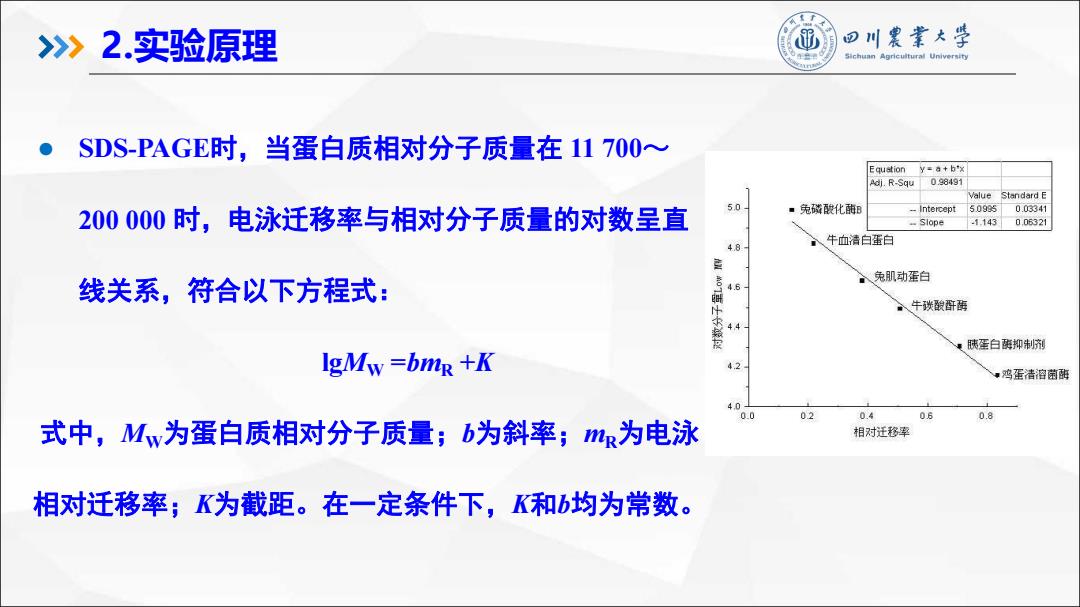
l SDS-PAGE时,当蛋白质相对分子质量在 11 700~ 200 000 时,电泳迁移率与相对分子质量的对数呈直 线关系,符合以下方程式: lgMW =bmR +K 式中,MW为蛋白质相对分子质量;b为斜率;mR为电泳 相对迁移率;K为截距。在一定条件下,K和b均为常数。 2.实验原理

>》3.实验药品、仪器 ⑩D川袭素大学 ●(1)实验材料为未知分子量蛋白样品。 (2)分离胶缓冲液(Tris-HCl,pH=8.8):称取18.17 g Tris,0.4gSDS,溶 于双蒸水,用3mol/LHCl调至pH=8.8,用双蒸水定容至100mL,其中Tris 为1.5mol/L,SDS为0.4%,4C存放。 (3)浓缩胶缓冲液(Tris-HCl,pH-6.8):称取Tris6.06g,0.4gSDS,溶 于双蒸水,用3mo/LHCI调至pH=6.8,用双蒸水定容至100mL,其中Tis 为0.5mol/L,SDS为0.4%,4C存放
l (1)实验材料为未知分子量蛋白样品。 l (2)分离胶缓冲液(Tris-HCl,pH= 8.8):称取 18.17 g Tris, 0.4 g SDS,溶 于双蒸水,用3 mol/L HCl 调至 pH =8.8,用双蒸水定容至 100 mL,其中 Tris 为 1.5 mol/L,SDS 为 0.4%,4℃存放。 l (3)浓缩胶缓冲液(Tris-HCl,pH=6.8):称取 Tris 6.06 g,0.4 g SDS,溶 于双蒸水,用3 mol/L HCl 调至 pH=6.8,用双蒸水定容至 100 mL,其中 Tris 为 0.5 mol/L,SDS 为 0.4%,4℃存放。 3.实验药品、仪器

>》3.实验药品、仪器 明回川果素大学 ●(4)30%丙烯酰胺N,N'-亚甲基双丙烯酰胺(Acr/Bis):29.2gAcr、0.8g Bis,用双蒸水溶解,并定容至100L,装入棕色瓶备用,4C保存。 ●(5)10%过硫酸铵(AP,WN):称取过硫酸铵NH)2S20g1g,溶于10mL 双蒸水中,临用时配制。 )(6)2倍上样缓冲液(Tris-HCl,pH=8.0):含0.5mol/LTris-HCl(pH6.8) 2mL,甘油2mL,20%SDS(WW)2mL,0.1%溴酚蓝0.5mL,2-β-巯基 乙醇1.0mL,双蒸水2.5mL(注:调完pH后再加疏基乙醇)
l (4)30%丙烯酰胺/N,N′-亚甲基双丙烯酰胺(Acr/Bis):29.2 g Acr、0.8 g Bis,用双蒸水溶解,并定容至 100 mL,装入棕色瓶备用,4℃保存。 l (5)10%过硫酸铵(AP,W/V):称取过硫酸铵(NH4)2S2O8 1 g,溶于 10 mL 双蒸水中,临用时配制。 l (6)2 倍上样缓冲液(Tris-HCl,pH= 8.0):含 0.5 mol/L Tris-HCl(pH 6.8) 2 mL,甘油 2 mL,20% SDS (W/V)2 mL,0.1% 溴酚蓝 0.5 mL,2-β-巯基 乙醇 1.0 mL,双蒸水 2.5 mL(注:调完pH后再加巯基乙醇)。 3.实验药品、仪器

>3.实验药品、仪器 ⑩D川震掌大学 Sichuan Agricuttu时aUn时w◆rt ●(7)电极缓冲液(Tis-甘氨酸,pH8.3):称取3.03 g Tris,14.41g甘氨酸, 1.0gSDS,溶于双蒸水,用HCl调pH至8.3(若准确称量则无需再调pH), 定容至1000mL。 (8)染色液:45%甲醇,10%乙酸,0.25%考马斯亮蓝R-250。 (9)脱色液:①酸-甲醇-水脱色液:25%甲醇,10%乙酸。②7%(VV) 乙酸脱色液:取冰乙酸7mL,加蒸馏水100mL
3.实验药品、仪器 l (7)电极缓冲液(Tris-甘氨酸,pH 8.3):称取 3.03g Tris, 14.41g 甘氨酸, 1.0g SDS,溶于双蒸水,用HCl 调 pH 至 8.3(若准确称量则无需再调 pH), 定容至 1 000 mL。 l (8)染色液:45%甲醇,10%乙酸,0.25%考马斯亮蓝 R-250。 l (9)脱色液:① 酸-甲醇-水脱色液:25% 甲醇,10% 乙酸。② 7%(V/V) 乙酸脱色液:取冰乙酸 7 mL,加蒸馏水 100 mL