
蛋白质浓度测定:考马斯亮蓝法 和紫外吸收法 生化与分子生物学系 生命科学学院 四川农业大学
蛋白质浓度测定:考马斯亮蓝法 和紫外吸收法 生化与分子生物学系 生命科学学院 四川农业大学

目录 1.蛋白质含量测定的意义 2.测定方法、原理、优缺点 3.药品和器材 4.主要步骤 5.实验结果及数据处理 6.注意事项
目录 1. 蛋白质含量测定的意义 2. 测定方法、原理、优缺点 3. 药品和器材 4. 主要步骤 5. 实验结果及数据处理 6. 注意事项

蛋白质含量测定的意义 ·生物体重要的组成成分。 ·食品的重要营养指标。 ·产品开发、优化、控制和质检等方面
蛋白质含量测定的意义 • 生物体重要的组成成分。 • 食品的重要营养指标。 • 产品开发、优化、控制和质检等方面。 • ……

测定方法 蛋白质含量不仅可根据其物理性质:折射率、体积质量(比重)、紫外光吸收及 近红外法来测定;也可利用蛋白质的化学性质,用化学反应方法,如凯氏定氮法、 双缩脲法、福林(Foli)-酚试剂法测定,还可用染色法,如用氨基黑l0B、考马斯亮 蓝测定;还可用萤光激发、氯胺T、放射性同位素计数等灵敏度较高的方法测定。 上述方法中凯氏定氮法是测定蛋白质含量的经典方法,是蛋白质含量测定的国际 和国家标准测定方法;而紫外吸收法、双缩脲法、福林-酚试剂法、考马斯亮蓝染色 法是蛋白质含量测定的常用方法,它们操作简单快速,不需要昂贵的设备。 蛋白质测定方法各有优缺点,需要综合考虑样品纯度、干扰物质、灵敏度成本、 时间等要求而确定
测定方法 蛋白质含量不仅可根据其物理性质:折射率、体积质量(比重)、紫外光吸收及 近红外法来测定;也可利用蛋白质的化学性质,用化学反应方法,如凯氏定氮法、 双缩脲法、福林(Folin)-酚试剂法测定,还可用染色法,如用氨基黑10B、考马斯亮 蓝测定;还可用萤光激发、氯胺T、放射性同位素计数等灵敏度较高的方法测定。 上述方法中凯氏定氮法是测定蛋白质含量的经典方法,是蛋白质含量测定的国际 和国家标准测定方法;而紫外吸收法、双缩脲法、福林-酚试剂法、考马斯亮蓝染色 法是蛋白质含量测定的常用方法,它们操作简单快速,不需要昂贵的设备。 蛋白质测定方法各有优缺点,需要综合考虑样品纯度、干扰物质、灵敏度成本、 时间等要求而确定

凯氏定氮法 蛋白质是一类复杂的有机含氮化合物。其中每一种蛋白 质都有其恒定的含氮量,大约在14%~18%,平均为16%。 由凯氏定氮法测定出样品中的含氮量,再乘以系数6.25,即 得到样品蛋白质含量。含氮的有机物与浓硫酸共热时,其中 的碳、氢等元素被氧化成二氧化碳和水,而氮则转变成氨, 并进一步与硫酸作用生成硫酸铵。通常称此过程为“消化” 通常需要加入硫酸钾或疏酸钠以提高反应液的沸点,并加入 硫酸铜作为催化剂,以促进反应的进行。 该法是蛋白质含量测定的国标法。 优点是准确度很高,可处理复杂样品;缺点是周期长, 不能区分N的来源(三聚氰胺事件)
蛋白质是一类复杂的有机含氮化合物。其中每一种蛋白 质都有其恒定的含氮量,大约在14%~18%,平均为16%。 由凯氏定氮法测定出样品中的含氮量,再乘以系数6.25,即 得到样品蛋白质含量。含氮的有机物与浓硫酸共热时,其中 的碳、氢等元素被氧化成二氧化碳和水,而氮则转变成氨, 并进一步与硫酸作用生成硫酸铵。通常称此过程为“消化” 。 通常需要加入硫酸钾或硫酸钠以提高反应液的沸点,并加入 硫酸铜作为催化剂,以促进反应的进行。 该法是蛋白质含量测定的国标法。 优点是准确度很高,可处理复杂样品;缺点是周期长, 不能区分N的来源(三聚氰胺事件)。 凯氏定氮法
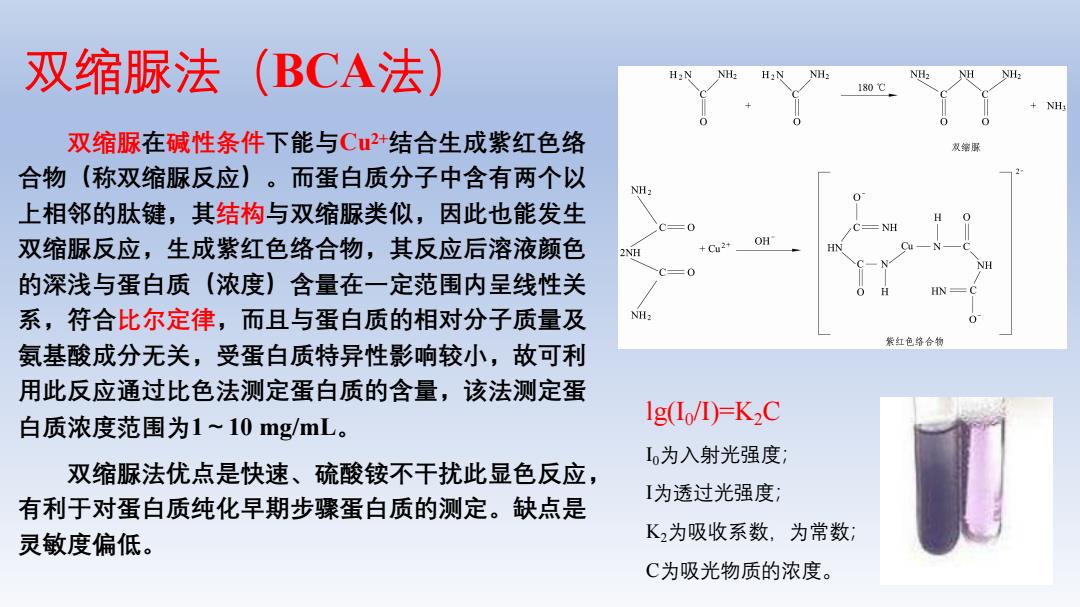
双缩脲法(BCA法) 双缩脲在碱性条件下能与Cu+结合生成紫红色络 合物(称双缩脲反应)。而蛋白质分子中含有两个以 NH 上相邻的肽键,其结构与双缩脲类似,因此也能发生 双缩脲反应,生成紫红色络合物,其反应后溶液颜色 的深浅与蛋白质(浓度)含量在一定范围内呈线性关 系,符合比尔定律,而且与蛋白质的相对分子质量及 H 氨基酸成分无关,受蛋白质特异性影响较小,故可利 用此反应通过比色法测定蛋白质的含量,该法测定蛋 白质浓度范围为1~10mgmL。 Ig(Io/D)=K2C I为入射光强度 双缩脲法优点是快速、硫酸铵不干扰此显色反应, 有利于对蛋白质纯化早期步骤蛋白质的测定。缺点是 I为透过光强度 灵敏度偏低。 K2为吸收系数,为常数 C为吸光物质的浓度
双缩脲法(BCA法) 双缩脲在碱性条件下能与Cu2+结合生成紫红色络 合物(称双缩脲反应)。而蛋白质分子中含有两个以 上相邻的肽键,其结构与双缩脲类似,因此也能发生 双缩脲反应,生成紫红色络合物,其反应后溶液颜色 的深浅与蛋白质(浓度)含量在一定范围内呈线性关 系,符合比尔定律,而且与蛋白质的相对分子质量及 氨基酸成分无关,受蛋白质特异性影响较小,故可利 用此反应通过比色法测定蛋白质的含量,该法测定蛋 白质浓度范围为1~10 mg/mL。 双缩脲法优点是快速、硫酸铵不干扰此显色反应, 有利于对蛋白质纯化早期步骤蛋白质的测定。缺点是 灵敏度偏低。 lg(I0 /I)=K2C I0为入射光强度; I为透过光强度; K2为吸收系数,为常数; C为吸光物质的浓度

考马斯亮蓝法(Bradford法) 考马斯亮蓝G-250在酸性溶液中呈棕红色,可与蛋白质 O3S 的疏水微区结合,使蛋白质被“染色”呈现蓝色。在一定范围 内,溶液在595nm波长下的吸光值与蛋白质含量成正比, 符合比色法测定原理,因此可用于蛋白质的定量测定。 考马斯亮蓝染料该法试剂配制简单,操作简便快捷, 灵敏度比Folin-酚法还高4倍,测定范围1~1000ug,而且 干扰物质少,蛋白质间的变动也较小,是一种常用的蛋白 Coomassie brilliant blue G-250 质快速、灵敏测定方法。 缺点是SDS等去污剂干扰、蛋白氨基酸组成影响、考马 斯亮蓝污染的试管不易清洗
考马斯亮蓝法(Bradford法) Coomassie brilliant blue G-250 考马斯亮蓝G-250在酸性溶液中呈棕红色,可与蛋白质 的疏水微区结合,使蛋白质被“染色”呈现蓝色。在一定范围 内,溶液在595 nm波长下的吸光值与蛋白质含量成正比, 符合比色法测定原理,因此可用于蛋白质的定量测定。 考马斯亮蓝染料该法试剂配制简单,操作简便快捷, 灵敏度比Folin-酚法还高4倍,测定范围1~1 000 μg,而且 干扰物质少,蛋白质间的变动也较小,是一种常用的蛋白 质快速、灵敏测定方法。 缺点是SDS等去污剂干扰、蛋白氨基酸组成影响、考马 斯亮蓝污染的试管不易清洗

Phenylalanine Tryptophan (Phe)B (yn (TP)W 紫外吸收法 由于蛋白质中存在含有共轭双键的酪氨酸、色氨酸和苯丙氨酸, 因此蛋白质具有吸收紫外光的性质,吸收高峰在280nm处。在一定浓 度范围内(0.1~1.0mg/mL),蛋白质溶液在280nm处光吸收值A280 与其浓度成正比,故可用作蛋白质含量的定量测定。 Amino acid Absorption maxima(nm) 该测定方法简单、灵敏、快速、低浓度的盐类不干扰测定,同时 Tryptophan 219,279 在测定过程中无试剂加入,蛋白质可回收,特别适用于柱层析洗脱液 Tyrosine 193,222.275 Phenylalanine 188,206,257 的快速连续检测,因此在蛋白质和酶的分离纯化过程中广泛采用。 此法的缺点是:(1)对测定那些与标准蛋白质中酪氨酸和色氨酸 含量差异较大的蛋白质,有一定的误差。(2)适合较纯蛋白质的测定, 若待测样中含有嘌呤、嘧啶等吸收紫外光的物质,干扰较大
紫外吸收法 由于蛋白质中存在含有共轭双键的酪氨酸、色氨酸和苯丙氨酸, 因此蛋白质具有吸收紫外光的性质,吸收高峰在280 nm处。在一定浓 度范围内(0.1~1.0 mg/mL),蛋白质溶液在280 nm处光吸收值A280 与其浓度成正比,故可用作蛋白质含量的定量测定。 该测定方法简单、灵敏、快速、低浓度的盐类不干扰测定,同时 在测定过程中无试剂加入,蛋白质可回收,特别适用于柱层析洗脱液 的快速连续检测,因此在蛋白质和酶的分离纯化过程中广泛采用。 此法的缺点是:(1)对测定那些与标准蛋白质中酪氨酸和色氨酸 含量差异较大的蛋白质,有一定的误差。(2)适合较纯蛋白质的测定, 若待测样中含有嘌呤、嘧啶等吸收紫外光的物质,干扰较大

考马斯亮蓝法
考马斯亮蓝法

主要药品 主要器材 亮蓝法 的语个找 09%Na@溶液 0.01%考马斯亮蓝G250溶液未知雷白质样品 VS
主要药品 主要器材 vs