
过氧化氢酶米氏常数的测定 生化与分子生物学系 生命科学学院 四川农业大学
过氧化氢酶米氏常数的测定 生化与分子生物学系 生命科学学院 四川农业大学

目录 1.米氏常数定义及意义 2.过氧化氢酶米氏常数的测量的原理 3.药品与仪器 4.操作步骤 5.计算实验结果及分析 6.注意事项
目录 1. 米氏常数定义及意义 2. 过氧化氢酶米氏常数的测量的原理 3. 药品与仪器 4. 操作步骤 5. 计算实验结果及分析 6. 注意事项

1.米氏常数的定义及意义
1. 米氏常数的定义及意义
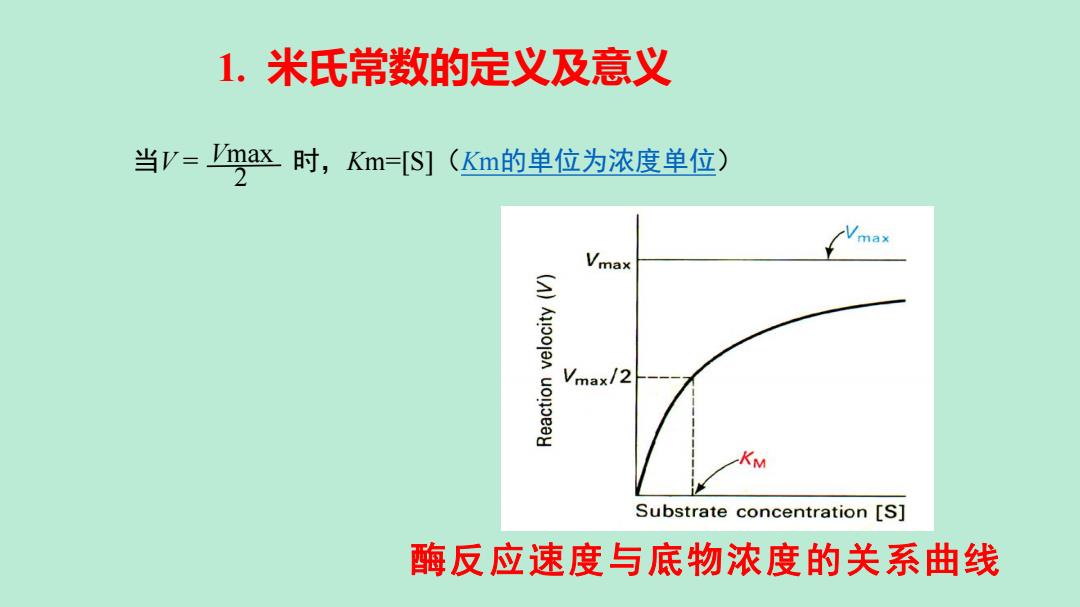
1.米氏常数的定义及意义 当V-max时,Km=[S](Km的单位为浓度单位) Vmax Vmax/2 KM Substrate concentration [S] 酶反应速度与底物浓度的关系曲线
酶反应速度与底物浓度的关系曲线 Vmax 2 当V = 时,Km=[S](Km的单位为浓度单位) 1. 米氏常数的定义及意义

E+S→S2P+E Vmax 米氏方程 Vmax s v= Vn [S] K+[S] Vmax/2 米氏常数 Km= k2+k3 k Substrate concentration [S]
E S k1 2 k ES k 3 P E K S V S v m max 米氏方程 1 2 3 k k k K m 米氏常数

k3 E+S ES P十E k2 1913年,Michaelis和Menten根据酶和底物反应的“快速平衡” 理论,提出酶促反应的基本原理,推导出底物浓度和反应速度之 间的定量关系式。 米氏方程 P= Vm[S] K+[S] 1925年,Briggs--Haldane从酶被底物饱和的现象出发,按照“稳 态平衡”的设想,对上述方程的推导假设作了修正
1913年,Michaelis和Menten根据酶和底物反应的“快速平衡” 理论,提出酶促反应的基本原理,推导出底物浓度和反应速度之 间的定量关系式。 K S V S v m 米氏方程 max : 1925年,Briggs-Haldane 从酶被底物饱和的现象出发,按照“稳 态平衡”的设想,对上述方程的推导假设作了修正。 E S ES P E k3 k2 k1

S+E ES k2 k3 。P+E 时[EJ-[E [ES] [Es]生成速度:y=k①E,]-[ES[S],[Es]分解速度:=k,[ES]+k[ES] 米 当酶反应体系处于恒态时:V1=V2 即:kIE]-[Es]S]=k[ES]+k[ES] →E-EsS_k+k ES] k 方 令:飞+长=Km 则:Kn[ES]+[ESS=[EIS k 经整理得:[ES]= [E,IS] Km+S可 (1) 推导 由于酶促反应速度由[ES]决定,即V=人[ES] ,所以[ES]=V2 将(2)代入(1)得: y[E,][S] S]() k3 K+[S] K+[S] 当E]=[E]时,v=V。 所以Vm=k[E,] (4) 将(4)代入(3),则: V= VnasS K+S]
米 氏 方 程 的 推 导 1 2 3 k k k ES Et S ES S 令: Km k k k 1 2 3 将(4)代入(3),则: K S V S v m max S E k1 2 k ES k 3 P E E ES S t ES [ES]生成速度:v k E ESS 1 1 t ,[ES]分解速度:v k ES k ES 2 2 3 即: k E ESS k ES k ES 1 t 2 3 则: K ES ESS S m Et 经整理得: (1) K S E S m t ES 由于酶促反应速度由[ES]决定,即 v k3 ES 3 v k ,所以 ES (2) 将(2)代入(1)得: 3 t m v E S k K S 3 t m k E S K S v (3) 当酶反应体系处于恒态时: 1 2 v v 当 所以 Vm k3 Et (4) [Et]=[ES]时, V m v

米氏常数的意义和应用 ●血是酶在一定条件下的特征物理常数,与酶的种类有关,与酶浓度、 底物浓度无关; ●通过测定血的数值,可对酶进行鉴别,同时可以判断酶的最适底物。 Km则可近似表示酶和底物亲合力,故血愈小,E对S的亲合力愈大;m 愈大,E对S的亲合力愈小。 ●在已知血的情况下,应用米氏方程可计算一定[S]时的W,或一定下的 [S]。(用的倍数表示)
米氏常数的意义和应用 l Km是酶在一定条件下的特征物理常数,与酶的种类有关,与酶浓度、 底物浓度无关; l 通过测定Km的数值,可对酶进行鉴别,同时可以判断酶的最适底物。 Km则可近似表示酶和底物亲合力,故Km愈小,E对S的亲合力愈大;Km 愈大,E对S的亲合力愈小。 l 在已知Km的情况下,应用米氏方程可计算一定[S]时的V,或一定V下的 [S]。(用Km的倍数表示)

2.过氧化氢酶米氏常数的测量的原理
2. 过氧化氢酶米氏常数的测量的原理

(1)直观作图法:以V~S]作图 米氏方程: Vmas V= V [S] Vmax/2 Km+[S] Ka 阿