
基于人用经验的中药复方制剂新药 临床研发指导原则(试行) 2022年4月

一、概述 中药复方制剂一般来源于中医临床实践,具有传统中医 药理论的支持和指导,在总结个体用药经验的基础上,在临 床实践当中逐步明确适用人群、用药剂量、疗效特点和临床 获益,形成固定处方,研发制成适合群体用药的中药新药。 为了促进中药传承精华、守正创新,加快构建“中医药 理论、人用经验和临床试验相结合的中药注册审评证据体系” (以下简称“三结合”审评证据体系),引导中药复方制剂基 于中药的研发规律和特点开展新药研发,特制定本指导原则。 中医药理论是中药复方制剂在临床遣方用药的重要依 据,主要体现组方对拟定功能主治的中医药理论的合理性解 释,即“理法方药”的合理性,拟研发的中药复方制剂应当有 中医药理论的支持。 人用经验包含了中药处方/制剂在临床用药过程中积累 的对其适用人群、用药剂量、疗效特点和临床获益的认识和 总结。获取人用经验的过程即为逐步探索明确中药复方制剂 有效性、安全性以及临床获益的过程,也是中药复方制剂研 发过程中的重要阶段,其研究可贯穿研发全过程。 临床试验应当结合上述中医药理论依据和人用经验的 总结,对尚未明确的有效性、安全性问题开展研究,可根据 需要采用不同的研发策略和灵活多样的试验设计
1 一、概述 中药复方制剂一般来源于中医临床实践,具有传统中医 药理论的支持和指导,在总结个体用药经验的基础上,在临 床实践当中逐步明确适用人群、用药剂量、疗效特点和临床 获益,形成固定处方,研发制成适合群体用药的中药新药。 为了促进中药传承精华、守正创新,加快构建“中医药 理论、人用经验和临床试验相结合的中药注册审评证据体系” (以下简称“三结合”审评证据体系),引导中药复方制剂基 于中药的研发规律和特点开展新药研发,特制定本指导原则。 中医药理论是中药复方制剂在临床遣方用药的重要依 据,主要体现组方对拟定功能主治的中医药理论的合理性解 释,即“理法方药”的合理性,拟研发的中药复方制剂应当有 中医药理论的支持。 人用经验包含了中药处方/制剂在临床用药过程中积累 的对其适用人群、用药剂量、疗效特点和临床获益的认识和 总结。获取人用经验的过程即为逐步探索明确中药复方制剂 有效性、安全性以及临床获益的过程,也是中药复方制剂研 发过程中的重要阶段,其研究可贯穿研发全过程。 临床试验应当结合上述中医药理论依据和人用经验的 总结,对尚未明确的有效性、安全性问题开展研究,可根据 需要采用不同的研发策略和灵活多样的试验设计

中医药理论、人用经验和临床试验相结合形成支持中药 复方制剂上市注册申请的证据体系。 中药复方制剂新药研发应当以患者为中心、以临床价值 为导向、体现中医药的作用特点、发挥中医药的临床优势, 以病证结合、专病专药或证候类中药等多种方式开展,明确 患者的临床获益。 中药复方制剂来源不仅包括中医临床经验方、医疗机构 制剂、古代经典名方化裁,还包括基于现代研究的科研方等, 其研发具有多路径的特点。本指导原则侧重阐述人用经验的 收集以及如何基于人用经验产生支持监管决策的证据,适用 于基于人用经验的中药复方制剂新药临床研发。随着相关法 规的更新和实践经验的积累,本指导原则也将随之更新与完 善。 二、一般原则 1.本指导原则所讨论的人用经验的信息是在具有中医 药理论支持的固定的中药处方或中药复方制剂在临床实践 过程中,处方药味(包括基原、药用部位、炮制等)及其用 量、临床定位基本明确后,经较长时间和/或较大人群范围临 床使用而积累形成的,包括处方来源(和演变)、关键药学资 料、临床使用情况、临床实践数据、以及与其相关的其他临 床研究数据等,用于支持中药复方制剂新药的研发决策或注
2 中医药理论、人用经验和临床试验相结合形成支持中药 复方制剂上市注册申请的证据体系。 中药复方制剂新药研发应当以患者为中心、以临床价值 为导向、体现中医药的作用特点、发挥中医药的临床优势, 以病证结合、专病专药或证候类中药等多种方式开展,明确 患者的临床获益。 中药复方制剂来源不仅包括中医临床经验方、医疗机构 制剂、古代经典名方化裁,还包括基于现代研究的科研方等, 其研发具有多路径的特点。本指导原则侧重阐述人用经验的 收集以及如何基于人用经验产生支持监管决策的证据,适用 于基于人用经验的中药复方制剂新药临床研发。随着相关法 规的更新和实践经验的积累,本指导原则也将随之更新与完 善。 二、一般原则 1. 本指导原则所讨论的人用经验的信息是在具有中医 药理论支持的固定的中药处方或中药复方制剂在临床实践 过程中,处方药味(包括基原、药用部位、炮制等)及其用 量、临床定位基本明确后,经较长时间和/或较大人群范围临 床使用而积累形成的,包括处方来源(和演变)、关键药学资 料、临床使用情况、临床实践数据、以及与其相关的其他临 床研究数据等,用于支持中药复方制剂新药的研发决策或注

册申请。 2.除已获批准的制剂(如医疗机构中药制剂)外,其制 备工艺应当为能够反映中医临床实践实际情况的传统工艺。 3.人用经验研究可贯穿中药复方制剂新药研发的全过 程,尤其是基于古代经典名方、名老中医经验方、医疗机构 制剂等具有人用经验的中药新药,可通过预先的研究设计, 将中医临床诊疗实践过程中产生的信息进行合理利用,进一 步说明其临床应用人群、疗效特点等,为研究者制定药物研 发策略提供支撑,为制定非临床研究及临床研究方案提供参 考。 4.如人用经验满足数据治理与评估的相关要求,并具备 对人用经验数据的合理与充分的分析以及正确的结果解释, 可作为支持注册申请的证据。基于人用经验的中药复方制剂 的新药研发,可通过人用经验初步确定临床获益、适用人群、 用药剂量、疗效特点等,通常不需要开展非临床药效学研究。 如需开展临床试验,应当根据处方特点及人用经验的支持情 况合理设计后续临床试验,可采用随机对照的临床试验设计, 也可采用实用临床试验(PCT)等真实世界研究设计方法。 5.根据中药复方制剂不同的申报类别和人用经验情况, 可选择不同的中药新药研发路径。在实际应用过程中,申请 人可根据具体品种情况,与药审中心进行沟通交流
3 册申请。 2. 除已获批准的制剂(如医疗机构中药制剂)外,其制 备工艺应当为能够反映中医临床实践实际情况的传统工艺。 3. 人用经验研究可贯穿中药复方制剂新药研发的全过 程,尤其是基于古代经典名方、名老中医经验方、医疗机构 制剂等具有人用经验的中药新药,可通过预先的研究设计, 将中医临床诊疗实践过程中产生的信息进行合理利用,进一 步说明其临床应用人群、疗效特点等,为研究者制定药物研 发策略提供支撑,为制定非临床研究及临床研究方案提供参 考。 4. 如人用经验满足数据治理与评估的相关要求,并具备 对人用经验数据的合理与充分的分析以及正确的结果解释, 可作为支持注册申请的证据。基于人用经验的中药复方制剂 的新药研发,可通过人用经验初步确定临床获益、适用人群、 用药剂量、疗效特点等,通常不需要开展非临床药效学研究。 如需开展临床试验,应当根据处方特点及人用经验的支持情 况合理设计后续临床试验,可采用随机对照的临床试验设计, 也可采用实用临床试验(PCT)等真实世界研究设计方法。 5. 根据中药复方制剂不同的申报类别和人用经验情况, 可选择不同的中药新药研发路径。在实际应用过程中,申请 人可根据具体品种情况,与药审中心进行沟通交流

三、适用范围 本指导原则适用于基于人用经验的中药复方制剂的新 药临床研发,如1.1类中药复方制剂、3.2类其他来源于古代 经典名方的中药复方制剂等。 四、人用经验信息 (一)处方来源与演变 中药复方制剂的处方来源与演变包括处方的来源、所依 据的中医药理论基础,处方药味药量、剂型、功能主治范围、 适用人群、用法用量、疗程、是否含有毒性药味或含有中药 配伍禁忌等信息。如果处方是基于古代经典名方加减化裁的, 还应当提供相应的变化及其依据。更具体的内容和要求参见 《中药新药复方制剂中医药理论申报资料撰写指导原则(试 行)》。 (二)关键药学资料 包括但不限于:处方药味(包括基原、药用部位、炮制 等)、剂型和制备工艺及其变更演变(如果有)情况,具体要 求参见相关指导原则。 (三)临床使用情况 中药复方制剂从原始方剂到申报制剂的整个临床使用 及其演变(如果有)情况,包括临床使用的医疗机构(名称、 等级、地域)、起始年月、科室、主要人群、人数剂次、不良
4 三、适用范围 本指导原则适用于基于人用经验的中药复方制剂的新 药临床研发,如 1.1 类中药复方制剂、3.2 类其他来源于古代 经典名方的中药复方制剂等。 四、人用经验信息 (一)处方来源与演变 中药复方制剂的处方来源与演变包括处方的来源、所依 据的中医药理论基础,处方药味药量、剂型、功能主治范围、 适用人群、用法用量、疗程、是否含有毒性药味或含有中药 配伍禁忌等信息。如果处方是基于古代经典名方加减化裁的, 还应当提供相应的变化及其依据。更具体的内容和要求参见 《中药新药复方制剂中医药理论申报资料撰写指导原则(试 行)》。 (二)关键药学资料 包括但不限于:处方药味(包括基原、药用部位、炮制 等)、剂型和制备工艺及其变更演变(如果有)情况,具体要 求参见相关指导原则。 (三)临床使用情况 中药复方制剂从原始方剂到申报制剂的整个临床使用 及其演变(如果有)情况,包括临床使用的医疗机构(名称、 等级、地域)、起始年月、科室、主要人群、人数剂次、不良

反应情况等。如果存在临床使用中断情况,应当说明其原因。 (四)临床实践数据 临床实践的原始数据主要来源于医院信息系统及病案 库等原始记录数据,包括结构化和非结构化数据,数字化或 非数字化的病历记录。临床实践的数据还可以来源于既往开 展的临床研究。 1.病历记录数据 病历记录数据是最主要的临床实践数据来源。目前的病 历记录绝大多数使用的是电子病历,但也有可能是纸质病历 记录形式。无论何种形式,都需要经过数据治理才能达到后 续分析的要求,并符合注册申报的递交标准。 一般而言,门诊和急诊病历记录的信息量较少,院外数 据缺失较多,特别是临床结局变量,直接影响到个体病例纵 向数据的完整性,此类数据用于临床研究应当非常慎重。因 此,应当通过信息化手段加强门诊和急诊病历记录的完整性, 提升数据质量,从而支持中药的临床研发。 2.临床研究数据 对于既往针对中药复方制剂开展的临床研究,无论是前 瞻性或回顾性观察性研究,还是随机对照临床试验,其数据 质量通常优于医疗实践中的病历记录。针对同一中药复方制 剂开展的临床研究可能有多项,而且研究类型也可能有多种
5 反应情况等。如果存在临床使用中断情况,应当说明其原因。 (四)临床实践数据 临床实践的原始数据主要来源于医院信息系统及病案 库等原始记录数据,包括结构化和非结构化数据,数字化或 非数字化的病历记录。临床实践的数据还可以来源于既往开 展的临床研究。 1.病历记录数据 病历记录数据是最主要的临床实践数据来源。目前的病 历记录绝大多数使用的是电子病历,但也有可能是纸质病历 记录形式。无论何种形式,都需要经过数据治理才能达到后 续分析的要求,并符合注册申报的递交标准。 一般而言,门诊和急诊病历记录的信息量较少,院外数 据缺失较多,特别是临床结局变量,直接影响到个体病例纵 向数据的完整性,此类数据用于临床研究应当非常慎重。因 此,应当通过信息化手段加强门诊和急诊病历记录的完整性, 提升数据质量,从而支持中药的临床研发。 2.临床研究数据 对于既往针对中药复方制剂开展的临床研究,无论是前 瞻性或回顾性观察性研究,还是随机对照临床试验,其数据 质量通常优于医疗实践中的病历记录。针对同一中药复方制 剂开展的临床研究可能有多项,而且研究类型也可能有多种

例如有回顾性研究也有前瞻性研究,有观察性研究也有干预 性研究等。如果这些研究没有执行统一的数据标准,或所采 用的标准不符合注册研究的要求,需要先对来源于这些研究 的数据进行统一和规范的治理,才可能适用于后续的以注册 上市为目的的数据分析。此外,这些研究数据应当可溯源到 原始的病历记录,或可溯源到所开展项目独立收集并录入的 源数据库。 对来源于同一固定的中药处方或中药复方制剂开展的 多项临床研究的数据,如需合并分析(如meta分析),鼓励 该分析基于各项临床研究的个体层面数据,而非从研究报告 摘录的汇总统计量。 五、基于人用经验的中药复方制剂新药临床研发策略 遵循“三结合”审评证据体系,在有充分的中医药理论 的前提下,人用经验可用于支持中药复方制剂新药的研发决 策或注册申请。基于人用经验的临床研发策略如图1所示。 6
6 例如有回顾性研究也有前瞻性研究,有观察性研究也有干预 性研究等。如果这些研究没有执行统一的数据标准,或所采 用的标准不符合注册研究的要求,需要先对来源于这些研究 的数据进行统一和规范的治理,才可能适用于后续的以注册 上市为目的的数据分析。此外,这些研究数据应当可溯源到 原始的病历记录,或可溯源到所开展项目独立收集并录入的 源数据库。 对来源于同一固定的中药处方或中药复方制剂开展的 多项临床研究的数据,如需合并分析(如 meta 分析),鼓励 该分析基于各项临床研究的个体层面数据,而非从研究报告 摘录的汇总统计量。 五、基于人用经验的中药复方制剂新药临床研发策略 遵循“三结合”审评证据体系,在有充分的中医药理论 的前提下,人用经验可用于支持中药复方制剂新药的研发决 策或注册申请。基于人用经验的临床研发策略如图 1 所示
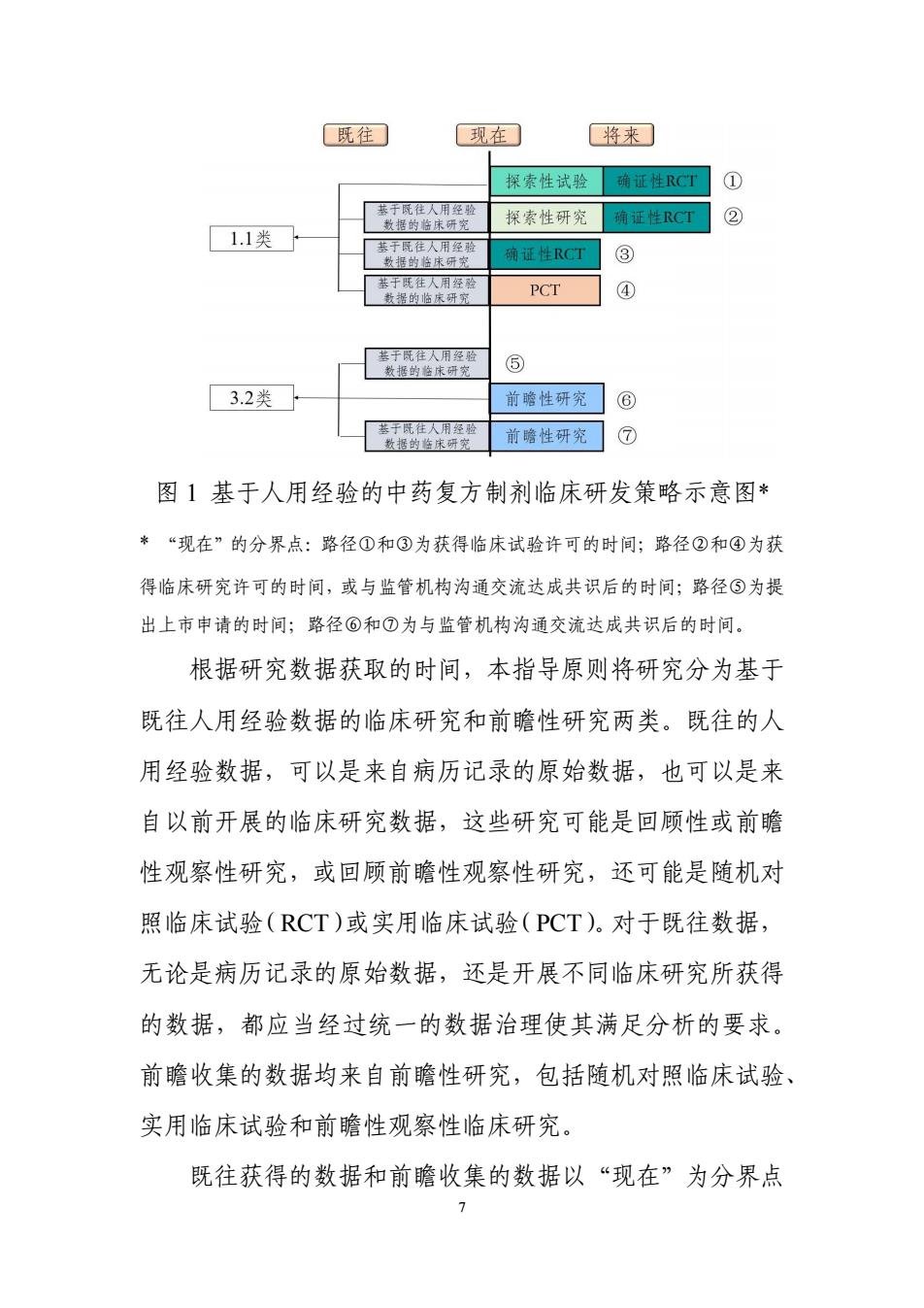
既往 现在 将来 探索性试验 确证性RCT ① 基于既往人用经验 数据的临床研究 探索性研究 确证性RCT ② 11类 基于既往人用经验 数据的检床研究 确证性RCT ③ 基于既往人用经验 数据的临床研究 PCT ④ 基于既往人用经验 数据的在床研究 ⑤ 3.2类 前瞻性研究 ⑥ 基于既往人用经验 数据的临床研究 前瞻性研究 ⑦ 图1基于人用经验的中药复方制剂临床研发策略示意图* *“现在”的分界点:路径①和③为获得临床试验许可的时间;路径②和④为获 得临床研究许可的时间,或与监管机构沟通交流达成共识后的时间;路径⑤为提 出上市申请的时间;路径⑥和⑦为与监管机构沟通交流达成共识后的时间。 根据研究数据获取的时间,本指导原则将研究分为基于 既往人用经验数据的临床研究和前瞻性研究两类。既往的人 用经验数据,可以是来自病历记录的原始数据,也可以是来 自以前开展的临床研究数据,这些研究可能是回顾性或前瞻 性观察性研究,或回顾前瞻性观察性研究,还可能是随机对 照临床试验(RCT)或实用临床试验(PCT)。对于既往数据, 无论是病历记录的原始数据,还是开展不同临床研究所获得 的数据,都应当经过统一的数据治理使其满足分析的要求。 前瞻收集的数据均来自前瞻性研究,包括随机对照临床试验、 实用临床试验和前瞻性观察性临床研究。 既往获得的数据和前瞻收集的数据以“现在”为分界点 7
7 图 1 基于人用经验的中药复方制剂临床研发策略示意图* * “现在”的分界点:路径①和③为获得临床试验许可的时间;路径②和④为获 得临床研究许可的时间,或与监管机构沟通交流达成共识后的时间;路径⑤为提 出上市申请的时间;路径⑥和⑦为与监管机构沟通交流达成共识后的时间。 根据研究数据获取的时间,本指导原则将研究分为基于 既往人用经验数据的临床研究和前瞻性研究两类。既往的人 用经验数据,可以是来自病历记录的原始数据,也可以是来 自以前开展的临床研究数据,这些研究可能是回顾性或前瞻 性观察性研究,或回顾前瞻性观察性研究,还可能是随机对 照临床试验(RCT)或实用临床试验(PCT)。对于既往数据, 无论是病历记录的原始数据,还是开展不同临床研究所获得 的数据,都应当经过统一的数据治理使其满足分析的要求。 前瞻收集的数据均来自前瞻性研究,包括随机对照临床试验、 实用临床试验和前瞻性观察性临床研究。 既往获得的数据和前瞻收集的数据以“现在”为分界点

区分,根据申报的类别不同,“现在”可能是提出上市申请的 时间,或临床研究(包括临床试验和真实世界研究)许可的 时间,或与监管机构沟通交流达成共识后的时间(见图1注 释)。 基于人用经验获得的证据支持新药上市大致分为直接 支持上市和为后续临床研究奠定基础两种情况。 1.基于人用经验获得的证据支持注册 对于既往获得的人用经验数据,通过良好的研究设计、 规范的数据治理和充分合理的统计分析,如果在拟定的功能 主治范围及用法用量内,分析结果能够提供充分的有效性和 安全性证据,可与药品监管机构沟通后,直接作为支持产品 上市注册的关键性证据,如图1中3.2类其他来源于古代经 典名方的中药复方制剂的研发路径⑤。 2基于人用经验进一步开展临床研究 如果上述基于人用经验的研究结果对药物的有效性和 安全性支持证据尚不充分,不能完整准确地回答支持上市的 科学问题,则需要进一步开展临床研究,以获取更充分的临 床证据支持新药上市。 如果将人用经验用于支持后续的临床研究设计,可以通 过对人用经验数据的分析,为研究设计确定一些关键要素提 供依据,如适用人群和功能主治范围、药物的用法用量、主
8 区分,根据申报的类别不同,“现在”可能是提出上市申请的 时间,或临床研究(包括临床试验和真实世界研究)许可的 时间,或与监管机构沟通交流达成共识后的时间(见图 1 注 释)。 基于人用经验获得的证据支持新药上市大致分为直接 支持上市和为后续临床研究奠定基础两种情况。 1.基于人用经验获得的证据支持注册 对于既往获得的人用经验数据,通过良好的研究设计、 规范的数据治理和充分合理的统计分析,如果在拟定的功能 主治范围及用法用量内,分析结果能够提供充分的有效性和 安全性证据,可与药品监管机构沟通后,直接作为支持产品 上市注册的关键性证据,如图 1 中 3.2 类其他来源于古代经 典名方的中药复方制剂的研发路径⑤。 2.基于人用经验进一步开展临床研究 如果上述基于人用经验的研究结果对药物的有效性和 安全性支持证据尚不充分,不能完整准确地回答支持上市的 科学问题,则需要进一步开展临床研究,以获取更充分的临 床证据支持新药上市。 如果将人用经验用于支持后续的临床研究设计,可以通 过对人用经验数据的分析,为研究设计确定一些关键要素提 供依据,如适用人群和功能主治范围、药物的用法用量、主

要终点、观察期和随访节点、样本量估计所需的具体参数或 效应量参数等。不仅如此,如果人用经验数据质量较好,并 有一定的数量,其分析结果可与后续的临床研究结果同时作 为监管决策的证据。 后续开展的临床研究采用的研究类型,应当根据项目的 具体情况而定。如具有高质量人用经验数据,且研究结果积 极或显示较明确的积极趋势,则后续可以直接开展确证性随 机对照临床试验,或实用临床试验;否则,后续仍需先开展 探索性临床研究,这种探索性研究可以是干预性的,也可以 是观察性的,再在此基础上评估是否进一步开展确证性临床 试验。 需要指出,如果没有前期基于人用经验的研究基础,中 药复方制剂的临床研发仍然要遵循常规路径。 以下根据申报类别分别阐述不同的研发路径。需要强调, 图1所示的研发路径并不代表所有可能的研发路径,申请人 可以根据品种情况选择适宜的路径,也可以就研发策略与监 管机构充分沟通交流。 (一)1.1类中药复方制剂 路径①~④主要针对1.1类中药复方制剂。 路径①:无任何人用经验基础,遵循常规临床试验路径, 即按照探索性试验和确证性随机对照试验的顺序开展临床
9 要终点、观察期和随访节点、样本量估计所需的具体参数或 效应量参数等。不仅如此,如果人用经验数据质量较好,并 有一定的数量,其分析结果可与后续的临床研究结果同时作 为监管决策的证据。 后续开展的临床研究采用的研究类型,应当根据项目的 具体情况而定。如具有高质量人用经验数据,且研究结果积 极或显示较明确的积极趋势,则后续可以直接开展确证性随 机对照临床试验,或实用临床试验;否则,后续仍需先开展 探索性临床研究,这种探索性研究可以是干预性的,也可以 是观察性的,再在此基础上评估是否进一步开展确证性临床 试验。 需要指出,如果没有前期基于人用经验的研究基础,中 药复方制剂的临床研发仍然要遵循常规路径。 以下根据申报类别分别阐述不同的研发路径。需要强调, 图 1 所示的研发路径并不代表所有可能的研发路径,申请人 可以根据品种情况选择适宜的路径,也可以就研发策略与监 管机构充分沟通交流。 (一)1.1 类中药复方制剂 路径①~④主要针对 1.1 类中药复方制剂。 路径①:无任何人用经验基础,遵循常规临床试验路径, 即按照探索性试验和确证性随机对照试验的顺序开展临床