
材料与能源学院 School of Materials and Energy 第二章波谱分析 wvalp on moy 1aBioLianau 刘钰 电子科技大学 2021年-2022年春季 《材料分子结构分析》
第二章 波谱分析 刘 钰 电子科技大学 2021年-2022年 春季 《材料分子结构分析》

never forget how to dream 主要内容 ■2.1波谱分析概述 ■2.2波谱分析的产生 ■2.3波谱分析基本原理 ■2.4波谱分析基本类型 ■2.5波谱分析方法 ■2.6波谱分析应用 2
2 主要内容 ◼2.1 波谱分析概述 ◼2.2 波谱分析的产生 ◼2.3 波谱分析基本原理 ◼2.4 波谱分析基本类型 ◼2.5 波谱分析方法 ◼2.6 波谱分析应用

2.1波谱分析概述 never forget how to dream 什么是波谱分析? 物质在电磁波的照射下,引起分子内部某种运动,从而吸收、 散射或转动某种波长的光,将入射光在经过样品后强度的变 化或散射及转动光的信号记录下来,得到信号强度与波长或 波数(频率)或散射角的关系图,用于物质结构、组成及内 部运动规律的分析,即称为波谱分析。 散射光 入射光分子 出射光 Io I 3
3 2.1 波谱分析概述 什么是波谱分析? 物质在电磁波的照射下,引起分子内部某种运动,从而吸收、 散射或转动某种波长的光,将入射光在经过样品后强度的变 化或散射及转动光的信号记录下来,得到信号强度与波长或 波数(频率)或散射角的关系图,用于物质结构、组成及内 部运动规律的分析,即称为波谱分析

never forget how to dream 波谱法的范围 四大名谱:红外光谱、紫外-可见光谱、 核磁共振谱和质谱。 拉曼光谱、荧光光谱、旋光光谱和圆二色谱、顺 磁共振谱、X射线衍射谱都是属于波谱分析范畴 4 2.1波谱法概述
4 波谱法的范围 四大名谱:红外光谱、紫外-可见光谱、 核磁共振谱和质谱。 拉曼光谱、荧光光谱、旋光光谱和圆二色谱、顺 磁共振谱、X射线衍射谱都是属于波谱分析范畴 2.1 波谱法概述

never forget how to dream 2.2波谱法的产生 在十九世纪三四十年代,开始应用目视比色法 不久发现了Beer定律 分光光度法定量分析的依据 第一台实用光谱仪 十九世纪六十年代 十九世纪末开始了化合物的红外和紫外光谱测定 1912年,第一台质谱仪 1945年,核磁共振现象被发现 二十世纪,波谱法得到了突飞猛进的发展 5 2.1波谱法概述
5 在十九世纪三四十年代,开始应用目视比色法 不久发现了Beer定律 十九世纪六十年代 十九世纪末开始了化合物的红外和紫外光谱测定 1912年,第一台质谱仪 1945年,核磁共振现象被发现 二十世纪,波谱法得到了突飞猛进的发展 2.2 波谱法的产生 2.1 波谱法概述 分光光度法定量分析的依据 第一台实用光谱仪

never forget how to dream 23波谱分析原理 2.3.1电磁波的性质 光:是一种电磁波,具有波动性和粒子性, 波动性:传播运动过程中突出,表现在光的偏振,干涉,衍射 粒子性:与物质相互作用时突出,表现在光电效应,光的吸收 和散射 衍射 干涉 手涉條紋 色散 Dispersion Angle 获缝 狹缝 Prism 圆孔荷射 光源 E=hy hc/A 6 2.1波谱法概述
6 光: 是一种电磁波, 具有波动性和粒子性. 波动性:传播运动过程中突出, 表现在光的偏振, 干涉, 衍射 粒子性:与物质相互作用时突出, 表现在光电效应, 光的吸收 和散射 衍射 干涉 色散 2.1 波谱法概述 2.3.1 电磁波的性质 2.3 波谱分析原理 E = h = hc/
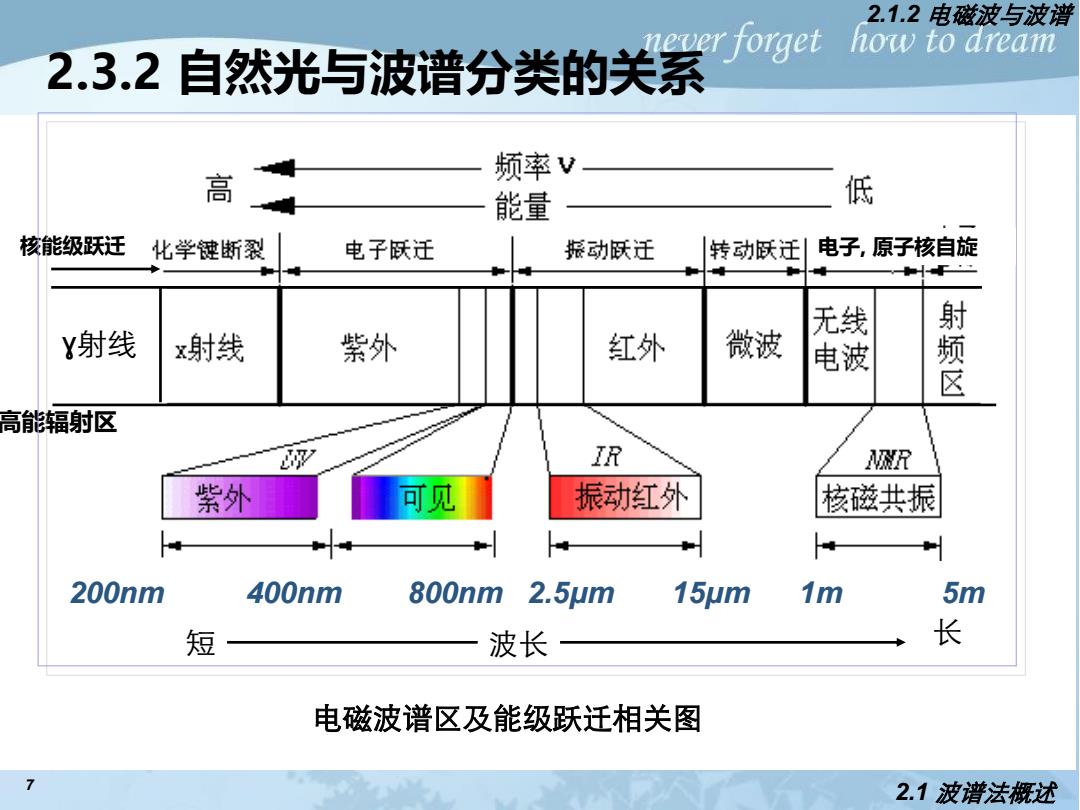
2.1.2电磁波与波谱 never forget how to aream 2.3.2自然光与波谱分类的关系 高 频率V 能量 低 核能级跃迁 化学键断裂 电子低迁 振动低迁 转动跃迁引 电子,原子核自旋 无 Y射线 x射线 紫外 红外 微波 电波 频 高能辐射区 凉 IR R 紫外 可见 振动红外 核磁共振 200nm 400nm 800nm 2.5m 15m 1m 5m 短 波长 长 电磁波谱区及能级跃迁相关图 7 2.1波谱法概述
7 2.3.2 自然光与波谱分类的关系 2.1 波谱法概述 2.1.2 电磁波与波谱 外层 高能辐射区 光学光谱区 波谱区 内层电子跃迁 短 波长 长 核能级跃迁 200nm 400nm 800nm 2.5μm 15μm 1m 5m ɣ射线 电子, 原子核自旋 电磁波谱区及能级跃迁相关图
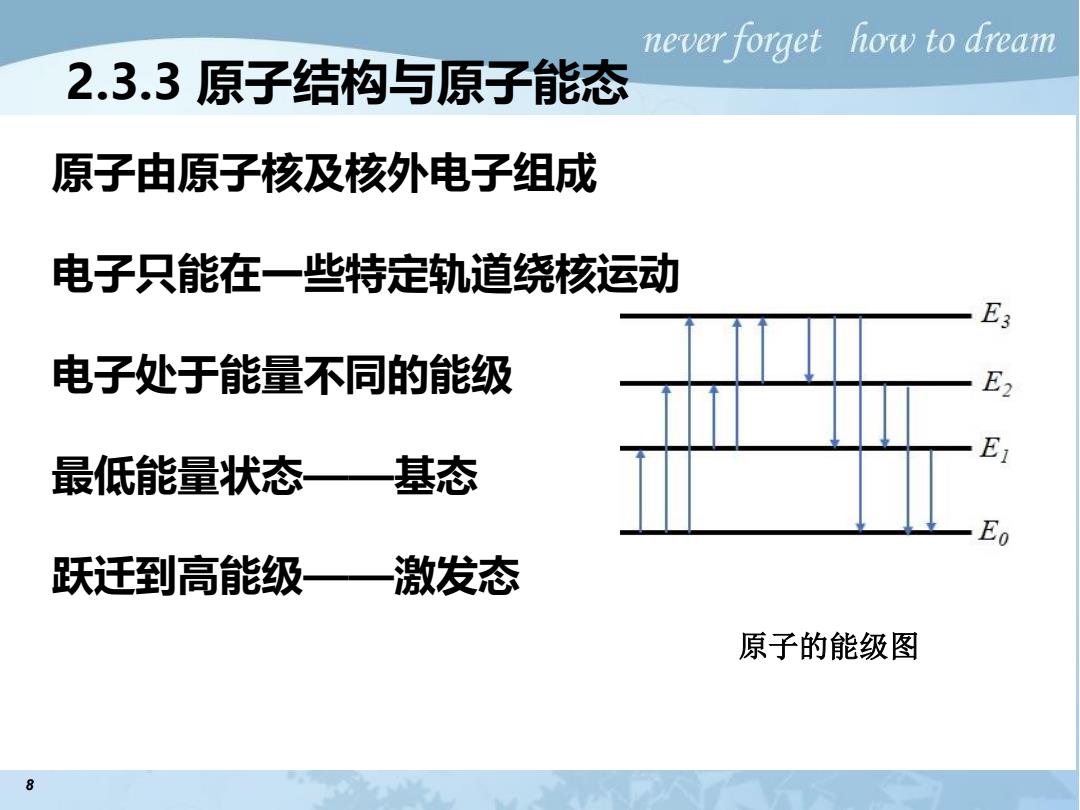
neverforget how to dream 2.3.3原子结构与原子能态 原子由原子核及核外电子组成 电子只能在一些特定轨道绕核运动 电子处于能量不同的能级 E2 E 最低能量状态 —基态 Eo 跃迁到高能级一激发态 原子的能级图 8
8 2.3.3 原子结构与原子能态 原子的能级图 原子由原子核及核外电子组成 电子只能在一些特定轨道绕核运动 电子处于能量不同的能级 最低能量状态——基态 跃迁到高能级——激发态
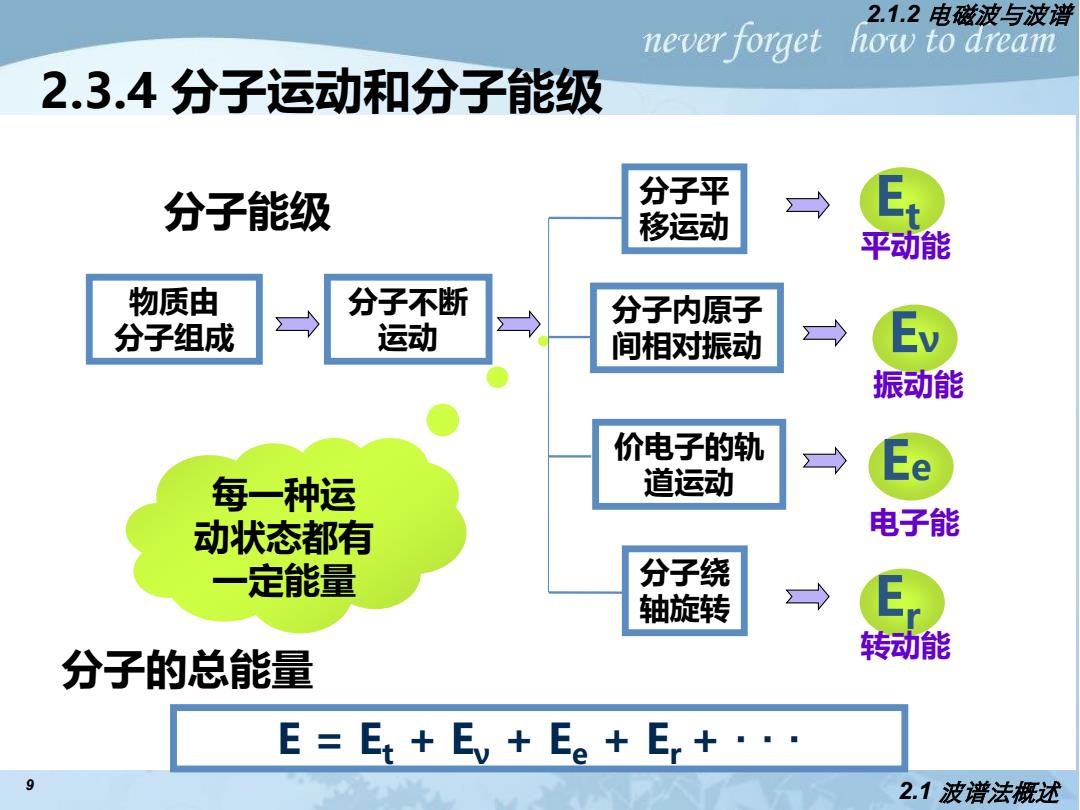
2.1.2电磁波与波谱 never forget how to aream 2.3.4分子运动和分子能级 分子能级 分子平 E, 移运动 平动能 物质由 分子不断 分子内原子 分子组成 运动 间相对振动 Ev 振动能 价电子的轨 每一种运 道运动 动状态都有 电子能 一定能量 分子绕 轴旋转 转动能 分子的总能量 E=Et+E+Ee+Er+·· 9 2.1波谱法概述
9 2.3.4 分子运动和分子能级 每一种运 动状态都有 一定能量 分子不断 运动 分子平 移运动 分子绕 轴旋转 物质由 分子组成 分子内原子 间相对振动 价电子的轨 道运动 Et Eν Ee Er 平动能 振动能 电子能 转动能 2.1.2 电磁波与波谱 2.1 波谱法概述 分子能级 E = Et + Eν + Ee + Er + ··· 分子的总能量

2.1.2电磁波与波谱 never forget how to aream 2.分子能级 平动能E+:能级差小,近似地看成能量变化是连续的 核的自旋跃迁能:大于平动能,小于其它分子运动 各种能级跃迁 转动能E:能级差(3.5×10-3-5×102eV) 所需能量不同 ,则在不同电 振动能E:能级差(5×10-2~1eV) 磁波区出现不 同谱带 电子能Ee:能级差(1~20eV) 分子能量的变化是量子化的 能量最低的运动状态称为基态,其它能级称为激发态 能量由低到高依次称为基态,第一激发态,第二激发态 等等. 10 2.1波谱法概述
10 分子能量的变化是量子化的 能量最低的运动状态称为基态, 其它能级称为激发态 能量由低到高依次称为基态, 第一激发态, 第二激发态 等等. 2.1 波谱法概述 2. 分子能级 2.1.2 电磁波与波谱 平动能Et : 能级差小, 近似地看成能量变化是连续的 核的自旋跃迁能:大于平动能,小于其它分子运动 转动能Er : 能级差(3.5×10-3~ 5×10-2eV) 振动能Eν : 能级差(5×10-2~ 1eV) 电子能Ee : 能级差(1~ 20eV) 各种能级跃迁 所需能量不同 ,则在不同电 磁波区出现不 同谱带