
第一节概述 体内大部分物质都可进行氧化反应,在生物体内进行的氧化反应与体外氧化反应有许多共同之处:它们都遵循氧化反应的一般规律,常见 的氧化方式有脱电子、脱氢和加氧等类型;最终氧化分解产物是C02和H20,同时释放能量。但是生物氧化反应又有其特点:①体外氧化反应 主要以热能形式释放能量;而生物氧化主要以生成ATP方式释放能量,为生物体所利用。②其最大区别在于:体外氧化往往在高温,强酸,强 碱或强氧化剂的催化下进行;而生物氧化是在恒温(37℃)和中性H环境下进行,催化氧化反应的催化剂是酶。 一、生物氧化酶类 体内催化氧化反应的酶有许多种,按照其催化氧化反应方式不同可分为三大类。 (一)脱氢氧化酶类 这一类中依据其反应受氢体或氧化产物不同,又可以分为三种, 1.氧化酶类(oxidases) 氧化酶直接作用于底物,以氧作为受氢体或受电子体,生成产物是水。氧化酶均为结合蛋白质,辅基常含有C2+,如细胞色素氧化酶、酚 氧化酶、抗坏血酸氧化酶等。抗坏血酸氧化酶可催化下述反应: 抗坏血酸越年复化通脱氢抗坏直酸十H,0 +1/202 2.需氧脱氢酶类(aerobic dehydrogenases) 需氧脱氢酶以FAD或FMN为辅基,以氧为直接受氢体,产物为H2O2或超氧离子(O2),某些色素如甲烯蓝(methylene blue,MB)、铁氰化钾 (【K3F(CN)6]、二氯酚靛酚可以作为这类酶的人工受氢体。如D?氨基酸氧化酶(辅基FAD)、L-氨基酸氧化酶(辅基FMN)、黄嘌呤氧化酶(辅 基FAD)、醛脱氢酶(辅基FAD)、单胺氧化酶(辅基FAD)、二胺氧化酶等。 胺YO,+H0 次黄呤(或黄吟)HO+O 醛人H,O,+NH 黄票岭(成尿酸) 人H0, 单胺氧化醇(含FAD) 黄琴吟氧化醇(含FAD.Mo.Fe) 粒细胞中NADH氧化酶和NADPH氧化酶也是需氧脱氢酶,它们催化下述反应: NAD(P)H+20,NADP)H氯化鹰NAD(P)+205+H+ 超氧离子在超氧化物歧化酶(superoxidedismutase,SOD)催化下生成H202与O2: 0+05+2Ht00H,0,+0, 3.不需氧脱氢酶类(anaerobic dehydrogenases) 这是人体内主要的脱氢酶类,其直接受氢体不是O2,而只能是某些辅酶(NAD+、NADP+)或辅基(FAD、FMN),辅酶或辅基还原后又将氢 原子传递至线粒体氧化呼吸链,最后将电子传给氧生成水,在此过程中释放出来的能量使ADP磷酸化生成ATP,如3?磷酸甘油醛脱氢酶、琥珀 酸脱氢酶、细胞色素体系等。 3-磷酸甘油醛)YNAD+B 琥珀酸YFAD 1,3-二醉酸廿袖酸人NADH+H 延胡索酸入FADH 3一映酸甘油醛脱氢酶 琥珀酸脱氢酶(SDH) 4.加氧酶类(oxygenases) 顾名思义,加氧酶催化加氧反应。根据向底物分子中加入氧原子的数目,又可分为加单氧酶(monooxygenase)和加双氧酶(dioxygenase): (I)加单氧酶又称为多功能氧化酶、混合功能氧化酶(mixed function oxidase)、羟化酶(hydroxylase)。加单氧酶催化O2分子中的一个原子 加到底物分子上使之羟化,另一个氧原子被NDPH+H+提供的氢还原生成水,在此氧化过程中无高能磷酸化合物生成,反应如下: RH+NADPH+H+O,加#毫ROH+NADP+HO 加单氧酶实际上是含有黄素酶及细胞色素的酶体系,常常是由细胞色素P450、NADPH细胞色素P450还原酶、NADPH和磷脂组成的复合 物。细胞色素P450是一种以血色素为辅基的b族细胞色素,其中的Fe3+可被Na2S203等还原为Fe2+,还原型的细胞色素P450与C0结合后在 450nm有最大吸收峰,故名细胞色素P450,它的作用类似于细胞色素aa3,能与氧直接反应,将电子传递给氧,因此也是一种终末氧化酶. 加单氧酶主要分布在肝、肾组织微粒体中,少数加单氧酶也存在于线粒体中,加单氧酶主要参与类固醇激素(性激素、肾上腺皮质激素)、 胆汁酸盐、胆色素、活性维生素D的生成和某些药物、毒物的生物转化过程。加单氧酶可受底物诱导,而且细胞色素P450基质特异性低,一种 基质提高了加单氧酶的活性便可同时加快几种物质的代谢速度,这与体内的药物代谢关系十分密切,例如以苯巴比妥作诱导物,可以提高机体 代谢胆红素、睾酮、氢化可地松、香豆素、洋地黄毒苷的速度,临床用药时应予考虑
第一节 概 述 体内大部分物质都可进行氧化反应,在生物体内进行的氧化反应与体外氧化反应有许多共同之处:它们都遵循氧化反应的一般规律,常见 的氧化方式有脱电子、脱氢和加氧等类型;最终氧化分解产物是CO2和H2O,同时释放能量。但是生物氧化反应又有其特点:①体外氧化反应 主要以热能形式释放能量;而生物氧化主要以生成ATP方式释放能量,为生物体所利用。②其最大区别在于:体外氧化往往在高温,强酸,强 碱或强氧化剂的催化下进行;而生物氧化是在恒温(37℃)和中性pH环境下进行,催化氧化反应的催化剂是酶。 一、生物氧化酶类 体内催化氧化反应的酶有许多种,按照其催化氧化反应方式不同可分为三大类。 (一)脱氢氧化酶类 这一类中依据其反应受氢体或氧化产物不同,又可以分为三种。 1.氧化酶类(oxidases) 氧化酶直接作用于底物,以氧作为受氢体或受电子体,生成产物是水。氧化酶均为结合蛋白质,辅基常含有Cu2+,如细胞色素氧化酶、酚 氧化酶、抗坏血酸氧化酶等。抗坏血酸氧化酶可催化下述反应: 2.需氧脱氢酶类(aerobic dehydrogenases) 需氧脱氢酶以FAD或FMN为辅基,以氧为直接受氢体,产物为H2O2或超氧离子(O2),某些色素如甲烯蓝(methylene blue,MB)、铁氰化钾 ([K3Fe(CN)6]、二氯酚靛酚可以作为这类酶的人工受氢体。如D?氨基酸氧化酶(辅基FAD)、L-氨基酸氧化酶(辅基FMN)、黄嘌呤氧化酶(辅 基FAD)、醛脱氢酶(辅基FAD)、单胺氧化酶(辅基FAD)、二胺氧化酶等。 粒细胞中NADH氧化酶和NADPH氧化酶也是需氧脱氢酶,它们催化下述反应: 超氧离子在超氧化物歧化酶(superoxidedismutase,SOD)催化下生成H2O2与O2: 3.不需氧脱氢酶类(anaerobic dehydrogenases) 这是人体内主要的脱氢酶类,其直接受氢体不是O2,而只能是某些辅酶(NAD+、NADP+)或辅基(FAD、FMN),辅酶或辅基还原后又将氢 原子传递至线粒体氧化呼吸链,最后将电子传给氧生成水,在此过程中释放出来的能量使ADP磷酸化生成ATP,如3?磷酸甘油醛脱氢酶、琥珀 酸脱氢酶、细胞色素体系等。 4.加氧酶类(oxygenases) 顾名思义,加氧酶催化加氧反应。根据向底物分子中加入氧原子的数目,又可分为加单氧酶(monooxygenase)和加双氧酶(dioxygenase)。 (1)加单氧酶 又称为多功能氧化酶、混合功能氧化酶(mixed function oxidase)、羟化酶(hydroxylase)。加单氧酶催化O2分子中的一个原子 加到底物分子上使之羟化,另一个氧原子被NADPH+H+提供的氢还原生成水,在此氧化过程中无高能磷酸化合物生成,反应如下: 加单氧酶实际上是含有黄素酶及细胞色素的酶体系,常常是由细胞色素P450、NADPH细胞色素P450还原酶、NADPH和磷脂组成的复合 物。细胞色素P450是一种以血色素为辅基的b族细胞色素,其中的Fe3+可被Na2S2O3等还原为Fe2+,还原型的细胞色素P450与CO结合后在 450nm有最大吸收峰,故名细胞色素P450,它的作用类似于细胞色素aa3,能与氧直接反应,将电子传递给氧,因此也是一种终末氧化酶。 加单氧酶主要分布在肝、肾组织微粒体中,少数加单氧酶也存在于线粒体中,加单氧酶主要参与类固醇激素(性激素、肾上腺皮质激素)、 胆汁酸盐、胆色素、活性维生素D的生成和某些药物、毒物的生物转化过程。加单氧酶可受底物诱导,而且细胞色素P450基质特异性低,一种 基质提高了加单氧酶的活性便可同时加快几种物质的代谢速度,这与体内的药物代谢关系十分密切,例如以苯巴比妥作诱导物,可以提高机体 代谢胆红素、睾酮、氢化可地松、香豆素、洋地黄毒苷的速度,临床用药时应予考虑

(2)加双氧酶此酶催化02分子中的两个原子分别加到底物分子中构成双键的两个碳原子上,如色氨酸毗咯酶(色氨酸加双氧酶)、胡萝卜素 加双氧酶分别催化下述反应: CH,-CHCOOH 色氨酸呲咯群、0 -CH,-CHCOOH NH, (色氮酸脚双氧酶) -NHCHO NH, 色氨酸 甲酰犬尿酸元 CH。-CH=CH-C B-胡数卜常 CHCHO 加双氧群,O B一胡梦卜素 视黄醛 5.过氧化氢酶和过氧化物酶 前已叙及需氧脱氢酶和超氧化物歧化酶催化的反应中有H202生成。过氧化氢具有一定的生理作用,粒细胞和吞噬细胞中的H202可杀死吞 噬的细菌,甲状腺上皮细胞和粒细胞中的H202可使?氧化生成12,进而使蛋白质碘化,这与甲状腺素的生成和消灭细菌有关。但是H202也可 使巯基酶和蛋白质氧化失活,还能氧化生物膜磷脂分子中的多不饱和脂防酸,损伤生物膜结构、影响生物膜的功能,此外H2O2还能破坏核酸 和粘多糖。人体某些组织如肝、肾、中性粒细胞及小肠粘膜上皮细胞中的过氧化物酶体内含有过氧化氢酶(触酶)和过氧化物酶,可利用或消除 细胞内的H2O2和过氧化物,防止其含量过高而起保护作用。 (1)过氧化氢酶(Catalase)此酶催化两个H202分子的氧化还原反应,生成H20并释放出02. H,0,+H,0,过x化氢鹿2H,0+0: 过氧化氢酶的催化效率极高,每个酶分子在0℃每分钟可催化264万个过氧化氢分子分解,因此人体一般不会发生H202的蓄积中毒。 (2)过氧化物酶(Peroxidase)此酶催化H2O2或过氧化物直接氧化酚类或胺类物质. R+H202一一→R0+H20或RH2+H202一-→R+2H20 某些组织的细胞中还有一种含硒(Se)的谷胱甘肽过氧化物酶(glutathione peroxidase),可催化下述反应: H202+2G-SH- -→2H20+GSSG ROOH+2G-SH- .→ROH+GSSG+H2O 生成的GSSG又可在谷胱甘肽还原酶催化下由NADPH+H+供氢还原生成G-SH: GSSG+NADPH十H+谷肤甘#还NADP++2G一SH 临床工作中判定粪便、消化液中是否有隐血时,就是利用血细胞中的过氧化物酶活性将愈创木酯或联苯胺氧化成蓝色化合物。 二、生物氧化的基本概念 机体内进行的脱氢,加氧等氧化反应总称为生物氧化,按照生理意义不同可分为两大类,一类主要是将代谢物或药物和毒物等通过氧化反 应进行生物转化,这类反应不伴有ATP的生成;另一类是糖、脂肪和蛋白质等营养物质通过氧化反应进行分解,生成H2O和CO2,同时伴有 ATP生物能的生成,这类反应进行过程中细胞要摄取O2,释放CO2故又形象地称之为细胞呼吸(cellularrespiration). 代谢物在体内的氧化可以分为三个阶段,首行是糖、脂肪和蛋白质经过分解代谢生成乙酰辅酶A中的乙酰基;接着乙酰辅酶A进入三羧酸 循环脱氢,生成CO2并使NAD+和FAD还原成NADH+H+、FADH2;第三阶段是NADH+H+和FADH2中的氢经呼吸链将电子传递给氧生成水, 氧化过程中释放出来的能量用于ATP合成。从广义来讲,上述三个阶段均为生物氧化,狭义地说只有第三个阶段才算是生物氧化,这是体内能 量生成的主要阶段,有关的前两个阶段已在代谢各章中讲述,本章只讨论第三个阶段,即代谢物脱下的氢是如何交给氧生成水的?细胞通过什 么方式将氧化过程中释放的能量转变成ATP分子中的高能键的? 第二节呼吸链 呼吸链(respiratorychain)是由一系列的递氢体(hydrogen transfer)和递电子体(eletron transfer)按一定的顺序排列所组成的连续反应体系, 它将代谢物脱下的成对氢原子交给氧生成水,同时有ATP生成。实际上呼吸链的作用代表着线粒体最基本的功能,呼吸链中的递氢体和递电子 体就是能传递氢原子或电子的载体,由于氢原子可以看作是由H+和组成的,所以递氢体也是递电子体,递氢体和递电子体的本质是酶、辅 酶、铺基或辅因子。 一、呼吸链的组成 构成呼吸链的递氢体和递电子体主要分为以下五类 (一)尼克酰胺腺嘌呤二核苷酸NAD+)或称辅酶I(Co。 为体内很多脱氢酶的辅酶,是连接作用物与呼吸链的重要环节,分子中除含尼克酰胺(维生素PP)外,还含有核糖、磷酸及一分子腺苷酸 (AMP),其结构如下:
(2)加双氧酶 此酶催化O2分子中的两个原子分别加到底物分子中构成双键的两个碳原子上,如色氨酸吡咯酶(色氨酸加双氧酶)、胡萝卜素 加双氧酶分别催化下述反应: 5.过氧化氢酶和过氧化物酶 前已叙及需氧脱氢酶和超氧化物歧化酶催化的反应中有H2O2生成。过氧化氢具有一定的生理作用,粒细胞和吞噬细胞中的H2O2可杀死吞 噬的细菌,甲状腺上皮细胞和粒细胞中的H2O2可使I?氧化生成I2,进而使蛋白质碘化,这与甲状腺素的生成和消灭细菌有关。但是H2O2也可 使巯基酶和蛋白质氧化失活,还能氧化生物膜磷脂分子中的多不饱和脂肪酸,损伤生物膜结构、影响生物膜的功能,此外H2O2还能破坏核酸 和粘多糖。人体某些组织如肝、肾、中性粒细胞及小肠粘膜上皮细胞中的过氧化物酶体内含有过氧化氢酶(触酶)和过氧化物酶,可利用或消除 细胞内的H2O2和过氧化物,防止其含量过高而起保护作用。 (1)过氧化氢酶(Catalase)此酶催化两个H2O2分子的氧化还原反应,生成H2O并释放出O2。 过氧化氢酶的催化效率极高,每个酶分子在0℃每分钟可催化264万个过氧化氢分子分解,因此人体一般不会发生H2O2的蓄积中毒。 (2)过氧化物酶(Peroxidase)此酶催化H2O2或过氧化物直接氧化酚类或胺类物质。 R+H2O2——→RO+H2O或RH2+H2O2——→R+2H2O 某些组织的细胞中还有一种含硒(Se)的谷胱甘肽过氧化物酶(glutathione peroxidase),可催化下述反应: H2O2+2G-SH——→2H2O+GSSG ROOH+2G-SH——→ROH+GSSG+H2O 生成的GSSG又可在谷胱甘肽还原酶催化下由NADPH+H+供氢还原生成G-SH: 临床工作中判定粪便、消化液中是否有隐血时,就是利用血细胞中的过氧化物酶活性将愈创木酯或联苯胺氧化成蓝色化合物。 二、生物氧化的基本概念 机体内进行的脱氢,加氧等氧化反应总称为生物氧化,按照生理意义不同可分为两大类,一类主要是将代谢物或药物和毒物等通过氧化反 应进行生物转化,这类反应不伴有ATP的生成;另一类是糖、脂肪和蛋白质等营养物质通过氧化反应进行分解,生成H2O和CO2,同时伴有 ATP生物能的生成,这类反应进行过程中细胞要摄取O2,释放CO2故又形象地称之为细胞呼吸(cellularrespiration)。 代谢物在体内的氧化可以分为三个阶段,首行是糖、脂肪和蛋白质经过分解代谢生成乙酰辅酶A中的乙酰基;接着乙酰辅酶A进入三羧酸 循环脱氢,生成CO2并使NAD+和FAD还原成NADH+H+、FADH2;第三阶段是NADH+H+和FADH2中的氢经呼吸链将电子传递给氧生成水, 氧化过程中释放出来的能量用于ATP合成。从广义来讲,上述三个阶段均为生物氧化,狭义地说只有第三个阶段才算是生物氧化,这是体内能 量生成的主要阶段,有关的前两个阶段已在代谢各章中讲述,本章只讨论第三个阶段,即代谢物脱下的氢是如何交给氧生成水的?细胞通过什 么方式将氧化过程中释放的能量转变成ATP分子中的高能键的? 第二节 呼 吸 链 呼吸链(respiratorychain)是由一系列的递氢体(hydrogen transfer)和递电子体(eletron transfer)按一定的顺序排列所组成的连续反应体系, 它将代谢物脱下的成对氢原子交给氧生成水,同时有ATP生成。实际上呼吸链的作用代表着线粒体最基本的功能,呼吸链中的递氢体和递电子 体就是能传递氢原子或电子的载体,由于氢原子可以看作是由H+和e组成的,所以递氢体也是递电子体,递氢体和递电子体的本质是酶、辅 酶、辅基或辅因子。 一、呼吸链的组成 构成呼吸链的递氢体和递电子体主要分为以下五类 (一)尼克酰胺腺嘌呤二核苷酸(NAD+)或称辅酶I(CoI)。 为体内很多脱氢酶的辅酶,是连接作用物与呼吸链的重要环节,分子中除含尼克酰胺(维生素PP)外,还含有核糖、磷酸及一分子腺苷酸 (AMP),其结构如下:
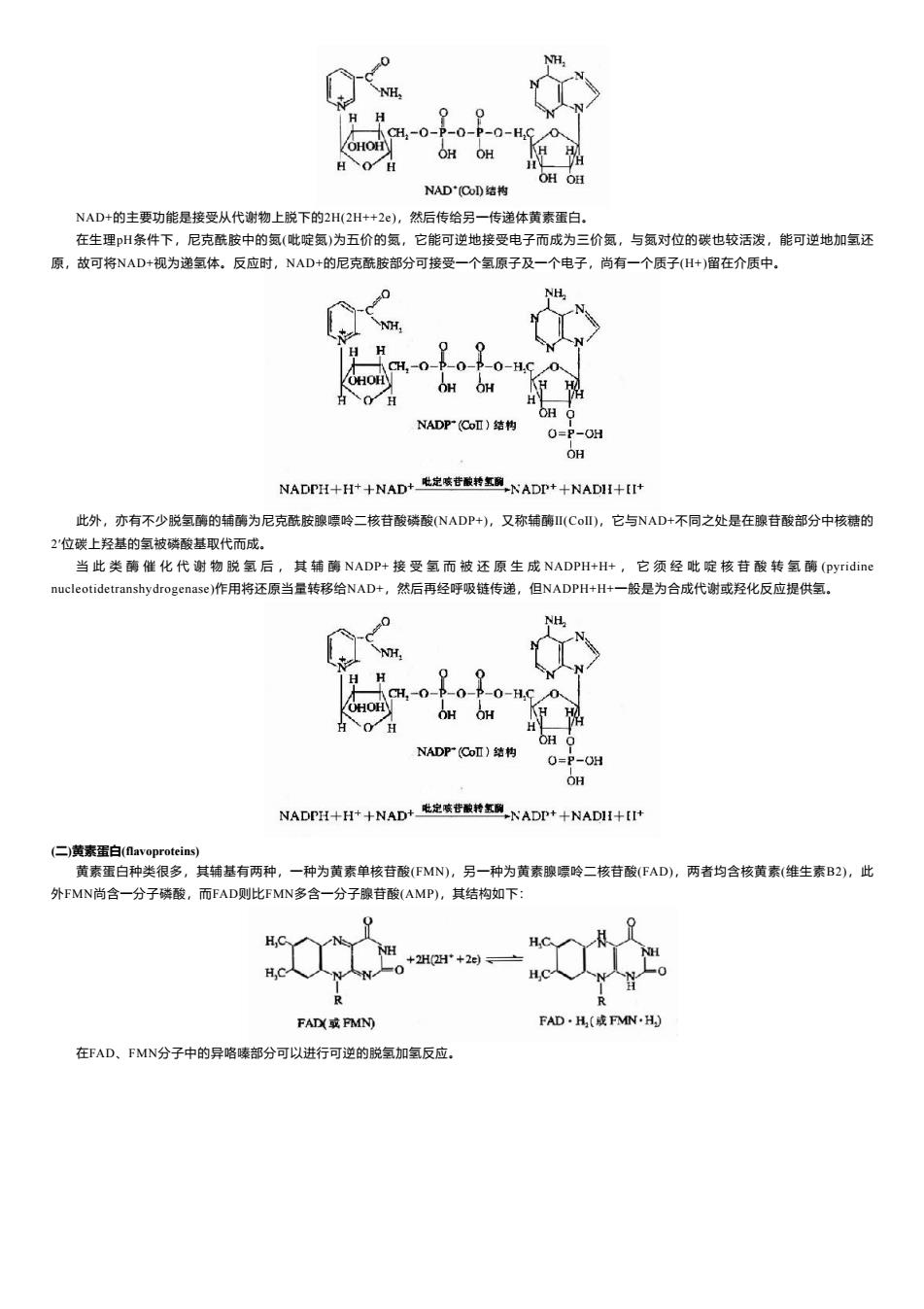
H H CH-0-P-0-P-0-H,C /OHOH OHOH H OH O NAD'(Co结构 NAD+的主要功能是接受从代谢物上脱下的2H(2H++2),然后传给另一传递体黄素蛋白。 在生理H条件下,尼克酰胺中的氨(吡啶氨)为五价的氨,它能可逆地接受电子而成为三价氨,与氨对位的碳也较活泼,能可逆地加氢还 原,故可将NAD+视为递氢体。反应时,NAD+的尼克酰胺部分可接受一个氢原子及一个电子,尚有一个质子(H+)留在介质中。 NH CH,-0-p-0-p-0-H.C OHOH OH OH H OH O NADP(Coll)结构 0=P-0H OH NADPH+-H+十NAD+定孩苷酸转氢NADP+十NADI+I时 此外,亦有不少脱氢酶的辅酶为尼克酰胺腺嘌呤二核苷酸磷酸(NADP+),又称辅酶I(CoI),它与NAD+不同之处是在腺苷酸部分中核糖的 2'位碳上羟基的氢被磷酸基取代而成。 当此类酶催化代谢物脱氢后,其辅酶NADP+接受氢而被还原生成NADPH+H+,它须经吡啶核苷酸转氢酶(pyridine nucleotidetranshydrogenase)作用将还原当量转移给NAD+,然后再经呼吸链传递,但NADPH+H+一般是为合成代谢或羟化反应提供氢。 H NH CH,-0-P-0-P-0-HC OHOH OH OH H 0 H OH Q NADP (Coll)结构 O=P-OH OH NADPH-+H+十NAD+飞定陵苷酸转氢NADP++NADI+-IIt (二)黄素蛋白(flavoproteins) 黄素蛋白种类很多,其辅基有两种,一种为黄素单核苷酸(FMN),另一种为黄素腺嘌呤二核苷酸(FAD),两者均含核黄素(维生素B2),此 外FMN尚含一分子磷酸,而FAD则比FMN多含一分子腺苷酸(AMP),其结构如下: H,9 H = +2H+2 FAD或FMN FAD·H(或FMN·H) 在FAD、FMN分子中的异咯嗪部分可以进行可逆的脱氢加氢反应
NAD+的主要功能是接受从代谢物上脱下的2H(2H++2e),然后传给另一传递体黄素蛋白。 在生理pH条件下,尼克酰胺中的氮(吡啶氮)为五价的氮,它能可逆地接受电子而成为三价氮,与氮对位的碳也较活泼,能可逆地加氢还 原,故可将NAD+视为递氢体。反应时,NAD+的尼克酰胺部分可接受一个氢原子及一个电子,尚有一个质子(H+)留在介质中。 此外,亦有不少脱氢酶的辅酶为尼克酰胺腺嘌呤二核苷酸磷酸(NADP+),又称辅酶Ⅱ(CoⅡ),它与NAD+不同之处是在腺苷酸部分中核糖的 2′位碳上羟基的氢被磷酸基取代而成。 当 此 类 酶 催 化 代 谢 物 脱 氢 后 , 其 辅 酶 NADP+ 接 受 氢 而 被 还 原 生 成 NADPH+H+ , 它 须 经 吡 啶 核 苷 酸 转 氢 酶 (pyridine nucleotidetranshydrogenase)作用将还原当量转移给NAD+,然后再经呼吸链传递,但NADPH+H+一般是为合成代谢或羟化反应提供氢。 (二)黄素蛋白(flavoproteins) 黄素蛋白种类很多,其辅基有两种,一种为黄素单核苷酸(FMN),另一种为黄素腺嘌呤二核苷酸(FAD),两者均含核黄素(维生素B2),此 外FMN尚含一分子磷酸,而FAD则比FMN多含一分子腺苷酸(AMP),其结构如下: 在FAD、FMN分子中的异咯嗪部分可以进行可逆的脱氢加氢反应

,蛋白质 a】 ●5 @ FD或FMN与酶蛋白部分之间是通过非共价键相连,但结合牢固,因此氧化与还原(即电子的失与得)都在同一个酶蛋白上进行,故黄素核 苷酸的氧化还原电位取决于和它们结合的蛋白质,所以有关的标准还原电位指的是特定的黄素蛋白,而不是游离的FMN或FAD;在电子转移反 应中它们只是在黄素蛋白的活性中心部分,而其本身不能作为作用物或产物,这和NAD+不同,NAD+与酶蛋白结合疏松,当与某酶蛋白结合 时可以从代谢物接受氢,而被还原为NADH,后者可以游离,再与另一种酶蛋白结合,释放氢后又被氧化为NAD+。 多数黄素蛋白参与呼吸链组成,与电子转移有关,如NADH脱氢酶(NADh dehydrogenase)以FMN为辅基,是呼吸链的组分之一,介于 NADH与其它电子传递体之间:琥珀酸脱氢酶,线粒体内的甘油磷酸脱氢酶(glycerol phosphate dehydrogenase)的辅基为FAD,它们可直接从 作用物转移还原当量H+e reducing equivalent)到呼吸链,此外脂肪酰CoA脱氢酶与琥珀酸脱氢酶相似,亦属于FAD为辅基的黄素蛋白类,也 能将还原当量从作用物传递进入呼吸链,但中间尚需另一电子传递体称为电子转移黄素蛋白(electron?transferring flavo?protein,ETFP,辅基为 FAD)参与才能完成。 (三)铁硫蛋白(iron?sulfur proteins,.Fe-S) 又称铁硫中心,其特点是含铁原子。铁是与无机硫原子或是蛋白质肽链上半胱氨酸残基的硫相结合,常见的铁硫蛋白有三种组合方式()单 个铁原子与4个半胱氨酸残基上的疏基硫相连。(b)两个铁原子、两个无机硫原子组成(2F-2S),其中每个铁原子还各与两个半胱氨酸残基的疏 基硫相结合。(c)由4个铁原子与4个无机硫原子相连(4F?4S),铁与硫相间排列在一个正六面体的8个顶角端;此外4个铁原子还各与一个半胱氨 酸残基上的疏基硫相连(图6-1)。 Fet Fott 图6·1铁硫蛋白结构 (a)单个铁与半胱氨酸硫相连(b)2Fe-2S(c)4Fe-4S 铁硫蛋白中的铁可以呈两价(还原型),也可呈三价(氧化型),由于铁的氧化、还原而达到传递电子作用
FAD或FMN与酶蛋白部分之间是通过非共价键相连,但结合牢固,因此氧化与还原(即电子的失与得)都在同一个酶蛋白上进行,故黄素核 苷酸的氧化还原电位取决于和它们结合的蛋白质,所以有关的标准还原电位指的是特定的黄素蛋白,而不是游离的FMN或FAD;在电子转移反 应中它们只是在黄素蛋白的活性中心部分,而其本身不能作为作用物或产物,这和NAD+不同,NAD+与酶蛋白结合疏松,当与某酶蛋白结合 时可以从代谢物接受氢,而被还原为NADH,后者可以游离,再与另一种酶蛋白结合,释放氢后又被氧化为NAD+。 多数黄素蛋白参与呼吸链组成,与电子转移有关,如NADH脱氢酶(NADh dehydrogenase)以FMN为辅基,是呼吸链的组分之一,介于 NADH与其它电子传递体之间;琥珀酸脱氢酶,线粒体内的甘油磷酸脱氢酶(glycerol phosphate dehydrogenase)的辅基为FAD,它们可直接从 作用物转移还原当量H++e reducing equivalent)到呼吸链,此外脂肪酰CoA脱氢酶与琥珀酸脱氢酶相似,亦属于FAD为辅基的黄素蛋白类,也 能将还原当量从作用物传递进入呼吸链,但中间尚需另一电子传递体称为电子转移黄素蛋白(electron?transferring flavo?protein,ETFP,辅基为 FAD)参与才能完成。 (三)铁硫蛋白(iron?sulfur proteins,Fe-S) 又称铁硫中心,其特点是含铁原子。铁是与无机硫原子或是蛋白质肽链上半胱氨酸残基的硫相结合,常见的铁硫蛋白有三种组合方式(a)单 个铁原子与4个半胱氨酸残基上的巯基硫相连。(b)两个铁原子、两个无机硫原子组成(2Fe-2S),其中每个铁原子还各与两个半胱氨酸残基的巯 基硫相结合。(c)由4个铁原子与4个无机硫原子相连(4Fe?4S),铁与硫相间排列在一个正六面体的8个顶角端;此外4个铁原子还各与一个半胱氨 酸残基上的巯基硫相连(图6-1)。 图6-1 铁硫蛋白结构 (a)单个铁与半胱氨酸硫相连 (b)2Fe-2S (c)4Fe-4S 铁硫蛋白中的铁可以呈两价(还原型),也可呈三价(氧化型),由于铁的氧化、还原而达到传递电子作用
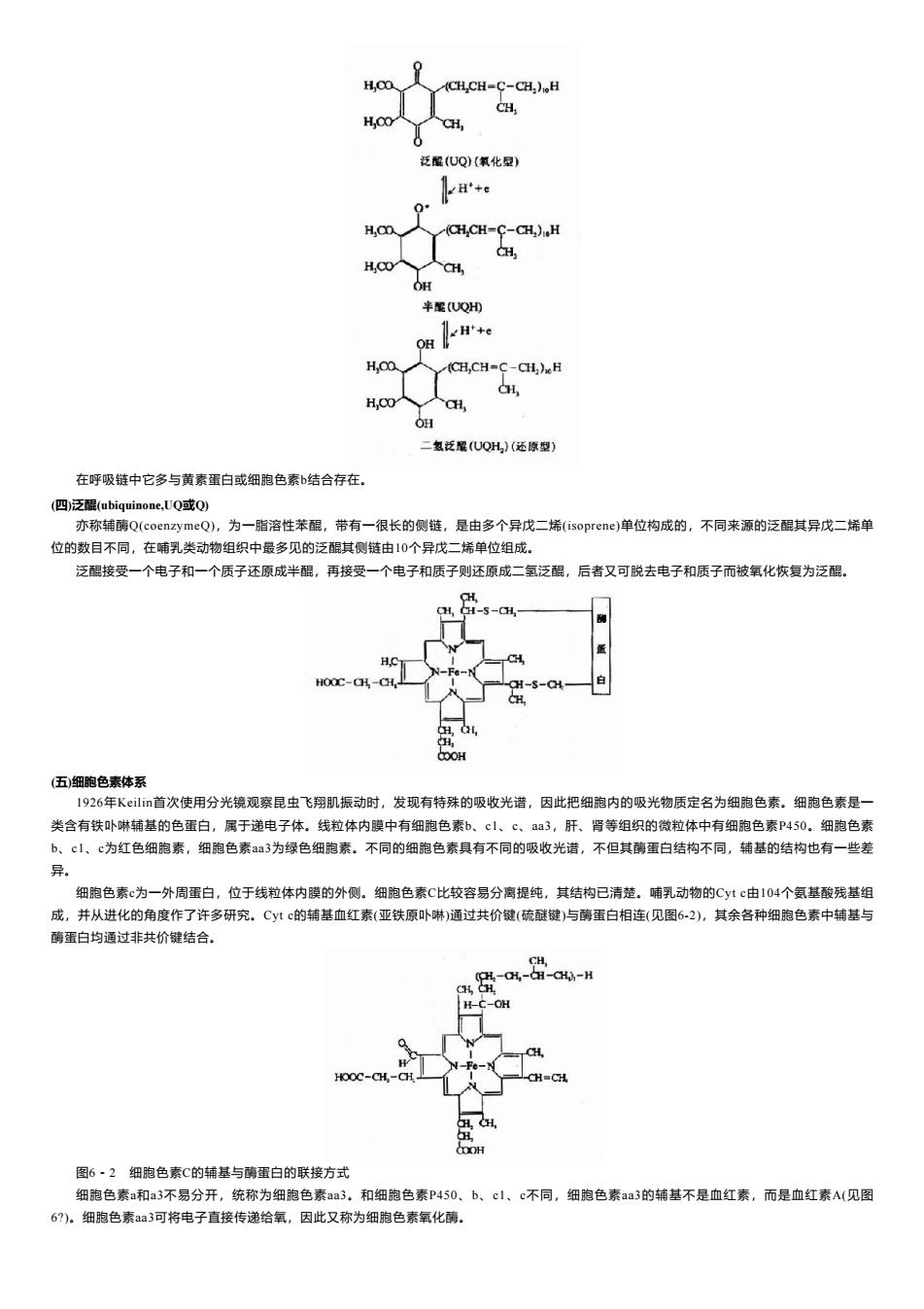
H,CO (CH,CH=C-CH)。H CH, H,CO CH, 泛鼠(UQ)(氧化型) 0* H,0 CH,CH=C-CH)。H H H,C人aH OH 半配UQH H'+e OH H,CO (CH,CH=C-CH,)H H H CO H OH 二氢泛曜(UQH)(还原型) 在呼吸链中它多与黄素蛋白或细胞色素b结合存在。 (四)泛醌(ubiquinone,Q或Q) 亦称辅酶Q(coenzymeQ),为一脂溶性苯醌,带有一很长的侧链,是由多个异戊二烯(isoprene)单位构成的,不同来源的泛醌其异戊二烯单 位的数目不同,在哺乳类动物组织中最多见的泛醌其侧链由10个异戊二烯单位组成。 泛醌接受一个电子和一个质子还原成半醌,再接受一个电子和质子则还原成二氢泛醌,后者又可脱去电子和质子而被氧化恢复为泛醌。 CH, H.H-S-●H 蛋 HC -Fe- HOOC-CH-CH- H-S- 白 (五)细胞色素体系 1926年Kεili首次使用分光镜观察昆虫飞翔肌振动时,发现有特殊的吸收光谱,因此把细胞内的吸光物质定名为细胞色素。细胞色素是一 类含有铁卟啉辅基的色蛋白,属于递电子体。线粒体内膜中有细胞色素b、cl、c、a3,肝、肾等组织的微粒体中有细胞色素P450。细胞色素 b、c1、c为红色细胞素,细胞色素aa3为绿色细胞素。不同的细胞色素具有不同的吸收光谱,不但其酶蛋白结构不同,辅基的结构也有一些差 异。 细胞色素c为一外周蛋白,位于线粒体内膜的外侧。细胞色素C比较容易分离提纯,其结构已清楚。哺乳动物的Cytc由104个氨基酸残基组 成,并从进化的角度作了许多研究。Cytc的辅基血红素(亚铁原卟琳)通过共价键(硫醚键)与酶蛋白相连(见图6-2),其余各种细胞色素中辅基与 酶蛋白均通过非共价键结合。 CH, (H-CH,--CH)-H CH,白H H-C-OH HO0C-CH-H CH=CH COOH 图6·2细胞色素C的辅基与酶蛋白的联接方式 细胞色素a和a3不易分开,统称为细胞色素aa3.和细胞色素P450、b、cl、c不同,细胞色素aa3的辅基不是血红素,而是血红素A(见图 6?)。细胞色素a3可将电子直接传递给氧,因此又称为细胞色素氧化酶
在呼吸链中它多与黄素蛋白或细胞色素b结合存在。 (四)泛醌(ubiquinone,UQ或Q) 亦称辅酶Q(coenzymeQ),为一脂溶性苯醌,带有一很长的侧链,是由多个异戊二烯(isoprene)单位构成的,不同来源的泛醌其异戊二烯单 位的数目不同,在哺乳类动物组织中最多见的泛醌其侧链由10个异戊二烯单位组成。 泛醌接受一个电子和一个质子还原成半醌,再接受一个电子和质子则还原成二氢泛醌,后者又可脱去电子和质子而被氧化恢复为泛醌。 (五)细胞色素体系 1926年Keilin首次使用分光镜观察昆虫飞翔肌振动时,发现有特殊的吸收光谱,因此把细胞内的吸光物质定名为细胞色素。细胞色素是一 类含有铁卟啉辅基的色蛋白,属于递电子体。线粒体内膜中有细胞色素b、c1、c、aa3,肝、肾等组织的微粒体中有细胞色素P450。细胞色素 b、c1、c为红色细胞素,细胞色素aa3为绿色细胞素。不同的细胞色素具有不同的吸收光谱,不但其酶蛋白结构不同,辅基的结构也有一些差 异。 细胞色素c为一外周蛋白,位于线粒体内膜的外侧。细胞色素C比较容易分离提纯,其结构已清楚。哺乳动物的Cyt c由104个氨基酸残基组 成,并从进化的角度作了许多研究。Cyt c的辅基血红素(亚铁原卟啉)通过共价键(硫醚键)与酶蛋白相连(见图6-2),其余各种细胞色素中辅基与 酶蛋白均通过非共价键结合。 图6-2 细胞色素C的辅基与酶蛋白的联接方式 细胞色素a和a3不易分开,统称为细胞色素aa3。和细胞色素P450、b、c1、c不同,细胞色素aa3的辅基不是血红素,而是血红素A(见图 6?)。细胞色素aa3可将电子直接传递给氧,因此又称为细胞色素氧化酶

-04卡 0.34◆NaD 02 氧 -0.07 还原 0 +0.05- 的 +02 +0.25 伏特 +028 +04 +06 +0.8+0.82 图6-3血红素A结构式 铁卟啉辅基所含Fe2+可有Fε2+←一Fe3+e的互变,因此起到传递电子的作用。铁原子可以和酶蛋白及卟啉环形成6个配位键。细胞色素 a3和P?450铺基中的铁原子只形成5个配位键,还能与氧再形成一个配位键,将电子直接传递给氧,也可与CO、氰化物、H2S或叠氨化合物形 成一个配位键。细胞色素aa3与氰化物结合就阻断了整个呼吸链的电子传递,引起氰化物中毒。 二、呼吸链中各种传递体的排列顺序 (一确定排列顺序的方法 1标准氧化还原电位的数值表示氧化还原能力的大小,标准氧化还原电位负值越大,其还原性越强,容易被氧化:标准氧化还原电位正值 越大,其氧化性越强,容易被还原。因此呼吸链中各种组分的排列顺序应当由低电位依次向高电位排列(图·4)。 100 00 分数 2 NAD FP b c NAD FP b 图64各种传递体的标准氧化还原电位 2.还原程度来确定。Chance和Williams使用分光光度法测定离体的线粒体在有氧条件下三羧酸循环反应达到平衡时,呼吸链中各种传递体 的还原程度。反应达到平衡时从底物一侧到氧一侧的各种传递体的还原程度应当是递减的,底物的一侧最高,氧一侧最低,如下表中数据所 示。 表6.1有氧动态平衡时电子传递体的还原程度 传递体 NAD FP Cytb Cyte Cty aa3 还原型% 53 20 16 6 1 FP:黄素蛋白 这种情况好象物理学上的联通管,图6?中,若进水量等于出水量,即流量达到平衡时,离进水口最近的水管中水位最高,离出水管最近 的水管中水位最低,从进水管到出水管水位逐渐减低,若把水流视为电子流,就是上述实验中的情况。 3使用特异的抑制剂特异的抑制剂能阻断呼吸链中的特定环节,阻断部位的底物一侧的各种传递体应为还原型,阻断部位的氧一侧的各 种传递体应为氧化型,正象我们阻断联通管的底部一样,阻断部位以前的各水管中水是满的,而阻断部位以后的各水管中水均流光(见图6-5, B). 2H* FMNH SH/NAD*AL(Fe-S) CoQ2Ct-Fe“ 0 FMN 1 Fe-s) CoQH 2-F2八0H,0 +H* 图6-5有氧氧化稳定时各种传递体的还原太分数 A.不加抑制剂B.加入抗霉A阻断 复合物I:催化NADH氧化、CoQ还原。 复合物:催化琥珀酸氧化、CoQ还原
图6-3 血红素A结构式 铁卟啉辅基所含Fe2+可有Fe2+←→Fe3++e的互变,因此起到传递电子的作用。铁原子可以和酶蛋白及卟啉环形成6个配位键。细胞色素 aa3和P?450辅基中的铁原子只形成5个配位键,还能与氧再形成一个配位键,将电子直接传递给氧,也可与CO、氰化物、H2S或叠氮化合物形 成一个配位键。细胞色素aa3与氰化物结合就阻断了整个呼吸链的电子传递,引起氰化物中毒。 二、呼吸链中各种传递体的排列顺序 (一)确定排列顺序的方法 1.标准氧化还原电位的数值表示氧化还原能力的大小,标准氧化还原电位负值越大,其还原性越强,容易被氧化;标准氧化还原电位正值 越大,其氧化性越强,容易被还原。因此呼吸链中各种组分的排列顺序应当由低电位依次向高电位排列(图-4)。 图6-4 各种传递体的标准氧化还原电位 2.还原程度来确定。Chance和Williams使用分光光度法测定离体的线粒体在有氧条件下三羧酸循环反应达到平衡时,呼吸链中各种传递体 的还原程度。反应达到平衡时从底物一侧到氧一侧的各种传递体的还原程度应当是递减的,底物的一侧最高,氧一侧最低,如下表中数据所 示。 表6-1 有氧动态平衡时电子传递体的还原程度 传递体 NAD FP Cyt b Cyt c Cty aa3 还原型% 53 20 16 6 1 FP:黄素蛋白 这种情况好象物理学上的联通管,图6?A中,若进水量等于出水量,即流量达到平衡时,离进水口最近的水管中水位最高,离出水管最近 的水管中水位最低,从进水管到出水管水位逐渐减低,若把水流视为电子流,就是上述实验中的情况。 3.使用特异的抑制剂 特异的抑制剂能阻断呼吸链中的特定环节,阻断部位的底物一侧的各种传递体应为还原型,阻断部位的氧一侧的各 种传递体应为氧化型,正象我们阻断联通管的底部一样,阻断部位以前的各水管中水是满的,而阻断部位以后的各水管中水均流光(见图6-5, B)。 图6-5 有氧氧化稳定时各种传递体的还原太分数 A.不加抑制剂 B.加入抗霉A阻断 复合物Ⅰ:催化NADH氧化、CoQ还原。 复合物Ⅱ:催化琥珀酸氧化、CoQ还原
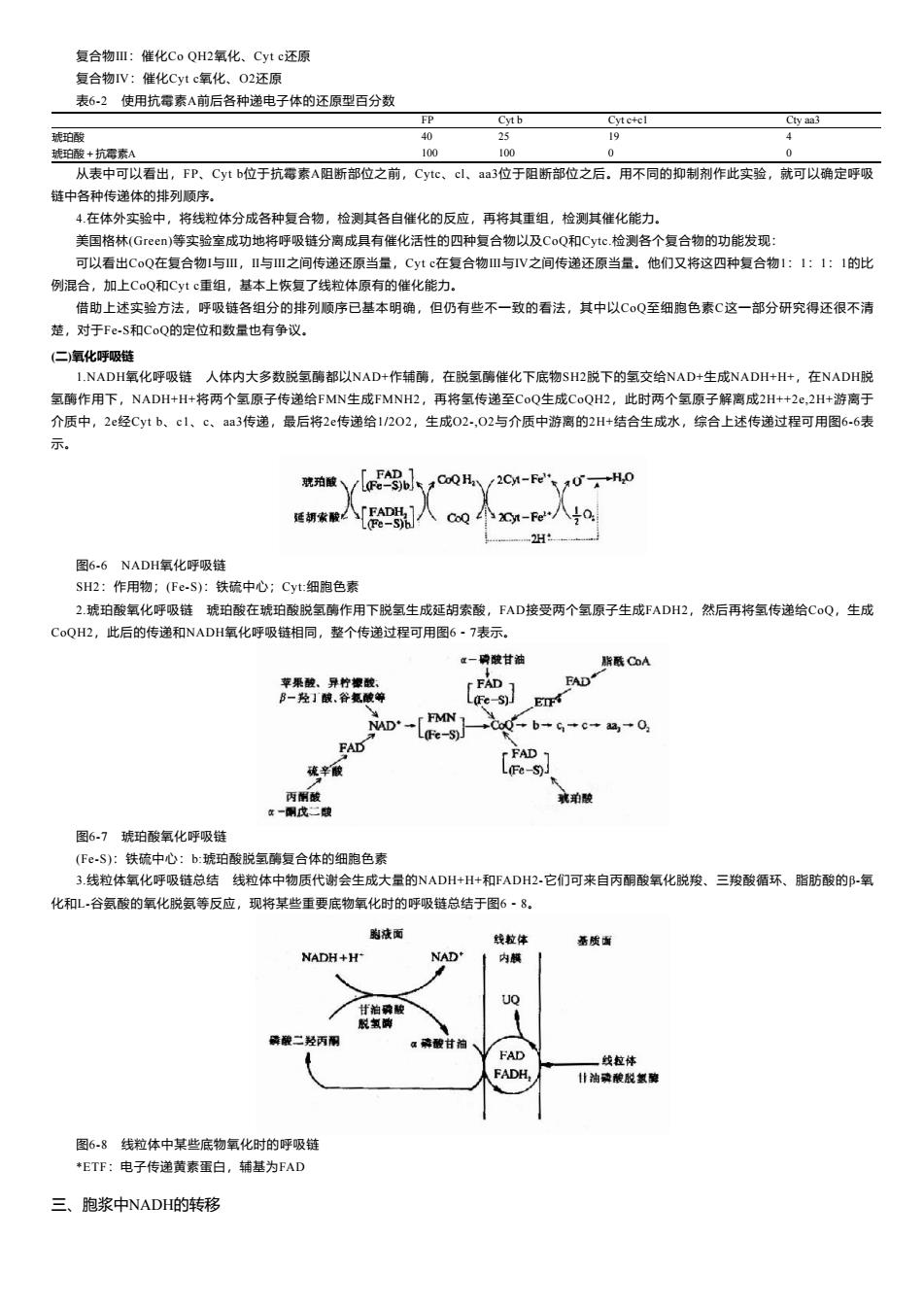
复合物Ⅲ:催化CoQH2氧化、Cytc还原 复合物IV:催化Cytc氧化、O2还原 表6-2使用抗霉素A前后各种递电子体的还原型百分数 FP Cytb Cytc+cl Cty aa3 琥珀酸 40 25 19 琥珀酸+抗霉素A 100 100 0 0 从表中可以看出,FP、Cytb位于抗霉素A阻断部位之前,Cytc、cl、aa3位于阻断部位之后。用不同的抑制剂作此实验,就可以确定呼吸 链中各种传递体的排列顺序。 4在体外实验中,将线粒体分成各种复合物,检测其各自催化的反应,再将其重组,检测其催化能力。 美国格林(Green)等实验室成功地将呼吸链分离成具有催化活性的四种复合物以及CoQ和Cytc.检测各个复合物的功能发现: 可以看出CoQ在复合物I与Ⅲ,Ⅱ与Ⅲ之间传递还原当量,Cytc在复合物Ⅲ与V之间传递还原当量。他们又将这四种复合物1:1:1:1的比 例混合,加上CoQ和Cytc重组,基本上恢复了线粒体原有的催化能力。 借助上述实验方法,呼吸链各组分的排列顺序已基本明确,但仍有些不一致的看法,其中以CQ至细胞色素C这一部分研究得还很不清 楚,对于Fe-S和CoQ的定位和数量也有争议。 (仁)氧化呼吸链 1.NADH氧化呼吸链人体内大多数脱氢酶都以NAD+作辅酶,在脱氢酶催化下底物SH2脱下的氢交给NAD+生成NADH+H+,在NADH脱 氢酶作用下,NADH+H+将两个氢原子传递给FMN生成FMNH2,再将氢传递至CoQ生成CoQH2,此时两个氢原子解离成2H++2e,2H+游离于 介质中,2e经Cytb、c1、c、aa3传递,最后将2e传递给1/202,生成02-,02与介质中游离的2H+结合生成水,综合上述传递过程可用图6-6表 示。 院珀酸 FAD 1 (Fe-s)b CoQ H/2Cy1-Fe 0+H0 延胡索酸 FADH e-sth 2Cyt-Fe 2 图6-6NADH氧化呼吸链 SH2:作用物;(Fe-S):铁硫中心;Cyt:细胞色素 2.琥珀酸氧化呼吸链琥珀酸在琥珀酸脱氢酶作用下脱氢生成延胡索酸,FAD接受两个氢原子生成FADH2,然后再将氢传递给CoQ,生成 CoQH2,此后的传递和NADH氧化呼吸链相同,整个传递过程可用图6-7表示。 位一碑酸甘油 脂酥C0A 苹果酸、异柠檬酸、 FAD 1 FAD B一羟」酸,谷氮酸等 L民eS)E MD·-[MN L(Fe-S)J +Cc0→b→G+c+4+0 FAD FAD 硫辛酸 L(Fe-S)J 丙削酸 观珀酸 年一酮戊二酸 图6.7琥珀酸氧化呼吸链 (Fe-S):铁硫中心:b:琥珀酸脱氢酶复合体的细胞色素 3.线粒体氧化呼吸链总结线粒体中物质代谢会生成大量的NADH+H+和FADH2-它们可来自丙酮酸氧化脱羧、三羧酸循环、脂肪酸的邹-氧 化和L-谷氨酸的氧化脱氨等反应,现将某些重要底物氧化时的呼吸链总结于图6·8。 跑液面 线拉体 蕃质面 NADH+H NaD' 内麟 UQ 甘泊磷酸 脱氢脚 磷酸二羟丙丽 a磷酸甘油 FAD 一线拉体 FADH. 甘油磷酸脱氢魏 图6-8线粒体中某些底物氧化时的呼吸链 *ETF:电子传递黄素蛋白,铺基为FAD 三、胞浆中NADH的转移
复合物Ⅲ:催化Co QH2氧化、Cyt c还原 复合物Ⅳ:催化Cyt c氧化、O2还原 表6-2 使用抗霉素A前后各种递电子体的还原型百分数 FP Cyt b Cyt c+c1 Cty aa3 琥珀酸 40 25 19 4 琥珀酸+抗霉素A 100 100 0 0 从表中可以看出,FP、Cyt b位于抗霉素A阻断部位之前,Cytc、cl、aa3位于阻断部位之后。用不同的抑制剂作此实验,就可以确定呼吸 链中各种传递体的排列顺序。 4.在体外实验中,将线粒体分成各种复合物,检测其各自催化的反应,再将其重组,检测其催化能力。 美国格林(Green)等实验室成功地将呼吸链分离成具有催化活性的四种复合物以及CoQ和Cytc.检测各个复合物的功能发现: 可以看出CoQ在复合物Ⅰ与Ⅲ,Ⅱ与Ⅲ之间传递还原当量,Cyt c在复合物Ⅲ与Ⅳ之间传递还原当量。他们又将这四种复合物1:1:1:1的比 例混合,加上CoQ和Cyt c重组,基本上恢复了线粒体原有的催化能力。 借助上述实验方法,呼吸链各组分的排列顺序已基本明确,但仍有些不一致的看法,其中以CoQ至细胞色素C这一部分研究得还很不清 楚,对于Fe-S和CoQ的定位和数量也有争议。 (二)氧化呼吸链 1.NADH氧化呼吸链 人体内大多数脱氢酶都以NAD+作辅酶,在脱氢酶催化下底物SH2脱下的氢交给NAD+生成NADH+H+,在NADH脱 氢酶作用下,NADH+H+将两个氢原子传递给FMN生成FMNH2,再将氢传递至CoQ生成CoQH2,此时两个氢原子解离成2H++2e,2H+游离于 介质中,2e经Cyt b、c1、c、aa3传递,最后将2e传递给1/2O2,生成O2-,O2与介质中游离的2H+结合生成水,综合上述传递过程可用图6-6表 示。 图6-6 NADH氧化呼吸链 SH2:作用物;(Fe-S):铁硫中心;Cyt:细胞色素 2.琥珀酸氧化呼吸链 琥珀酸在琥珀酸脱氢酶作用下脱氢生成延胡索酸,FAD接受两个氢原子生成FADH2,然后再将氢传递给CoQ,生成 CoQH2,此后的传递和NADH氧化呼吸链相同,整个传递过程可用图6-7表示。 图6-7 琥珀酸氧化呼吸链 (Fe-S):铁硫中心:b:琥珀酸脱氢酶复合体的细胞色素 3.线粒体氧化呼吸链总结 线粒体中物质代谢会生成大量的NADH+H+和FADH2-它们可来自丙酮酸氧化脱羧、三羧酸循环、脂肪酸的β-氧 化和L-谷氨酸的氧化脱氨等反应,现将某些重要底物氧化时的呼吸链总结于图6-8。 图6-8 线粒体中某些底物氧化时的呼吸链 *ETF:电子传递黄素蛋白,辅基为FAD 三、胞浆中NADH的转移
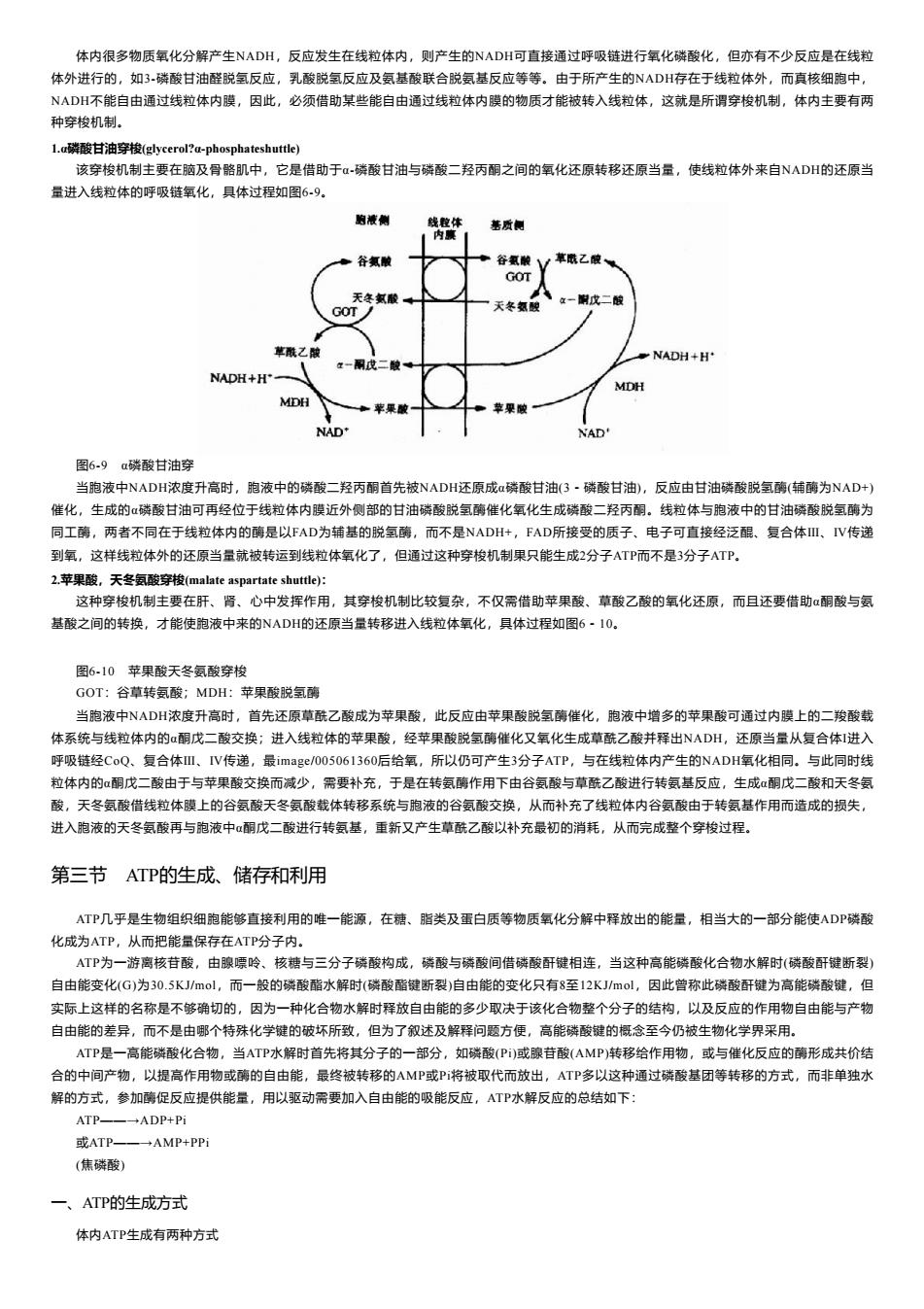
体内很多物质氧化分解产生NADH,反应发生在线粒体内,则产生的NADH可直接通过呼吸链进行氧化磷酸化,但亦有不少反应是在线粒 体外进行的,如3-磷酸甘油醛脱氢反应,乳酸脱氢反应及氨基酸联合脱氨基反应等等。由于所产生的NADH存在于线粒体外,而真核细胞中, NADH不能自由通过线粒体内膜,因此,必须借助某些能自由通过线粒体内膜的物质才能被转入线粒体,这就是所谓穿梭机制,体内主要有两 种穿梭机制。 L.a磷酸甘油穿梭(glycerol?a-phosphateshuttle) 该穿梭机制主要在脑及骨骼肌中,它是借助于α-磷酸甘油与磷酸二羟丙酮之间的氧化还原转移还原当量,使线粒体外来自NADH的还原当 量进入线粒体的呼吸链氧化,具体过程如图6-9。 的液侧 线粒体 基质侧 内腹 谷氯酸 谷氨酸1 草鼠乙酸 GOT 天冬氨酸。 GOT 天冬氢酸 立一时戊二酸 草酰乙酸 NADH+H' NADH+H MDH MDH NAD' NAD' 图6-9α磷酸甘油穿 当胞液中NADH浓度升高时,胞液中的磷酸二羟丙酮首先被NADH还原成α磷酸甘油(3·磷酸甘油),反应由甘油磷酸脱氢酶(辅酶为NAD+) 催化,生成的α磷酸甘油可再经位于线粒体内膜近外侧部的甘油磷酸脱氢酶催化氧化生成磷酸二羟丙酮。线粒体与胞液中的甘油磷酸脱氢酶为 同工酶,两者不同在于线粒体内的酶是以FAD为铺基的脱氢酶,而不是NADH+,FAD所接受的质子、电子可直接经泛醌、复合体Ⅲ、IV传递 到氧,这样线粒体外的还原当量就被转运到线粒体氧化了,但通过这种穿梭机制果只能生成2分子ATP而不是3分子ATP。 2.,苹果酸,天冬氨酸穿梭(malate aspartate shuttle)少: 这种穿梭机制主要在肝、肾、心中发挥作用,其穿梭机制比较复杂,不仅需借助苹果酸、草酸乙酸的氧化还原,而且还要借助α酮酸与氨 基酸之间的转换,才能使胞液中来的NDH的还原当量转移进入线粒体氧化,具体过程如图6·1O。 图6-10苹果酸天冬氨酸穿梭 GOT:谷草转氨酸;MDH:苹果酸脱氢酶 当胞液中NADH浓度升高时,首先还原草酰乙酸成为苹果酸,此反应由苹果酸脱氢酶催化,胞液中增多的苹果酸可通过内膜上的二羧酸载 体系统与线粒体内的α酮戊二酸交换;进入线粒体的苹果酸,经苹果酸脱氢酶催化又氧化生成草酰乙酸并释出NADH,还原当量从复合体1进入 呼吸链经CoQ、复合体Ⅲ、IV传递,最image/005061360后给氧,所以仍可产生3分子ATP,与在线粒体内产生的NADH氧化相同.。与此同时线 粒体内的α酮戊二酸由于与苹果酸交换而减少,需要补充,于是在转氨酶作用下由谷氨酸与草酰乙酸进行转氨基反应,生成酮戊二酸和天冬氨 酸,天冬氨酸借线粒体膜上的谷氨酸天冬氨酸载体转移系统与胞液的谷氨酸交换,从而补充了线粒体内谷氨酸由于转氨基作用而造成的损失, 进入胞液的天冬氨酸再与胞液中α酮戊二酸进行转氨基,重新又产生草酰乙酸以补充最初的消耗,从而完成整个穿梭过程。 第三节ATP的生成、储存和利用 ATP几乎是生物组织细胞能够直接利用的唯一能源,在糖、脂类及蛋白质等物质氧化分解中释放出的能量,相当大的一部分能使ADP磷酸 化成为ATP,从而把能量保存在ATP分子内。 ATP为一游离核苷酸,由腺嘌呤、核糖与三分子磷酸构成,磷酸与磷酸间借磷酸酐键相连,当这种高能磷酸化合物水解时(磷酸酐键断裂) 自由能变化(G)为30.5KJ/mol,而一般的磷酸酯水解时(磷酸酯键断裂)自由能的变化只有8至12KJ/mol,因此曾称此磷酸酐键为高能磷酸键,但 实际上这样的名称是不够确切的,因为一种化合物水解时释放自由能的多少取决于该化合物整个分子的结构,以及反应的作用物自由能与产物 自由能的差异,而不是由哪个特殊化学键的破坏所致,但为了叙述及解释问题方便,高能磷酸键的概念至今仍被生物化学界采用。 ATP是一高能磷酸化合物,当ATP水解时首先将其分子的一部分,如磷酸(P)或腺苷酸(AMP)转移给作用物,或与催化反应的酶形成共价结 合的中间产物,以提高作用物或酶的自由能,最终被转移的AMP或P将被取代而放出,ATP多以这种通过磷酸基团等转移的方式,而非单独水 解的方式,参加酶促反应提供能量,用以驱动需要加入自由能的吸能反应,ATP水解反应的总结如下: ATP- -ADP+Pi 或ATP AMP+PPi (焦磷酸) 一、ATP的生成方式 体内ATP生成有两种方式
体内很多物质氧化分解产生NADH,反应发生在线粒体内,则产生的NADH可直接通过呼吸链进行氧化磷酸化,但亦有不少反应是在线粒 体外进行的,如3-磷酸甘油醛脱氢反应,乳酸脱氢反应及氨基酸联合脱氨基反应等等。由于所产生的NADH存在于线粒体外,而真核细胞中, NADH不能自由通过线粒体内膜,因此,必须借助某些能自由通过线粒体内膜的物质才能被转入线粒体,这就是所谓穿梭机制,体内主要有两 种穿梭机制。 1.α磷酸甘油穿梭(glycerol?α-phosphateshuttle) 该穿梭机制主要在脑及骨骼肌中,它是借助于α-磷酸甘油与磷酸二羟丙酮之间的氧化还原转移还原当量,使线粒体外来自NADH的还原当 量进入线粒体的呼吸链氧化,具体过程如图6-9。 图6-9 α磷酸甘油穿 当胞液中NADH浓度升高时,胞液中的磷酸二羟丙酮首先被NADH还原成α磷酸甘油(3-磷酸甘油),反应由甘油磷酸脱氢酶(辅酶为NAD+) 催化,生成的α磷酸甘油可再经位于线粒体内膜近外侧部的甘油磷酸脱氢酶催化氧化生成磷酸二羟丙酮。线粒体与胞液中的甘油磷酸脱氢酶为 同工酶,两者不同在于线粒体内的酶是以FAD为辅基的脱氢酶,而不是NADH+,FAD所接受的质子、电子可直接经泛醌、复合体Ⅲ、Ⅳ传递 到氧,这样线粒体外的还原当量就被转运到线粒体氧化了,但通过这种穿梭机制果只能生成2分子ATP而不是3分子ATP。 2.苹果酸,天冬氨酸穿梭(malate aspartate shuttle): 这种穿梭机制主要在肝、肾、心中发挥作用,其穿梭机制比较复杂,不仅需借助苹果酸、草酸乙酸的氧化还原,而且还要借助α酮酸与氨 基酸之间的转换,才能使胞液中来的NADH的还原当量转移进入线粒体氧化,具体过程如图6-10。 图6-10 苹果酸天冬氨酸穿梭 GOT:谷草转氨酸;MDH:苹果酸脱氢酶 当胞液中NADH浓度升高时,首先还原草酰乙酸成为苹果酸,此反应由苹果酸脱氢酶催化,胞液中增多的苹果酸可通过内膜上的二羧酸载 体系统与线粒体内的α酮戊二酸交换;进入线粒体的苹果酸,经苹果酸脱氢酶催化又氧化生成草酰乙酸并释出NADH,还原当量从复合体I进入 呼吸链经CoQ、复合体Ⅲ、Ⅳ传递,最image/005061360后给氧,所以仍可产生3分子ATP,与在线粒体内产生的NADH氧化相同。与此同时线 粒体内的α酮戊二酸由于与苹果酸交换而减少,需要补充,于是在转氨酶作用下由谷氨酸与草酰乙酸进行转氨基反应,生成α酮戊二酸和天冬氨 酸,天冬氨酸借线粒体膜上的谷氨酸天冬氨酸载体转移系统与胞液的谷氨酸交换,从而补充了线粒体内谷氨酸由于转氨基作用而造成的损失, 进入胞液的天冬氨酸再与胞液中α酮戊二酸进行转氨基,重新又产生草酰乙酸以补充最初的消耗,从而完成整个穿梭过程。 第三节 ATP的生成、储存和利用 ATP几乎是生物组织细胞能够直接利用的唯一能源,在糖、脂类及蛋白质等物质氧化分解中释放出的能量,相当大的一部分能使ADP磷酸 化成为ATP,从而把能量保存在ATP分子内。 ATP为一游离核苷酸,由腺嘌呤、核糖与三分子磷酸构成,磷酸与磷酸间借磷酸酐键相连,当这种高能磷酸化合物水解时(磷酸酐键断裂) 自由能变化(G)为30.5KJ/mol,而一般的磷酸酯水解时(磷酸酯键断裂)自由能的变化只有8至12KJ/mol,因此曾称此磷酸酐键为高能磷酸键,但 实际上这样的名称是不够确切的,因为一种化合物水解时释放自由能的多少取决于该化合物整个分子的结构,以及反应的作用物自由能与产物 自由能的差异,而不是由哪个特殊化学键的破坏所致,但为了叙述及解释问题方便,高能磷酸键的概念至今仍被生物化学界采用。 ATP是一高能磷酸化合物,当ATP水解时首先将其分子的一部分,如磷酸(Pi)或腺苷酸(AMP)转移给作用物,或与催化反应的酶形成共价结 合的中间产物,以提高作用物或酶的自由能,最终被转移的AMP或Pi将被取代而放出,ATP多以这种通过磷酸基团等转移的方式,而非单独水 解的方式,参加酶促反应提供能量,用以驱动需要加入自由能的吸能反应,ATP水解反应的总结如下: ATP——→ADP+Pi 或ATP——→AMP+PPi (焦磷酸) 一、ATP的生成方式 体内ATP生成有两种方式

(一)底物水平磷酸化(substrate level phosphorylation) 底物分子中的能量直接以高能键形式转移给ADP生成ATP,这个过程称为底物水平磷酸化,这一磷酸化过程在胞浆和线粒体中进行,包括 有 1.1,子二磷酸甘泊酸十ADP一酸甘油酸题3-瞬酸甘油酸十ATP 2.群酸烯醇式丙酮酸十ADP因酸盖烯醇式丙酮酸+ATP 3.琥珀酰CoA十H,PO,+GDP装险酸t整能我珀酸+-CoASH+-GTP (二)氧化磷酸化(oxidative phosphorylation) 氧化和磷酸化是两个不同的概念。氧化是底物脱氢或失电子的过程,而磷酸化是指ADP与P合成ATP的过程。在结构完整的线粒体中氧化 与磷酸化这两个过程是紧密地偶联在一起的,即氧化释放的能量用于ATP合成,这个过程就是氧化磷酸化,氧化是磷酸化的基础,而磷酸化是 氧化的结果。 机体代谢过程中能量的主要来源是线粒体,既有氧化磷酸化,也有底物水平磷酸化,以前者为主要来源。胞液中底物水平磷酸化也能获得 部分能量,实际上这是酵解过程的能量来源。对于酵解组织、红细胞和组织相对缺氧时的能量来源是十分重要的。 二、氧化磷酸化偶联部位的测定 确定氧化磷酸化偶联部位通常用两种方法。 (一P/0值测定 P0值指在氧化磷酸化过程中消耗一克原子氧所消耗的无机磷的克原子数,或者说消耗一克原子氧所生成的ATP的克分子数。P0值实质上 指的是呼吸过程中磷酸化的效率。 测定P/0值的方法通常是在一密闭的容器中加入氧化的底物、ADP、P、氧饱和的缓冲液,再加入线粒体制剂时就会有氧化磷酸化进行。反 应终了时测定O2消耗量(可用氧电极法)和P消耗量(或ATP生成量)就可以计算出P/0值了.在反应系统中加入不同的底物,可测得各自的P10 值,结合我们所了解的呼吸链的传递顺序,就可以分析出大致的偶联部位了。 表6-3离体线粒体的P/0比值 底物 呼吸的组成 P/O比值 生成ATP数 (1)B羟丁酸 NAD+-FMN-CoQ-Cyt-+02 2.4-2.8 3 (2)琥珀酸 FAN→CoQ→Cyt→O2 1.7 (3)抗坏血酸 Cyt→Cytaa3-02 0.88 1 (4)细胞色素c Cytaa3-02 0.61-0.68 1 从上表可以看出P0值为小数,由于线粒体的偶联作用在离体条件下不能完全发挥,故可认为实际的TP生成数是他们所接近的正整数值。 比较表中的(1)和(2),呼吸链传递的差异是在CoQ之间,两者ATP的生成数相差1,所以这个ATP的生成部位一定在NAD→CoQ之间。 比较表中(2)和(3),呼吸链传递的差异是在Cytc之间,两者ATP的生成数相差1,所以这个ATP的生成部位在CoQ→Cytc之间。 比较表中(3)和(4),生成的ATP数均为l,呼吸链传递的区别是在Cytc一Cyt aa3,故Cytc一aa3不存在偶联部位,而在Cyt aa3一O2之间存 在若一个偶联部位。 二)根据氧化还原电位计算电子传递释放的能量是否能满足ATP合成的需要 氧化还原反应中释放的自由能△G'O与反应底物和产物标准氧化还原电位差值(aE'O)之间存在下述关系:aG'O=?F△E'O 式中n为氧化还原反应中电子转移数目,F为法拉弟常数(23.062千卡/克分子·伏特,或96500库仑克分子)。 一克分子ATP水解生成ADP与P所释放的能量为7.3千卡,凡氧化过程中释放的能量大于7.3千,均有可能生成一克分子ATP,就是说可能存 在有一个偶联部位,根据上式计算,当=2时,△E'O=0.1583V时可释放7.3千卡能量,所以反应底物与生成物的标准氧化还原电位的变化大于 0.1583V的部位均可能存在若一个偶联部位。 从图6-11可以看出,在NAD→CoQ,Cytb→Cytc和Cyt aa3→O2处可能存在着偶联部位。必须明确,这种计算的基础是反应处在热力学平 衡状态,温度为25℃,pH为7.0,反应底物和产物的浓度均为1克分子,这种条件在体内是不存在的。因此这一计算结果只能供参考
(一)底物水平磷酸化(substrate level phosphorylation) 底物分子中的能量直接以高能键形式转移给ADP生成ATP,这个过程称为底物水平磷酸化,这一磷酸化过程在胞浆和线粒体中进行,包括 有: (二)氧化磷酸化(oxidative phosphorylation) 氧化和磷酸化是两个不同的概念。氧化是底物脱氢或失电子的过程,而磷酸化是指ADP与Pi合成ATP的过程。在结构完整的线粒体中氧化 与磷酸化这两个过程是紧密地偶联在一起的,即氧化释放的能量用于ATP合成,这个过程就是氧化磷酸化,氧化是磷酸化的基础,而磷酸化是 氧化的结果。 机体代谢过程中能量的主要来源是线粒体,既有氧化磷酸化,也有底物水平磷酸化,以前者为主要来源。胞液中底物水平磷酸化也能获得 部分能量,实际上这是酵解过程的能量来源。对于酵解组织、红细胞和组织相对缺氧时的能量来源是十分重要的。 二、氧化磷酸化偶联部位的测定 确定氧化磷酸化偶联部位通常用两种方法。 (一)P/0值测定 P/0值指在氧化磷酸化过程中消耗一克原子氧所消耗的无机磷的克原子数,或者说消耗一克原子氧所生成的ATP的克分子数。P/0值实质上 指的是呼吸过程中磷酸化的效率。 测定P/0值的方法通常是在一密闭的容器中加入氧化的底物、ADP、Pi、氧饱和的缓冲液,再加入线粒体制剂时就会有氧化磷酸化进行。反 应终了时测定O2消耗量(可用氧电极法)和Pi消耗量(或ATP生成量)就可以计算出P/0值了。在反应系统中加入不同的底物,可测得各自的P/0 值,结合我们所了解的呼吸链的传递顺序,就可以分析出大致的偶联部位了。 表6-3 离体线粒体的P/0比值 底物 呼吸的组成 P/0比值 生成ATP数 (1)β-羟丁酸 NAD+→FMN→CoQ→Cyt→O2 2.4-2.8 3 (2)琥珀酸 FAN→CoQ→Cyt→O2 1.7 2 (3)抗坏血酸 Cyt→Cytaa3→O2 0.88 1 (4)细胞色素c Cytaa3→O2 0.61-0.68 1 从上表可以看出P/0值为小数,由于线粒体的偶联作用在离体条件下不能完全发挥,故可认为实际的ATP生成数是他们所接近的正整数值。 比较表中的(1)和(2),呼吸链传递的差异是在CoQ之间,两者ATP的生成数相差1,所以这个ATP的生成部位一定在NAD→CoQ之间。 比较表中(2)和(3),呼吸链传递的差异是在Cyt c之间,两者ATP的生成数相差1,所以这个ATP的生成部位在CoQ→Cyt c之间。 比较表中(3)和(4),生成的ATP数均为1,呼吸链传递的区别是在Cyt c→Cyt aa3,故Cytc→ aa3不存在偶联部位,而在Cyt aa3→O2之间存 在着一个偶联部位。 (二)根据氧化还原电位计算电子传递释放的能量是否能满足ATP合成的需要 氧化还原反应中释放的自由能△G'O与反应底物和产物标准氧化还原电位差值(△E'O)之间存在下述关系:△G'O=?nF△E'O 式中n为氧化还原反应中电子转移数目,F为法拉弟常数(23.062千卡/克分子·伏特,或96500库仑/克分子)。 一克分子ATP水解生成ADP与Pi所释放的能量为7.3千卡,凡氧化过程中释放的能量大于7.3千,均有可能生成一克分子ATP,就是说可能存 在有一个偶联部位,根据上式计算,当n=2时,△E'O=0.1583V时可释放7.3千卡能量,所以反应底物与生成物的标准氧化还原电位的变化大于 0.1583V的部位均可能存在着一个偶联部位。 从图6-11可以看出,在NAD→CoQ,Cyt b→Cyt c和Cyt aa3→O2处可能存在着偶联部位。必须明确,这种计算的基础是反应处在热力学平 衡状态,温度为25℃,pH为7.0,反应底物和产物的浓度均为1克分子,这种条件在体内是不存在的。因此这一计算结果只能供参考
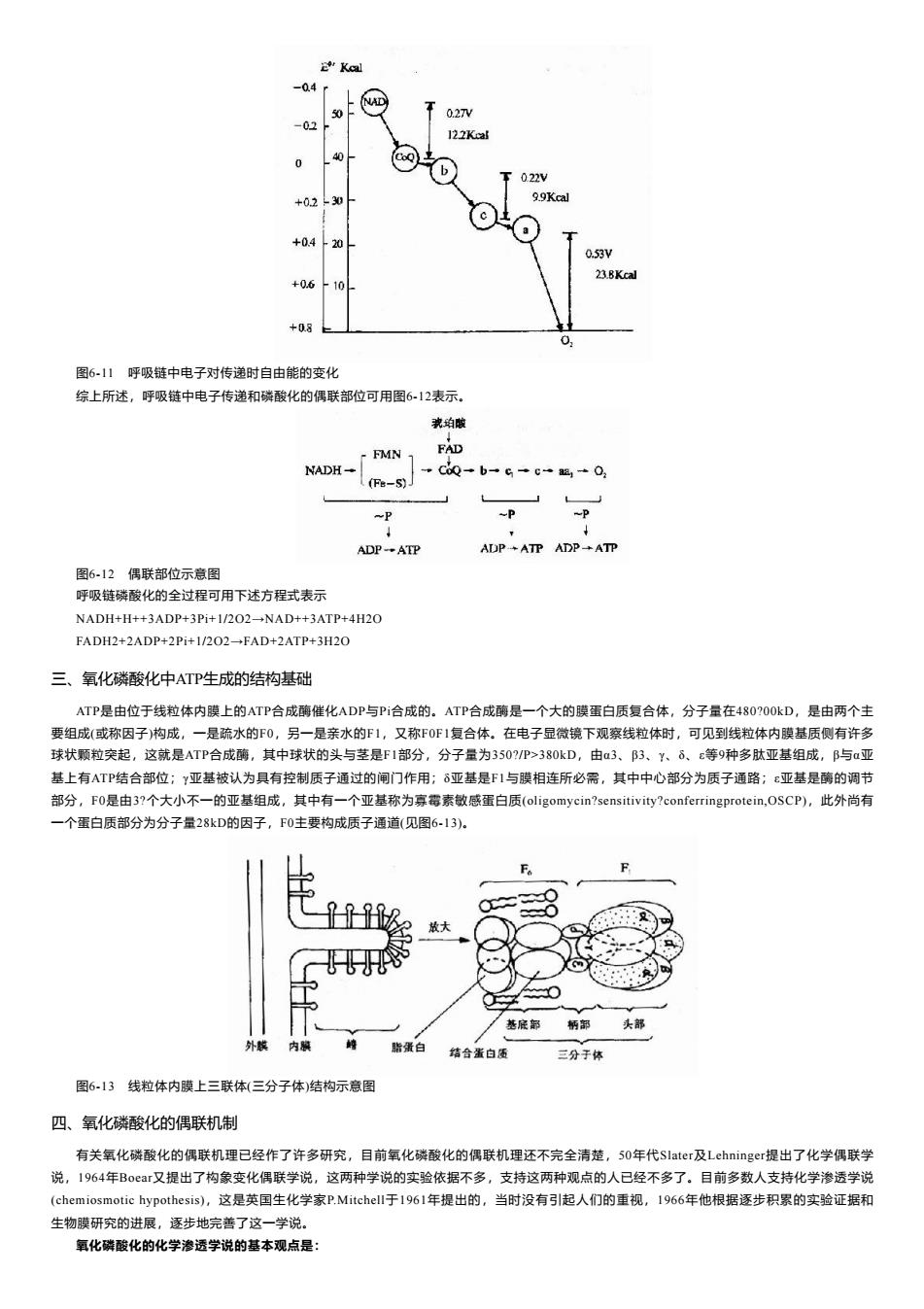
-04r 50 02N -02 12.2Kcal 0 T022W +02-30 99Kcal +0.420 0.53V 23.BKcal +0.6210 +08e 0 图6-11呼吸链中电子对传递时自由能的变化 综上所述,呼吸链中电子传递和磷酸化的偶联部位可用图6-12表示。 我珀酸 FMN 1 FAD NADH- +C60→b-G→c-盟1→0 (Fe-S) ~P -P ADP-ATP ADP+ATP ADP-ATP 图6.12偶联部位示意图 呼吸链磷酸化的全过程可用下述方程式表示 NADH+H++3ADP+3Pi+1/202-NAD++3ATP+4H20 FADH2+2ADP+2Pi+1/202-FAD+2ATP+3H20 三、氧化磷酸化中ATP生成的结构基础 ATP是由位于线粒体内膜上的ATP合成酶催化ADP与Pi合成的。ATP合成酶是一个大的膜蛋白质复合体,分子量在480?00kD,是由两个主 要组成(或称因子)构成,一是疏水的F0,另一是亲水的F1,又称F0F1复合体。在电子显微镜下观察线粒体时,可见到线粒体内膜基质侧有许多 球状颗粒突起,这就是ATP合成酶,其中球状的头与茎是F1部分,分子量为350?/P>380kD,由a3、B3、Y、δ、c等9种多肽亚基组成,B与a亚 基上有ATP结合部位;y亚基被认为具有控制质子通过的闸门作用:δ亚基是F1与膜相连所必需,其中中心部分为质子通路;ε亚基是酶的调节 部分,F0是由3?个大小不一的亚基组成,其中有一个亚基称为寡霉素敏感蛋白质(oligomycin?sensitivity?conferringprotein,OSCP),此外尚有 一个蛋白质部分为分子量28kD的因子,F0主要构成质子通道(见图6-13)。 F 基底部 柄部 头部 外熊 内膜 脂蛋白 结合蛋白质 三分于体 图6-13线粒体内膜上三联体(三分子体)结构示意图 四、氧化磷酸化的偶联机制 有关氧化磷酸化的偶联机理已经作了许多研究,目前氧化磷酸化的偶联机理还不完全清楚,50年代Slater及Lehninger提出了化学偶联学 说,1964年Boer又提出了构象变化偶联学说,这两种学说的实验依据不多,支持这两种观点的人已经不多了。目前多数人支持化学渗透学说 (chemiosmotic hypothesis),这是英国生化学家P.Mitchell-于1961年提出的,当时没有引起人们的重视,1966年他根据逐步积累的实验证据和 生物膜研究的进展,逐步地完善了这一学说。 氧化磷酸化的化学渗透学说的基本观点是:
图6-11 呼吸链中电子对传递时自由能的变化 综上所述,呼吸链中电子传递和磷酸化的偶联部位可用图6-12表示。 图6-12 偶联部位示意图 呼吸链磷酸化的全过程可用下述方程式表示 NADH+H++3ADP+3Pi+1/2O2→NAD++3ATP+4H2O FADH2+2ADP+2Pi+1/2O2→FAD+2ATP+3H2O 三、氧化磷酸化中ATP生成的结构基础 ATP是由位于线粒体内膜上的ATP合成酶催化ADP与Pi合成的。ATP合成酶是一个大的膜蛋白质复合体,分子量在480?00kD,是由两个主 要组成(或称因子)构成,一是疏水的F0,另一是亲水的F1,又称F0F1复合体。在电子显微镜下观察线粒体时,可见到线粒体内膜基质侧有许多 球状颗粒突起,这就是ATP合成酶,其中球状的头与茎是F1部分,分子量为350?/P>380kD,由α3、β3、γ、δ、ε等9种多肽亚基组成,β与α亚 基上有ATP结合部位;γ亚基被认为具有控制质子通过的闸门作用;δ亚基是F1与膜相连所必需,其中中心部分为质子通路;ε亚基是酶的调节 部分,F0是由3?个大小不一的亚基组成,其中有一个亚基称为寡霉素敏感蛋白质(oligomycin?sensitivity?conferringprotein,OSCP),此外尚有 一个蛋白质部分为分子量28kD的因子,F0主要构成质子通道(见图6-13)。 图6-13 线粒体内膜上三联体(三分子体)结构示意图 四、氧化磷酸化的偶联机制 有关氧化磷酸化的偶联机理已经作了许多研究,目前氧化磷酸化的偶联机理还不完全清楚,50年代Slater及Lehninger提出了化学偶联学 说,1964年Boear又提出了构象变化偶联学说,这两种学说的实验依据不多,支持这两种观点的人已经不多了。目前多数人支持化学渗透学说 (chemiosmotic hypothesis),这是英国生化学家P.Mitchell于1961年提出的,当时没有引起人们的重视,1966年他根据逐步积累的实验证据和 生物膜研究的进展,逐步地完善了这一学说。 氧化磷酸化的化学渗透学说的基本观点是: