
物质代谢是生命现象的基本特征,是生命活动的物质基础。人体物质代谢是由许多连续的和相关的代谢途径所组成,而代谢途径(如糖的氧 化,脂肪酸的合成等)又是由一系列的酶促化学反应组成。在正常情况下,各种代谢途径几乎全部按照生理的需求,有节奏、有规律地进行, 同时,为适应体内外环境的变化,及时地调整反应速度,保持整体的动态平衡。可见,体内物质代谢是在严密的调控下进行的。 代谢调节机制普遍存在于生物界,是生物在长期进化过程中逐步形成的一种适应能力。进化程度越高的生物,其代谢调节的机制越复杂。 单细胞的微生物受细胞内代谢物浓度变化的影响,改变其各种相关酶的活性和酶的含量,从而调节代谢的速度,这是细胞水平的代谢调节,是 生物体在进化上较为原始的调节方式。较复杂的多细胞生物,出现了内分泌细胞。高等动物则出现了专门的内分泌器官,这些器官所分泌的激 素可以对其他细胞发挥代谢调节作用。激素可以改变某些酶的催化活性或含量,也可以改变细胞内代谢物的浓度,从而影响代谢反应的速度, 这称为激素水平的调节。高等动物不仅有完整的内分泌系统,而且还有功能复杂的神经系统。在中枢神经的控制下,或者通过神经递质对效应 器直接发生影响,或者通过改变某些激素的分泌,来调节某些细胞的功能状态,并通过各种激素的互相协调而对整体代谢进行综合调节,这种 调节即称整体水平的调节。以上所述的细胞水平的代谢调节、激素水平的调节和整体水平的调节,在高等动物和人体内全都存在,下面分别进 行介绍。 第一节细胞水平的代谢调节 一、细胞内酶的分隔分布 从物质代谢过程中可知,酶在细胞内是分隔着分布的。代谢上有关的酶,常常组成一个酶体系,分布在细胞的某一组分中,例如,糖酵解酶 系和糖元合成、分解酶系存在于胞液中;三羧酸循环酶系和脂肪酸阝-氧化酶系定位于线粒体;核酸合成的酶系则绝大部分集中在细胞核内。这 样的酶的隔离分布为代谢调节创造了有利条件,使某些调节因素可以较为专一地影响某一细胞组分中的酶的活性,而不致影响其他组分中的酶 的活性,从而保证了整体反应的有序性。一些代谢物或离子在各细胞组分间的穿梭移动也可以改变细胞中某些组分的代谢速度。例如,在胞液 中生成的脂酰辅酶A主要用于合成脂肪;但在肉毒碱的作用下,经肉毒碱脂酰转移酶的催化,脂酰辅酶A可进入线粒体,参与B-氧化的过程。 又如,Ca++从肌细胞线粒体中出来,可以促进胞液中的糖元分解,而Ca++进入线粒体则有利于糖元合成. 物质代谢实质上是一系列的酶促反应,代谢速度的改变并不是由于代谢途径中全部酶活性的改变,而常常只取决于某些甚至某一个关键酶 活性的变化。此酶通常是整条通路中催化最慢一个反应的酶,称为限速酶。它的活性改变不但可以影响整个酶体系催化反应的总速度,甚至还 可以改变代谢反应的方向。如,细胞中ATP1AMP的比值增加,可以抑制磷酸果糖激酶(和丙酮酸激酶)的活性,这不但减慢了糖酵解的速度,还 可以通过激活果糖-1,6二磷酸酶而使糖代谢方向倾向于糖异生。因此,改变某些关键酶的活性是体内代谢调节的一种重要方式。 人体代谢的细胞水平调节,从速度方面来说有两种方式,一种是快速调节,一般在数秒或数分钟内即可发生。这种调节是通过激活或抑制 体内原有的酶分子来调节酶促反应速度的,是在温度、pH、作用物和辅酶等因素不变的情况下,通过改变酶分子的构象或对酶分子进行化学修 饰来实现酶促反应速度的迅速改变的。另一种是迟缓调节,一般经数小时后才能实现。这种方式主要是通过改变酶分子的合成或降解速度来调 节细胞内酶分子的含量。现将这两类调节作用分述如下: 二、酶分子结构的调节 (一变构调节 1变构调节的概念某些物质能与酶分子上的非催化部位特异地结合,引起酶蛋白的分子构象发生改变,从而改变酶的活性,这种现象称 为酶的变构调节或称别位调节(allosteric regulation)。受这种调节作用的酶称为别构酶或变构酶(allostericenzyme),能使酶发生变构效应的物 质称为变构效应剂(allosteric effector);如变构后引起酶活性的增强,则此效应剂称为激活变构剂(allosteric activator)或正效应物;反之则称为 抑制变构剂(allostericinhibitor)或负效应物。变构调节在生物界普遍存在,它是人体内快速调节酶活性的一种重要方式。现将某些代谢途径的 变构效应剂列表如下: 表9.1 糖和脂肪代谢酶系中某些变构酶及其变构效应剂 代谢途径 变构酶 激活变构剂 抑制变构剂 糖氧化分解 已塘激酶 G-6-P 诚酸果糖激璃 AMP、ADP、FDP、Pi ATP、柠檬酸 丙酮酸激确 FDP ATP、乙酸CaA 异柠檬酸脱氢醉 AMP ATP、长链脂酰CoA 柠檬酸合成确 ADP、AMP ATP 糖异生 果糖-1,6二磷酸确 AMP 丙酮酸羟化酶 乙酰CoA、ATP 脂肪酸合成 乙酰CoA羟化酶 柠檬酸、异柠檬酸 长链脂酰CoA 2.变构调节的生理意义变构效应在酶的快速调节中占有特别重要的地位。在前面已经提及,代谢速度的改变,常常是由于影响了整条代 谢通路中催化第一步反应的酶或整条代谢反应中限速酶的活性而引起的。这些酶对底物不遵守米曼氏动力学原则。它们往往受到一些代谢物的 抑制或激,这些抑制或激活作用大多是通过变构效应来实现的。因而,这些酶的活力可以极灵敏地受到代谢产物浓度的调节,这对机体的自身代 谢调控具有重要的意义。例如,变构酶对于人体能量代谢的调节具有重要意义。在休息状态下,机体能量消耗降低,ATP在细胞内积聚,而 ATP是磷酸果糖激酶的抑制变构剂,所以导致F·6·P和G-6·P的积聚,G·6·P又是已糖激酶的抑制变构剂,从而减少葡萄糖的氧化分解。 同时,ATP也是丙酮酸激酶和柠檬酸合成酶的抑制变构剂,更加强了对葡萄糖氧化分解的抑制,从而减少了ATP的进一步生成。反之,当体内 ATP减少而ADP或AMP增加时,AMP则可抑制果糖?1,6·二磷酸酶,降低糖异生,同时激活磷酸果糖激酶和柠檬酸合成酶等酶,加速糖的分 解氧化,利于体内ATP的生成。这样,通过变构调节,使体内ATP的生成不致过多或过少,保证了机体的能源被有效利用
物质代谢是生命现象的基本特征,是生命活动的物质基础。人体物质代谢是由许多连续的和相关的代谢途径所组成,而代谢途径(如糖的氧 化,脂肪酸的合成等)又是由一系列的酶促化学反应组成。在正常情况下,各种代谢途径几乎全部按照生理的需求,有节奏、有规律地进行, 同时,为适应体内外环境的变化,及时地调整反应速度,保持整体的动态平衡。可见,体内物质代谢是在严密的调控下进行的。 代谢调节机制普遍存在于生物界,是生物在长期进化过程中逐步形成的一种适应能力。进化程度越高的生物,其代谢调节的机制越复杂。 单细胞的微生物受细胞内代谢物浓度变化的影响,改变其各种相关酶的活性和酶的含量,从而调节代谢的速度,这是细胞水平的代谢调节,是 生物体在进化上较为原始的调节方式。较复杂的多细胞生物,出现了内分泌细胞。高等动物则出现了专门的内分泌器官,这些器官所分泌的激 素可以对其他细胞发挥代谢调节作用。激素可以改变某些酶的催化活性或含量,也可以改变细胞内代谢物的浓度,从而影响代谢反应的速度, 这称为激素水平的调节。高等动物不仅有完整的内分泌系统,而且还有功能复杂的神经系统。在中枢神经的控制下,或者通过神经递质对效应 器直接发生影响,或者通过改变某些激素的分泌,来调节某些细胞的功能状态,并通过各种激素的互相协调而对整体代谢进行综合调节,这种 调节即称整体水平的调节。以上所述的细胞水平的代谢调节、激素水平的调节和整体水平的调节,在高等动物和人体内全都存在,下面分别进 行介绍。 第一节 细胞水平的代谢调节 一、细胞内酶的分隔分布 从物质代谢过程中可知,酶在细胞内是分隔着分布的。代谢上有关的酶,常常组成一个酶体系,分布在细胞的某一组分中,例如,糖酵解酶 系和糖元合成、分解酶系存在于胞液中;三羧酸循环酶系和脂肪酸β-氧化酶系定位于线粒体;核酸合成的酶系则绝大部分集中在细胞核内。这 样的酶的隔离分布为代谢调节创造了有利条件,使某些调节因素可以较为专一地影响某一细胞组分中的酶的活性,而不致影响其他组分中的酶 的活性,从而保证了整体反应的有序性。一些代谢物或离子在各细胞组分间的穿梭移动也可以改变细胞中某些组分的代谢速度。例如,在胞液 中生成的脂酰辅酶A主要用于合成脂肪;但在肉毒碱的作用下,经肉毒碱脂酰转移酶的催化,脂酰辅酶A可进入线粒体,参与β-氧化的过程。 又如,Ca++从肌细胞线粒体中出来,可以促进胞液中的糖元分解,而Ca++进入线粒体则有利于糖元合成。 物质代谢实质上是一系列的酶促反应,代谢速度的改变并不是由于代谢途径中全部酶活性的改变,而常常只取决于某些甚至某一个关键酶 活性的变化。此酶通常是整条通路中催化最慢一个反应的酶,称为限速酶。它的活性改变不但可以影响整个酶体系催化反应的总速度,甚至还 可以改变代谢反应的方向。如,细胞中ATP/AMP的比值增加,可以抑制磷酸果糖激酶(和丙酮酸激酶)的活性,这不但减慢了糖酵解的速度,还 可以通过激活果糖-1,6-二磷酸酶而使糖代谢方向倾向于糖异生。因此,改变某些关键酶的活性是体内代谢调节的一种重要方式。 人体代谢的细胞水平调节,从速度方面来说有两种方式,一种是快速调节,一般在数秒或数分钟内即可发生。这种调节是通过激活或抑制 体内原有的酶分子来调节酶促反应速度的,是在温度、pH、作用物和辅酶等因素不变的情况下,通过改变酶分子的构象或对酶分子进行化学修 饰来实现酶促反应速度的迅速改变的。另一种是迟缓调节,一般经数小时后才能实现。这种方式主要是通过改变酶分子的合成或降解速度来调 节细胞内酶分子的含量。现将这两类调节作用分述如下: 二、酶分子结构的调节 (一)变构调节 1.变构调节的概念 某些物质能与酶分子上的非催化部位特异地结合,引起酶蛋白的分子构象发生改变,从而改变酶的活性,这种现象称 为酶的变构调节或称别位调节(allosteric regulation)。受这种调节作用的酶称为别构酶或变构酶(allostericenzyme),能使酶发生变构效应的物 质称为变构效应剂(allosteric effector);如变构后引起酶活性的增强,则此效应剂称为激活变构剂(allosteric activator)或正效应物;反之则称为 抑制变构剂(allostericinhibitor)或负效应物。变构调节在生物界普遍存在,它是人体内快速调节酶活性的一种重要方式。现将某些代谢途径的 变构效应剂列表如下: 表9-1 糖和脂肪代谢酶系中某些变构酶及其变构效应剂 代谢途径 变构酶 激活变构剂 抑制变构剂 糖氧化分解 已糖激酶 G-6-P 磷酸果糖激酶 AMP、ADP、FDP、Pi ATP、柠檬酸 丙酮酸激酶 FDP ATP、乙酸CoA 异柠檬酸脱氢酶 AMP ATP、长链脂酰CoA 柠檬酸合成酶 ADP、AMP ATP 糖异生 果糖-1,6-二磷酸酶 AMP 丙酮酸羟化酶 乙酰CoA、ATP 脂肪酸合成 乙酰CoA羟化酶 柠檬酸、异柠檬酸 长链脂酰CoA 2.变构调节的生理意义 变构效应在酶的快速调节中占有特别重要的地位。在前面已经提及,代谢速度的改变,常常是由于影响了整条代 谢通路中催化第一步反应的酶或整条代谢反应中限速酶的活性而引起的。这些酶对底物不遵守米曼氏动力学原则。它们往往受到一些代谢物的 抑制或激,这些抑制或激活作用大多是通过变构效应来实现的。因而,这些酶的活力可以极灵敏地受到代谢产物浓度的调节,这对机体的自身代 谢调控具有重要的意义。例如,变构酶对于人体能量代谢的调节具有重要意义。在休息状态下,机体能量消耗降低,ATP在细胞内积聚,而 ATP是磷酸果糖激酶的抑制变构剂,所以导致F-6-P和G-6-P的积聚,G-6-P又是已糖激酶的抑制变构剂,从而减少葡萄糖的氧化分解。 同时,ATP也是丙酮酸激酶和柠檬酸合成酶的抑制变构剂,更加强了对葡萄糖氧化分解的抑制,从而减少了ATP的进一步生成。反之,当体内 ATP减少而ADP或AMP增加时,AMP则可抑制果糖?1,6-二磷酸酶,降低糖异生,同时激活磷酸果糖激酶和柠檬酸合成酶等酶,加速糖的分 解氧化,利于体内ATP的生成。这样,通过变构调节,使体内ATP的生成不致过多或过少,保证了机体的能源被有效利用
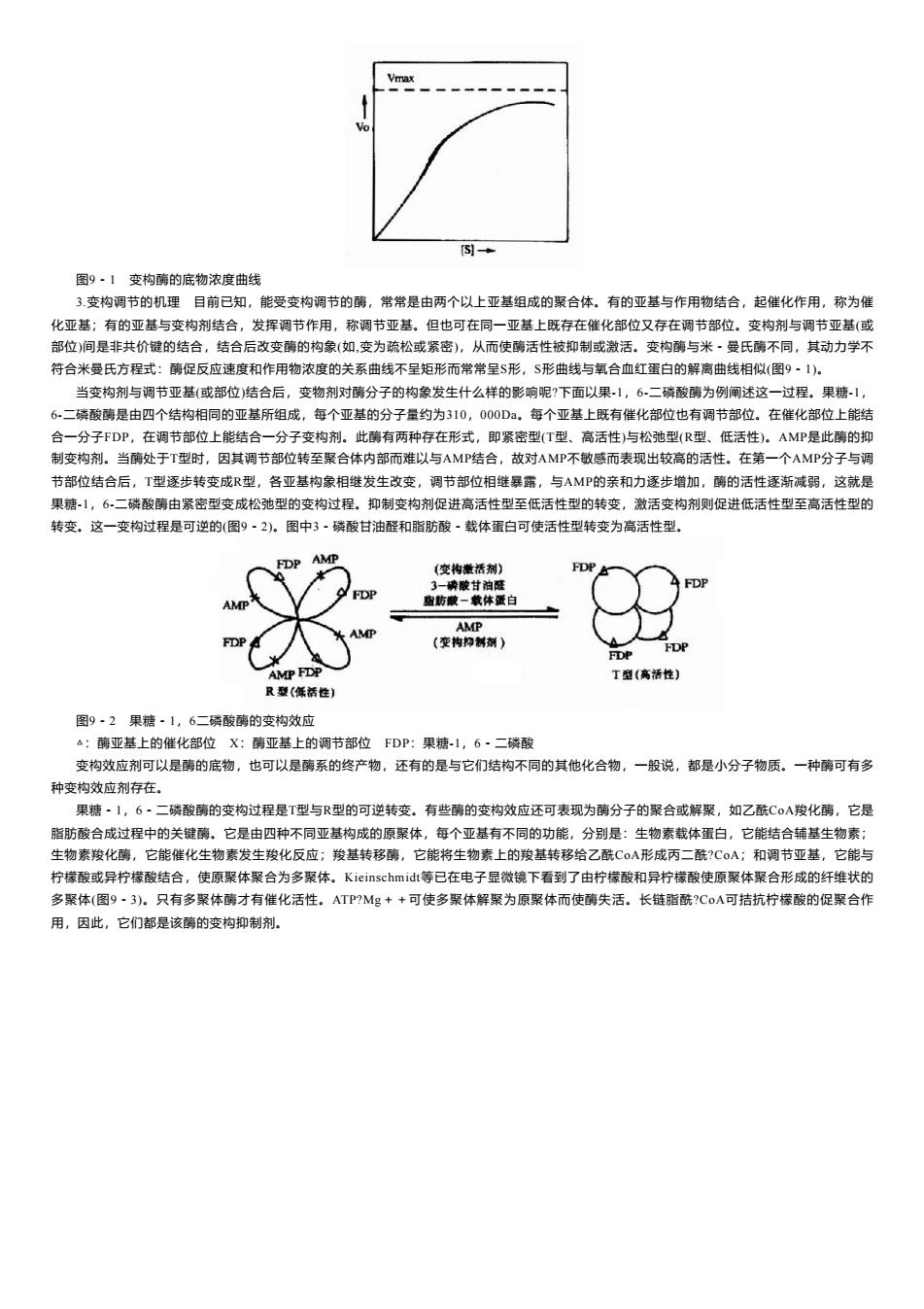
Vma 图9·1变构酶的底物浓度曲线 3变构调节的机理目前已知,能受变构调节的酶,常常是由两个以上亚基组成的聚合体。有的亚基与作用物结合,起催化作用,称为催 化亚基;有的亚基与变构剂结合,发挥调节作用,称调节亚基。但也可在同一亚基上既存在催化部位又存在调节部位。变构剂与调节亚基(或 部位)间是非共价键的结合,结合后改变酶的构象(如,变为疏松或紧密),从而使酶活性被抑制或激活。变构酶与米·曼氏酶不同,其动力学不 符合米曼氏方程式:酶促反应速度和作用物浓度的关系曲线不呈矩形而常常呈$形,S形曲线与氧合血红蛋白的解离曲线相似(图9·1)。 当变构剂与调节亚基(或部位)结合后,变物剂对酶分子的构象发生什么样的影响呢?下面以果1,6二磷酸酶为例闸述这一过程。果糖-1, 6.二磷酸酶是由四个结构相同的亚基所组成,每个亚基的分子量约为310,000Da。每个亚基上既有催化部位也有调节部位。在催化部位上能结 合一分子FDP,在调节部位上能结合一分子变构剂。此酶有两种存在形式,即紧密型(T型、高活性)与松弛型(R型、低活性)。AMP是此酶的抑 制变构剂。当酶处于T型时,因其调节部位转至聚合体内部而难以与AMP结合,故对AMP不敏感而表现出较高的活性。在第一个AMP分子与调 节部位结合后,T型逐步转变成R型,各亚基构象相继发生改变,调节部位相继暴露,与AMP的亲和力逐步增加,酶的活性逐渐减弱,这就是 果糖1,6-二磷酸酶由紧密型变成松弛型的变构过程。抑制变构剂促进高活性型至低活性型的转变,激活变构剂则促进低活性型至高活性型的 转变。这一变构过程是可逆的(图9·2)。图中3·磷酸甘油醛和脂肪酸·载体蛋白可使活性型转变为高活性型。 FDP AMP (变构撒活剂)】 FDP 3一磷酸甘油硅 FDP 指防酸一载体蛋白 AMP AMP (变构抑制剂) FDP FDP AMP FDP T型(高活性) R型(低活性) 图9·2果糖·1,6二磷酸酶的变构效应 △:酶亚基上的催化部位X:酶亚基上的调节部位FDP:果糖-1,6·二磷酸 变构效应剂可以是酶的底物,也可以是酶系的终产物,还有的是与它们结构不同的其他化合物,一般说,都是小分子物质。一种酶可有多 种变构效应剂存在。 果糖·1,6·二磷酸酶的变构过程是T型与R型的可逆转变。有些酶的变构效应还可表现为酶分子的聚合或解聚,如乙酰CoA羧化酶,它是 脂肪酸合成过程中的关键酶。它是由四种不同亚基构成的原聚体,每个亚基有不同的功能,分别是:生物素载体蛋白,它能结合辅基生物素: 生物素羧化酶,它能催化生物素发生羧化反应;羧基转移酶,它能将生物素上的羧基转移给乙酰CoA形成丙二酰?CoA;和调节亚基,它能与 柠檬酸或异柠檬酸结合,使原聚体聚合为多聚体。Kieinschmidt等已在电子显微镜下看到了由柠檬酸和异柠檬酸使原聚体聚合形成的纤维状的 多聚体(图9~3)。只有多聚体酶才有催化活性。ATP?Mg++可使多聚体解聚为原聚体而使酶失活。长链脂酰?C0A可拮抗柠檬酸的促聚合作 用,因此,它们都是该酶的变构抑制剂
图9-1 变构酶的底物浓度曲线 3.变构调节的机理 目前已知,能受变构调节的酶,常常是由两个以上亚基组成的聚合体。有的亚基与作用物结合,起催化作用,称为催 化亚基;有的亚基与变构剂结合,发挥调节作用,称调节亚基。但也可在同一亚基上既存在催化部位又存在调节部位。变构剂与调节亚基(或 部位)间是非共价键的结合,结合后改变酶的构象(如,变为疏松或紧密),从而使酶活性被抑制或激活。变构酶与米-曼氏酶不同,其动力学不 符合米曼氏方程式:酶促反应速度和作用物浓度的关系曲线不呈矩形而常常呈S形,S形曲线与氧合血红蛋白的解离曲线相似(图9-1)。 当变构剂与调节亚基(或部位)结合后,变物剂对酶分子的构象发生什么样的影响呢?下面以果-1,6-二磷酸酶为例阐述这一过程。果糖-1, 6-二磷酸酶是由四个结构相同的亚基所组成,每个亚基的分子量约为310,000Da。每个亚基上既有催化部位也有调节部位。在催化部位上能结 合一分子FDP,在调节部位上能结合一分子变构剂。此酶有两种存在形式,即紧密型(T型、高活性)与松弛型(R型、低活性)。AMP是此酶的抑 制变构剂。当酶处于T型时,因其调节部位转至聚合体内部而难以与AMP结合,故对AMP不敏感而表现出较高的活性。在第一个AMP分子与调 节部位结合后,T型逐步转变成R型,各亚基构象相继发生改变,调节部位相继暴露,与AMP的亲和力逐步增加,酶的活性逐渐减弱,这就是 果糖-1,6-二磷酸酶由紧密型变成松弛型的变构过程。抑制变构剂促进高活性型至低活性型的转变,激活变构剂则促进低活性型至高活性型的 转变。这一变构过程是可逆的(图9-2)。图中3-磷酸甘油醛和脂肪酸-载体蛋白可使活性型转变为高活性型。 图9-2 果糖-1,6二磷酸酶的变构效应 △:酶亚基上的催化部位 X:酶亚基上的调节部位 FDP:果糖-1,6-二磷酸 变构效应剂可以是酶的底物,也可以是酶系的终产物,还有的是与它们结构不同的其他化合物,一般说,都是小分子物质。一种酶可有多 种变构效应剂存在。 果糖-1,6-二磷酸酶的变构过程是T型与R型的可逆转变。有些酶的变构效应还可表现为酶分子的聚合或解聚,如乙酰CoA羧化酶,它是 脂肪酸合成过程中的关键酶。它是由四种不同亚基构成的原聚体,每个亚基有不同的功能,分别是:生物素载体蛋白,它能结合辅基生物素; 生物素羧化酶,它能催化生物素发生羧化反应;羧基转移酶,它能将生物素上的羧基转移给乙酰CoA形成丙二酰?CoA;和调节亚基,它能与 柠檬酸或异柠檬酸结合,使原聚体聚合为多聚体。Kieinschmidt等已在电子显微镜下看到了由柠檬酸和异柠檬酸使原聚体聚合形成的纤维状的 多聚体(图9-3)。只有多聚体酶才有催化活性。ATP?Mg++可使多聚体解聚为原聚体而使酶失活。长链脂酰?CoA可拮抗柠檬酸的促聚合作 用,因此,它们都是该酶的变构抑制剂

生物素貌体蛋白 生物家瘦化膜 调节亚基 破萏转移酶 无活性原豪体 (四种不同亚基。约400,000道尔顿) 柠 ATP-M 长硅脂酰辅酶A 洋柠檬 原廉体 约400000道尔板 个一轴基生物紫 有活性的纤维状多聚体 有活性的纤维状多聚体 图9.3乙酰CoA羧化酶聚合解聚示意图 (二)酶分子化学修饰调节 1.酶分子化学修饰的概念 酶分子肽链上的某些基团可在另一种酶的催化下发生可逆的共价修饰,从而引起酶活性的改变,这个过程称为酶的酶促化学修饰(chemical modification)。如磷酸化和脱磷酸,乙酰化和去乙酰化,腺苷化和去腺苷化,甲基化和去甲基化以及-SH基和·S·S·基互变等,其中磷酸化 和脱磷酸作用在物质代谢调节中最为常见。 细胞内存在着多种蛋白激酶(ProteinKinase),它们可以将ATP分子中的yr-磷酸基团转移至特定的蛋白分子底物上,使后者磷酸化 (phosphorylation)。磷酸化反应可以发生在丝氨酸、苏氨酸或酪氨酸残基上。催化丝氨酸或苏氨酸残基磷酸化的酶统称为蛋白丝氨酸/苏氨酸激 酶(Protein Serine/Threonine Kinase).催化酪氨酸残基磷酸化的酶统称为蛋白酪氨酸激酶(ProteinTyrosine Kinase)。与此相对应的,细胞内亦 存在着多种蛋白丝氨酸/苏氨酸磷酸酶(ProteinSerine/Threonine Phosphotase)和蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphotase),它们可将相 应的磷酸基团移去。酶的化学修饰如变构调节一样,也是机体物质代谢中快速调节的一种重要方式,表9?列出了一些酶的酶促化学修饰的实 例。 表9·2某些酶的酶促化学修饰调节 爵类 反应类型 效应 糖无瑛酸化确 磷酸化/脱磷酸 激活抑制 磷酸化酶激酶 磷酸化/脱磷酸 激活抑制 磷酸化酶磷酸确 磷酸化/脱磷酸 抑制/激活 糖元合成酶 磷酸化/脱磷酸 抑制/激活 丙酮酸脱羟确 磷酸化/脱磷酸 抑制激活 脂肪酶(脂防细跑) 磷酸化/脱磷酸 激活抑制 谷氨酰胺合成确(大肠杆菌) 腺苷化/脱腺苷 抑制/激活 黄嘌岭氧化(脱氢)确 SH/-S-S- 脱氢氧化 2酶促化学修饰的机理 肌肉糖元磷酸化酶的酶促化学修饰是研究得比较清楚的一个例子。该酶有两种形式,即无活性的磷酸化酶6和有活性的磷酸化酶a。磷酸化 酶b是二聚体,分子量约为85,000D。它在酶的催化下,使每个亚基分别接受ATP供给的一个磷酸基团,转变为磷酸化酶,后者具有高活 性。两分子磷酸化酶a二聚体可以再聚合成活性较低的(低于高活性的二聚体)磷酸化酶a四聚体(图9·4)。 2ATP 眸酸化酶b激酶 2ADP Mg* 磷酸化簧b 洗酸化驹器 诗酸化酯 ⊙ 二豪体) 2P碑酸化酶a2H,0 (二案体) 无活性 确酸酶 (因聚体) 高活性 有活性 图9·4肌肉磷酸化酶的酶促化学修饰作用 3.酶促化学修饰的特点 (1)绝大多数酶促化学修饰的酶都具有无活性(或低活性)与有活性(或高活性)两种形式。它们之间的互变反应,正逆两向都有共价变化,由不 同的酶进行催化,而催化这互变反应的酶又受机体调节物质(如激素)的控制
图9-3 乙酰CoA羧化酶聚合解聚示意图 (二)酶分子化学修饰调节 1.酶分子化学修饰的概念 酶分子肽链上的某些基团可在另一种酶的催化下发生可逆的共价修饰,从而引起酶活性的改变,这个过程称为酶的酶促化学修饰(chemical modification)。如磷酸化和脱磷酸,乙酰化和去乙酰化,腺苷化和去腺苷化,甲基化和去甲基化以及-SH基和-S-S-基互变等,其中磷酸化 和脱磷酸作用在物质代谢调节中最为常见。 细 胞 内 存 在 着 多 种 蛋 白 激 酶 (ProteinKinase) , 它 们 可 以 将 ATP 分 子 中 的 γ- 磷 酸 基 团 转 移 至 特 定 的 蛋 白 分 子 底 物 上 , 使 后 者 磷 酸 化 (phosphorylation)。磷酸化反应可以发生在丝氨酸、苏氨酸或酪氨酸残基上。催化丝氨酸或苏氨酸残基磷酸化的酶统称为蛋白丝氨酸/苏氨酸激 酶(Protein Serine/Threonine Kinase)。催化酪氨酸残基磷酸化的酶统称为蛋白酪氨酸激酶(ProteinTyrosine Kinase)。与此相对应的,细胞内亦 存在着多种蛋白丝氨酸/苏氨酸磷酸酶(ProteinSerine/Threonine Phosphotase)和蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphotase),它们可将相 应的磷酸基团移去。酶的化学修饰如变构调节一样,也是机体物质代谢中快速调节的一种重要方式,表9?列出了一些酶的酶促化学修饰的实 例。 表9-2 某些酶的酶促化学修饰调节 酶类 反应类型 效应 糖无磷酸化酶 磷酸化/脱磷酸 激活/抑制 磷酸化酶b激酶 磷酸化/脱磷酸 激活/抑制 磷酸化酶磷酸酶 磷酸化/脱磷酸 抑制/激活 糖元合成酶 磷酸化/脱磷酸 抑制/激活 丙酮酸脱羟酶 磷酸化/脱磷酸 抑制/激活 脂肪酶(脂肪细胞) 磷酸化/脱磷酸 激活/抑制 谷氨酰胺合成酶(大肠杆菌) 腺苷化/脱腺苷 抑制/激活 黄嘌呤氧化(脱氢)酶 -SH/-S-S- 脱氢/氧化 2.酶促化学修饰的机理 肌肉糖元磷酸化酶的酶促化学修饰是研究得比较清楚的一个例子。该酶有两种形式,即无活性的磷酸化酶b和有活性的磷酸化酶a。磷酸化 酶b是二聚体,分子量约为85,000Da。它在酶的催化下,使每个亚基分别接受ATP供给的一个磷酸基团,转变为磷酸化酶a,后者具有高活 性。两分子磷酸化酶a二聚体可以再聚合成活性较低的(低于高活性的二聚体)磷酸化酶a四聚体(图9-4)。 图9-4 肌肉磷酸化酶的酶促化学修饰作用 3.酶促化学修饰的特点 (1)绝大多数酶促化学修饰的酶都具有无活性(或低活性)与有活性(或高活性)两种形式。它们之间的互变反应,正逆两向都有共价变化,由不 同的酶进行催化,而催化这互变反应的酶又受机体调节物质(如激素)的控制

(2)存在瀑布式效应。由于酶促化学修饰是酶所催化的反应,故有瀑布式(逐级放大)效应。少量的调节因素就可通过加速这种酶促反应,使 大量的另一种酶发生化学修饰。因此,这类反应的催化效率常较变构调节为高。 (3)磷酸化与脱磷酸是常见的酶促化学修饰反应。一分子亚基发生磷酸化常需消耗一分子ATP,这与合成酶蛋白所消耗的ATP相比,显然是 少得多;同时酶促化学修饰又有放大效应,因此,这种调节方式更为经济有效。 (4)此种调节同变构调节一样,可以按着生理的需要来进行。在前述的肌肉糖元磷酸化酶的化学修饰过程中,若细胞要减弱或停止糖元分解, 则磷酸化酶在磷酸化酶a磷酸酶的催化下即水解脱去磷酸基而转变成无活性的磷酸化酶b,从而减弱或停止了糖元的分解。 此外,酶促化学修饰与变构调节只是两种主要的调节方式。对某一种酶来说,它可以同时受这两种方式的调节。如,糖元磷酸化酶受化学 修饰的同时也是一种变构酶,其二聚体的每个亚基都有催化部位和调节部位。它可由AMP激活,并受ATP抑制,这属于变构调节。细胞中同一 种酶受双重调节的意义可能在于,变构调节是细胞的一种基本调节机制,它对于维持代谢物和能量平衡具有重要作用,但当效应剂浓度过低, 不足以与全部酶分子的调节部位结合时,就不能动员所有的酶发挥作用,故难以应急。当在应激等情况下,若有少量肾上腺素释放,即可通过 cAMP,启动一系列的瀑布式的酶促化学修饰反应,快速转变磷酸化酶b成为有活性的磷酸化酶,加速糖元的分解,迅速有效地满足机体的急 需。 三、酶含量调节 除通过改变酶分子的结构来调节细胞内原有酶的活性外,生物体还可通过改变酶的合成或降解速度以控制酶的绝对含量来调节代谢。要升 高或降低某种酶的浓度,除调节酶蛋白合成的诱导和阻遏过程外,还必须同时控制酶降解的速度,现分述如下: (一)酶蛋白合成的诱导和阻遏 酶的底物或产物、激素以及药物等都可以影响酶的合成。一般将加强酶合成的化合物称为诱导剂(inducer),减少酶合成的化合物称为阻遏 剂(repressor)。诱导剂和阻遏剂可在转录水平或翻译水平影响蛋白质的合成,但以影响转录过程较为常见。这种调节作用要通过一系列蛋白质 生物合成的环节,故调节效应出现较迟缓。但一旦酶被诱导合成,即使除去诱导剂,酶仍能保持活性,直至酶蛋白降解完毕。因此,这种调节 的效应持续时间较长。 1底物对酶合成的诱导作用受酶催化的底物常常可以诱导该酶的合成,此现象在生物界普遍存在。高等动物体内,因有激素的调节作 用,底物诱导作用不如微生物体内重要,但是,某些代谢途径中的关键酶也受底物的诱导调节。例如,若鼠的饲料中酪蛋白含量从8%增至 70%,则鼠肝中的精氨酸酶的活性可增加2?倍。在食物消化吸收后,血中多种氨基酸的浓度增加,氨基酸浓度的增加又可以诱导氨基酸分解酶 体系中的关键酶,如苏氨酸脱水酶和酪氨酸转氨酶等酶的合成。这种诱导作用对于维持体内游离氨基酸浓度的相对恒定有一定的生理意义。 2.产物对酶合成的阻遏代谢反应的终产物不但可通过变构调节直接抑制酶体系中的关键酶或起催化起始反应作用的酶,有时还可阻遏这 些酶的合成。例如,在胆固醇的生物合成中,阝·羟·B·甲基戊二酰辅酶A(HMgCoA)还原酶是关键酶,它受胆固醇的反馈阻遏。但这种反馈 阻遏只在肝脏和骨髓中发生,肠粘膜中胆固醇的合成似乎不受这种反馈调节的影响。因此摄食大量胆固醇,浆胆固醇仍有升高的危险。此外, 如δ-氨基-Y~酮戊酸(ALA)合成酶,它是血红素合成酶系中的起始反应酶,它受血红素的反馈阻遏。 3激素对酶合成的诱导作用激素是高等动物体内影响酶合成的最重要的调节因素。糖皮质激素能诱导一些氨基酸分解代谢中起催化起始 反应作用的酶和糖异生途径关键酶的合成,而胰岛素则能诱导糖酵解和脂防酸合成途径中的关键酶的合成。 4.药物对酶合成的诱导作用 很多药物和毒物可促进肝细胞微粒体中单加氧酶(或称混合功能氧化酶)或其他一些药物代谢酶的诱导合成,从而促进药物本身或其他药物 的氧化失话,这对防止药物或毒物的中毒和累积有着重要的意义。其作用的本质,也属于底物对酶合成的诱导作用。另一方面,它也会因此而导 致出现耐药现象。如,长期服用苯巴比妥的病人,会因苯巴比妥诱导生成过多的单加氧酶而使苯巴比妥药效降低。氨甲喋呤治疗肿瘤时,也可 因诱导叶酸还原酶的合成而使原来剂量的氨甲喋呤不足而出现药物失效现象。 (二)酶分子降解的调节 细胞内酶的含量也可通过改变酶分子的降解速度来调节。饥饿情况下,精氨酸酶的活性增加,主要是由于酶蛋白降解的速度减慢所致。饥 饿也可使乙酰辅酶A羧化酶浓度降低,这除了与酶蛋白合成减少有关外,还与酶分子的降解速度加强有关。苯巴比妥等药物可使细胞色素5和 NADPH·细胞色素P450还原酶降解减少,这也是这类药物使单加氧酶活性增强的一个原因。 酶蛋白受细胞内溶酶体中蛋白水解酶的催化而降解,因此,凡能改变蛋白水解酶活性或蛋白水解酶在溶酶体内分布的因素,都可间接地影响 酶蛋白的降解速度。有关情况尚了解不多。总之,通过酶降解以调节酶含量的重要性不如酶的诱导和阻遏作用。 第二节激素对物质代谢的调节 细胞的物质代谢反应不仅受到局部环镜的影响,即各种代谢底物、产物的正、负反馈调节,而且还受来自于机体其它组织器官的各种化学 信号的控制,激素就属于这类化学信号。激素是一类由特殊的细胞合成并分泌的化学物质,它随血液循环于全身,作用于特定的组织或细胞 (称为靶组织或靶细胞,target cell),指导细胞物质代谢沿着一定的方向进行。同一激素可以使某些代谢反应加强,而使另一些代谢反应减弱, 从而适应整体的需要。对于每一个细胞来说,激素是外源性调控信号,而对于机体整体而言,它仍然属于内环境的一部分。通过激素来控制物 质代谢是高等动物体内代谢调节的一种重要方式。 激素的作用必须通过其受体来实现。受体是一类可以与相应的配体(igad)特异地结合的物质,常为糖蛋白或脂蛋白。激素作为一类配 体,与受体的结合具有高度的特异性和亲和性。只有那些具有相应受体的细胞才可以成为该激素的靶细胞。 在糖、脂类和氨基酸代谢过程中,具有重要调节作用的激素·胰岛素、肾上腺素和胰高血糖素等(具体作用见代谢各章)均为水溶性物质, 因此不能进入细胞内。但这类激素的受体均存在于细胞膜表面,那么它们是如何通过与细胞膜表面受体结合,将位于胞外的化学信号传递至胞
(2)存在瀑布式效应。由于酶促化学修饰是酶所催化的反应,故有瀑布式(逐级放大)效应。少量的调节因素就可通过加速这种酶促反应,使 大量的另一种酶发生化学修饰。因此,这类反应的催化效率常较变构调节为高。 (3)磷酸化与脱磷酸是常见的酶促化学修饰反应。一分子亚基发生磷酸化常需消耗一分子ATP,这与合成酶蛋白所消耗的ATP相比,显然是 少得多;同时酶促化学修饰又有放大效应,因此,这种调节方式更为经济有效。 (4)此种调节同变构调节一样,可以按着生理的需要来进行。在前述的肌肉糖元磷酸化酶的化学修饰过程中,若细胞要减弱或停止糖元分解, 则磷酸化酶a在磷酸化酶a磷酸酶的催化下即水解脱去磷酸基而转变成无活性的磷酸化酶b,从而减弱或停止了糖元的分解。 此外,酶促化学修饰与变构调节只是两种主要的调节方式。对某一种酶来说,它可以同时受这两种方式的调节。如,糖元磷酸化酶受化学 修饰的同时也是一种变构酶,其二聚体的每个亚基都有催化部位和调节部位。它可由AMP激活,并受ATP抑制,这属于变构调节。细胞中同一 种酶受双重调节的意义可能在于,变构调节是细胞的一种基本调节机制,它对于维持代谢物和能量平衡具有重要作用,但当效应剂浓度过低, 不足以与全部酶分子的调节部位结合时,就不能动员所有的酶发挥作用,故难以应急。当在应激等情况下,若有少量肾上腺素释放,即可通过 cAMP,启动一系列的瀑布式的酶促化学修饰反应,快速转变磷酸化酶b成为有活性的磷酸化酶a,加速糖元的分解,迅速有效地满足机体的急 需。 三、酶含量调节 除通过改变酶分子的结构来调节细胞内原有酶的活性外,生物体还可通过改变酶的合成或降解速度以控制酶的绝对含量来调节代谢。要升 高或降低某种酶的浓度,除调节酶蛋白合成的诱导和阻遏过程外,还必须同时控制酶降解的速度,现分述如下: (一)酶蛋白合成的诱导和阻遏 酶的底物或产物、激素以及药物等都可以影响酶的合成。一般将加强酶合成的化合物称为诱导剂(inducer),减少酶合成的化合物称为阻遏 剂(repressor)。诱导剂和阻遏剂可在转录水平或翻译水平影响蛋白质的合成,但以影响转录过程较为常见。这种调节作用要通过一系列蛋白质 生物合成的环节,故调节效应出现较迟缓。但一旦酶被诱导合成,即使除去诱导剂,酶仍能保持活性,直至酶蛋白降解完毕。因此,这种调节 的效应持续时间较长。 1.底物对酶合成的诱导作用 受酶催化的底物常常可以诱导该酶的合成,此现象在生物界普遍存在。高等动物体内,因有激素的调节作 用,底物诱导作用不如微生物体内重要,但是,某些代谢途径中的关键酶也受底物的诱导调节。例如,若鼠的饲料中酪蛋白含量从8%增至 70%,则鼠肝中的精氨酸酶的活性可增加2?倍。在食物消化吸收后,血中多种氨基酸的浓度增加,氨基酸浓度的增加又可以诱导氨基酸分解酶 体系中的关键酶,如苏氨酸脱水酶和酪氨酸转氨酶等酶的合成。这种诱导作用对于维持体内游离氨基酸浓度的相对恒定有一定的生理意义。 2.产物对酶合成的阻遏 代谢反应的终产物不但可通过变构调节直接抑制酶体系中的关键酶或起催化起始反应作用的酶,有时还可阻遏这 些酶的合成。例如,在胆固醇的生物合成中,β-羟-β-甲基戊二酰辅酶A(HMgCoA)还原酶是关键酶,它受胆固醇的反馈阻遏。但这种反馈 阻遏只在肝脏和骨髓中发生,肠粘膜中胆固醇的合成似乎不受这种反馈调节的影响。因此摄食大量胆固醇,浆胆固醇仍有升高的危险。此外, 如δ-氨基-γ-酮戊酸(ALA)合成酶,它是血红素合成酶系中的起始反应酶,它受血红素的反馈阻遏。 3.激素对酶合成的诱导作用 激素是高等动物体内影响酶合成的最重要的调节因素。糖皮质激素能诱导一些氨基酸分解代谢中起催化起始 反应作用的酶和糖异生途径关键酶的合成,而胰岛素则能诱导糖酵解和脂肪酸合成途径中的关键酶的合成。 4.药物对酶合成的诱导作用 很多药物和毒物可促进肝细胞微粒体中单加氧酶(或称混合功能氧化酶)或其他一些药物代谢酶的诱导合成,从而促进药物本身或其他药物 的氧化失活,这对防止药物或毒物的中毒和累积有着重要的意义。其作用的本质,也属于底物对酶合成的诱导作用。另一方面,它也会因此而导 致出现耐药现象。如,长期服用苯巴比妥的病人,会因苯巴比妥诱导生成过多的单加氧酶而使苯巴比妥药效降低。氨甲喋呤治疗肿瘤时,也可 因诱导叶酸还原酶的合成而使原来剂量的氨甲喋呤不足而出现药物失效现象。 (二)酶分子降解的调节 细胞内酶的含量也可通过改变酶分子的降解速度来调节。饥饿情况下,精氨酸酶的活性增加,主要是由于酶蛋白降解的速度减慢所致。饥 饿也可使乙酰辅酶A羧化酶浓度降低,这除了与酶蛋白合成减少有关外,还与酶分子的降解速度加强有关。苯巴比妥等药物可使细胞色素b5和 NADPH-细胞色素P450还原酶降解减少,这也是这类药物使单加氧酶活性增强的一个原因。 酶蛋白受细胞内溶酶体中蛋白水解酶的催化而降解,因此,凡能改变蛋白水解酶活性或蛋白水解酶在溶酶体内分布的因素,都可间接地影响 酶蛋白的降解速度。有关情况尚了解不多。总之,通过酶降解以调节酶含量的重要性不如酶的诱导和阻遏作用。 第二节 激素对物质代谢的调节 细胞的物质代谢反应不仅受到局部环镜的影响,即各种代谢底物、产物的正、负反馈调节,而且还受来自于机体其它组织器官的各种化学 信号的控制,激素就属于这类化学信号。激素是一类由特殊的细胞合成并分泌的化学物质,它随血液循环于全身,作用于特定的组织或细胞 (称为靶组织或靶细胞,target cell),指导细胞物质代谢沿着一定的方向进行。同一激素可以使某些代谢反应加强,而使另一些代谢反应减弱, 从而适应整体的需要。对于每一个细胞来说,激素是外源性调控信号,而对于机体整体而言,它仍然属于内环境的一部分。通过激素来控制物 质代谢是高等动物体内代谢调节的一种重要方式。 激素的作用必须通过其受体来实现。受体是一类可以与相应的配体(ligand)特异地结合的物质,常为糖蛋白或脂蛋白。激素作为一类配 体,与受体的结合具有高度的特异性和亲和性。只有那些具有相应受体的细胞才可以成为该激素的靶细胞。 在糖、脂类和氨基酸代谢过程中,具有重要调节作用的激素-胰岛素、肾上腺素和胰高血糖素等(具体作用见代谢各章)均为水溶性物质, 因此不能进入细胞内。但这类激素的受体均存在于细胞膜表面,那么它们是如何通过与细胞膜表面受体结合,将位于胞外的化学信号传递至胞

内,又是如何引起细胞内各种代谢过程的改变的呢?这里以肾上腺素为例做一简要说明。 环化磷 E AM CAM 图9·5CAMP的结构和代谢 (一)CAMP是激素在细胞内的信使 五十年代初期,Sutherland在实验中发现,肝细胞组织切片若加入肾上腺素,可以加速肝糖原分解为葡萄糖;测定磷酸化酶(分解肝糖元的 酶),发现其活性增加。因此他认为,磷酸化酶是肝糖元分解的限速酶,肾上腺素能激活此酶。但是,若用纯化的磷酸化酶与肾上腺素一起温 育,后者对酶则没有激活作用。由此提示,肾上腺素激活磷酸化酶是一间接过程,需要肝细胞中其它物质的协助。进一步对肝匀浆做试验,若 其中加入ATP、Mg++及肾上腺素,则磷酸化酶又可被激活。若只取肝匀浆离心后的上清液,则不能观察到肾上腺素的这种激活作用;只有再 加入沉淀中的细胞膜,激活效应才又恢复。这一实验表明,肾上腺素对磷酸化酶的激活至少需要两种以上的因素。后来的实验证实,肾上腺素 首先作用于细胞膜,使膜上的腺苷酸环化酶活化,后者使细胞内ATP在Mg2+的存在下转变为cAMP,而cAMP可再使胞浆中的磷酸化酶b转变 为磷酸化酶a。由于肾上腺素并不进入细胞,其作用是通过细胞内cAMP传递的,因此将cAMP称为细胞内信使(Intracellular Messenger). cAMP广泛存在于生物界,但其在正常细胞中的含量甚微,仅为0.IM,在激素作用下,可升高约1O0倍。细胞中cAMP的浓度除了与催化 cAMP生成的腺苷酸环化酶有关外,还受到催化cAMP分解的磷酸二酯酶的控制(见图9·5). 有许多药物能抑制磷酸二酯酶的活性,如甲基黄嘌呤(包括茶碱、氨茶碱和咖啡因等)。二丁基?AMP不易被磷酸二酯酶水解,同时又能抑 制此酶活性,故有提高cAMP水平的作用。 激素中多数激素可使cAMP的生成加速,少数激素则可以降低细胞内cAMP的浓度。大部分肽类激素,包括胰高血糖素、甲状旁腺素、降钙 素、抗利尿激素和催产素等以及儿茶酚胺类激素均可通过相应的受体激活靶细胞膜上的腺苷酸环化酶,从而使胞内©AMP的浓度增加。 现将几种激素对cAMP浓度的影响及其与受体结合后引起的生理效应列表如下: 表9·3某些激素对cAMP浓度的影响及其最终生理效应 激素 靶组织或靶器官 cAMP浓度 对菌或化学反应的影响 最终生理效应 肾上腺素 g ↑ 糖原合成酶! 糖原合成! 磷酸化酶1 糖原分解1 脂肪组织 ↑ 脂肪酶↑ 脂肪分解↑ 心肌、骨骼肌 磷酸化确↑ 糖原分解1 肝、心肌 磷酸化酶↑ 糖原分解1 胰高血糖素 脂肪组织 脂肪酶1 脂肪分解1 胰岛鄢-细胞 胰岛素分泌1 促肾上腺皮质激索 肾上腺皮质 ↑ 胆固醇一,孕烯醇酮1 糖皮质激素合成 (ACTH) 脂防肪组织 脂肪酶↑ 脂肪分解↑ 促甲状腺激素 甲状腺 磷酸化砖1 糖原分解1,摄到碘 及合成分泌T3.、T4↑ (TSH) 脂防组织 脂舫酶1 脂肪分解1 脂肪组织 脂肪酶! 脂肪分解! 胰岛素 肝、骨酪肌 磷酸化酶! 糖原分解! 糖原合成璃1 糖原合成 丙酮酸→磷酸烯醇式丙酮酸! 糖异生↑ ↑代表增高或增强 !代表降低或减弱 激素与其专一性细胞膜受体结合后,是如何激活腺苷酸环化酶的呢?近来有人认为,GTP和GTP调节蛋白即G蛋白,起着介导激素对腺苷酸 环化酶激活的作用。当激素与受体结合后,G·蛋白与TP结合,生成GTP·G蛋白复合物,后者能活化腺苷酸环化酶(详见第十二章)
内,又是如何引起细胞内各种代谢过程的改变的呢?这里以肾上腺素为例做一简要说明。 图9-5 CAMP的结构和代谢 (一)cAMP是激素在细胞内的信使 五十年代初期,Sutherland在实验中发现,肝细胞组织切片若加入肾上腺素,可以加速肝糖原分解为葡萄糖;测定磷酸化酶(分解肝糖元的 酶),发现其活性增加。因此他认为,磷酸化酶是肝糖元分解的限速酶,肾上腺素能激活此酶。但是,若用纯化的磷酸化酶与肾上腺素一起温 育,后者对酶则没有激活作用。由此提示,肾上腺素激活磷酸化酶是一间接过程,需要肝细胞中其它物质的协助。进一步对肝匀浆做试验,若 其中加入ATP、Mg++及肾上腺素,则磷酸化酶又可被激活。若只取肝匀浆离心后的上清液,则不能观察到肾上腺素的这种激活作用;只有再 加入沉淀中的细胞膜,激活效应才又恢复。这一实验表明,肾上腺素对磷酸化酶的激活至少需要两种以上的因素。后来的实验证实,肾上腺素 首先作用于细胞膜,使膜上的腺苷酸环化酶活化,后者使细胞内ATP在Mg2+的存在下转变为cAMP,而cAMP可再使胞浆中的磷酸化酶b转变 为磷酸化酶a。由于肾上腺素并不进入细胞,其作用是通过细胞内cAMP传递的,因此将cAMP称为细胞内信使(Intracellular Messenger)。 cAMP广泛存在于生物界,但其在正常细胞中的含量甚微,仅为0.1μM,在激素作用下,可升高约100倍。细胞中cAMP的浓度除了与催化 cAMP生成的腺苷酸环化酶有关外,还受到催化cAMP分解的磷酸二酯酶的控制(见图9-5)。 有许多药物能抑制磷酸二酯酶的活性,如甲基黄嘌呤(包括茶碱、氨茶碱和咖啡因等)。二丁基?cAMP不易被磷酸二酯酶水解,同时又能抑 制此酶活性,故有提高cAMP水平的作用。 激素中多数激素可使cAMP的生成加速,少数激素则可以降低细胞内cAMP的浓度。大部分肽类激素,包括胰高血糖素、甲状旁腺素、降钙 素、抗利尿激素和催产素等以及儿茶酚胺类激素均可通过相应的受体激活靶细胞膜上的腺苷酸环化酶,从而使胞内cAMP的浓度增加。 现将几种激素对cAMP浓度的影响及其与受体结合后引起的生理效应列表如下: 表9-3 某些激素对cAMP浓度的影响及其最终生理效应 激素 靶组织或靶器官 cAMP浓度 对酶或化学反应的影响 最终生理效应 肾上腺素 肝 ↑ 糖原合成酶↓ 糖原合成↓ 磷酸化酶↑ 糖原分解↑ 脂肪组织 ↑ 脂肪酶↑ 脂肪分解↑ 心肌、骨骼肌 ↑ 磷酸化酶↑ 糖原分解↑ 胰高血糖素 肝、心肌 ↑ 磷酸化酶↑ 糖原分解↑ 脂肪组织 ↑ 脂肪酶↑ 脂肪分解↑ 胰岛β-细胞 ↑ - 胰岛素分泌↑ 促肾上腺皮质激素 肾上腺皮质 ↑ 胆固醇→孕烯醇酮↑ 糖皮质激素合成↑ (ACTH) 脂肪组织 ↑ 脂肪酶↑ 脂肪分解↑ 促甲状腺激素 甲状腺 ↑ 磷酸化酶↑ 糖原分解↑,摄到碘 (TSH) 及合成分泌T3、T4↑ 脂肪组织 ↑ 脂肪酶↑ 脂肪分解↑ 脂肪组织 ↓ 脂肪酶↓ 脂肪分解↓ 胰岛素 肝、骨骼肌 ↓ 磷酸化酶↓ 糖原分解↓ 糖原合成酶↑ 糖原合成↑ 丙酮酸→磷酸烯醇式丙酮酸↓ 糖异生↑ ↑代表增高或增强 ↓代表降低或减弱 激素与其专一性细胞膜受体结合后,是如何激活腺苷酸环化酶的呢?近来有人认为,GTP和GTP调节蛋白即G蛋白,起着介导激素对腺苷酸 环化酶激活的作用。当激素与受体结合后,G-蛋白与TP结合,生成GTP-G蛋白复合物,后者能活化腺苷酸环化酶(详见第十二章)

(二)cAMP依赖性蛋白激酶是cAMP的靶分子 cAMP作为变构剂作用于cAMP依赖性蛋白激酶(cAMP.dependentProtein Kinase A激酶)。这种蛋白激酶由两个亚基组成,一个亚基是催 化亚基,具有催化蛋白质磷酸化的作用:另一个亚基是调节亚基,是催化亚基的抑制物。当调节亚基与催化亚基结合时,酶呈无活性状态。 cAMP的效应是与调节亚基结合,使后者发生变构而脱离催化亚基,从而使催化亚基进入激活状态(图9·6)。 器+2AMr一器c一8+8e洲 图9·6蛋白激酶的激活过程C为催化亚基R为调节亚基 活化形式的催化亚基在TP的作用下,使细胞中的相应底物磷酸化,从而改变这些蛋白质的功能:有些被激活,有些则被抑制。例如,糖 原分解过程中的磷酸化酶可在A激酶的作用下被磷酸化而激活(图9-6),而糖原合成酶则侧在A激酶的作用下被磷酸化而失去活性。总的效应是糖 原分解加强和糖原合成的抑制,使血糖浓度升高。 总之,很多多肽和儿茶酚胺类激素的作用是通过下列过程来实现的,即激素与膜受体结合→腺苷酸环化酶活性↑一cΛMP水平↑一A激酶被 激活→蛋白质发生磷酸化→生理效应发生。 八十年代中期,对腺苷酸环化酶活化机制的研究导致了另外一种重要的调节蛋白梧蛋白的发现。G蛋白在膜受体和腺苷酸环化酶间具有中 介作用。它的发现使我们更为深入地认识了激素的作用机理(详见第十二章)。 储元合成鞋D磷陵酚 无活性「有活性的 无活性的 第二信使 蛋白激爵情元合成酶I 糖元合成醉D CAMP 有活性 ATP M&" 蛋白敬酶 ATPM” 、ATP 无活性的 有活性的 体《 磷酸化冀b澈隔 牌酸化酶b激霸回 屏蛋白确酸酶 (+) 一 无活性的 有活性的 磷酸化酶b 解酸化藤a⊙ 磷酸化胸磷酸陶 图9·7激素调节糖原代谢的连续激活反应 第三节物质代谢的整体调节 机体内各种组织器官和各种细胞在功能上都不会独立于整体之外,而是处于一个严密的整体系统中。一个组织可以为其它组织提供底物, 也可以代谢来自其它组织的物质。这些器官之间的相互联系是依靠神经·内分泌系统的调节来实现的。神经系统可以释放经递质来影响组织中 的代谢,又能影响内分泌腺的活动,改变激素分泌的状态,从而实现机体整体的代谢协调和平衡。图9~8、图9·9和图9·10分别展示了在早 期饥饿、饥饿和饱食情况下机体的代谢调节过程。在早期饥饿时,血糖浓度有下降趋势,这时肾上腺素和糖皮质激素的调节占优势,促进肝糖 原分解和肝脏糖异生功能,在短期内维持血糖浓度的恒定,以供给脑组织和红细胞等重要组织对萄萄糖的需求。若饥饿时间继续延长,则肝糖 原被消耗怡尽,这时糖皮质激素也参与发挥调节作用,促进肝外组织蛋白分解为氨基酸,便于肝脏利用氨基酸、乳酸和甘油等物质生成葡萄 糖,这在一定程度上维持了血糖浓度的恒定;这时,脂动员也加强,分解为甘油和脂肪酸,肝脏将脂肪酸分解生成酮体,酮体在此时是脑组织 和肌肉等器官重要的能量来源。在饱食情况下,胰岛素发挥重要作用,它促进肝脏合成糖原和将糖转变为脂肪,抑制糖异生;胰岛素还促进肌 肉和脂肪组织的细胞膜对葡萄糖的通透性,使血糖容易进入细胞,并被氧化利用
(二)cAMP依赖性蛋白激酶是cAMP的靶分子 cAMP作为变构剂作用于cAMP依赖性蛋白激酶(cAMP-dependentProtein Kinase A激酶)。这种蛋白激酶由两个亚基组成,一个亚基是催 化亚基,具有催化蛋白质磷酸化的作用;另一个亚基是调节亚基,是催化亚基的抑制物。当调节亚基与催化亚基结合时,酶呈无活性状态。 cAMP的效应是与调节亚基结合,使后者发生变构而脱离催化亚基,从而使催化亚基进入激活状态(图9-6)。 图9-6 蛋白激酶的激活过程 C为催化亚基 R为调节亚基 活化形式的催化亚基在ATP的作用下,使细胞中的相应底物磷酸化,从而改变这些蛋白质的功能:有些被激活,有些则被抑制。例如,糖 原分解过程中的磷酸化酶可在A激酶的作用下被磷酸化而激活(图9-6),而糖原合成酶则在A激酶的作用下被磷酸化而失去活性。总的效应是糖 原分解加强和糖原合成的抑制,使血糖浓度升高。 总之,很多多肽和儿茶酚胺类激素的作用是通过下列过程来实现的,即激素与膜受体结合→腺苷酸环化酶活性↑→cAMP水平↑→A激酶被 激活→蛋白质发生磷酸化→生理效应发生。 八十年代中期,对腺苷酸环化酶活化机制的研究导致了另外一种重要的调节蛋白桮蛋白的发现。G蛋白在膜受体和腺苷酸环化酶间具有中 介作用。它的发现使我们更为深入地认识了激素的作用机理(详见第十二章)。 图9-7 激素调节糖原代谢的连续激活反应 第三节 物质代谢的整体调节 机体内各种组织器官和各种细胞在功能上都不会独立于整体之外,而是处于一个严密的整体系统中。一个组织可以为其它组织提供底物, 也可以代谢来自其它组织的物质。这些器官之间的相互联系是依靠神经-内分泌系统的调节来实现的。神经系统可以释放经递质来影响组织中 的代谢,又能影响内分泌腺的活动,改变激素分泌的状态,从而实现机体整体的代谢协调和平衡。图9-8、图9-9和图9-10分别展示了在早 期饥饿、饥饿和饱食情况下机体的代谢调节过程。在早期饥饿时,血糖浓度有下降趋势,这时肾上腺素和糖皮质激素的调节占优势,促进肝糖 原分解和肝脏糖异生功能,在短期内维持血糖浓度的恒定,以供给脑组织和红细胞等重要组织对葡萄糖的需求。若饥饿时间继续延长,则肝糖 原被消耗饴尽,这时糖皮质激素也参与发挥调节作用,促进肝外组织蛋白分解为氨基酸,便于肝脏利用氨基酸、乳酸和甘油等物质生成葡萄 糖,这在一定程度上维持了血糖浓度的恒定;这时,脂动员也加强,分解为甘油和脂肪酸,肝脏将脂肪酸分解生成酮体,酮体在此时是脑组织 和肌肉等器官重要的能量来源。在饱食情况下,胰岛素发挥重要作用,它促进肝脏合成糖原和将糖转变为脂肪,抑制糖异生;胰岛素还促进肌 肉和脂肪组织的细胞膜对葡萄糖的通透性,使血糖容易进入细胞,并被氧化利用
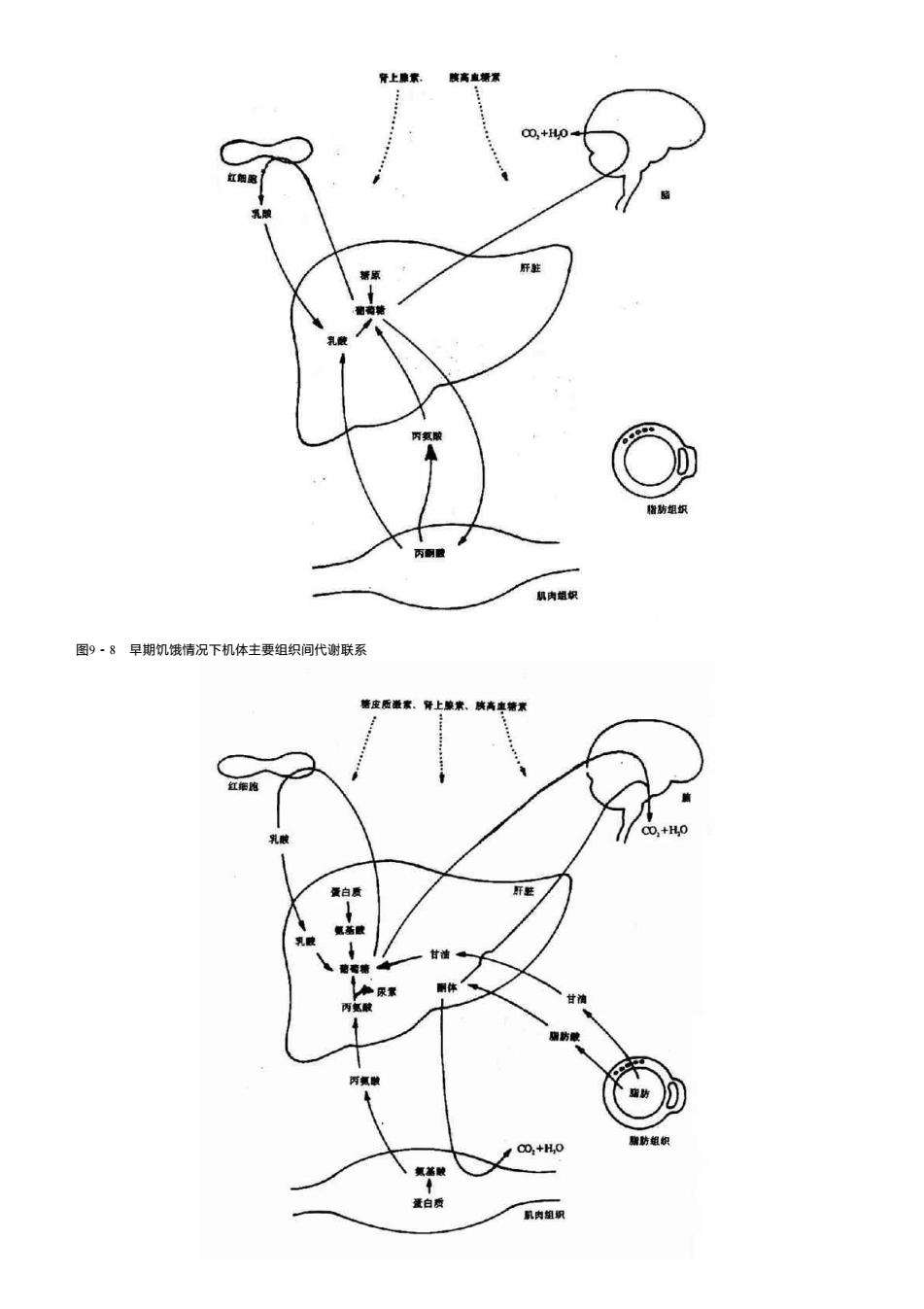
肾上藤紧 腹高直培常 : 0,+H0 红细 乳 肝鞋 乳酸 D 者药组织 机肉姐织 图9·8早期饥饿情况下机体主要组织间代谢联系 绪皮质业素,府上映来、族高虫塘素 红细胞 C0,+H,0 乳酸 蛋白质 乳 甘油 甘滴 扇防酸 丙氯 D C0,+H0 醒防组织 量白质 航肉组帆
图9-8 早期饥饿情况下机体主要组织间代谢联系
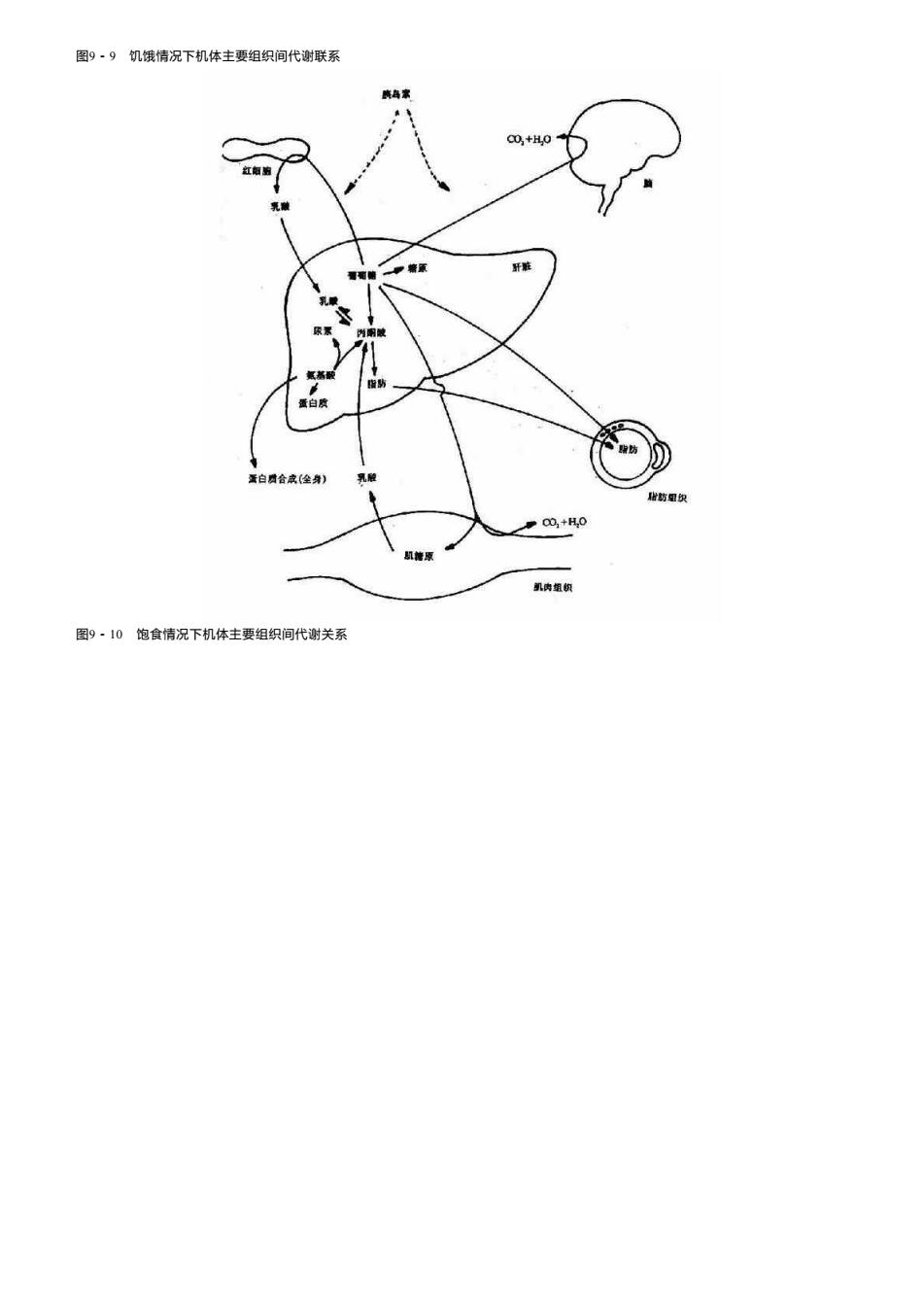
图9·9饥饿情况下机体主要组织间代谢联系 晓乌家 0o,+H0 红的 乳 籍原 肝鞋 乳眼 原不 e防 蛋白质 公防 置白贯合成(全身) 乳酸 出防里织 O0,+H,0 糖原 凯肉组织 图9·10饱食情况下机体主要组织间代谢关系
图9-9 饥饿情况下机体主要组织间代谢联系 图9-10 饱食情况下机体主要组织间代谢关系