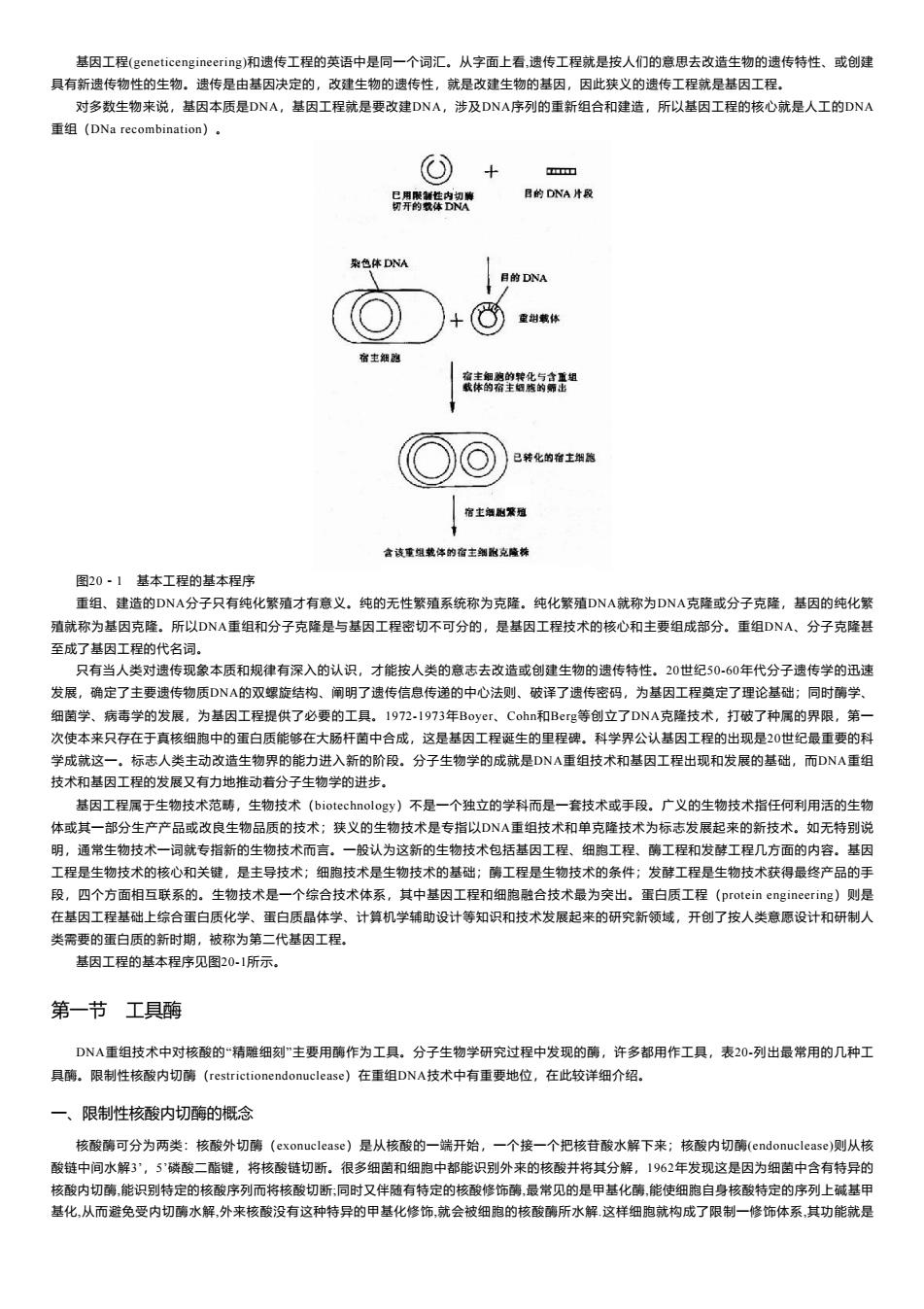
基因工程(geneticengineering)和遗传工程的英语中是同一个词汇。从字面上看,遗传工程就是按人们的意思去改造生物的遗传特性、或创建 具有新遗传物性的生物。遗传是由基因决定的,改建生物的遗传性,就是改建生物的基因,因此狭义的遗传工程就是基因工程。 对多数生物来说,基因本质是DNA,基因工程就是要改建DNA,涉及DNA序列的重新组合和建造,所以基因工程的核心就是人工的DNA 重组(DNa recombination)。 十 Tmm 号舞腾 B的DNA片段 染色体DNA 目的DNA 重甜戴体 宿主细胞 宿主细购的转化与含重组 载体的宿主细旅的师出 已转化的宿士细胞 宿士解胞繁殖 含该重组装体的宿主细张克隆株 图20·1基本工程的基本程序 重组、建造的DNA分子只有纯化繁殖才有意义。纯的无性繁殖系统称为克隆。纯化繁殖DNA就称为DNA克隆或分子克隆,基因的纯化繁 殖就称为基因克隆。所以DNA重组和分子克隆是与基因工程密切不可分的,是基因工程技术的核心和主要组成部分。重组DNA、分子克隆甚 至成了基因工程的代名词。 只有当人类对遗传现象本质和规律有深入的认识,才能按人类的意志去改造或创建生物的遗传特性。20世纪50-60年代分子遗传学的迅速 发展,确定了主要遗传物质DNA的双螺旋结构、阐明了遗传信息传递的中心法则、破译了遗传密码,为基因工程奠定了理论基础;同时酶学、 细菌学、病毒学的发展,为基因工程提供了必要的工具。1972-I973年Boyer、.Cohn和Berg等创立了DNA克隆技术,打破了种属的界限,第- 次使本来只存在于真核细胞中的蛋白质能够在大肠杆菌中合成,这是基因工程诞生的里程碑。科学界公认基因工程的出现是20世纪最重要的科 学成就这一,标志人类主动改造生物界的能力进入新的阶段。分子生物学的成就是DNA重组技术和基因工程出现和发展的基础,而DNA重组 技术和基因工程的发展又有力地推动若分子生物学的进步。 基因工程属于生物技术范畴,生物技术(biotechnology)不是一个独立的学科而是一套技术或手段。广义的生物技术指任何利用活的生物 体或其一部分生产产品或改良生物品质的技术;狭义的生物技术是专指以DN重组技术和单克隆技术为标志发展起来的新技术。如无特别说 明,通常生物技术一词就专指新的生物技术而言。一般认为这新的生物技术包括基因工程、细胞工程、酶工程和发酵工程几方面的内容。基因 工程是生物技术的核心和关键,是主导技术:细胞技术是生物技术的基础:酶工程是生物技术的条件;发酵工程是生物技术获得最终产品的手 段,四个方面相互联系的。生物技术是一个综合技术体系,其中基因工程和细胞融合技术最为突出。蛋白质工程(protein engineering)则是 在基因工程基础上综合蛋白质化学、蛋白质晶体学、计算机学辅助设计等知识和技术发展起来的研究新领域,开创了按人类意愿设计和研制人 类需要的蛋白质的新时期,被称为第二代基因工程。 基因工程的基本程序见图20-1所示。 第一节工具酶 DNA重组技术中对核酸的“精雕细刻”主要用酶作为工具。分子生物学研究过程中发现的酶,许多都用作工具,表20-列出最常用的几种工 具酶。限制性核酸内切酶(restrictionendonuclease)在重组DNA技术中有重要地位,在此较详细介绍。 一、限制性核酸内切酶的概念 核酸酶可分为两类:核酸外切酶(exonuclease)是从核酸的一端开始,一个接一个把核苷酸水解下来;核酸内切酶(endonuclease)则从核 酸链中间水解3',5'磷酸二酯键,将核酸链切断。很多细菌和细胞中都能识别外来的核酸并将其分解,1962年发现这是因为细菌中含有特异的 核酸内切酶,能识别特定的核酸序列而将核酸切断:同时又伴随有特定的核酸修饰酶,最常见的是甲基化酶,能使细胞自身核酸特定的序列上碱基甲 基化,从而避免受内切酶水解,外来核酸没有这种特异的甲基化修饰,就会被细胞的核酸酶所水解这样细胞就构成了限制一修饰体系,其功能就是
基因工程(geneticengineering)和遗传工程的英语中是同一个词汇。从字面上看,遗传工程就是按人们的意思去改造生物的遗传特性、或创建 具有新遗传物性的生物。遗传是由基因决定的,改建生物的遗传性,就是改建生物的基因,因此狭义的遗传工程就是基因工程。 对多数生物来说,基因本质是DNA,基因工程就是要改建DNA,涉及DNA序列的重新组合和建造,所以基因工程的核心就是人工的DNA 重组(DNa recombination)。 图20-1 基本工程的基本程序 重组、建造的DNA分子只有纯化繁殖才有意义。纯的无性繁殖系统称为克隆。纯化繁殖DNA就称为DNA克隆或分子克隆,基因的纯化繁 殖就称为基因克隆。所以DNA重组和分子克隆是与基因工程密切不可分的,是基因工程技术的核心和主要组成部分。重组DNA、分子克隆甚 至成了基因工程的代名词。 只有当人类对遗传现象本质和规律有深入的认识,才能按人类的意志去改造或创建生物的遗传特性。20世纪50-60年代分子遗传学的迅速 发展,确定了主要遗传物质DNA的双螺旋结构、阐明了遗传信息传递的中心法则、破译了遗传密码,为基因工程奠定了理论基础;同时酶学、 细菌学、病毒学的发展,为基因工程提供了必要的工具。1972-1973年Boyer、Cohn和Berg等创立了DNA克隆技术,打破了种属的界限,第一 次使本来只存在于真核细胞中的蛋白质能够在大肠杆菌中合成,这是基因工程诞生的里程碑。科学界公认基因工程的出现是20世纪最重要的科 学成就这一。标志人类主动改造生物界的能力进入新的阶段。分子生物学的成就是DNA重组技术和基因工程出现和发展的基础,而DNA重组 技术和基因工程的发展又有力地推动着分子生物学的进步。 基因工程属于生物技术范畴,生物技术(biotechnology)不是一个独立的学科而是一套技术或手段。广义的生物技术指任何利用活的生物 体或其一部分生产产品或改良生物品质的技术;狭义的生物技术是专指以DNA重组技术和单克隆技术为标志发展起来的新技术。如无特别说 明,通常生物技术一词就专指新的生物技术而言。一般认为这新的生物技术包括基因工程、细胞工程、酶工程和发酵工程几方面的内容。基因 工程是生物技术的核心和关键,是主导技术;细胞技术是生物技术的基础;酶工程是生物技术的条件;发酵工程是生物技术获得最终产品的手 段,四个方面相互联系的。生物技术是一个综合技术体系,其中基因工程和细胞融合技术最为突出。蛋白质工程(protein engineering)则是 在基因工程基础上综合蛋白质化学、蛋白质晶体学、计算机学辅助设计等知识和技术发展起来的研究新领域,开创了按人类意愿设计和研制人 类需要的蛋白质的新时期,被称为第二代基因工程。 基因工程的基本程序见图20-1所示。 第一节 工具酶 DNA重组技术中对核酸的“精雕细刻”主要用酶作为工具。分子生物学研究过程中发现的酶,许多都用作工具,表20-列出最常用的几种工 具酶。限制性核酸内切酶(restrictionendonuclease)在重组DNA技术中有重要地位,在此较详细介绍。 一、限制性核酸内切酶的概念 核酸酶可分为两类:核酸外切酶(exonuclease)是从核酸的一端开始,一个接一个把核苷酸水解下来;核酸内切酶(endonuclease)则从核 酸链中间水解3’,5’磷酸二酯键,将核酸链切断。很多细菌和细胞中都能识别外来的核酸并将其分解,1962年发现这是因为细菌中含有特异的 核酸内切酶,能识别特定的核酸序列而将核酸切断;同时又伴随有特定的核酸修饰酶,最常见的是甲基化酶,能使细胞自身核酸特定的序列上碱基甲 基化,从而避免受内切酶水解,外来核酸没有这种特异的甲基化修饰,就会被细胞的核酸酶所水解.这样细胞就构成了限制一修饰体系,其功能就是

保护自身的DNA,分解外来的DNA,以保护和维持自身遗传信息的稳定,这对细菌的生存和繁衍具有重要意义。这就是限制性核酸内切酶名称 中“限制”二字概念的由来。 二、限制性核酸内切酶的命名 按酶的来源的属、种名而定,取属名的第一个字母与种名的头两个字母组成的三个斜体字母作略语表示;如有株名,再加上一个字母,其 后再按发现的先后写上罗马数字。例如:从流感嗜血杆菌d株(Haemophilus influenzae d)中先后分离到3种限制酶,则分别命名为HindI、 Hind和HindIl. 三、限制性核酸内切酶的分类 按限制酶的组成、与修饰酶活性关系,切断核酸的情况不同,分为三类: I类限制性核酸内切酶由3种不同亚基构成,兼具有修饰酶活性和依赖于ATP的限制性内切酶活性,它能识别和结合于特定的DN序列位 点,去随机切断在识别位点以外的DNA序列,通常在识别位点周围400-700bp。这类酶的作用需要Mg2+,S腺苷甲硫氨酸及ATP. Ⅱ类限制性核酸内切酶与1类酶相似,是多亚蛋白质,既有内切酶活性,又有修饰酶活性,切断位点在识别序列周围25-30p范围内,酶促 反应除Mg2+外,也需要ATP供给能量, Ⅲ类限制性核酸内切酶只由一条肽链构成,仅需Mg2+,切割DNA特异性最强,且就在识别位点范围内切断DNA。是分子生物学中应用 最广的限制性内切酶。通常在重组DNA技术提到的限制性核酸内切酶主要指Ⅱ类酶而言。 表20-1DNA重组技术中最常用的工具酶 确 主要用途 限制性核酸钠切酶 识别DNA特定序列,切断DNA链 @缺口平移制作标记DNA探针 ②合成cDNA的第二链 DNA聚合酶I或其大片段(Klenow) ③填补双链DNA3'凹端 ④DNA序列分析 耐热DNA聚合酶(Tag DNA聚合酶等) 聚合酶链反应(PCR) DNA连接 连接两个DNA分子或片段 多核苷酸激 催化多核苷酸5羟基末端磷酸化,制备末端标记探针 未端转移酶 在3末端加入同质多聚物尾 $核酸确,绿豆核酸酶 降解单链DNA或RNA,使双链DNA突出端变为平端 DNA端 降解DNA,在双链DNA上产生随机切口 RNAA 降解除RNA 磷酸 切除核酸末端磷酸基 四、限制性核酸内切酶的作用 大部分限制性核酸内切酶识别DNA序列具有回文结构特征,切断的双链DNA都产生5磷酸基和3'羟基末端。不同限制性核酸内切酶识别和 切割的特异性不同,结果有三种不同的情况: ①产生3'突出粘性末端(cohesive end):以Eoor为例: 5'...GAATT C...35'...Gp OHTTAAC...3" 3'...C ATAAG...5'EooP I 3'...CTTAAOH pG...5' ②产生5'突出的粘性末端:以PstI为例: 5'...CTGCALG...3'5'...CTGCAp OHG...3' 3'...GACGTC...5'PstI 3'...GOH pACGTC...5 ③产生平未端(blunt end):NruI为例: 5'...TCGICGA...35'...TCGp OHCGA...3' 3'...AGCGCT...5'Nru I3'...AGCOhpGCT...5 不同有限制性核酸内切酶识别的DNA序列可以不相同。有的识别四核苷酸序列,有的识别六或八核苷酸序列。如果DNA中的核苷酸序列 是随机排列的,则一个识别四核苷酸序列的内切酶平均每隔256即出现一次该酶的识别切割位点,同样的对识别六或八核苷酸序列的内切酶则 大致上分别是每隔4kb或6Skb出现一次识别切割位点。按此可大致估计一个未知的DNA分子限制性内切酶可能具有切点频率,以便选用合适的 内切酶。 限制性核酸内切酶的种类很多,至今已发现近8O0多种,可以根据它们对DNA有不同的识别序列和切割特征选用,从而为基因工程提供了 有力的工具。表20-2列出了几种最常用的限制性核酸内切酶的识别序列和切割点。 表20·2几种最常用的限制性核酸内切酶 限制性核酸内切酶名称 识别序列和切割点 BamHI GIGATCe ClaI ATICGAT EooR I GIAATTC Hind III AJAGCTT
保护自身的DNA,分解外来的DNA,以保护和维持自身遗传信息的稳定,这对细菌的生存和繁衍具有重要意义。这就是限制性核酸内切酶名称 中“限制”二字概念的由来。 二、限制性核酸内切酶的命名 按酶的来源的属、种名而定,取属名的第一个字母与种名的头两个字母组成的三个斜体字母作略语表示;如有株名,再加上一个字母,其 后再按发现的先后写上罗马数字。例如:从流感嗜血杆菌d株(Haemophilus influenzae d)中先后分离到3种限制酶,则分别命名为HindⅠ、 HindⅡ和HindⅢ。 三、限制性核酸内切酶的分类 按限制酶的组成、与修饰酶活性关系,切断核酸的情况不同,分为三类: Ⅰ类限制性核酸内切酶 由3种不同亚基构成,兼具有修饰酶活性和依赖于ATP的限制性内切酶活性,它能识别和结合于特定的DNA序列位 点,去随机切断在识别位点以外的DNA序列,通常在识别位点周围400-700bp。这类酶的作用需要Mg2+,S腺苷甲硫氨酸及ATP。 Ⅱ类限制性核酸内切酶 与Ⅰ类酶相似,是多亚蛋白质,既有内切酶活性,又有修饰酶活性,切断位点在识别序列周围25-30bp范围内,酶促 反应除Mg2+外,也需要ATP供给能量。 Ⅲ类限制性核酸内切酶 只由一条肽链构成,仅需Mg2+,切割DNA特异性最强,且就在识别位点范围内切断DNA。是分子生物学中应用 最广的限制性内切酶。通常在重组DNA技术提到的限制性核酸内切酶主要指Ⅱ类酶而言。 表20-1 DNA重组技术中最常用的工具酶 酶 主要用途 限制性核酸内切酶 识别DNA特定序列,切断DNA链 DNA聚合酶Ⅰ或其大片段(Klenow) ①缺口平移制作标记DNA探针 ②合成cDNA的第二链 ③填补双链DNA3’凹端 ④DNA序列分析 耐热DNA聚合酶(Taq DNA聚合酶等) 聚合酶链反应(PCR) DNA连接酶 连接两个DNA分子或片段 多核苷酸激酶 催化多核苷酸5’羟基末端磷酸化,制备末端标记探针 末端转移酶 在3’末端加入同质多聚物尾 SI核酸酶,绿豆核酸酶 降解单链DNA或RNA,使双链DNA突出端变为平端 DNA端酶Ⅰ 降解DNA,在双链DNA上产生随机切口 RNA酶A 降解除RNA 磷酸酶 切除核酸末端磷酸基 四、限制性核酸内切酶的作用 大部分限制性核酸内切酶识别DNA序列具有回文结构特征,切断的双链DNA都产生5’磷酸基和3’羟基末端。不同限制性核酸内切酶识别和 切割的特异性不同,结果有三种不同的情况: ①产生3’突出粘性末端(cohesive end):以Eoor 为例: 5’…G↓AATT C…3’→5’…Gp OHTTAAC…3’ 3’…C ATAA↑G…5’EooP Ⅰ 3'… CTTAAOH pG…5' ②产生5’突出的粘性末端:以PstⅠ为例: 5’…CTGCA↓G…3’→5’…CTGCAp OHG…3’ 3’…G↑ACGTC…5’PstⅠ 3’…GOH pACGTC…5 ③产生平末端(blunt end):Nru Ⅰ为例: 5’…TCG↓CGA…3’→5’…TCGp OHCGA…3’ 3’…AGC↑GCT…5’Nru Ⅰ3’…AGCOhpGCT…5’ 不同有限制性核酸内切酶识别的DNA序列可以不相同。有的识别四核苷酸序列,有的识别六或八核苷酸序列。如果DNA中的核苷酸序列 是随机排列的,则一个识别四核苷酸序列的内切酶平均每隔256bp出现一次该酶的识别切割位点,同样的对识别六或八核苷酸序列的内切酶则 大致上分别是每隔4kb或65kb出现一次识别切割位点。按此可大致估计一个未知的DNA分子限制性内切酶可能具有切点频率,以便选用合适的 内切酶。 限制性核酸内切酶的种类很多,至今已发现近800多种,可以根据它们对DNA有不同的识别序列和切割特征选用,从而为基因工程提供了 有力的工具。表20-2列出了几种最常用的限制性核酸内切酶的识别序列和切割点。 表20-2 几种最常用的限制性核酸内切酶 限制性核酸内切酶名称 识别序列和切割点 BamHⅠ Cla Ⅰ EooR Ⅰ Hind Ⅲ G↓GATCc AT↓CGAT G↓AATTC A↓AGCTT

HindII GTPyIPuAC KpnI GGTACIC NotI GCJGGCCGC PstI CTGCAIG SalI GITCGAC Sau3A I IGATC SfiI GGCCNNNNINGGCC Sma I CCCIGGG Xba I TICTAGA Xho I CITCGAG 第二节 基因工程载体 基因工程是要按人们的意愿去有目的地改造,创建生物遗传性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。分离或改建 的基因和核酸序列自身不能繁殖,需要载体携带它们到合适的细胞中复制和表现功能。对理想的基因工程载体一般至少有以下几点要求: ①能在宿主细胞中复制繁殖,而且最好要有较高的自主复制能力。 ②容易进入宿主细胞,而且进入效率越高越好。 ③容易插入外来核酸片段,插入后不影响其进入宿主细胞和在细胞中的复制。这就要求载体DNA上要有合适的限制性核酸内切酶位点。 ④容易从宿主细胞中分离纯化出来,这才便于重组操作。 ⑤有容易被识别筛选的标志,当其进入宿主细胞、或携带着外来的核酸序列进入宿主细胞都能容易被辨认和分离出来。这才介于克隆操 作。 常用的载体有质粒,噬菌体和病毒等。 一、质粒载体 质粒(plasmid))是细菌或细胞染色质以外的,能自主复制的,与细菌或细胞共生的遗传成分。其特点如下: ①是染色质外的双链共价闭合环形DNA(covalentlyclosed circuar DNA,cccDNA),可自然形成超螺旋结构,不同质粒大小在2-30Okb之 间,15kb的大质粒则不易提取。 ②能自主复制,是能独立复制的复制子(autonomous replicon)。一般质粒DNA复制的质粒可随宿主细胞分裂而传给后代。按质粒复制的 调控及其拷贝数可分两类:严紧控制(stringent control)型质粒的复制常与宿主的繁殖偶联,拷贝数较少,每个细胞中只有1个到十几个拷 贝;另一类是松弛控制(relaxed control)型质粒,其复制宿主不偶联,每个细胞中有几十到几百个拷贝。每个质粒DNA上都有复制的起点, 只有能被宿主细胞复制蛋白质识别的质粒才能在该种细胞中复制,不同质粒复制控制状况主要与复制起点的序列结构相关。有的质粒的可以 整合到宿主细胞染色质DNA中,随宿主DNA复制,称为附加体,例如细菌的性质粒就是一种附加体,它可以质粒形式存在,也能整合入细菌 的DNA,又能从细菌染色质DNA上切下来。F因子携带基因编码的蛋白质能使两个细菌间形成纤毛状细管连接的接合(conjugation),通过这 细管遗传物质可在两个细菌间传递。 ③质粒对宿主生存并不是必需的。这点不同于线粒体,线粒体DN也是环状双链分子,也有独立复制的调控,但线粒体的功能是细胞生存 所必需的。线粒体是细胞的一部分,质粒也往往有其表型,其表现不是宿主生存所必需的,但也不妨碍宿主的生存。某些质粒携带的基因功能 有利于宿主细胞的特定条件下生存,例如,细菌中许多天然的质粒带有抗药性基因,如编码合成能分解破坏四环素、氯霉素、氨苄表霉素等的 酶基因,这种质粒称为抗药性质粒,又称R质粒,带有R质粒的细菌就能在相应的抗生素存在生存繁殖。所以质粒对宿主不是寄生的,而是共 生的。医学上遇到许多细菌的抗药性,常与R质粒在细菌间的传播有关,F质粒就能促使这种传递
HindⅡ KpnⅠ Not Ⅰ Pst Ⅰ Sal Ⅰ Sau3A Ⅰ Sfi Ⅰ Sma Ⅰ Xba Ⅰ Xho Ⅰ GTPy↓PuAC GGTAC↓C GC↓GGCCGC CTGCA↓G G↓TCGAC ↓GATC GGCCNNNN↓NGGCC CCC↓GGG T↓CTAGA C↓TCGAG 第二节 基因工程载体 基因工程是要按人们的意愿去有目的地改造,创建生物遗传性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。分离或改建 的基因和核酸序列自身不能繁殖,需要载体携带它们到合适的细胞中复制和表现功能。对理想的基因工程载体一般至少有以下几点要求: ①能在宿主细胞中复制繁殖,而且最好要有较高的自主复制能力。 ②容易进入宿主细胞,而且进入效率越高越好。 ③容易插入外来核酸片段,插入后不影响其进入宿主细胞和在细胞中的复制。这就要求载体DNA上要有合适的限制性核酸内切酶位点。 ④容易从宿主细胞中分离纯化出来,这才便于重组操作。 ⑤有容易被识别筛选的标志,当其进入宿主细胞、或携带着外来的核酸序列进入宿主细胞都能容易被辨认和分离出来。这才介于克隆操 作。 常用的载体有质粒,噬菌体和病毒等。 一、质粒载体 质粒(plasmid)是细菌或细胞染色质以外的,能自主复制的,与细菌或细胞共生的遗传成分。其特点如下: ①是染色质外的双链共价闭合环形DNA(covalentlyclosed circuar DNA,cccDNA),可自然形成超螺旋结构,不同质粒大小在2-300kb之 间,<15kb的小质粒比较容易分离纯化,>15kb的大质粒则不易提取。 ②能自主复制,是能独立复制的复制子(autonomous replicon)。一般质粒DNA复制的质粒可随宿主细胞分裂而传给后代。按质粒复制的 调控及其拷贝数可分两类:严紧控制(stringent control)型质粒的复制常与宿主的繁殖偶联,拷贝数较少,每个细胞中只有1个到十几个拷 贝;另一类是松弛控制(relaxed control)型质粒,其复制宿主不偶联,每个细胞中有几十到几百个拷贝。每个质粒DNA上都有复制的起点, 只有ori能被宿主细胞复制蛋白质识别的质粒才能在该种细胞中复制,不同质粒复制控制状况主要与复制起点的序列结构相关。有的质粒的可以 整合到宿主细胞染色质DNA中,随宿主DNA复制,称为附加体,例如细菌的性质粒就是一种附加体,它可以质粒形式存在,也能整合入细菌 的DNA,又能从细菌染色质DNA上切下来。F因子携带基因编码的蛋白质能使两个细菌间形成纤毛状细管连接的接合(conjugation),通过这 细管遗传物质可在两个细菌间传递。 ③质粒对宿主生存并不是必需的。这点不同于线粒体,线粒体DNA也是环状双链分子,也有独立复制的调控,但线粒体的功能是细胞生存 所必需的。线粒体是细胞的一部分,质粒也往往有其表型,其表现不是宿主生存所必需的,但也不妨碍宿主的生存。某些质粒携带的基因功能 有利于宿主细胞的特定条件下生存,例如,细菌中许多天然的质粒带有抗药性基因,如编码合成能分解破坏四环素、氯霉素、氨芐表霉素等的 酶基因,这种质粒称为抗药性质粒,又称R质粒,带有R质粒的细菌就能在相应的抗生素存在生存繁殖。所以质粒对宿主不是寄生的,而是共 生的。医学上遇到许多细菌的抗药性,常与R质粒在细菌间的传播有关,F质粒就能促使这种传递
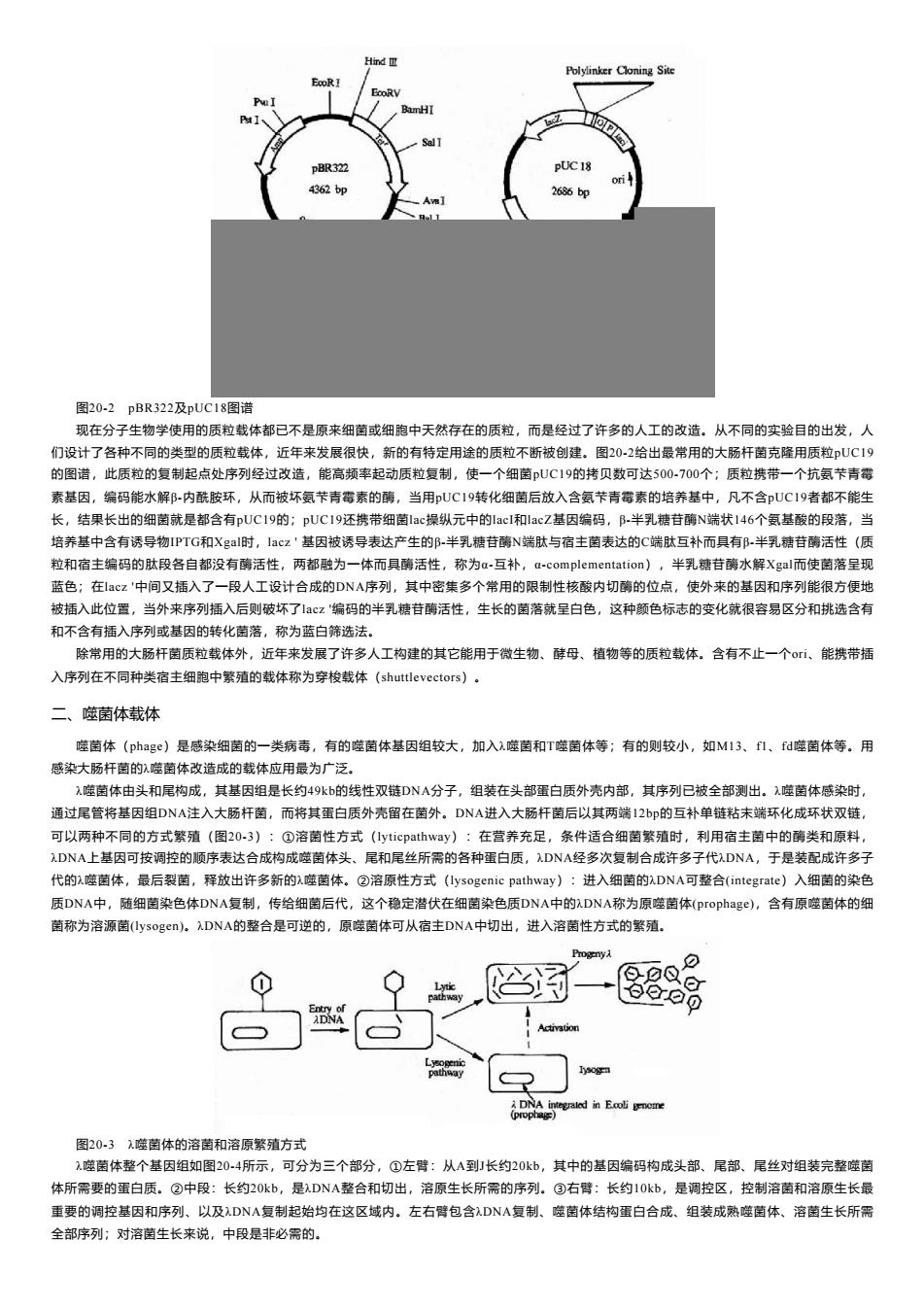
HindⅢ Polylinker Cloning Site EcoRI EooRV BamHI pBR322 PUC 18 ori 4362bp A】 2686bp 图20-2pBR322及pUC18图谱 现在分子生物学使用的质粒载体都已不是原来细菌或细胞中天然存在的质粒,而是经过了许多的人工的改造。从不同的实验目的出发,人 们设计了各种不同的类型的质粒载体,近年来发展很快,新的有特定用途的质粒不断被创建。图20-2给出最常用的大肠杆菌克隆用质粒UC19 的图谱,此质粒的复制起点处序列经过改造,能高频率起动质粒复制,使一个细菌UC19的拷贝数可达500700个;质粒携带一个抗氨卡青霉 素基因,编码能水解郢-内酰胺环,从而被坏氨苄青霉素的酶,当用UC19转化细菌后放入含氨苄青霉素的培养基中,凡不含pUC19者都不能生 长,结果长出的细菌就是都含有pUC19的;pUC19还携带细菌lac操纵元中的lacl和lacZ基因编码,B-半乳糖苷酶N端状146个氨基酸的段落,当 培养基中含有诱导物IPTG和Xgal时,lacz'基因被诱导表达产生的邹-半乳糖苷酶N端肽与宿主菌表达的C端肽互补而具有B-半乳糖苷酶活性(质 粒和宿主编码的肽段各自都没有酶活性,两都融为一体而具酶活性,称为a-互补,-complementation),半乳糖苷酶水解Xgal而使菌落呈现 蓝色;在lcz'中间又插入了一段人工设计合成的DA序列,其中密集多个常用的限制性核酸内切酶的位点,使外来的基因和序列能很方便地 被插入此位置,当外来序列插入后则破坏了lcz'编码的半乳糖苷酶活性,生长的菌落就呈白色,这种颜色标志的变化就很容易区分和挑选含有 和不含有插入序列或基因的转化菌落,称为蓝白筛选法。 除常用的大肠杆菌质粒载体外,近年来发展了许多人工构建的其它能用于微生物、酵母、植物等的质粒载体。含有不止一个o、能携带插 入序列在不同种类宿主细胞中繁殖的载体称为穿梭载体(shuttlevectors)。 二、噬菌体载体 噬菌体(phage)是感染细菌的一类病毒,有的噬菌体基因组较大,加入).噬菌和T噬菌体等;有的则较小,如M13、f1、f阳噬菌体等。用 感染大肠杆菌的,噬菌体改造成的载体应用最为广泛。 ),噬菌体由头和尾构成,其基因组是长约49k的线性双链DNA分子,组装在头部蛋白质外壳内部,其序列已被全部测出。,噬菌体感染时, 通过尾管将基因组DNA注入大肠杆菌,而将其蛋白质外壳留在菌外。DNA进入大肠杆菌后以其两端I2b的互补单链粘未端环化成环状双链, 可以两种不同的方式繁殖(图20-3):①溶菌性方式(lyticpathway):在营养充足,条件适合细菌繁殖时,利用宿主菌中的酶类和原料, DNA上基因可按调控的顺序表达合成构成噬菌体头、尾和尾丝所需的各种蛋白质,DNA经多次复制合成许多子代).DNA,于是装配成许多子 代的.噬菌体,最后裂菌,释放出许多新的,噬菌体。②溶原性方式(lysogenic pathway):进入细菌的,DNA可整合(integrate)入细菌的染色 质DNA中,随细菌染色体DNA复制,传给细菌后代,这个稳定潜伏在细菌染色质DNA中的,DNA称为原噬菌体(prophage),含有原噬菌体的细 菌称为溶源菌(lysoger)。DNA的整合是可逆的,原噬菌体可从宿主DNA中切出,进入溶菌性方式的繁殖. ⊙ 图20-31噬菌体的溶菌和溶原繁殖方式 )噬菌体整个基因组如图20-4所示,可分为三个部分,①左臂:从A到J长约20kb,其中的基因编码构成头部、尾部、尾丝对组装完整噬菌 体所需要的蛋白质。②中段:长约2Okb,是λDNA整合和切出,溶原生长所需的序列。③右臂:长约1Okb,是调控区,控制溶菌和溶原生长最 重要的调控基因和序列、以及)DNA复制起始均在这区域内。左右臂包含λDNA复制、噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生长所需 全部序列:对溶菌生长来说,中段是非必需的
图20-2 pBR322及pUC18图谱 现在分子生物学使用的质粒载体都已不是原来细菌或细胞中天然存在的质粒,而是经过了许多的人工的改造。从不同的实验目的出发,人 们设计了各种不同的类型的质粒载体,近年来发展很快,新的有特定用途的质粒不断被创建。图20-2给出最常用的大肠杆菌克隆用质粒pUC19 的图谱,此质粒的复制起点处序列经过改造,能高频率起动质粒复制,使一个细菌pUC19的拷贝数可达500-700个;质粒携带一个抗氨芐青霉 素基因,编码能水解β-内酰胺环,从而被坏氨芐青霉素的酶,当用pUC19转化细菌后放入含氨芐青霉素的培养基中,凡不含pUC19者都不能生 长,结果长出的细菌就是都含有pUC19的;pUC19还携带细菌lac操纵元中的lacI和lacZ基因编码,β-半乳糖苷酶N端状146个氨基酸的段落,当 培养基中含有诱导物IPTG和Xgal时,lacz ' 基因被诱导表达产生的β-半乳糖苷酶N端肽与宿主菌表达的C端肽互补而具有β-半乳糖苷酶活性(质 粒和宿主编码的肽段各自都没有酶活性,两都融为一体而具酶活性,称为α-互补,α-complementation),半乳糖苷酶水解Xgal而使菌落呈现 蓝色;在lacz '中间又插入了一段人工设计合成的DNA序列,其中密集多个常用的限制性核酸内切酶的位点,使外来的基因和序列能很方便地 被插入此位置,当外来序列插入后则破坏了lacz '编码的半乳糖苷酶活性,生长的菌落就呈白色,这种颜色标志的变化就很容易区分和挑选含有 和不含有插入序列或基因的转化菌落,称为蓝白筛选法。 除常用的大肠杆菌质粒载体外,近年来发展了许多人工构建的其它能用于微生物、酵母、植物等的质粒载体。含有不止一个ori、能携带插 入序列在不同种类宿主细胞中繁殖的载体称为穿梭载体(shuttlevectors)。 二、噬菌体载体 噬菌体(phage)是感染细菌的一类病毒,有的噬菌体基因组较大,加入λ噬菌和T噬菌体等;有的则较小,如M13、f1、fd噬菌体等。用 感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。 λ噬菌体由头和尾构成,其基因组是长约49kb的线性双链DNA分子,组装在头部蛋白质外壳内部,其序列已被全部测出。λ噬菌体感染时, 通过尾管将基因组DNA注入大肠杆菌,而将其蛋白质外壳留在菌外。DNA进入大肠杆菌后以其两端12bp的互补单链粘末端环化成环状双链, 可以两种不同的方式繁殖(图20-3):①溶菌性方式(lyticpathway):在营养充足,条件适合细菌繁殖时,利用宿主菌中的酶类和原料, λDNA上基因可按调控的顺序表达合成构成噬菌体头、尾和尾丝所需的各种蛋白质,λDNA经多次复制合成许多子代λDNA,于是装配成许多子 代的λ噬菌体,最后裂菌,释放出许多新的λ噬菌体。②溶原性方式(lysogenic pathway):进入细菌的λDNA可整合(integrate)入细菌的染色 质DNA中,随细菌染色体DNA复制,传给细菌后代,这个稳定潜伏在细菌染色质DNA中的λDNA称为原噬菌体(prophage),含有原噬菌体的细 菌称为溶源菌(lysogen)。λDNA的整合是可逆的,原噬菌体可从宿主DNA中切出,进入溶菌性方式的繁殖。 图20-3 λ噬菌体的溶菌和溶原繁殖方式 λ噬菌体整个基因组如图20-4所示,可分为三个部分,①左臂:从A到J长约20kb,其中的基因编码构成头部、尾部、尾丝对组装完整噬菌 体所需要的蛋白质。②中段:长约20kb,是λDNA整合和切出,溶原生长所需的序列。③右臂:长约10kb,是调控区,控制溶菌和溶原生长最 重要的调控基因和序列、以及λDNA复制起始均在这区域内。左右臂包含λDNA复制、噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生长所需 全部序列;对溶菌生长来说,中段是非必需的

利用噬菌体作载体,主要是将外来目的DNA替代或插入中段序列,使其随左右臂一起包装成噬菌体,去感染大肠杆菌,并随噬菌体的溶 菌繁殖而繁殖。现在广泛使用的噬菌体载体也是已作过许多人工改造的,主要的改造是:@设计去除DNA上的一些限制性酶切点。这是因为 DNA较大,序列中的限制性酶切点过多,妨碍其应用。②在中段非必需区,替换插入某些标志基因如上述的可供蓝白筛选lac-lacZ'序列,和 多克隆位点等。由此可构建出两类噬菌体作载体;一类是插入型载体,可将外来序列插中段,常用的gt系列载体,一般容许插入57kb外来 DNA;另一类是转换型载体,即可用外来DNA替代中段,如IMBL系列载体。 Kb 10 49 晚 头部蛋白 尾都置白 乌区 整合,重组 费 AWBDEFZ UVGTHMLKJ 胜恋dN阳o0PQSR A Phage COS A BE C E D 裂解生长非必要 Wam Eam 缺失 d gtWES-1B 图20-4野生型,噬菌体DNA及相应的1噬菌体DNA图谱 插入或置换中段外来的DNA长度是有一定限制的,当噬菌体DNA长度大于野生型)噬菌体基因组I05%或小于78%时,包装而成的噬菌体存 活力显著下降。所以噬菌体载体可插入长5-2Okb的外来DNA,这比质粒载体能插入的DNA长得多;而且包装的,噬菌体感染大肠杆菌要比质 粒转化细菌的效率高得多,所以)噬菌体载体常用于构建cDNA文库或基因组文库。但λ噬菌体载体的克隆操作要比质粒载体复杂。 如果将左右臂和中段都去除,仅留下DNA而端包装噬菌体所必需的cos序列,再加上质粒的复制序列、标志基因、多克隆位点等,就可构 成cos质粒或称为粘粒的载体。粘粒可插入45kb长的外源DNA,然后用入噬菌体外壳蛋白包装成噬菌体,感染大肠杆菌后,粘粒的DNA能以质 粒的形式在细菌中繁殖而被克隆。所以粘粒主要用于DNA文库的构建。 三、动物病毒载体 质粒和噬菌体载体只能在细菌中繁殖,不能满足真核DNA重组需要。感染动物的病毒可改造用作动物细胞的载体。由于动物细胞的培养和 操作较复杂、花费也较多,因而病毒载体构建时一般都把细菌质粒复制起始序列放置其中。使载体及其携带的外来序列能方便地在细菌中繁殖 和克隆,然后再引入真核细胞。目前病毒载体常用者有改造来自猴肾病毒SV40(Simian Virus40)、逆转录病毒和昆虫杆状病毒等,使用这 些病毒载体的目的多为将目的基因或序列放入动物细胞中表达或试验其功能、或作基因治疗等(见后)· 人基因组十分庞大,约含4×109bp,建立和筛选人的基因组文库,要求有容量更大的载体,酵母人工染色体(yeast artificial chromosome,YAC)载体应运而生。YAC含有酵母染色体端粒(telesome)、着丝点(centromere)及复制起点等功能序列,可插入长度达200: 500kb的外源DNA,导入酵母细胞可以随细胞分裂周期复制繁殖供作克隆,成为人基因组研究计划的重要 第三节目的序列与载体的连接 将目的基因或序列插入载体,主要靠DNA连接酶和双链DNA粘末端单链序列互补结合的配合使用。有以下主要的方式。 一、粘性末端连接 如果目的序列两端有与载体上相同的限制性核酸内切酶位点,则同一限制酶切开产生的粘末端,在降低温度退火时,能重新互补结合,在 DNA连接酶催化下,目的序列就与载体DNA链相连接(见图20-5)
利用λ噬菌体作载体,主要是将外来目的DNA替代或插入中段序列,使其随左右臂一起包装成噬菌体,去感染大肠杆菌,并随噬菌体的溶 菌繁殖而繁殖。现在广泛使用的λ噬菌体载体也是已作过许多人工改造的,主要的改造是:①设计去除λDNA上的一些限制性酶切点。这是因为 λDNA较大,序列中的限制性酶切点过多,妨碍其应用。②在中段非必需区,替换插入某些标志基因如上述的可供蓝白筛选lacI-lacZ’序列,和 多克隆位点等。由此可构建出两类λ噬菌体作载体;一类是插入型载体,可将外来序列插中段,常用的λgt系列载体,一般容许插入5-7kb外来 DNA;另一类是转换型载体,即可用外来DNA替代中段,如IMBL系列载体。 图20-4 野生型λ噬菌体DNA及相应的λ噬菌体DNA图谱 插入或置换中段外来的DNA长度是有一定限制的,当噬菌体DNA长度大于野生型λ噬菌体基因组105%或小于78%时,包装而成的噬菌体存 活力显著下降。所以λ噬菌体载体可插入长5-20kb的外来DNA,这比质粒载体能插入的DNA长得多;而且包装的λ噬菌体感染大肠杆菌要比质 粒转化细菌的效率高得多,所以λ噬菌体载体常用于构建cDNA文库或基因组文库。但λ噬菌体载体的克隆操作要比质粒载体复杂。 如果将左右臂和中段都去除,仅留下λDNA而端包装噬菌体所必需的cos序列,再加上质粒的复制序列、标志基因、多克隆位点等,就可构 成cos质粒或称为粘粒的载体。粘粒可插入45kb长的外源DNA,然后用λ噬菌体外壳蛋白包装成噬菌体,感染大肠杆菌后,粘粒的DNA能以质 粒的形式在细菌中繁殖而被克隆。所以粘粒主要用于DNA文库的构建。 三、动物病毒载体 质粒和噬菌体载体只能在细菌中繁殖,不能满足真核DNA重组需要。感染动物的病毒可改造用作动物细胞的载体。由于动物细胞的培养和 操作较复杂、花费也较多,因而病毒载体构建时一般都把细菌质粒复制起始序列放置其中。使载体及其携带的外来序列能方便地在细菌中繁殖 和克隆,然后再引入真核细胞。目前病毒载体常用者有改造来自猴肾病毒SV40(Simian Virus 40)、逆转录病毒和昆虫杆状病毒等,使用这 些病毒载体的目的多为将目的基因或序列放入动物细胞中表达或试验其功能、或作基因治疗等(见后)。 人 基 因 组 十 分 庞 大 , 约 含 4×109bp , 建 立 和 筛 选 人 的 基 因 组 文 库 , 要 求 有 容 量 更 大 的 载 体 , 酵 母 人 工 染 色 体 ( yeast artificial chromosome,YAC)载体应运而生。YAC含有酵母染色体端粒(telesome)、着丝点(centromere)及复制起点等功能序列,可插入长度达200- 500kb的外源DNA,导入酵母细胞可以随细胞分裂周期复制繁殖供作克隆,成为人基因组研究计划的重要 第三节 目的序列与载体的连接 将目的基因或序列插入载体,主要靠DNA连接酶和双链DNA粘末端单链序列互补结合的配合使用。有以下主要的方式。 一、粘性末端连接 如果目的序列两端有与载体上相同的限制性核酸内切酶位点,则同一限制酶切开产生的粘末端,在降低温度退火时,能重新互补结合,在 DNA连接酶催化下,目的序列就与载体DNA链相连接(见图20-5)
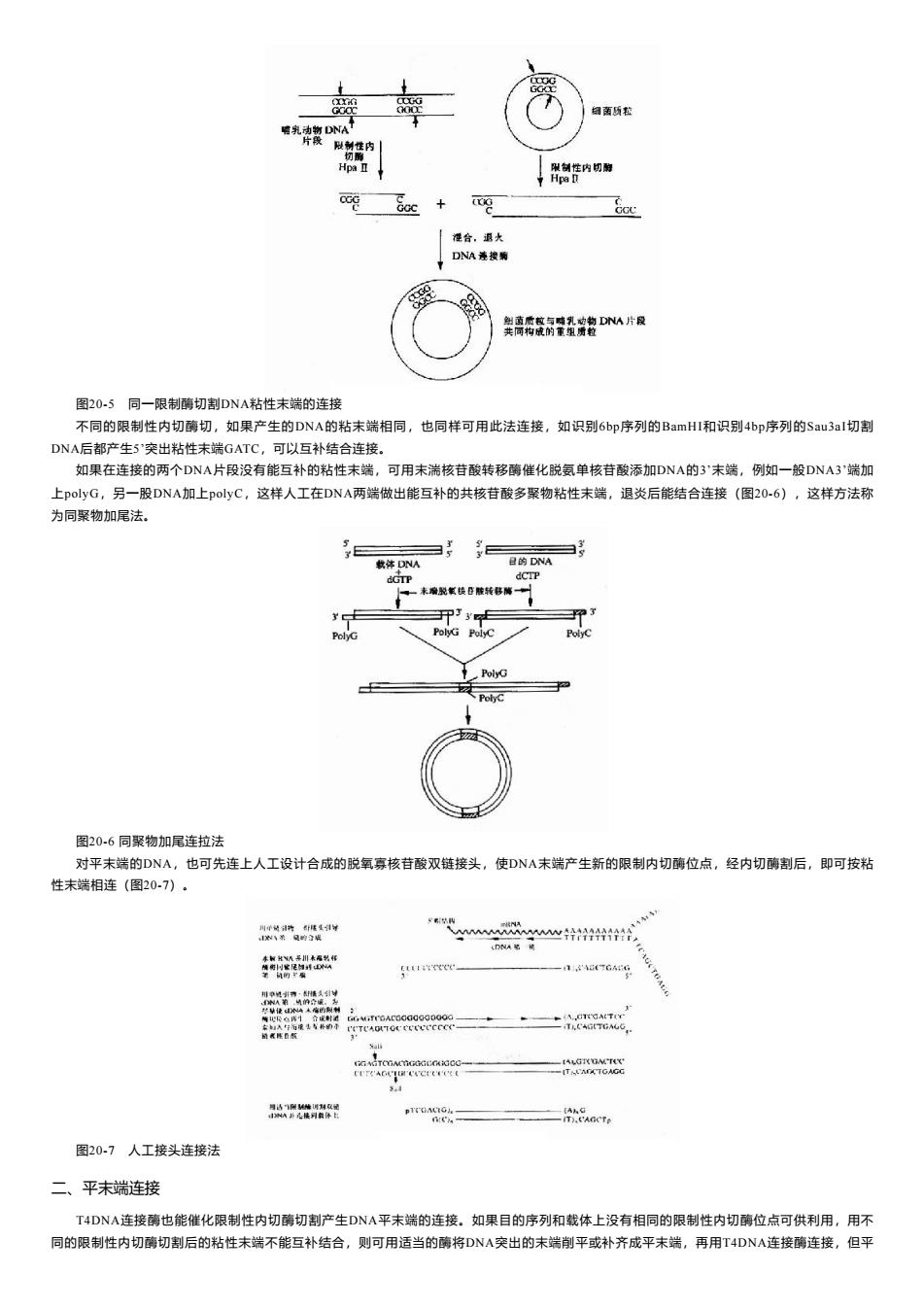
细菌质松 响乳动物DNA 片段啾制性内 Hpa II 限制性内切剩 Hpa D Gcc 准合,退火 DNA连接乘 舆离袋瓷隔经教D从片风 图20-5同一限制酶切割DNA粘性末端的连接 不同的限制性内切酶切,如果产生的DNA的粘末端相同,也同样可用此法连接,如识别6bp序列的BamHI和识别4bp序列的Sau3aI切割 DNA后都产生5'突出粘性未端GATC,可以互补结合连接。 如果在连接的两个DNA片段没有能互补的粘性末端,可用末湍核苷酸转移酶催化脱氨单核苷酸添加DNA的3末端,例如一般DNA3'端加 上polyG,另一股DNA加上polyC,这样人工在DNA两端做出能互补的共核苷酸多聚物粘性未端,退炎后能结合连接(图2O-6),这样方法称 为同聚物加尾法。 载体DNA 目的DNA dGTP 。未瘤脱氧铁B脑转移隔一 PolyG Polyc PolyC PolyG 图20-6同聚物加尾连拉法 对平未端的DNA,也可先连上人工设计合成的脱氧寡核苷酸双链接头,使DNA未端产生新的限制内切酶位点,经内切酶割后,即可按粘 性未端相连(图20-7)。 川中动清持新样夏¥ N弟见的城 心t4和制 MR基香瓶 CrrCAGCICVCe( A花 图20-7人工接头连接法 二、平末端连接 T4DNA连接酶也能催化限制性内切酶切割产生DNA平末端的连接。如果目的序列和载体上没有相同的限制性内切酶位点可供利用,用不 同的限制性内切酶切割后的粘性未端不能互补结合,则可用适当的酶将DNA突出的未端削平或补齐成平未端,再用T4DNA连接酶连接,但平
图20-5 同一限制酶切割DNA粘性末端的连接 不同的限制性内切酶切,如果产生的DNA的粘末端相同,也同样可用此法连接,如识别6bp序列的BamHⅠ和识别4bp序列的Sau3aⅠ切割 DNA后都产生5’突出粘性末端GATC,可以互补结合连接。 如果在连接的两个DNA片段没有能互补的粘性末端,可用末湍核苷酸转移酶催化脱氨单核苷酸添加DNA的3’末端,例如一般DNA3’端加 上polyG,另一股DNA加上polyC,这样人工在DNA两端做出能互补的共核苷酸多聚物粘性末端,退炎后能结合连接(图20-6),这样方法称 为同聚物加尾法。 图20-6 同聚物加尾连拉法 对平末端的DNA,也可先连上人工设计合成的脱氧寡核苷酸双链接头,使DNA末端产生新的限制内切酶位点,经内切酶割后,即可按粘 性末端相连(图20-7)。 图20-7 人工接头连接法 二、平末端连接 T4DNA连接酶也能催化限制性内切酶切割产生DNA平末端的连接。如果目的序列和载体上没有相同的限制性内切酶位点可供利用,用不 同的限制性内切酶切割后的粘性末端不能互补结合,则可用适当的酶将DNA突出的末端削平或补齐成平末端,再用T4DNA连接酶连接,但平

未端连接要比粘性未端连接的效率低得多。 第四节目的基因序列的来源和分离 一、基因组DNA文库 从生物组织细胞提取出全部DNA,用物理方法(超声波、搅拌剪力等)或酶法(限制性核酸内切酶的不完全酶解)将DNA降解成预期大 小的片段,然后将这些片段与适当的载体(常用噬菌体、粘粒或YC载体)连接,转入受体细菌或细胞,这样每一个细胞接受了含有一个基因 组DNA片段与载体连接的重组DNA分子,而且可以繁殖扩增,许多细胞一起组成一个含有基因组各DNA片段克隆的集合体,就称为基因组 DNA文库(genomic DNA library)。如果这个文库足够大,能包含该生物基因组DNA全部的序列,就是该生物完整的基因组文库,能从这文 库中钓取该生物的全部基因或DNA序列。从基因组含有生物生存、活动和繁殖的全部遗传信息的概念出发,基因组文库是具有生物种属特异性 的。 构建基因组文库,再用分子杂交等技术去钓取基因克隆的方法,称为鸟枪法或散弹射击法,意味着从含有众多的基因序列克隆群中去获取 目的基因或序列。当生物基因组比较小时,此法较易成功;当生物基因组很大时,构建其完整的基因组文库就非易事,从庞大的文库中去克隆 目的基因工程量也很大。 Vector DNA Eukaryote genomc DNA BamH1 sites C06 CUs Lef arn rghi an C06 L R 00s Partial digestion with Mbol COS L -20 kb DNA fiagment Ligtion R -20kb R oov I vitro packaging 甲穿卵有」 recombinint bucteroph 骨999 Infext B.coli T Construction of Genamic Library 图20-8基因组DNA文库的构建 二、cDNA文库 以mRNA为模板,经反转录酶催化合成DNA,则此DNA序列与mRNA互补,称为互补DNA或cDNA。提取出组织细胞的全部mRNA,在体 外反转录成cDNA,与适当的载体常用噬菌体或质粒载体连接后转化受体菌,则每个细菌含有一段cDNA,并能繁殖扩增,这样包含着细胞全 部RNA信息的cDNA克隆集合称为该组织细胞的cDNA文库,基因组含有的基因在特定的组织细胞中只有一部分表达,而且处在不同环境条 件、不同分化时期的细胞其基因表达的种类和强度也不尽相同,所以cDNA文库具有组织细胞特异性。cDNA文库显然比基因组DNA文库小得 多,能够比较容易从中筛选克隆得细胞特异表达的基因。但对真核细胞来说,从基因组DNA文库获得的基因与从cDNA文库获得的不同,基因 组DNA文库所含的是带有含子和外显子的基因组基因,而从cDNA文库中获得的是已经过剪接、去除了内含子的cDNA
末端连接要比粘性末端连接的效率低得多。 第四节 目的基因序列的来源和分离 一、基因组DNA文库 从生物组织细胞提取出全部DNA,用物理方法(超声波、搅拌剪力等)或酶法(限制性核酸内切酶的不完全酶解)将DNA降解成预期大 小的片段,然后将这些片段与适当的载体(常用噬菌体、粘粒或YAC载体)连接,转入受体细菌或细胞,这样每一个细胞接受了含有一个基因 组DNA片段与载体连接的重组DNA分子,而且可以繁殖扩增,许多细胞一起组成一个含有基因组各DNA片段克隆的集合体,就称为基因组 DNA文库(genomic DNA library)。如果这个文库足够大,能包含该生物基因组DNA全部的序列,就是该生物完整的基因组文库,能从这文 库中钓取该生物的全部基因或DNA序列。从基因组含有生物生存、活动和繁殖的全部遗传信息的概念出发,基因组文库是具有生物种属特异性 的。 构建基因组文库,再用分子杂交等技术去钓取基因克隆的方法,称为鸟枪法或散弹射击法,意味着从含有众多的基因序列克隆群中去获取 目的基因或序列。当生物基因组比较小时,此法较易成功;当生物基因组很大时,构建其完整的基因组文库就非易事,从庞大的文库中去克隆 目的基因工程量也很大。 图20-8 基因组DNA文库的构建 二、cDNA文库 以mRNA为模板,经反转录酶催化合成DNA,则此DNA序列与mRNA互补,称为互补DNA或cDNA。提取出组织细胞的全部mRNA,在体 外反转录成cDNA,与适当的载体常用噬菌体或质粒载体连接后转化受体菌,则每个细菌含有一段cDNA,并能繁殖扩增,这样包含着细胞全 部mRNA信息的cDNA克隆集合称为该组织细胞的cDNA文库,基因组含有的基因在特定的组织细胞中只有一部分表达,而且处在不同环境条 件、不同分化时期的细胞其基因表达的种类和强度也不尽相同,所以cDNA文库具有组织细胞特异性。cDNA文库显然比基因组DNA文库小得 多,能够比较容易从中筛选克隆得细胞特异表达的基因。但对真核细胞来说,从基因组DNA文库获得的基因与从cDNA文库获得的不同,基因 组DNA文库所含的是带有含子和外显子的基因组基因,而从cDNA文库中获得的是已经过剪接、去除了内含子的cDNA
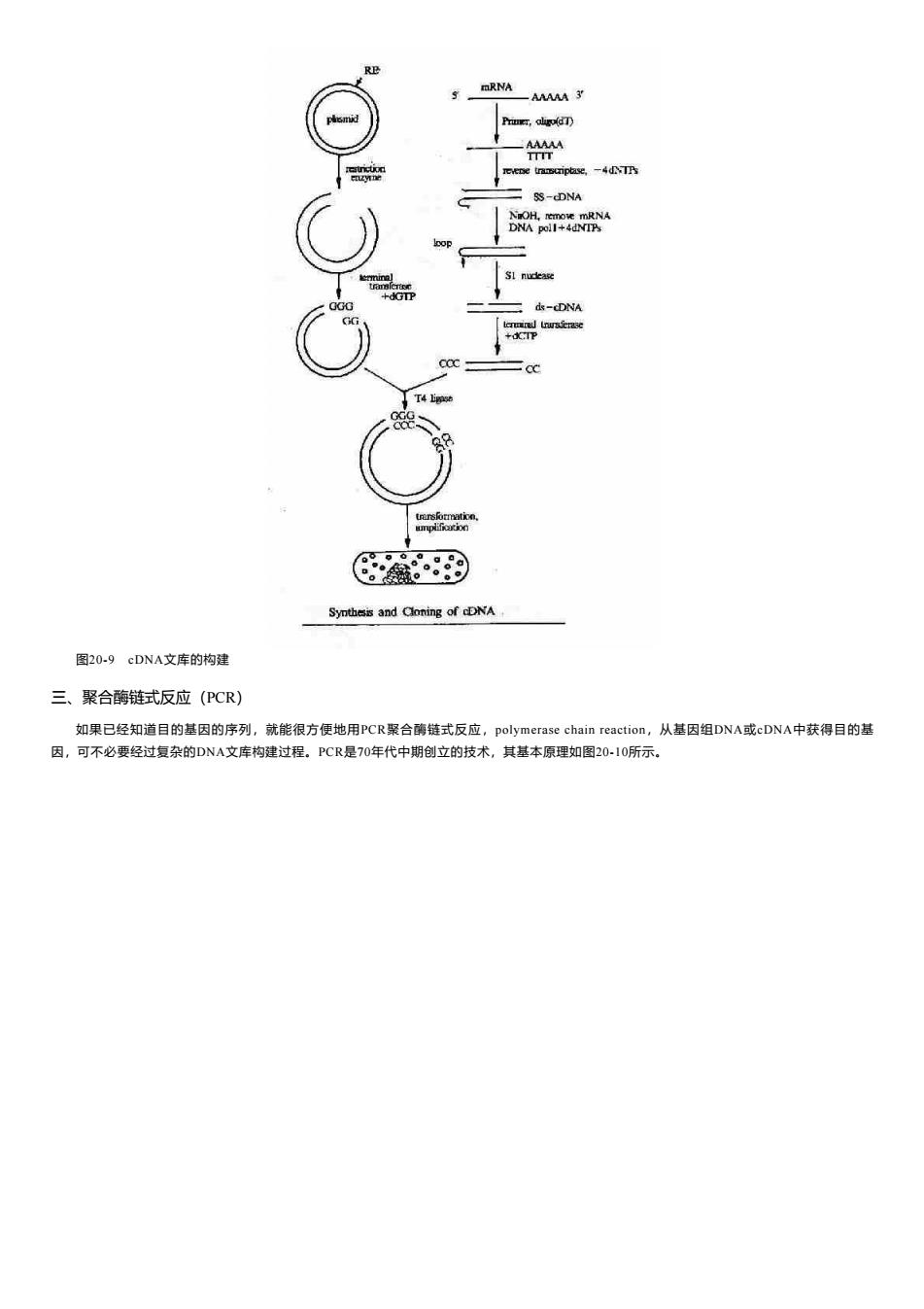
Primer,aligo(dT) TTTT revene tramcriptase,-4d.TPs SS-(DNA DNA poll+4dNTP d-DNA Synthesis and Cloning of cDNA 图20-9cDNA文库的构建 三、聚合酶链式反应(PCR) 如果已经知道目的基因的序列,就能很方便地用PCR聚合酶链式反应,polymerase chain reaction,从基因组DNA或cDNA中获得目的基 因,可不必要经过复杂的DNA文库构建过程。PCR是70年代中期创立的技术,其基本原理如图20I0所示
图20-9 cDNA文库的构建 三、聚合酶链式反应(PCR) 如果已经知道目的基因的序列,就能很方便地用PCR聚合酶链式反应,polymerase chain reaction,从基因组DNA或cDNA中获得目的基 因,可不必要经过复杂的DNA文库构建过程。PCR是70年代中期创立的技术,其基本原理如图20-10所示

Ag未扩增的DNA 周期1 变性引物透光 引物姓长 周期2 变性引物送大 引物延长 3 变性引物道火 引物延长 周期4-25 DNA至少增加1O倍 图20-10PCR基本原理示意图 PCR反应系统包括含有目的基因或序列的DNA模板,对热稳定的DNA聚合酶,一对脱氧寡核苷酸引物、DNA合成所需要的4种脱氧核苷三 磷酸以及保证聚合酶催化反应的Mg2+及缓冲液等。人工合成引物的序列设计是PCR成功的关键,一般两条引物的序列反应分别与欲获得的双 链DNA两条链3'端的序列互补。先升高温度使模板DNA变性、双链分开;再降低温度退火使引物与模板DNA配对互补结合;然后升温到聚合 酶反应适宜的温度,此时在聚合酶催化下,从引物3'羟基端开始,与模板DNA上的碱基配对逐个加上核苷酸,合成新的DNA链。其后再按高 温变性、低温退火、适温合成三步反复循环,新合成的DNA在下一循环中又作为模板使用,每循环一次,合成的目的序列扩增一倍,而且很快 扩增的序列主要限制在所设计的一对引物规定的模板序列范围内,一般循环30-40次,按理论计算,目的序列可扩增230-240倍,而实际上由于 底物和引物的消耗,酶的失活等因素,产物量并不是始终以指数增加的,但通常实验获得目的序列106-108倍的扩增产物并不困难,因而PCR 具有很高度的灵敏度,由于引物与模板的配对互补结合的特异的,因而PCR也具有高度的特异性。所以可以方便地用PCR在成干上万的基因序 列中获得只有极微含量的特定目的基因或序列,PCR获得的目的序列产物连接在适当的载体上,转化受体细胞,经筛选就能得到目的序列的克 隆。 现在PCR技术还在不断发展,已知部分序列或未知序列的基因有的也能设计PCR来扩增和克隆,模板核酸可用双链DNA,单链DNA,甚至 RNA。由于PCR的高灵敏度和特异性,在基因诊断上有更广泛的应用,后面的章节还要叙述。 四、人工化学合成 随化学合成技术的发展,现在计算机控制的全自动核酸合成仪已被广泛应用,按人们设计好的序列一次合成100-200p长的DNA片段已不 成问题。可能用这些合成的片段组合连接成完整的基因。但目前人工合成基因最大的限制是人们并未掌握怎样的核酸序列能具有生命功能的规 律,例如1kb长的DNA最通常编码功能蛋白质的基因长度就可以有~10600种不同的序列,随意合成的DNA绝大多数肯定是不具有生物功能或 无法知道它会有什么功能的,因而只能模仿自然界生物中已知的基因序列来合成,而化学合成这样长的基因DNA序列,其价格远高于用PCR法 获得基因,所以目前很少全部用化学方法去合成基因。但人工设计化学合成核酸片段作为引物、接头等已经是分子生物学和基因工程中必不可 少的、十分重要的手段。 第五节基因序列导入细胞 目的基因序列与载体连接后,要导入细胞中才能繁殖扩增,再经过筛选,才能获得重组DA分子克隆,不同的载体在不同的宿主细胞中繁 殖,导入细胞的方法也不相同。 一、转化 由于外源DNA的进入而使细胞遗传性改变称为转化,早在1943年,Avery等就发现有毒肺炎双球菌的DNA与无毒肺炎双球菌共培养后产生 有毒性的肺炎双球菌后代的转化现象。但DN八进入细胞的效率很低,在分子生物学和基因工程工作中可采取一些方法处理细胞,经处理后的细
图20-10 PCR基本原理示意图 PCR反应系统包括含有目的基因或序列的DNA模板,对热稳定的DNA聚合酶,一对脱氧寡核苷酸引物、DNA合成所需要的4种脱氧核苷三 磷酸以及保证聚合酶催化反应的Mg2+及缓冲液等。人工合成引物的序列设计是PCR成功的关键,一般两条引物的序列反应分别与欲获得的双 链DNA两条链3’端的序列互补。先升高温度使模板DNA变性、双链分开;再降低温度退火使引物与模板DNA配对互补结合;然后升温到聚合 酶反应适宜的温度,此时在聚合酶催化下,从引物3’羟基端开始,与模板DNA上的碱基配对逐个加上核苷酸,合成新的DNA链。其后再按高 温变性、低温退火、适温合成三步反复循环,新合成的DNA在下一循环中又作为模板使用,每循环一次,合成的目的序列扩增一倍,而且很快 扩增的序列主要限制在所设计的一对引物规定的模板序列范围内,一般循环30-40次,按理论计算,目的序列可扩增230-240倍,而实际上由于 底物和引物的消耗,酶的失活等因素,产物量并不是始终以指数增加的,但通常实验获得目的序列106-108倍的扩增产物并不困难,因而PCR 具有很高度的灵敏度,由于引物与模板的配对互补结合的特异的,因而PCR也具有高度的特异性。所以可以方便地用PCR在成千上万的基因序 列中获得只有极微含量的特定目的基因或序列,PCR获得的目的序列产物连接在适当的载体上,转化受体细胞,经筛选就能得到目的序列的克 隆。 现在PCR技术还在不断发展,已知部分序列或未知序列的基因有的也能设计PCR来扩增和克隆,模板核酸可用双链DNA,单链DNA,甚至 RNA。由于PCR的高灵敏度和特异性,在基因诊断上有更广泛的应用,后面的章节还要叙述。 四、人工化学合成 随化学合成技术的发展,现在计算机控制的全自动核酸合成仪已被广泛应用,按人们设计好的序列一次合成100-200bp长的DNA片段已不 成问题。可能用这些合成的片段组合连接成完整的基因。但目前人工合成基因最大的限制是人们并未掌握怎样的核酸序列能具有生命功能的规 律,例如1kb长的DNA最通常编码功能蛋白质的基因长度就可以有~10600种不同的序列,随意合成的DNA绝大多数肯定是不具有生物功能或 无法知道它会有什么功能的,因而只能模仿自然界生物中已知的基因序列来合成,而化学合成这样长的基因DNA序列,其价格远高于用PCR法 获得基因,所以目前很少全部用化学方法去合成基因。但人工设计化学合成核酸片段作为引物、接头等已经是分子生物学和基因工程中必不可 少的、十分重要的手段。 第五节 基因序列导入细胞 目的基因序列与载体连接后,要导入细胞中才能繁殖扩增,再经过筛选,才能获得重组DNA分子克隆,不同的载体在不同的宿主细胞中繁 殖,导入细胞的方法也不相同。 一、转化 由于外源DNA的进入而使细胞遗传性改变称为转化,早在1943年,Avery等就发现有毒肺炎双球菌的DNA与无毒肺炎双球菌共培养后产生 有毒性的肺炎双球菌后代的转化现象。但DNA进入细胞的效率很低,在分子生物学和基因工程工作中可采取一些方法处理细胞,经处理后的细

胞就容易接受外界DNA,称为感受态细胞,再与外源DNA接触,就能提高转化效率。例如大肠杆菌经冰冷CCI2的处理,就成为感受态细菌, 当加入重组质粒并突然由4℃转入42℃作短时间处理,质粒DNA就能进入细菌;用高电压脉冲短暂作用于细菌也能显着提高转化效率,这称为 电穿孔(electroporation)转化法。 二、感染 噬菌体进入宿主细菌,病毒进入宿主细胞中繁殖就是感染(infection)。用经人工改造的噬菌体活病毒作载体,以其DNA与目的序列重组 后,在体外用噬菌体或病毒的外壳蛋白将重组DNA包装成有活力的噬菌体或病毒,就能以感染的方式进入宿主细菌或细胞,使目的序列得以复 制繁殖。感染的效率很高,但DNA包装成噬菌体或病毒的操作较麻烦。 三、转染 重组的噬菌体DNA也可象质粒DNA的方式进入宿主菌,即宿主菌先经过CCI2,电穿孔等处理成感受态细菌再接受DNA,进入感受态细菌 的噬菌体DNA可以同样复制和繁殖,这种方式称为转染(transfection)。MI3噬菌体DNA导入大肠杆菌就常用转染的方法。重组DNA进入宿 主细胞也常用转染方式。最经典的是1973年建立的磷酸钙法,其利用的基本现象是:DNA如以磷酸钙-DNA共沉淀物形式出现时,培养细胞摄 取DNA的效率会显着提高。用电穿孔法处理培养的哺乳类细胞也能提高细胞摄取DNA能力,但所用外加电场的强度、电脉冲的长度等条件与 处理细菌者都很不相同。近年来用人工脂质膜包裹DNA,形成的脂质体(Liposome)可以通过与细胞膜融合而将DNA导入细胞,方法简单而 有效,现有商售的脂质体试剂,使用日益广泛。 第六节目的基因序列克隆的筛选与鉴定 目的序列与载体DNA正确连接的效率、重组导入细胞的效率都不是百分之百的,因而最后生长繁殖出来的细胞并不同都带有目的序列。一 般一个载体只携带某一段外源DNA,一个细胞只接受一个重组DNA分子。最后培养出来的细胞群中只有一部分、甚至只有很小一部分是含有 目的序列的重组体(recombinant)。将目的重组体筛选出来就等于获得了目的序列的克隆,所以筛选(dcreening)是基因克隆的重要步骤。在 构建载体,选择宿主细胞、设计分子克隆方案时都必须仔细考虑筛选的问题。以下就常用技术的基本原理加以介绍。 一、根据重组载体的标志作筛选 最常见的载体携带的标志是抗药性标志,如抗氨苄青霉素(anpr)、抗四环素(terr)、抗卡那霉素(kanr)等。当培养基中含有抗生素时,只 有携带相应抗药性基因载体的细胞才能生存繁殖,这就把凡未能接受载体DNA的细胞全部筛除掉了。如果外源目的序列是插入在载体的抗药性 基因中间使这抗药性基因失活,这个抗药性标志就会消失。例如质粒pBR322含有anpr、和terr两个抗药基因,若将目的序列插入terr基因序列 中,转化大肠杆菌,让细菌放在含氨苄青霉素或四环素培养基中,凡未接受质粒DNA的细胞都不能生长;凡在含氨苄青霉素和四环素中都能生 长的细菌是含有质粒pBR322的,但其pBR322未插入目的序列,凡在氨苄青霉素中能生长、而在四环素中不能生长的细菌就很可能是含有目的 序列的重组质粒。 载体含有lacZ'的蓝白筛选法,近年更被广泛应用。例如将目的序列插入前面述及的质粒pUC19的多克隆位点,转化大肠杆菌,放入含氨苄 青霉素、IPTG、X-gl的培养基中培养,凡能生长并呈白色的菌落,其细菌中就很可能含有插入目的序列的重组质粒,这样就很容易获得目的 序列的克隆。 根据重组载体的标志来筛选,可以筛选去大量的非目的重组体,但还只是粗筛,例如细菌可能发生变异而引起抗药性的改变,却并不代表 目的序列的插入,所以需要做进一步细致的筛选。 二、核酸杂交法 利用标记的核酸做探针与转化细胞的DNA进行分子杂交,可以直接筛选和鉴定目的序列克隆。常用的方法是将转化后生长的菌落复印到硝 酸纤维膜上,用碱裂菌,菌落释放的DNA就吸附在膜上,再与标记的核酸探针温育杂交,核酸探针就结合在含有目的序列的菌落DNA上而不 被洗脱。核酸探针可以用放射性核素标记,结合了放射性核酸探针的菌落集团可用放射性自显影(auroradiography)法指示出来,核酸探针也 可以用非放射性物质标记,通常是经颜色呈现指示位置,这样就可以将含有目的序列的菌落挑选出来。 三、PCR法 PCR技术的出现给克隆的筛选增加了一个新手段。如果已知目的序列的长度和两端的序列,则可以设计合成一对引物,以转化细胞所得的 DNA为模板进行扩增,若能得到预期长度的PCR产物,则该转化细胞就可能含有目的的序列。 四、免疫学方 利用特定抗体与目的基因表达产物特异性结合的作用进行筛选。此法不是直接筛选目的基因,而是通过与基因表达产物的反应指示含有目 的基因的转化细胞,因而要求实验设计要使目的基因进入受体细胞后能够表达出其编码产物。抗体可用特定的酶常用过氧化物酶、碱性磷酸酶 等标记,结合酶标抗体处,酶可催化特定的底物分解而呈现颜色,从而指示出含有目的的基因的细胞集落位置。免疫学方法特异性强、灵敏度 高,适用于从大量转化细胞集合体中筛选很少几个含目的基因的细胞克隆
胞就容易接受外界DNA,称为感受态细胞,再与外源DNA接触,就能提高转化效率。例如大肠杆菌经冰冷CaCl2的处理,就成为感受态细菌, 当加入重组质粒并突然由4℃转入42℃作短时间处理,质粒DNA就能进入细菌;用高电压脉冲短暂作用于细菌也能显着提高转化效率,这称为 电穿孔(electroporation)转化法。 二、感染 噬菌体进入宿主细菌,病毒进入宿主细胞中繁殖就是感染(infection)。用经人工改造的噬菌体活病毒作载体,以其DNA与目的序列重组 后,在体外用噬菌体或病毒的外壳蛋白将重组DNA包装成有活力的噬菌体或病毒,就能以感染的方式进入宿主细菌或细胞,使目的序列得以复 制繁殖。感染的效率很高,但DNA包装成噬菌体或病毒的操作较麻烦。 三、转染 重组的噬菌体DNA也可象质粒DNA的方式进入宿主菌,即宿主菌先经过CaCl2,电穿孔等处理成感受态细菌再接受DNA,进入感受态细菌 的噬菌体DNA可以同样复制和繁殖,这种方式称为转染(transfection)。M13噬菌体DNA导入大肠杆菌就常用转染的方法。重组DNA进入宿 主细胞也常用转染方式。最经典的是1973年建立的磷酸钙法,其利用的基本现象是:DNA如以磷酸钙-DNA共沉淀物形式出现时,培养细胞摄 取DNA的效率会显着提高。用电穿孔法处理培养的哺乳类细胞也能提高细胞摄取DNA能力,但所用外加电场的强度、电脉冲的长度等条件与 处理细菌者都很不相同。近年来用人工脂质膜包裹DNA,形成的脂质体(Liposome)可以通过与细胞膜融合而将DNA导入细胞,方法简单而 有效,现有商售的脂质体试剂,使用日益广泛。 第六节 目的基因序列克隆的筛选与鉴定 目的序列与载体DNA正确连接的效率、重组导入细胞的效率都不是百分之百的,因而最后生长繁殖出来的细胞并不同都带有目的序列。一 般一个载体只携带某一段外源DNA,一个细胞只接受一个重组DNA分子。最后培养出来的细胞群中只有一部分、甚至只有很小一部分是含有 目的序列的重组体(recombinant)。将目的重组体筛选出来就等于获得了目的序列的克隆,所以筛选(dcreening)是基因克隆的重要步骤。在 构建载体,选择宿主细胞、设计分子克隆方案时都必须仔细考虑筛选的问题。以下就常用技术的基本原理加以介绍。 一、根据重组载体的标志作筛选 最常见的载体携带的标志是抗药性标志,如抗氨芐青霉素(anpr)、抗四环素(terr)、抗卡那霉素(kanr)等。当培养基中含有抗生素时,只 有携带相应抗药性基因载体的细胞才能生存繁殖,这就把凡未能接受载体DNA的细胞全部筛除掉了。如果外源目的序列是插入在载体的抗药性 基因中间使这抗药性基因失活,这个抗药性标志就会消失。例如质粒pBR322含有anpr、和terr两个抗药基因,若将目的序列插入terr基因序列 中,转化大肠杆菌,让细菌放在含氨芐青霉素或四环素培养基中,凡未接受质粒DNA的细胞都不能生长;凡在含氨芐青霉素和四环素中都能生 长的细菌是含有质粒pBR322的,但其pBR322未插入目的序列,凡在氨芐青霉素中能生长、而在四环素中不能生长的细菌就很可能是含有目的 序列的重组质粒。 载体含有lacZ’的蓝白筛选法,近年更被广泛应用。例如将目的序列插入前面述及的质粒pUC19的多克隆位点,转化大肠杆菌,放入含氨芐 青霉素、IPTG、X-gal的培养基中培养,凡能生长并呈白色的菌落,其细菌中就很可能含有插入目的序列的重组质粒,这样就很容易获得目的 序列的克隆。 根据重组载体的标志来筛选,可以筛选去大量的非目的重组体,但还只是粗筛,例如细菌可能发生变异而引起抗药性的改变,却并不代表 目的序列的插入,所以需要做进一步细致的筛选。 二、核酸杂交法 利用标记的核酸做探针与转化细胞的DNA进行分子杂交,可以直接筛选和鉴定目的序列克隆。常用的方法是将转化后生长的菌落复印到硝 酸纤维膜上,用碱裂菌,菌落释放的DNA就吸附在膜上,再与标记的核酸探针温育杂交,核酸探针就结合在含有目的序列的菌落DNA上而不 被洗脱。核酸探针可以用放射性核素标记,结合了放射性核酸探针的菌落集团可用放射性自显影(auroradiography)法指示出来,核酸探针也 可以用非放射性物质标记,通常是经颜色呈现指示位置,这样就可以将含有目的序列的菌落挑选出来。 三、PCR法 PCR技术的出现给克隆的筛选增加了一个新手段。如果已知目的序列的长度和两端的序列,则可以设计合成一对引物,以转化细胞所得的 DNA为模板进行扩增,若能得到预期长度的PCR产物,则该转化细胞就可能含有目的的序列。 四、免疫学方 利用特定抗体与目的基因表达产物特异性结合的作用进行筛选。此法不是直接筛选目的基因,而是通过与基因表达产物的反应指示含有目 的基因的转化细胞,因而要求实验设计要使目的基因进入受体细胞后能够表达出其编码产物。抗体可用特定的酶常用过氧化物酶、碱性磷酸酶 等标记,结合酶标抗体处,酶可催化特定的底物分解而呈现颜色,从而指示出含有目的的基因的细胞集落位置。免疫学方法特异性强、灵敏度 高,适用于从大量转化细胞集合体中筛选很少几个含目的基因的细胞克隆