
酶(enzyme)是活细胞内产生的具有高度专一性和催化效率的蛋白质,又称为生物催化剂,生物体在新陈代谢过程中,几乎所有的化学反应 都是在酶的催化下进行的。 细胞内合成的酶主要是在细胞内起催化作用,也有些酶合成后释入血液或消化道,并在那里发挥其催化作用,人工提取的酶在合适的条件 下也可在试管中对其特殊底物起催化作用。 酶学知识来源于生产实践,我国4千多年前的夏禹时代就酿酒盛行,周朝已开始制醋、酱,并用曲来治疗消化不良。酶的系统研究起始于 19世纪中叶对发酵本质的研究。Pasteur提出,发酵离不了酵母细胞。1897年Buchnerf成功地用不含细胞的酵母液实现发酵,说明具有发酵作用 的物质存在于细胞内,并不依赖活细胞。1926年Sumner首次提取出脲酶,并进行结晶,提出酶的本质是蛋白质。现已有二干余种酶被鉴定出 来,其中有二百余种得到结晶,特别是近三十年来,随着蛋白质分离技术的进步,酶的分子结构、酶作用机理的研究得到发展,有些酶的结构 和作用机理已被阐明。总之,随着酶学理论不断深入,必将对揭示生命本质研究作出更大的贡献。 第一节酶的作用特点 酶是生物催化剂(biological catalyst),具有两方面的特性,既有与一般催化剂相同的催化性质,又具有一般催化剂所没有的生物大分子的 特征。 酶与一般催化剂一样,只能催化热力学允许的化学反应,缩短达到化学平衡的时间,而不改变平衡点。酶作为催化剂在化学反应的前后没 有质和量的改变。微量的酶就能发挥较大的催化作用。酶和一般催化剂的作用机理都是降低反应的活化能(activation energy)。 因为酶是蛋白质,所以酶促反应又固有其特点: 1高度的催化效率 一般而论,酶促反应速度比非催化反应高107?020倍,例如,反应 H202+H202→2H20+02 在无催化剂时,需活化能18,000卡/克分子;胶体钯存在时,需活化能11,700卡/克分子;有过氧化氢酶(catalase)存在时,仅需活化能 2,000卡/克分子以下。 2.高度的专一性 一种酶只作用于一类化合物或一定的化学键,以促进一定的化学变化,并生成一定的产物,这种现象称为酶的特异性或专一性 (specificity)。受酶催化的化合物称为该酶的底物或作用物(substrate)。 酶对底物的专一性通常分为以下几种: (l)绝对特异性(absolutespecifictity) 有的酶只作用于一种底物产生一定的反应,称为绝对专一性,如脲酶(urease),只能催化尿素水解成NH3和CO2,而不能催化甲基尿素水 解。 (2)相对特异性(relativespecificity) 一种酶可作用于一类化合物或一种化学键,这种不太严格的专一性称为相对专一性。如脂肪酶(Ips)不仅水解脂肪,也能水解简单的酯 类;磷酸酶(phosphatase)对一般的磷酸酯都有作用,无论是甘油的还是一元醇或酚的磷酸酯均可被其水解。 (3)立体异构特异性(stereopecificity) 酶对底物的立体构型的特异要求,称为立体异构专一性或特异性。如a-淀粉酶(a-amylase)只能水解淀粉中a-1,4-糖苷键,不能水解纤维素 中的B-l,4-糖苷键:L-乳酸脱氢酶(L-lacticacid dehydrogenase)的底物只能是L型乳酸,而不能是D型乳酸。酶的立体异构特异性表明,酶与 底物的结合,至少存在三个结合点。 3.酶活性的可调节性 酶是生物体的组成成份,和体内其他物质一样,不断在体内新陈代谢,酶的催化活性也受多方面的调控。例如,酶的生物合成的诱导和阻 遏、酶的化学修饰、抑制物的调节作用、代谢物对酶的反馈调节、酶的别构调节以及神经体液因素的调节等,这些调控保证酶在体内新陈代谢 中发挥其恰如其分的催化作用,使生命活动中的种种化学反应都能够有条不紊、协调一致地进行。 4.酶活性的不稳定性 酶是蛋白质,酶促反应要求一定的H、温度等温和的条件,强酸、强碱、有机溶剂、重金属盐、高温、紫外线、剧烈震荡等任何使蛋白质 变性的理化因素都可能使酶变性而失去其催化活性。 第二节酶的分类和命名 一、酶的分类 国际酶学委员会(1EC)规定,按酶促反应的性质,可把酶分成六大类: 1.氧化还原酶类(oxidoreductases)指催化底物进行氧化还原反应的酶类。例如,乳酸脱氢酶、琥珀酸脱氢酶、细胞色素氧化酶、过氧化氢 酶等。 2.转移酶类(transferases)指催化底物之间进行某些基团的转移或交换的酶类。如转甲基酶、转氨酸、己糖激酶、磷酸化酶等。 3例如、淀粉酶、蛋白酶、脂肪酶、磷酸酶等。 4.裂解酶类(lyases)指催化一个底物分解为两个化合物或两个化合物合成为一个化合物的酶类。例如柠檬酸合成酶、醛缩酶等
酶(enzyme)是活细胞内产生的具有高度专一性和催化效率的蛋白质,又称为生物催化剂,生物体在新陈代谢过程中,几乎所有的化学反应 都是在酶的催化下进行的。 细胞内合成的酶主要是在细胞内起催化作用,也有些酶合成后释入血液或消化道,并在那里发挥其催化作用,人工提取的酶在合适的条件 下也可在试管中对其特殊底物起催化作用。 酶学知识来源于生产实践,我国4千多年前的夏禹时代就酿酒盛行,周朝已开始制醋、酱,并用曲来治疗消化不良。酶的系统研究起始于 19世纪中叶对发酵本质的研究。Pasteur提出,发酵离不了酵母细胞。1897年Buchner成功地用不含细胞的酵母液实现发酵,说明具有发酵作用 的物质存在于细胞内,并不依赖活细胞。1926年Sumner首次提取出脲酶,并进行结晶,提出酶的本质是蛋白质。现已有二千余种酶被鉴定出 来,其中有二百余种得到结晶,特别是近三十年来,随着蛋白质分离技术的进步,酶的分子结构、酶作用机理的研究得到发展,有些酶的结构 和作用机理已被阐明。总之,随着酶学理论不断深入,必将对揭示生命本质研究作出更大的贡献。 第一节 酶的作用特点 酶是生物催化剂(biological catalyst),具有两方面的特性,既有与一般催化剂相同的催化性质,又具有一般催化剂所没有的生物大分子的 特征。 酶与一般催化剂一样,只能催化热力学允许的化学反应,缩短达到化学平衡的时间,而不改变平衡点。酶作为催化剂在化学反应的前后没 有质和量的改变。微量的酶就能发挥较大的催化作用。酶和一般催化剂的作用机理都是降低反应的活化能(activation energy)。 因为酶是蛋白质,所以酶促反应又固有其特点: 1.高度的催化效率 一般而论,酶促反应速度比非催化反应高107?020倍,例如,反应 H2O2+H2O2→2H2O+O2 在无催化剂时,需活化能18,000卡/克分子;胶体钯存在时,需活化能11,700卡/克分子;有过氧化氢酶(catalase)存在时,仅需活化能 2,000卡/克分子以下。 2.高度的专一性 一 种 酶 只 作 用 于 一 类 化 合 物 或 一 定 的 化 学 键 , 以 促 进 一 定 的 化 学 变 化 , 并 生 成 一 定 的 产 物 , 这 种 现 象 称 为 酶 的 特 异 性 或 专 一 性 (specificity)。受酶催化的化合物称为该酶的底物或作用物(substrate)。 酶对底物的专一性通常分为以下几种: (1)绝对特异性(absolutespecifictity) 有的酶只作用于一种底物产生一定的反应,称为绝对专一性,如脲酶(urease),只能催化尿素水解成NH3和CO2,而不能催化甲基尿素水 解。 (2)相对特异性(relativespecificity) 一种酶可作用于一类化合物或一种化学键,这种不太严格的专一性称为相对专一性。如脂肪酶(lipase)不仅水解脂肪,也能水解简单的酯 类;磷酸酶(phosphatase)对一般的磷酸酯都有作用,无论是甘油的还是一元醇或酚的磷酸酯均可被其水解。 (3)立体异构特异性(stereopecificity) 酶对底物的立体构型的特异要求,称为立体异构专一性或特异性。如α-淀粉酶(α-amylase)只能水解淀粉中α-1,4-糖苷键,不能水解纤维素 中的β-1,4-糖苷键;L-乳酸脱氢酶(L-lacticacid dehydrogenase)的底物只能是L型乳酸,而不能是D型乳酸。酶的立体异构特异性表明,酶与 底物的结合,至少存在三个结合点。 3.酶活性的可调节性 酶是生物体的组成成份,和体内其他物质一样,不断在体内新陈代谢,酶的催化活性也受多方面的调控。例如,酶的生物合成的诱导和阻 遏、酶的化学修饰、抑制物的调节作用、代谢物对酶的反馈调节、酶的别构调节以及神经体液因素的调节等,这些调控保证酶在体内新陈代谢 中发挥其恰如其分的催化作用,使生命活动中的种种化学反应都能够有条不紊、协调一致地进行。 4.酶活性的不稳定性 酶是蛋白质,酶促反应要求一定的pH、温度等温和的条件,强酸、强碱、有机溶剂、重金属盐、高温、紫外线、剧烈震荡等任何使蛋白质 变性的理化因素都可能使酶变性而失去其催化活性。 第二节 酶的分类和命名 一、酶的分类 国际酶学委员会(I.E.C)规定,按酶促反应的性质,可把酶分成六大类: 1.氧化还原酶类(oxidoreductases)指催化底物进行氧化还原反应的酶类。例如,乳酸脱氢酶、琥珀酸脱氢酶、细胞色素氧化酶、过氧化氢 酶等。 2.转移酶类(transferases)指催化底物之间进行某些基团的转移或交换的酶类。如转甲基酶、转氨酸、己糖激酶、磷酸化酶等。 3.例如、淀粉酶、蛋白酶、脂肪酶、磷酸酶等。 4.裂解酶类(lyases)指催化一个底物分解为两个化合物或两个化合物合成为一个化合物的酶类。例如柠檬酸合成酶、醛缩酶等

5.异构酶类(isomerases)指催化各种同分异构体之间相互转化的酶类。例如,磷酸丙糖异构酶、消旋酶等。 6.合成酶类连接酶类,ligases))指催化两分子底物合成为一分子化合物,同时还必须偶联有ATP的磷酸键断裂的酶类。例如,谷氨酰胺合成 酶、氨基酸:tRNA连接酶等。 二、酶的命名 (一)习惯命名法 1.一般采用底物加反应类型而命名,如蛋白水解酶、乳酸脱氢酶、磷酸己糖异构酶等。 2对水解酶类,只要底物名称即可,如蔗糖酶、胆硷酯酶、蛋白酶等。 3有时在底物名称前冠以酶的来源,如血清谷氨酸·丙酮酸转氨酶、睡液淀粉酶等。 习惯命名法简单,应用历史长,但缺乏系统性,有时出现一酶数名或一名数酶的现象。 (二)系统命名法 鉴于新酶的不断发展和过去文献中对酶命名的混乱,国际酶学委员会规定了一套系统的命名法,使一种酶只有一种名称。它包括酶的系统 命名和4个数字分类的酶编号。例如对催化下列反应酶的命名。 ATP+D一萄萄糖→ADP+D一萄萄糖.6-磷酸 该酶的正式系统命名是:ATP:葡萄糖磷酸转移酶,表示该酶催化从ATP中转移一个磷酸到葡萄糖分子上的反应。它的分类数字是: E.C.2.7.1.1,E.C代表按国际酶学委员会规定的命名,第1个数字(2)代表酶的分类名称(转移酶类),第2个数字(7)代表亚类(磷酸转移酶类),第3 个数字(1)代表亚亚类(以羟基作为受体的磷酸转移酶类),第4个数字(1)代表该酶在亚-亚类中的排号(D葡萄糖作为磷酸基的受体)。 第三节酶的分子组成和化学结构 一、酶的分子组成 根据酶的组成成份,可分单纯酶和结合酶两类。 单纯酶(simpleenzyme)是基本组成单位仅为氨基酸的一类酶。它的催化活性仅仅决定于它的蛋白质结构。脲酶、消化道蛋白酶、淀粉酶、 酯酶、核糖核酸酶等均属此列。 结合酶(conjugatedenzyme)的催化活性,除蛋白质部分(酶蛋白apoenzyme)外,还需要非蛋白质的物质,即所谓酶的辅助因子(cofactors), 两者结合成的复合物称作全酶(holoenzyme),即: 全酶 =酶蛋白 +辅助因子 (结合蛋白质) (蛋白质部分) (非蛋白质部分) 酶的辅助因子可以是金属离子,也可以是小分子有机化合物。常见酶含有的金属离子有K+、Na+、Mg2+、Cu2+、(或Cu+)、Zn2+和Fe2+ (或F3+)等。它们或者是酶活性的组成部分;或者是连接底物和酶分子的桥梁:或者在稳定酶蛋白分子构象方面所必需。小分子有机化合物是 些化学稳定的小分子物质,其主要作用是在反应中传递电子、质子或一些基团,常可按其与酶蛋白结合的紧密程度不同分成辅酶和辅基两大 类。辅酶(coenzyme)与酶蛋白结合疏松,可以用透析或超滤方法除去;辅基(prostheticgroup)与酶蛋白结合紧密,不易用透析或超滤方法除 去,辅酶和辅基的差别仅仅是它们与酶蛋白结合的牢固程度不同,而无严格的界限。 现知大多数维生素(特别是B族维生素)是组成许多酶的辅酶或辅基的成分(见表2)。它们的化学结构式见生物氧化章。体内酶的种类很 多,而辅酶(基)的种类却较少,通常一种酶蛋白只能与一种辅酶结合,成为一种特异的酶,但一种辅酶往往能与不同的酶蛋白结合构成许多种 特异性酶。酶蛋白在酶促反应中主要起识别底物的作用,酶促反应的特异性、高效率以及酶对一些理化因素的不稳定性均决定于酶蛋白部分。 表2-1B族维生素及其铺酶形式 B族维生素 辅酶形式 主要作用 硫胺素(B1) 硫胺素焦碳酸酯(TPP) -阴酸氧化脱羧酮基转换作用 6,8-二硫辛酸 硫辛酸 a-酮酸氧化脱羧 泛酸 辅酶A(COA) 酰基转换作用 黄素单核苷酸FMN) 氢原子转移 核黄素(B2) 黄素腺嘌呤二核苷酸(FAD) 氢原子转移 尼克酰胺腺嘌哈二核苷酸NAD+) 氢原子转移 尼克酰胺(PP) 尼克酰胺腺嘌呤二核苷酸磷酸(NADP+)】 氢原子转移 吡哆素B6) 磷酸吡哆醛 氨基酸代谢 生物素田 生物素 羧化作用 叶酸 四氢叶酸 “一碳基团转移 5甲基钴铵素 钴胺素(B12) 5-脱氧腺苷钴按素 甲基转移 二、酶的分子结构和活性中心
5.异构酶类(isomerases)指催化各种同分异构体之间相互转化的酶类。例如,磷酸丙糖异构酶、消旋酶等。 6.合成酶类(连接酶类,ligases)指催化两分子底物合成为一分子化合物,同时还必须偶联有ATP的磷酸键断裂的酶类。例如,谷氨酰胺合成 酶、氨基酸:tRNA连接酶等。 二、酶的命名 (一)习惯命名法 1.一般采用底物加反应类型而命名,如蛋白水解酶、乳酸脱氢酶、磷酸己糖异构酶等。 2.对水解酶类,只要底物名称即可,如蔗糖酶、胆硷酯酶、蛋白酶等。 3.有时在底物名称前冠以酶的来源,如血清谷氨酸-丙酮酸转氨酶、唾液淀粉酶等。 习惯命名法简单,应用历史长,但缺乏系统性,有时出现一酶数名或一名数酶的现象。 (二)系统命名法 鉴于新酶的不断发展和过去文献中对酶命名的混乱,国际酶学委员会规定了一套系统的命名法,使一种酶只有一种名称。它包括酶的系统 命名和4个数字分类的酶编号。例如对催化下列反应酶的命名。 ATP+D—葡萄糖→ADP+D—葡萄糖-6-磷酸 该酶的正式系统命名是:ATP:葡萄糖磷酸转移酶,表示该酶催化从ATP中转移一个磷酸到葡萄糖分子上的反应。它的分类数字是: E.C.2.7.1.1,E.C代表按国际酶学委员会规定的命名,第1个数字(2)代表酶的分类名称(转移酶类),第2个数字(7)代表亚类(磷酸转移酶类),第3 个数字(1)代表亚亚类(以羟基作为受体的磷酸转移酶类),第4个数字(1)代表该酶在亚-亚类中的排号(D葡萄糖作为磷酸基的受体)。 第三节 酶的分子组成和化学结构 一、酶的分子组成 根据酶的组成成份,可分单纯酶和结合酶两类。 单纯酶(simpleenzyme)是基本组成单位仅为氨基酸的一类酶。它的催化活性仅仅决定于它的蛋白质结构。脲酶、消化道蛋白酶、淀粉酶、 酯酶、核糖核酸酶等均属此列。 结合酶(conjugatedenzyme)的催化活性,除蛋白质部分(酶蛋白apoenzyme)外,还需要非蛋白质的物质,即所谓酶的辅助因子(cofactors), 两者结合成的复合物称作全酶(holoenzyme),即: 全酶 =酶 蛋 白 + 辅助因子 (结合蛋白质) (蛋白质部分) (非蛋白质部分) 酶的辅助因子可以是金属离子,也可以是小分子有机化合物。常见酶含有的金属离子有K+、Na+、Mg2+、Cu2+、(或Cu+)、Zn2+和Fe2+ (或Fe3+)等。它们或者是酶活性的组成部分;或者是连接底物和酶分子的桥梁;或者在稳定酶蛋白分子构象方面所必需。小分子有机化合物是 些化学稳定的小分子物质,其主要作用是在反应中传递电子、质子或一些基团,常可按其与酶蛋白结合的紧密程度不同分成辅酶和辅基两大 类。辅酶(coenzyme)与酶蛋白结合疏松,可以用透析或超滤方法除去;辅基(prostheticgroup)与酶蛋白结合紧密,不易用透析或超滤方法除 去,辅酶和辅基的差别仅仅是它们与酶蛋白结合的牢固程度不同,而无严格的界限。 现知大多数维生素(特别是B族维生素)是组成许多酶的辅酶或辅基的成分(见表2-1)。它们的化学结构式见生物氧化章。体内酶的种类很 多,而辅酶(基)的种类却较少,通常一种酶蛋白只能与一种辅酶结合,成为一种特异的酶,但一种辅酶往往能与不同的酶蛋白结合构成许多种 特异性酶。酶蛋白在酶促反应中主要起识别底物的作用,酶促反应的特异性、高效率以及酶对一些理化因素的不稳定性均决定于酶蛋白部分。 表2-1 B族维生素及其辅酶形式 B族维生素 辅酶形式 主要作用 硫胺素(B1) 硫胺素焦磷酸酯(TPP) α-酮酸氧化脱羧酮基转换作用 硫辛酸 6,8-二硫辛酸 α-酮酸氧化脱羧 泛酸 辅酶A(CoA) 酰基转换作用 核黄素(B2) 黄素单核苷酸(FMN) 黄素腺嘌呤二核苷酸(FAD) 氢原子转移 氢原子转移 尼克酰胺(PP) 尼克酰胺腺嘌呤二核苷酸(NAD+) 尼克酰胺腺嘌呤二核苷酸磷酸(NADP+) 氢原子转移 氢原子转移 吡哆素(B6) 磷酸吡哆醛 氨基酸代谢 生物素(H) 生物素 羧化作用 叶酸 四氢叶酸 “一碳基团”转移 钴胺素(B12) 5-甲基钴铵素 5-脱氧腺苷钴铵素 甲基转移 二、酶的分子结构和活性中心

活性中心外必需基团 结合基团 性中心 作用物分 性中心 必需基团 多肽链 图2-1酶活性中心示意图 酶的分子中存在有许多功能基团例如,NH2、-COOH、-SH、-OH等,但并不是这些基团都与酶活性有关。一般将与酶活性有关的基团称 为酶的必需基团(essentialgroup)。有些必需基团虽然在一级结构上可能相距很远,但在空间结构上彼此靠近,集中在一起形成具有一定空间结 构的区域,该区域与底物相结合并将底物转化为产物,这一区域称为酶的活性中心(active center),对于结合酶来说,辅酶或辅基上的一部分结 构往往是活性中心的组成成分。 构成酶活性中心的必需基团可分为两种,与底物结合的必需基团称为结合基团(binding group),促进底物发生化学变化的基团称为催化基 团(catalyticgroup)。活性中心中有的必需基团可同时具有这两方面的功能。还有些必需基团虽然不参加酶的活性中心的组成,但为维持酶活性 中心应有的空间构象所必需,这些基团是酶的活性中心以外的必需基团。 酶分子很大,其催化作用往往并不需要整个分子,如用氨基肽酶处理木瓜蛋白酶,使其肽链自N端开始逐渐缩短,当其原有的180个氨基酸 残基被水解掉120个后,剩余的短肽仍有水解蛋白质的活性。又如将核糖核酸酶肽链C末端的三肽(棻魔丝楃?切断,余下部分也有酶的活性,足 见某些酶的催化活性仅与其分子的一小部分有关。 不同的酶有不同的活性中心,故对底物有严格的特异性。 例如乳酸脱氢酶是具有立体异构特异性的酶,它能催化乳酸脱氢生成丙酮酸的可 逆反应: COOH COOH 乳酸脱氢酶 C=0 HO-C-H CH3丙酮酸 CH3乳液 L(+)乳酸通过其不对称碳原子上的栈H3、栈OOH及粮H基分别与乳酸脱氢酶活性中心的A、B及C三个功能基团结合,故可受酶催化而转变 为丙酮酸。而D(~)乳酸由于粮H、栈00H的空间位置与L(+)乳酸相反,与酶的三个结合基团不能完全配合,故不能与酶结合受其催化(图2)。由 此可见,酶的特异性不但决定于酶活性中心的功能基团的性质,而且还决定于底物和活性中心的空间构象,只有那些有一定的化学结构,能与 酶的结合基团结合,而且空间构型又完全适应的化合物,才能作为酶的底物。 L(+)乳酸 D(-)乳酸 图2-2乳酸脱氢酶的立体异构特异性 A、B、C分别为LDH活性中心的三个功能基团 但是,酶的结构不是固定不变的,有人提出酶分子(包括辅酶在内)的构型与底物原来并非吻合,当底物分子与酶分子相碰时,可诱导酶分 子的构象变得能与底物配合,然后底物才能与酶的活性中心结合,进而引起底物分子发生相应化学变化,此即所谓酶作用的诱导契合学说 (induced fit theory)。用X衍射分析的方法已证明,酶在参与催化作用时发生了构象变化
图2-1 酶活性中心示意图 酶的分子中存在有许多功能基团例如,-NH2、-COOH、-SH、-OH等,但并不是这些基团都与酶活性有关。一般将与酶活性有关的基团称 为酶的必需基团(essentialgroup)。有些必需基团虽然在一级结构上可能相距很远,但在空间结构上彼此靠近,集中在一起形成具有一定空间结 构的区域,该区域与底物相结合并将底物转化为产物,这一区域称为酶的活性中心(active center),对于结合酶来说,辅酶或辅基上的一部分结 构往往是活性中心的组成成分。 构成酶活性中心的必需基团可分为两种,与底物结合的必需基团称为结合基团(binding group),促进底物发生化学变化的基团称为催化基 团(catalyticgroup)。活性中心中有的必需基团可同时具有这两方面的功能。还有些必需基团虽然不参加酶的活性中心的组成,但为维持酶活性 中心应有的空间构象所必需,这些基团是酶的活性中心以外的必需基团。 酶分子很大,其催化作用往往并不需要整个分子,如用氨基肽酶处理木瓜蛋白酶,使其肽链自N端开始逐渐缩短,当其原有的180个氨基酸 残基被水解掉120个后,剩余的短肽仍有水解蛋白质的活性。又如将核糖核酸酶肽链C末端的三肽(棻麠丝楃?切断,余下部分也有酶的活性,足 见某些酶的催化活性仅与其分子的一小部分有关。 不同的酶有不同的活性中心,故对底物有严格的特异性。例如乳酸脱氢酶是具有立体异构特异性的酶,它能催化乳酸脱氢生成丙酮酸的可 逆反应: L(+)乳酸通过其不对称碳原子上的桟H3、桟OOH及桹H基分别与乳酸脱氢酶活性中心的A、B及C三个功能基团结合,故可受酶催化而转变 为丙酮酸。而D(-)乳酸由于桹H、桟OOH的空间位置与L(+)乳酸相反,与酶的三个结合基团不能完全配合,故不能与酶结合受其催化(图2)。由 此可见,酶的特异性不但决定于酶活性中心的功能基团的性质,而且还决定于底物和活性中心的空间构象,只有那些有一定的化学结构,能与 酶的结合基团结合,而且空间构型又完全适应的化合物,才能作为酶的底物。 图2-2 乳酸脱氢酶的立体异构特异性 A、B、C分别为LDH活性中心的三个功能基团 但是,酶的结构不是固定不变的,有人提出酶分子(包括辅酶在内)的构型与底物原来并非吻合,当底物分子与酶分子相碰时,可诱导酶分 子的构象变得能与底物配合,然后底物才能与酶的活性中心结合,进而引起底物分子发生相应化学变化,此即所谓酶作用的诱导契合学说 (induced fit theory)。用X衍射分析的方法已证明,酶在参与催化作用时发生了构象变化
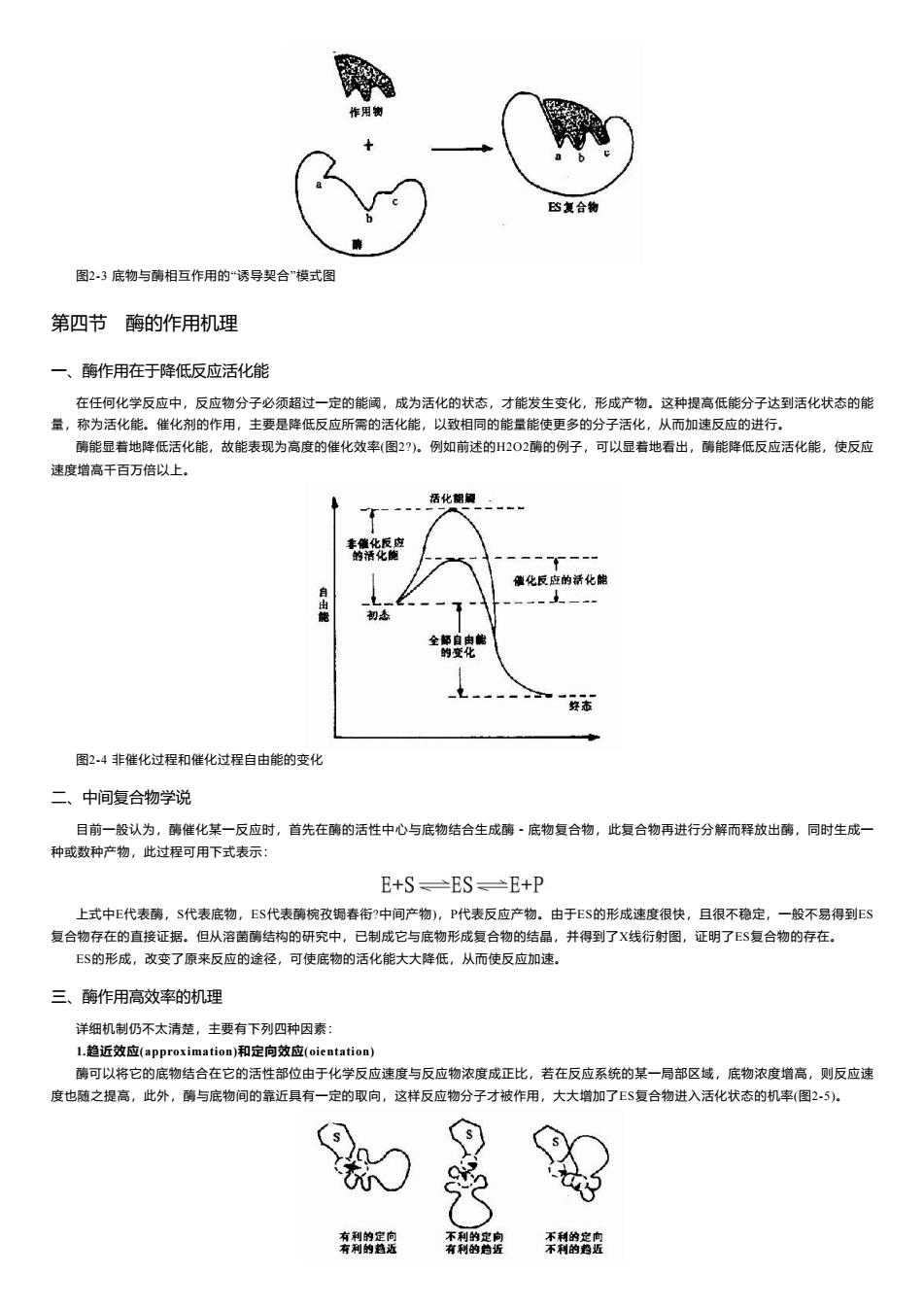
E图复合物 图2.3底物与酶相互作用的“诱导契合”模式图 第四节酶的作用机理 一、酶作用在于降低反应活化能 在任何化学反应中,反应物分子必须超过一定的能阈,成为活化的状态,才能发生变化,形成产物。这种提高低能分子达到活化状态的能 量,称为活化能。催化剂的作用,主要是降低反应所需的活化能,以致相同的能量能使更多的分子活化,从而加速反应的进行,。 酶能显着地降低活化能,故能表现为高度的催化效率(图2?)。例如前述的H202酶的例子,可以显着地看出,酶能降低反应活化能,使反应 速度增高干百万倍以上. 活化能履 丰熊化反应 的活化能 一一一 催化反应的活化能 自 初态 全都自由能 的度化 “经态 图2.4非催化过程和催化过程自由能的变化 二、中间复合物学说 目前一般认为,酶催化某一反应时,首先在酶的活性中心与底物结合生成酶·底物复合物,此复合物再进行分解而释放出酶,同时生成一 种或数种产物,此过程可用下式表示: E+S→ES≥E+P 上式中E代表酶,S代表底物,E$代表酶椀孜锔春衔?中间产物),P代表反应产物。由于E$的形成速度很快,且很不稳定,一般不易得到ES 复合物存在的直接证据。但从溶菌酶结构的研究中,已制成它与底物形成复合物的结晶,并得到了X线衍射图,证明了ES复合物的存在。 E$的形成,改变了原来反应的途径,可使底物的活化能大大降低,从而使反应加速。 三、酶作用高效率的机理 详细机制仍不太清楚,主要有下列四种因素: L.趋近效应(approximation)和定向效应(oientation) 酶可以将它的底物结合在它的活性部位由于化学反应速度与反应物浓度成正比,若在反应系统的某一局部区域,底物浓度增高,则反应速 度也随之提高,此外,酶与底物间的靠近具有一定的取向,这样反应物分子才被作用,大大增加了ES复合物进入活化状态的机率(图2-5)。 有利的定向 不利的定向 不利的定向 有利的趋近 有利的趋近 不利的趋近
图2-3 底物与酶相互作用的“诱导契合”模式图 第四节 酶的作用机理 一、酶作用在于降低反应活化能 在任何化学反应中,反应物分子必须超过一定的能阈,成为活化的状态,才能发生变化,形成产物。这种提高低能分子达到活化状态的能 量,称为活化能。催化剂的作用,主要是降低反应所需的活化能,以致相同的能量能使更多的分子活化,从而加速反应的进行。 酶能显着地降低活化能,故能表现为高度的催化效率(图2?)。例如前述的H2O2酶的例子,可以显着地看出,酶能降低反应活化能,使反应 速度增高千百万倍以上。 图2-4 非催化过程和催化过程自由能的变化 二、中间复合物学说 目前一般认为,酶催化某一反应时,首先在酶的活性中心与底物结合生成酶-底物复合物,此复合物再进行分解而释放出酶,同时生成一 种或数种产物,此过程可用下式表示: 上式中E代表酶,S代表底物,ES代表酶椀孜锔春衔?中间产物),P代表反应产物。由于ES的形成速度很快,且很不稳定,一般不易得到ES 复合物存在的直接证据。但从溶菌酶结构的研究中,已制成它与底物形成复合物的结晶,并得到了X线衍射图,证明了ES复合物的存在。 ES的形成,改变了原来反应的途径,可使底物的活化能大大降低,从而使反应加速。 三、酶作用高效率的机理 详细机制仍不太清楚,主要有下列四种因素: 1.趋近效应(approximation)和定向效应(oientation) 酶可以将它的底物结合在它的活性部位由于化学反应速度与反应物浓度成正比,若在反应系统的某一局部区域,底物浓度增高,则反应速 度也随之提高,此外,酶与底物间的靠近具有一定的取向,这样反应物分子才被作用,大大增加了ES复合物进入活化状态的机率(图2-5)
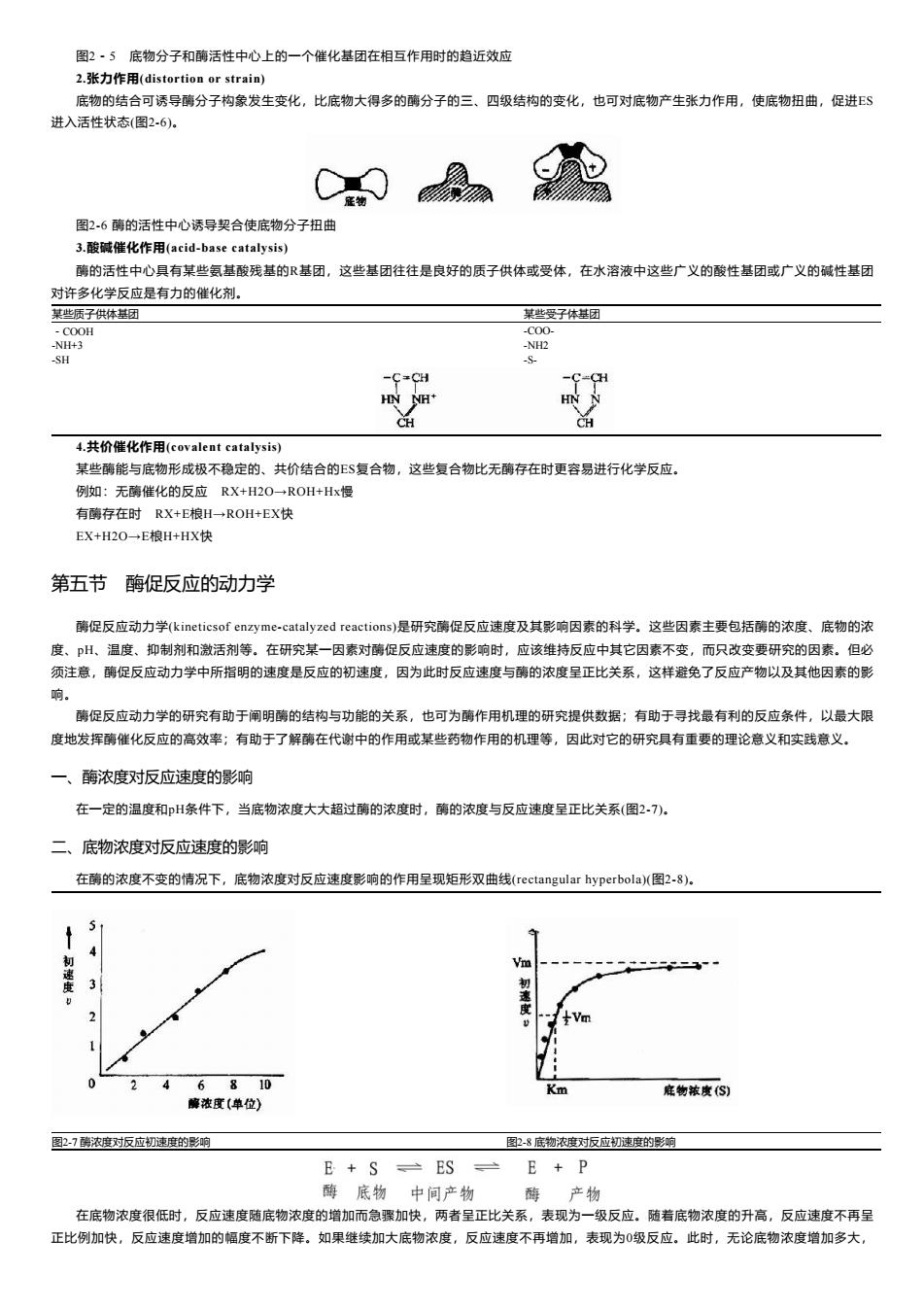
图2·5底物分子和酶活性中心上的一个催化基团在相互作用时的趋近效应 2.张力作用(distortion or strain) 底物的结合可诱导酶分子构象发生变化,比底物大得多的酶分子的三、四级结构的变化,也可对底物产生张力作用,使底物扭曲,促进E$ 进入活性状态(图2-6)。 图2-6酶的活性中心诱导契合使底物分子扭曲 3.酸碱催化作用(acid-base catalysis) 酶的活性中心具有某些氨基酸残基的基团,这些基团往往是良好的质子供体或受体,在水溶液中这些广义的酸性基团或广义的碱性基团 对许多化学反应是有力的催化剂。 某些质子供体基团 某些受子体基团 -C00H -C00- -NH+3 -NH2 -SH -S -C=CH -C=CH HN NH+ HN N CH CH 4.共价催化作用(covalent catalysis) 某些酶能与底物形成极不稳定的、共价结合的E$复合物,这些复合物比无酶存在时更容易进行化学反应。 例如:无酶催化的反应RX+H2O→ROH+Hx慢 有酶存在时RX+E粮H一→ROH+EX快 EX+H2O一E粮H+HX快 第五节酶促反应的动力学 酶促反应动力学(kineticsof enzyme-catalyzed reactions)是研究酶促反应速度及其影响因素的科学。这些因素主要包括酶的浓度、底物的浓 度、pH、温度、抑制剂和激活剂等。在研究某一因素对酶促反应速度的影响时,应该维持反应中其它因素不变,而只改变要研究的因素。但必 须注意,酶促反应动力学中所指明的速度是反应的初速度,因为此时反应速度与酶的浓度呈正比关系,这样避免了反应产物以及其他因素的影 响。 酶促反应动力学的研究有助于闸明酶的结构与功能的关系,也可为酶作用机理的研究提供数据:有助于寻找最有利的反应条件,以最大限 度地发挥酶催化反应的高效率;有助于了解酶在代谢中的作用或某些药物作用的机理等,因此对它的研究具有重要的理论意义和实践意义。 一、酶浓度对反应速度的影响 在一定的温度和H条件下,当底物浓度大大超过酶的浓度时,酶的浓度与反应速度呈正比关系(图2-7)。 二、底物浓度对反应速度的影响 在酶的浓度不变的情况下,底物浓度对反应速度影响的作用呈现矩形双曲线(rectangular hyperbola)(图2-8)。 初速度 Vm 3 初速度 -Vm 6810 Km 底物浓度(S) 酶浓度(单位) 图2-7酶浓度对反应初速度的影响 图2-8底物浓度对反应初速度的影响 E+S ES E+P 酶底物中间产物 酶产物 在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系,表现为一级反应。随着底物浓度的升高,反应速度不再呈 正比例加快,反应速度增加的幅度不断下降。如果继续加大底物浓度,反应速度不再增加,表现为0级反应。此时,无论底物浓度增加多大
图2-5 底物分子和酶活性中心上的一个催化基团在相互作用时的趋近效应 2.张力作用(distortion or strain) 底物的结合可诱导酶分子构象发生变化,比底物大得多的酶分子的三、四级结构的变化,也可对底物产生张力作用,使底物扭曲,促进ES 进入活性状态(图2-6)。 图2-6 酶的活性中心诱导契合使底物分子扭曲 3.酸碱催化作用(acid-base catalysis) 酶的活性中心具有某些氨基酸残基的R基团,这些基团往往是良好的质子供体或受体,在水溶液中这些广义的酸性基团或广义的碱性基团 对许多化学反应是有力的催化剂。 某些质子供体基团 某些受子体基团 -COOH -COO- -NH+3 -NH2 -SH -S- 4.共价催化作用(covalent catalysis) 某些酶能与底物形成极不稳定的、共价结合的ES复合物,这些复合物比无酶存在时更容易进行化学反应。 例如:无酶催化的反应 RX+H2O→ROH+Hx慢 有酶存在时 RX+E桹H→ROH+EX快 EX+H2O→E桹H+HX快 第五节 酶促反应的动力学 酶促反应动力学(kineticsof enzyme-catalyzed reactions)是研究酶促反应速度及其影响因素的科学。这些因素主要包括酶的浓度、底物的浓 度、pH、温度、抑制剂和激活剂等。在研究某一因素对酶促反应速度的影响时,应该维持反应中其它因素不变,而只改变要研究的因素。但必 须注意,酶促反应动力学中所指明的速度是反应的初速度,因为此时反应速度与酶的浓度呈正比关系,这样避免了反应产物以及其他因素的影 响。 酶促反应动力学的研究有助于阐明酶的结构与功能的关系,也可为酶作用机理的研究提供数据;有助于寻找最有利的反应条件,以最大限 度地发挥酶催化反应的高效率;有助于了解酶在代谢中的作用或某些药物作用的机理等,因此对它的研究具有重要的理论意义和实践意义。 一、酶浓度对反应速度的影响 在一定的温度和pH条件下,当底物浓度大大超过酶的浓度时,酶的浓度与反应速度呈正比关系(图2-7)。 二、底物浓度对反应速度的影响 在酶的浓度不变的情况下,底物浓度对反应速度影响的作用呈现矩形双曲线(rectangular hyperbola)(图2-8)。 图2-7 酶浓度对反应初速度的影响 图2-8 底物浓度对反应初速度的影响 在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系,表现为一级反应。随着底物浓度的升高,反应速度不再呈 正比例加快,反应速度增加的幅度不断下降。如果继续加大底物浓度,反应速度不再增加,表现为0级反应。此时,无论底物浓度增加多大

反应速度也不再增加,说明酶已被底物所饱和。所有的酶都有饱和现象,只是达到饱和时所需底物浓度各不相同而已。 (一)米曼氏方程式 解释酶促反应中底物浓度和反应速度关系的最合理学说是中间产物学说。酶首先与底物结合生成酶椀孜锔春衔?中间产物),此复合物再分 解为产物和游离的酶。 Michaelis和Menten:在前人工作的基础上,经过大量的实验,I9I3年前后提出了反应速度和底物浓度关系的数学方程式,即著名的米榴?戏 匠淌?michaelismenten equation). V=Vmax[S]/Km+[S] Vmax指该酶促反应的最大速度,[S]为底物浓度,Km是米氏常数,V是在某一底物浓度时相应的反应速度。当底物浓度很低时,[S]《Km, 则V=Vmax/KmS],反应速度与底物浓度呈正比。当底物浓度很高时,[S]》Km,此时V=Vmax,反应速度达最大速度,底物浓度再增高也不 影响反应速度(图2-9). 图 5 :ta 图29酶与不同浓度的底物相互作用模式 (二)米-曼氏方程式的推导 米·曼氏方程式提出后又经riggs和Haldane的充实和发展,经补充和发展的米·曼氏方程工推导如下: E+S ES E+P K2 K4 (1) 式中K1、K2、K3、K4分别为各向反应的速度常数。 从式(1)中知,ES的生成途径来自E+S和E+P,但其中E+P生成ES的速度极小(尤其在起始阶段,P的生成很少),可以忽略不计,又因为底 物浓度大大超过南的浓度,[S]》E],中间产物ES中的S浓度可以忽略不计,因此,ES的生成速度为: d[ES] KI([Et]-[ES][S] (2) dt 其中[Et]-【ES】为游离酶的浓度,ES的分解速度为: [ES] dt K2[ESH+K3[ES]=(K2+K3)ES] 3 当反应体系处于稳态时,ES生成和分解的速度相等,即 KI([Et]·[ES])[S]=(K2+K3)[ES] K2+K3 [E]-[ES] KI [ES] 令K2+K3/K1=Km则Km=[Et]·[ES]/[ES]~[S] [Es]=[Et][S]/Km+[S](4) 由于反应速度取决于产物P的生成量,故 V=K3[ES(5) 在酶促反应达最大速度时,所有的酶分子都已与底物结合形成中间产物,此时 [Et]=[ES](6) 那么Vmax=K3[Et] (7) 在(4)式两边乘以K3得: K3,【ES】=K3[Et][S]/Km+[S]以(5)和(7)式代入,即: V=Vmax[S]/Km+[S] (三)米氏常数的意义 当反应速度为最大速度一半时,米氏方程可以变换如下: Vmax=Vmax[S]/Km+[S] 进一步整理可得到: Km=[S] 可知,Km值等于酶反应速度为最大速度一半时的底物浓度。 因为Km=K2+K3/K1,当K2》K3,即ES解离成E和S的速度大大超过分离成E和P的速度时,K3可以忽略不计,此时Km值近似于ES解离 常数KS,此时Km值可用来表示酶对底物的亲和力
反应速度也不再增加,说明酶已被底物所饱和。所有的酶都有饱和现象,只是达到饱和时所需底物浓度各不相同而已。 (一)米曼氏方程式 解释酶促反应中底物浓度和反应速度关系的最合理学说是中间产物学说。酶首先与底物结合生成酶椀孜锔春衔?中间产物),此复合物再分 解为产物和游离的酶。 Michaelis和Menten在前人工作的基础上,经过大量的实验,1913年前后提出了反应速度和底物浓度关系的数学方程式,即著名的米椔?戏 匠淌?michaelismenten equation). V=Vmax[S]/Km+[S] Vmax指该酶促反应的最大速度,[S]为底物浓度,Km是米氏常数,V是在某一底物浓度时相应的反应速度。当底物浓度很低时,[S]《Km, 则V≌Vmax/Km[S],反应速度与底物浓度呈正比。当底物浓度很高时,[S]》Km,此时V≌Vmax,反应速度达最大速度,底物浓度再增高也不 影响反应速度(图2-9)。 图2-9 酶与不同浓度的底物相互作用模式 (二)米-曼氏方程式的推导 米-曼氏方程式提出后又经riggs和Haldane的充实和发展,经补充和发展的米-曼氏方程工推导如下: (1) 式中K1、K2、K3、K4分别为各向反应的速度常数。 从式(1)中知,ES的生成途径来自E+S和E+P,但其中E+P生成ES的速度极小(尤其在起始阶段,P的生成很少),可以忽略不计,又因为底 物浓度大大超过酶的浓度,[S]》[E],中间产物ES中的S浓度可以忽略不计,因此,ES的生成速度为: d[ES] = K1([Et]-[ES])·[S] (2) dt 其中[Et]-[ES]为游离酶的浓度,ES的分解速度为: - [ES] = K2[ES]+K3[ES]=(K2+K3)[ES] (3) dt 当反应体系处于稳态时,ES生成和分解的速度相等,即 K1([Et]-[ES])·[S]=(K2+K3)[ES] K2+K3 = [Et]-[ES] ·[S] K1 [ES] 令K2+K3/K1=Km 则 Km=[Et]-[ES]/[ES]·[S] [ES]=[Et][S]/Km+[S] (4) 由于反应速度取决于产物P的生成量,故 V=K3[ES (5) 在酶促反应达最大速度时,所有的酶分子都已与底物结合形成中间产物,此时 [Et]=[ES] (6) 那么 Vmax=K3[Et] (7) 在(4)式两边乘以K3得: K3·[ES]=K3·[Et][S]/Km+[S] 以(5)和(7)式代入,即: V=Vmax[S]/Km+[S] (三)米氏常数的意义 当反应速度为最大速度一半时,米氏方程可以变换如下: ½Vmax=Vmax[S]/Km+[S] 进一步整理可得到: Km=[S] 可知,Km值等于酶反应速度为最大速度一半时的底物浓度。 因为Km=K2+K3/K1,当K2》K3,即ES解离成E和S的速度大大超过分离成E和P的速度时,K3可以忽略不计,此时Km值近似于ES解离 常数KS,此时Km值可用来表示酶对底物的亲和力

Km=K2/K1=[E][S]/[ES]=KS Km值愈大,酶与底物的亲和力愈小;K值愈小,酶与底物亲和力愈大。酶与底物亲和力大,表示不需要很高的底物浓度,便可容易地达 到最大反应速度。但是K$值并非在所有酶促反应中都远小于K2,所以Ks值(又称酶促反应的底物常数)和Km值的涵义不同,不能互相代替使 用。 Km值是酶的特征性常数,只与酶的性质,酶所催化的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关,与酶的浓度无关。酶的种 类不同,Km值不同,同一种酶与不同底物作用时,Km值也不同。各种酶的Km值范围很广,大致在10-1~10-6M之间。 当K3不远远小于K2和K1时,Km表示整个反应的化学平衡的常数。 如果Km值已知,任何底物浓度时酶的饱和度(形成中间产物的酶占总酶的比例,saturation fraction fEs)fEs便可计算出来。 fES=[ES][Et]=K3 [ES]/K3 [Et]=V/Vmax=[S]/Km+[S] (四)Km和Vmax的求法 如图2?所示,底物浓度曲线是矩形双曲线。 从图中很难精确地测出Km和Vmax。为此人们将米氏方程进行种种变换,将曲线作图转变成直线作图。 l.双倒数作图(double?reciprocal plot or Lineweaver?Burk plot) 将米氏方程两边取倒数,可转化为下列形式: 1 V=Km Vmax-1 [S]+1/Vmax 从图2-10可知,1/V对1/[S]的作图得一直线,其斜率是Km/V,在纵轴上的截距为1/Vmx,横轴上的截距为-1/Km。此作图除用来求Km和 Vmax值外,在研究酶的抑制作用方面还有重要价值。 Km 1 文m可+ Km 斜率中Vm Vmax 图2.10双倒数作图法 斜率=一K 恕 可 图2-11v对v川s]作图法 2.V对V〖】[S][SX)]法(Eadie?Hofstee plot) 将米氏方程经移项整理后可写成 VKm+V[S]=Vm[S] V[S]=Vm[S]-VKm 故V=Vm-KmV/[S] 以V为纵坐标对V/[S]横坐标作图,所得直线,其纵轴的截距为Vmax,斜率为Km(图2-11)。 必须指出米氏方程只适用于较为简单的酶作用过程,对于比较复杂的酶促反应过程,如多酶体系、多底物、多产物、多中间物等,还不能 全面地籍此概括和说明,必须借助于复杂的计算过程。 三、pH对反应速度的影响 酶反应介质的H可影响酶分子,特别是活性中心上必需基团的解离程度和催化基团中质子供体或质子受体所需的离子化状态,也可影响底 物和辅酶的解离程度,从而影响酶与底物的结合。只有在特定的H条件下,酶、底物和辅酶的解离情况,最适宜于它们互相结合,并发生催化 作用,使酶促反应速度达最大值,这种pH值称为酶的最适pH(optimum pH)。它和酶的最稳定pH不一定相同,和体内环境的pH也未必相同
Km=K2/K1=[E][S]/[ES]=KS Km值愈大,酶与底物的亲和力愈小;Km值愈小,酶与底物亲和力愈大。酶与底物亲和力大,表示不需要很高的底物浓度,便可容易地达 到最大反应速度。但是KS值并非在所有酶促反应中都远小于K2,所以Ks值(又称酶促反应的底物常数)和Km值的涵义不同,不能互相代替使 用。 Km值是酶的特征性常数,只与酶的性质,酶所催化的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关,与酶的浓度无关。酶的种 类不同,Km值不同,同一种酶与不同底物作用时,Km值也不同。各种酶的Km值范围很广,大致在10-1~10-6M之间。 当K3不远远小于K2和K1时,Km表示整个反应的化学平衡的常数。 如果Km值已知,任何底物浓度时酶的饱和度(形成中间产物的酶占总酶的比例,saturation fraction fEs)fEs便可计算出来。 fES=[ES]/[Et]=K3[ES]/K3[Et]=V/Vmax=[S]/Km+[S] (四)Km和Vmax的求法 如图2?所示,底物浓度曲线是矩形双曲线。 从图中很难精确地测出Km和Vmax。为此人们将米氏方程进行种种变换,将曲线作图转变成直线作图。 1.双倒数作图(double?reciprocal plot or Lineweaver?Burk plot) 将米氏方程两边取倒数,可转化为下列形式: 1/V=Km/Vmax·1/[S]+1/Vmax 从图2-10可知,1/V对1/[S]的作图得一直线,其斜率是Km/V,在纵轴上的截距为1/Vmax,横轴上的截距为-1/Km。此作图除用来求Km和 Vmax值外,在研究酶的抑制作用方面还有重要价值。 图2-10 双倒数作图法 图2-11 v对v/[s]作图法 2.V对V〖〗[S][SX)]法(Eadie?Hofstee plot) 将米氏方程经移项整理后可写成 VKm+V[S]=Vm[S] V[S]=Vm[S]-VKm 故V=Vm-KmV/[S] 以V为纵坐标对V/[S]横坐标作图,所得直线,其纵轴的截距为Vmax,斜率为Km(图2-11)。 必须指出米氏方程只适用于较为简单的酶作用过程,对于比较复杂的酶促反应过程,如多酶体系、多底物、多产物、多中间物等,还不能 全面地籍此概括和说明,必须借助于复杂的计算过程。 三、pH对反应速度的影响 酶反应介质的pH可影响酶分子,特别是活性中心上必需基团的解离程度和催化基团中质子供体或质子受体所需的离子化状态,也可影响底 物和辅酶的解离程度,从而影响酶与底物的结合。只有在特定的pH条件下,酶、底物和辅酶的解离情况,最适宜于它们互相结合,并发生催化 作用,使酶促反应速度达最大值,这种pH值称为酶的最适pH(optimum pH)。它和酶的最稳定pH不一定相同,和体内环境的pH也未必相同

相对速度 相对速度 H 6 PH 10 pH 胃蛋白离 葡葡脑一6一染酸测 图2-12胃蛋白酶和葡萄糖-6-磷酸酶的pH活性曲线 动物体内多数酶的最适H值接近中性,但也有例外,如胃蛋白酶的最适pH约1.8,肝精氨酸酶最适pH约为9.8(见表2-2)。 表2-2一些酶的最适pH 酶 最适pH 酶 最适pH 酶 最适pH 胃蛋白酶 1.8 过氧化氢确 7.6 延胡索酸醇 7.8 胰蛋白酶 7.7 精氨酸酸 9.8 核糖核酸酶 7.8 最适即H不是酶的特征性常数,它受底物浓度、缓冲液的种类和浓度以及酶的纯度等因素的影响。 溶液的H值高于和低于最适H时都会使酶的活性降低,远离最适pH值时甚至导致酶的变性失活。测定酶的活性时,应选用适宜的缓冲 液,以保持酶活性的相对恒定。 四、温度对反应速度的影响 化学反应的速度随温度增高而加快。但酶是蛋白质,可随温度的升高而变性。在温度较低时,前一影响较大,反应速度随温度升高而加 快,一般地说,温度每升高10℃,反应速度大约增加一倍。但温度超过一定数值后,酶受热变性的因素占优势,反应速度反而随温度上升而减 缓,形成倒V形或倒U形曲线。在此曲线顶点所代表的温度,反应速度最大,称为酶的最适温度(optimum temperature))(图2-l3)。 20 芽 毫克教 10 05 10203040060℃ 温度 图2-13温度对唾液淀粉酶活性影响 从动物组织提取的酶,其最适温度多在35℃~40℃之间,温度升高到60℃以上时,大多数酶开始变性,80℃以上,多数酶的变性不可逆。 酶的活性虽然随温度的下降而降低,但低温一般不破坏酶。温度回升后,酶又恢复活性。临床上低温麻醉就是利用酶的这一性质以减慢组织细 胞代谢速度,提高机体对氧和营养物质缺乏的耐受体,有利于进行手术治疗。 酶的最适温度不是酶的特征性常数,这是因为它与反应所需时间有关,不是一个固定的值。酶可以在短时间内耐受较高的温度,相反,延 长反应时间,最适温度便降低 五、抑制剂对反应速度的影响 凡能使酶的活性下降而不引起酶蛋白变性的物质称做酶的抑制剂(inhibitor)。使酶变性失活(称为酶的钝化)的因素如强酸、强碱等,不属于 抑制剂。通常抑制作用分为可逆性抑制和不可逆性抑制两类。 (一)不可逆性抑制作用(irreversibleinhibition) 不可逆性抑制作用的抑制剂,通常以共价键方式与酶的必需基团进行不可逆结合而使酶丧失活性,按其作用特点,又有专一性及非专一性 之分。 1.非专一性不可逆抑制 抑制剂与酶分子中一类或几类基团作用,不论是必需基团与否,皆可共价结合,由于其中必需基团也被抑制剂结合,从而导致酶的失活。 某些重金属(Pb++、Cu++、Hg++)及对氨汞苯甲酸等,能与酶分子的疏基进行不可逆适合,许多以疏基作为必需基团的酶(通称巯基酶),会因 此而遭受抑制,属于此种类型。用二巯基丙醇(british anti?lewisite,BAL)或二巯基丁二酸钠等含巯基的化合物可使酶复话
图2-12 胃蛋白酶和葡萄糖-6-磷酸酶的pH活性曲线 动物体内多数酶的最适pH值接近中性,但也有例外,如胃蛋白酶的最适pH约1.8,肝精氨酸酶最适pH约为9.8(见表2-2)。 表2-2 一些酶的最适pH 酶 最适pH 酶 最适pH 酶 最适pH 胃蛋白酶 1.8 过氧化氢酶 7.6 延胡索酸酶 7.8 胰蛋白酶 7.7 精氨酸酶 9.8 核糖核酸酶 7.8 最适pH不是酶的特征性常数,它受底物浓度、缓冲液的种类和浓度以及酶的纯度等因素的影响。 溶液的pH值高于和低于最适pH时都会使酶的活性降低,远离最适pH值时甚至导致酶的变性失活。测定酶的活性时,应选用适宜的缓冲 液,以保持酶活性的相对恒定。 四、温度对反应速度的影响 化学反应的速度随温度增高而加快。但酶是蛋白质,可随温度的升高而变性。在温度较低时,前一影响较大,反应速度随温度升高而加 快,一般地说,温度每升高10℃,反应速度大约增加一倍。但温度超过一定数值后,酶受热变性的因素占优势,反应速度反而随温度上升而减 缓,形成倒V形或倒U形曲线。在此曲线顶点所代表的温度,反应速度最大,称为酶的最适温度(optimum temperature)(图2-13)。 图2-13 温度对唾液淀粉酶活性影响 从动物组织提取的酶,其最适温度多在35℃~40℃之间,温度升高到60℃以上时,大多数酶开始变性,80℃以上,多数酶的变性不可逆。 酶的活性虽然随温度的下降而降低,但低温一般不破坏酶。温度回升后,酶又恢复活性。临床上低温麻醉就是利用酶的这一性质以减慢组织细 胞代谢速度,提高机体对氧和营养物质缺乏的耐受体,有利于进行手术治疗。 酶的最适温度不是酶的特征性常数,这是因为它与反应所需时间有关,不是一个固定的值。酶可以在短时间内耐受较高的温度,相反,延 长反应时间,最适温度便降低。 五、抑制剂对反应速度的影响 凡能使酶的活性下降而不引起酶蛋白变性的物质称做酶的抑制剂(inhibitor)。使酶变性失活(称为酶的钝化)的因素如强酸、强碱等,不属于 抑制剂。通常抑制作用分为可逆性抑制和不可逆性抑制两类。 (一)不可逆性抑制作用(irreversibleinhibition) 不可逆性抑制作用的抑制剂,通常以共价键方式与酶的必需基团进行不可逆结合而使酶丧失活性,按其作用特点,又有专一性及非专一性 之分。 1.非专一性不可逆抑制 抑制剂与酶分子中一类或几类基团作用,不论是必需基团与否,皆可共价结合,由于其中必需基团也被抑制剂结合,从而导致酶的失活。 某些重金属(Pb++、Cu++、Hg++)及对氯汞苯甲酸等,能与酶分子的巯基进行不可逆适合,许多以巯基作为必需基团的酶(通称巯基酶),会因 此而遭受抑制,属于此种类型。用二巯基丙醇(british anti?lewisite,BAL)或二巯基丁二酸钠等含巯基的化合物可使酶复活

S +%“但g“成Cu“)一()bHg或O)+2H* 、$H s COONa COONa SH Pb +CHSH- CHS H CHSH CHS COONa COONa 二疏基丁二酸钠 2.专一性不可逆抑制 此属抑制剂专一地作用于酶的活性中心或其必需基团,进行共价结合,从而抑制酶的活性。有机磷杀虫剂能专一作用于胆碱酯酶活性中心 的丝氨酸残基,使其磷酰化而不可逆抑制酶的活性。当胆碱酯酶被有机磷杀虫剂抑制后,胆碱能神经未稍分泌的乙酰胆碱不能及时分解,过多 的乙酰胆碱会导致胆碱能神经过度兴奋的症状。解磷定等药物可与有机磷杀虫剂结合,使酶和有机磷杀虫剂分离而复活。 RO、 R0、 +H0-E→ +HX R,0/ OE 有机璃杀虫剂明碱酶麝 磷酰化薛 OR RO 0 -CHNOH- -CHNO OR. OE CH, CH, 瞬酰化 解弹定PAM) 璃陵化PAM (二)可逆性抑制(reversible inhibition) 抑制剂与酶以非共价键结合,在用透析等物理方法除去抑制剂后,酶的活性能恢复,即抑制剂与酶的结合是可逆的。这类抑制剂大致可分 为以下二类。 I.竞争性抑制(competitive inhibition) (1)含义和反应式 抑制剂1和底物S对游离酶E的结合有竞争作用,互相排斥,已结合底物的E$复合体,不能再结合1。同样已结合抑制剂的EI复合体,不能再 结合S. E+Sk -ES K-E+P K + 【KpI (K:抑制常数) 抑制剂1在化学结构上与底物$个相似,能与底物$竞争酶E分子活性中心的结合基团,因此,抑制作用大小取决于抑制剂与底物的浓度比, 加大底物浓度,可使抑制作用减弱。 例如,丙二酸、苹果酸及草酰乙酸皆和琥珀酸的结构相似,是琥珀酸脱氢酶的竞争性抑制剂。 C00 C00- c00- C00 CH: CH C00 CH CH, 联珀酸聪里网 CH, HC +2州 CH: CHOH c00 C00- C00- c00 CX- 虢珀酸 延胡崇酸丙二酸 草酰乙酸 苹果酸 竞争性抑制剂 (2)反应速度公式及作图 按米氏公式推导方法,也可演算出竞争性抑制时,抑制剂、底物和反应速度之间的动力学关系及其双倒数方程式为: V= V[S] K1+晨+ 一(门:抑制剂浓度) =+畏·周+ 以1V分别为横坐标和纵坐标作图,此方程式可绘成竞争性抑制作用的特性曲线(图2·14)
2.专一性不可逆抑制 此属抑制剂专一地作用于酶的活性中心或其必需基团,进行共价结合,从而抑制酶的活性。有机磷杀虫剂能专一作用于胆碱酯酶活性中心 的丝氨酸残基,使其磷酰化而不可逆抑制酶的活性。当胆碱酯酶被有机磷杀虫剂抑制后,胆碱能神经末稍分泌的乙酰胆碱不能及时分解,过多 的乙酰胆碱会导致胆碱能神经过度兴奋的症状。解磷定等药物可与有机磷杀虫剂结合,使酶和有机磷杀虫剂分离而复活。 (二)可逆性抑制(reversible inhibition) 抑制剂与酶以非共价键结合,在用透析等物理方法除去抑制剂后,酶的活性能恢复,即抑制剂与酶的结合是可逆的。这类抑制剂大致可分 为以下二类。 1.竞争性抑制(competitive inhibition) (1)含义和反应式 抑制剂I和底物S对游离酶E的结合有竞争作用,互相排斥,已结合底物的ES复合体,不能再结合I。同样已结合抑制剂的EI复合体,不能再 结合S。 抑制剂I在化学结构上与底物S个相似,能与底物S竞争酶E分子活性中心的结合基团,因此,抑制作用大小取决于抑制剂与底物的浓度比, 加大底物浓度,可使抑制作用减弱。 例如,丙二酸、苹果酸及草酰乙酸皆和琥珀酸的结构相似,是琥珀酸脱氢酶的竞争性抑制剂。 (2)反应速度公式及作图 按米氏公式推导方法,也可演算出竞争性抑制时,抑制剂、底物和反应速度之间的动力学关系及其双倒数方程式为: 以1V分别为横坐标和纵坐标作图,此方程式可绘成竞争性抑制作用的特性曲线(图2-14)

无抑制剂 Vmax 图2.14竞争性抑制 有竞争性抑制剂存在的曲线与无抑制剂的曲线相交于纵坐标/Vmax处,但横坐标的截距,因竞争性抑制存在变小,说明该抑制作用,并不 影响酶促反应的最大速度,而使Km值变大。 很多药物都是酶的竞争性抑制剂。例如磺胺药与对氨基苯甲酸具有类似的结构(如图215),而对氨基苯甲酸、二氢喋呤及谷氨酸是某些细 菌合成二氢叶酸的原料,后者能转变为四氢叶酸,它是细菌合成核酸不可缺少的辅酶。由于磺胺药是二氢叶酸合成酶的竞争性抑制剂,进而减 少菌体内四氢叶酸的合成,使核酸合成障碍,导致细菌死亡。抗菌增效剂甲氧苄氨嘧啶(TMP)能特异地抑制细菌的二氢叶酸还原为四氢叶酸, 故能增强磺胺药的作用。 NH:- COOH NH, SO,NHR 对氨基苯甲酸 胺药 对氨基苯甲酸 二氢喋岭 二氧叶歧合成酶 二氢叶酸二氢叶战还原晓 四氢叶酸 谷氨酸 碳特药(一】 TMP(-) 图2-15磺胺药物的抑菌作用 2.非竞争性抑制(non-competitive inhibition) (1)含义和反应式 抑制剂I和底物$与酶E的结合完全互不相关,既不排斥,也不促进结合,抑制剂1可以和酶E结合生成E1,也可以和ES复合物结合生成ESL。 底物S和酶E结合成ES后,仍可与I结合生成ESI,但一旦形成ESI复合物,再不能释放形成产物P。 E+5= KBS KE+P K 4 Ki Ki (Ki抑制常数) EI+SESI 和$在结构上一般无相似之处,I常与酶分子上结合基团以外的化学基团结合,这种结合并不影响底物和酶的结合,增加底物浓度并不能减 少I对酶的抑制程度。 无构制剂 可 图2-16非竞争性抑制 (2)反应速度公式及作图 按米氏公式推导方法可演算出非竞争性抑制时,抑制剂、底物浓度和反应速度之间动力学关系:
图 2-14 竞争性抑制 有竞争性抑制剂存在的曲线与无抑制剂的曲线相交于纵坐标I/Vmax处,但横坐标的截距,因竞争性抑制存在变小,说明该抑制作用,并不 影响酶促反应的最大速度,而使Km值变大。 很多药物都是酶的竞争性抑制剂。例如磺胺药与对氨基苯甲酸具有类似的结构(如图2-15),而对氨基苯甲酸、二氢喋呤及谷氨酸是某些细 菌合成二氢叶酸的原料,后者能转变为四氢叶酸,它是细菌合成核酸不可缺少的辅酶。由于磺胺药是二氢叶酸合成酶的竞争性抑制剂,进而减 少菌体内四氢叶酸的合成,使核酸合成障碍,导致细菌死亡。抗菌增效剂-甲氧苄氨嘧啶(TMP)能特异地抑制细菌的二氢叶酸还原为四氢叶酸, 故能增强磺胺药的作用。 图2-15 磺胺药物的抑菌作用 2.非竞争性抑制(non-competitive inhibition) (1)含义和反应式 抑制剂I和底物S与酶E的结合完全互不相关,既不排斥,也不促进结合,抑制剂I可以和酶E结合生成EI,也可以和ES复合物结合生成ESI。 底物S和酶E结合成ES后,仍可与I结合生成ESI,但一旦形成ESI复合物,再不能释放形成产物P。 I和S在结构上一般无相似之处,I常与酶分子上结合基团以外的化学基团结合,这种结合并不影响底物和酶的结合,增加底物浓度并不能减 少I对酶的抑制程度。 图2-16 非竞争性抑制 (2)反应速度公式及作图 按米氏公式推导方法可演算出非竞争性抑制时,抑制剂、底物浓度和反应速度之间动力学关系: