
第一节基因表达调控的现象和概念 一、基因表达调控是生命的必需 基因表达(gene expression)是指储存遗传信息的基因经过一系列步骤表现出其生物功能的整个过程。典型的基因表达是基因经过转录、翻 译,产生有生物活性的蛋白质的过程。rRNA或tRNA的基因经转录和转录后加工产生成熟的RNA或tRNA,也是rRNA或tRNA的基因表达,因 为rRNA或tRNA就具有在蛋白质翻译方面的功能。 基因组(genome)是指含有一个生物体生存、发育、活动和繁殖所需要的全部遗传信息的整套核酸。但生物基因组的遗传信息并不是同时全 部都表达出来的,即使极简单的生物(如最简单的病毒),其基因组所含的全部基因也不是以同样的强度同时表达的。大肠杆菌基因组含有约 4000个基因,一般情况下只有5·10%在高水平转录状态,其它基因有的处于较低水平的表达,有的就暂时不表达。哺乳类基因组更复杂,人 的基因组约含有10万个基因,但在一个组织细胞中通常只有一部分基因表达,多数基因处在沉静状态,典型的哺乳类细胞中开放转录的基因约 在1万个上下,即使蛋白质合成量比较多、基因开放比例较高的肝细胞,一般也只有不超过20%的基因处于表达状态。 生物个体的各种组织细胞一般都有相同的染色体数目,每个细胞含的DNA量基本相近。最初经典的遗传学认为只有生殖细胞能够繁衍后 代,随着科学的发展,能将植物的一些体细胞(如叶细胞)培育成为完整的植株,成年山羊的乳腺细胞在适当的条件下也能分化发育成山羊个体 (克隆羊),表明这些体细胞也像生殖细胞一样含有个体发育、生存和繁殖的全部遗传信息。但这些遗传信息的表达是受到严格调控的,通常各 组织细胞只合成其自身结构和功能所需要的蛋白质。不同组织细胞中不仅表达的基因数量不相同,而且基因表达的强度和种类也各不相同,这 就是基因表达的组织特异性(tissue specificity)。例如肝细胞中涉及编码鸟氨酸循环酶类的基因表达水平高于其它组织细胞,合成的某些酶(如 精氨酸酶)为肝脏所特有;胰岛β细胞合成胰岛素;甲状腺滤泡旁细胞(C细胞)专一分泌降血钙素等。细胞特定的基因表达状态,就决定了这个 组织细胞特有的形态和功能。如果基因表达调控发生变化,细胞的形态与功能也会随之改变,例如正常组织细胞转化为癌瘤细胞的过程,就首 先有基因表达方面的改变;人肝细胞在胚胎时期合成甲胎蛋白(alfa?fetal protein,AFP),成年后就很少合成AFP了,但当肝细胞转化成肝窟细 胞时编码AFP的基因又会开放,合成AFP的量会大幅度提高,成为肝癌早期诊断的一个重要指标;人肺组织并不合成降血钙素,但某些肺组织 细胞癌变时,合成降血钙素的基因会开放,能分泌降血钙素,引起血钙降低的症状。 细胞分化发育的不同时期,基因表达的情况是不相同的,这就是基因表达的阶段特异性(stagespecificity)。一个受精卵含有发育成一个成 熟个体的全部遗传信息,在个体发育分化的各个阶段,各种基因极为有序地表达,一般在胚胎时期基因开放的数量最多,随若分化发展,细胞 中某些基因关闭(turn off)、某些基因转向开放(turn on),胚胎发育不同阶段、不同部位的细胞中开放的基因及其开放的程度不一样,合成蛋白 质的种类和数量都不相同,显示出基因表达调控在空间和时间上极高的有序性,从而逐步生成形态与功能各不相同、极为协调、巧妙有序的组 织脏器。即使是同一个细胞,处在不同的细胞周期状态,其基因的表达和蛋白质合成的情况也不尽相同,这种细胞生长过程中基因表达调控的 变化,正是细胞生长繁殖的基础。 从上所述,不难看出:生物的基因表达不是杂乱无章的,而是受着严密、精确调控的,尽我们现在对调控机理的奥妙所知还不多,但已经 可以认识到,不仅生命的遗传信息是生物生存所必需的,而且遗传信息的表达调控也是生命本质所在。 二、基因表达适应环境的变化 生物只有适应环境才能生存。当周围的营养、温度、湿度、酸度等条件变化时,生物体就要改变自身基因表达状况,以调整体内执行相应 功能蛋白质的种类和数量,从而改变自身的代谢、活动等以适应环境。生物体内的基因调控各不相同,仔细观察基因表达随环境变化的情况, 可以大致把基因表达分成两类: ①组成性表达(constitutiveexpression)指不大受环境变动而变化的一类基因表达。其中某些基因表达产物是细胞或生物体整个生命过程中 都持续需要而必不可少的,这类基因可称为看家基因(housekeeping gene),这些基因中不少是在生物个体其它组织细胞、甚至在同一物种的细 胞中都是持续表达的,可以看成是细胞基本的基因表达。组成性基因表达也不是一成不变的,其表达强弱也是受一定机制调控的。 ②适应性表达(adaptiveexpression)指环境的变化容易使其表达水平变动的一类基因表达。应环境条件变化基因表达水平增高的现象称为诱 导(induction),这类基因被称为可诱导的基因(inducible gene);相反,随环境条件变化而基因表达水平降低的现象称为阻遏(repression),相应 的基因被称为可阻遏的基因(repressible gene), 改变基因表达的情况以适应环境,在原核生物、单细胞生物中尤其显得突出和重要,因为细胞的生存环境经常会有剧烈的变化。例如:周 围有充足的葡萄糖,细菌就可以利用葡萄糖作能源和碳源,不必更多去合成利用其它糖类的酶类,当外界没有葡萄糖时,细菌就要适应环境中 存在的其它糖类(如乳糖、半乳糖、阿拉伯糖等),开放能利用这些糖的酶类基因,以满足生长的需要。即使是内环境保持稳定的高等哺乳类, 也经常要变动基因的表达来适应环境,例如与适宜温度下生活相比较,在冷或热环境下适应生活的动物,其肝脏合成的蛋白质图谱就有明显的 不同;长期摄取不同的食物,体内合成代谢酶类的情况也会有所不同。所以,基因表达调控是生物适应环境生存的必需。 第二节原核基因表达调控 细菌能随环境的变化,迅速改变某些基因表达的状态,这就是很好的基因表达调控的实验型。人们就是从研究这种现象开始,打开认识基 因表达调控分子机理的窗口的。 一、操纵元的提出
第一节 基因表达调控的现象和概念 一、基因表达调控是生命的必需 基因表达(gene expression)是指储存遗传信息的基因经过一系列步骤表现出其生物功能的整个过程。典型的基因表达是基因经过转录、翻 译,产生有生物活性的蛋白质的过程。rRNA或tRNA的基因经转录和转录后加工产生成熟的rRNA或tRNA,也是rRNA或tRNA的基因表达,因 为rRNA或tRNA就具有在蛋白质翻译方面的功能。 基因组(genome)是指含有一个生物体生存、发育、活动和繁殖所需要的全部遗传信息的整套核酸。但生物基因组的遗传信息并不是同时全 部都表达出来的,即使极简单的生物(如最简单的病毒),其基因组所含的全部基因也不是以同样的强度同时表达的。大肠杆菌基因组含有约 4000个基因,一般情况下只有5-10%在高水平转录状态,其它基因有的处于较低水平的表达,有的就暂时不表达。哺乳类基因组更复杂,人 的基因组约含有10万个基因,但在一个组织细胞中通常只有一部分基因表达,多数基因处在沉静状态,典型的哺乳类细胞中开放转录的基因约 在1万个上下,即使蛋白质合成量比较多、基因开放比例较高的肝细胞,一般也只有不超过20%的基因处于表达状态。 生物个体的各种组织细胞一般都有相同的染色体数目,每个细胞含的DNA量基本相近。最初经典的遗传学认为只有生殖细胞能够繁衍后 代,随着科学的发展,能将植物的一些体细胞(如叶细胞)培育成为完整的植株,成年山羊的乳腺细胞在适当的条件下也能分化发育成山羊个体 (克隆羊),表明这些体细胞也像生殖细胞一样含有个体发育、生存和繁殖的全部遗传信息。但这些遗传信息的表达是受到严格调控的,通常各 组织细胞只合成其自身结构和功能所需要的蛋白质。不同组织细胞中不仅表达的基因数量不相同,而且基因表达的强度和种类也各不相同,这 就是基因表达的组织特异性(tissue specificity)。例如肝细胞中涉及编码鸟氨酸循环酶类的基因表达水平高于其它组织细胞,合成的某些酶(如 精氨酸酶)为肝脏所特有;胰岛β细胞合成胰岛素;甲状腺滤泡旁细胞(C细胞)专一分泌降血钙素等。细胞特定的基因表达状态,就决定了这个 组织细胞特有的形态和功能。如果基因表达调控发生变化,细胞的形态与功能也会随之改变,例如正常组织细胞转化为癌瘤细胞的过程,就首 先有基因表达方面的改变;人肝细胞在胚胎时期合成甲胎蛋白(alfa?fetal protein, AFP),成年后就很少合成AFP了,但当肝细胞转化成肝癌细 胞时编码AFP的基因又会开放,合成AFP的量会大幅度提高,成为肝癌早期诊断的一个重要指标;人肺组织并不合成降血钙素,但某些肺组织 细胞癌变时,合成降血钙素的基因会开放,能分泌降血钙素,引起血钙降低的症状。 细胞分化发育的不同时期,基因表达的情况是不相同的,这就是基因表达的阶段特异性(stagespecificity)。一个受精卵含有发育成一个成 熟个体的全部遗传信息,在个体发育分化的各个阶段,各种基因极为有序地表达,一般在胚胎时期基因开放的数量最多,随着分化发展,细胞 中某些基因关闭(turn off)、某些基因转向开放(turn on),胚胎发育不同阶段、不同部位的细胞中开放的基因及其开放的程度不一样,合成蛋白 质的种类和数量都不相同,显示出基因表达调控在空间和时间上极高的有序性,从而逐步生成形态与功能各不相同、极为协调、巧妙有序的组 织脏器。即使是同一个细胞,处在不同的细胞周期状态,其基因的表达和蛋白质合成的情况也不尽相同,这种细胞生长过程中基因表达调控的 变化,正是细胞生长繁殖的基础。 从上所述,不难看出:生物的基因表达不是杂乱无章的,而是受着严密、精确调控的,尽我们现在对调控机理的奥妙所知还不多,但已经 可以认识到,不仅生命的遗传信息是生物生存所必需的,而且遗传信息的表达调控也是生命本质所在。 二、基因表达适应环境的变化 生物只有适应环境才能生存。当周围的营养、温度、湿度、酸度等条件变化时,生物体就要改变自身基因表达状况,以调整体内执行相应 功能蛋白质的种类和数量,从而改变自身的代谢、活动等以适应环境。生物体内的基因调控各不相同,仔细观察基因表达随环境变化的情况, 可以大致把基因表达分成两类: ①组成性表达(constitutiveexpression)指不大受环境变动而变化的一类基因表达。其中某些基因表达产物是细胞或生物体整个生命过程中 都持续需要而必不可少的,这类基因可称为看家基因(housekeeping gene),这些基因中不少是在生物个体其它组织细胞、甚至在同一物种的细 胞中都是持续表达的,可以看成是细胞基本的基因表达。组成性基因表达也不是一成不变的,其表达强弱也是受一定机制调控的。 ②适应性表达(adaptiveexpression)指环境的变化容易使其表达水平变动的一类基因表达。应环境条件变化基因表达水平增高的现象称为诱 导(induction),这类基因被称为可诱导的基因(inducible gene);相反,随环境条件变化而基因表达水平降低的现象称为阻遏(repression),相应 的基因被称为可阻遏的基因(repressible gene)。 改变基因表达的情况以适应环境,在原核生物、单细胞生物中尤其显得突出和重要,因为细胞的生存环境经常会有剧烈的变化。例如:周 围有充足的葡萄糖,细菌就可以利用葡萄糖作能源和碳源,不必更多去合成利用其它糖类的酶类,当外界没有葡萄糖时,细菌就要适应环境中 存在的其它糖类(如乳糖、半乳糖、阿拉伯糖等),开放能利用这些糖的酶类基因,以满足生长的需要。即使是内环境保持稳定的高等哺乳类, 也经常要变动基因的表达来适应环境,例如与适宜温度下生活相比较,在冷或热环境下适应生活的动物,其肝脏合成的蛋白质图谱就有明显的 不同;长期摄取不同的食物,体内合成代谢酶类的情况也会有所不同。所以,基因表达调控是生物适应环境生存的必需。 第二节 原核基因表达调控 细菌能随环境的变化,迅速改变某些基因表达的状态,这就是很好的基因表达调控的实验型。人们就是从研究这种现象开始,打开认识基 因表达调控分子机理的窗口的。 一、操纵元的提出

大肠杆菌可以利用萄萄糖、乳糖、麦芽糖、阿拉伯糖等作为碳源而生长繁殖。当培养基中有萄萄糖和乳糖时,细菌优先使用萄萄糖,当萄 萄糖耗尽,细菌停止生长,经过短时间的适应,就能利用乳糖,细菌继续呈指数式繁殖增长(图19·)。 氧菌生长自规 6m H 手一伞乳能年酸 卡见等 00H. o 时 图19-1大肠杆茵菌二阶段生长现象图19-2B半乳糖苷衡的作用 大肠杆菌利用乳糖至少需要两个酶:促使乳糖进入细菌的乳糖透过酶(lactose permease)催化乳糖分解第一步的B·半乳糖苷酶(B- galactosidase)(19-2). 在环境中没有乳糖或其他邹半乳糖苷时,大肠杆菌合成β半乳糖苷酶量极少,加入乳糖2·3分钟后,细菌大量合成那-半乳糖苷酶,其量可 提高干倍以上,在以乳糖作为唯一碳源时,菌体内的邹半乳糖苷酶量可占到细菌总蛋白量的3%。在上述二阶段生长细菌利用乳糖再次繁殖前, 也能测出细菌中阝半乳糖苷酶活性显著增高的过程。这种典型的诱导现象,是研究基因表达调控的极好模型。 图19-3 Jacobi和Monod提出的lacoperon模 针对大肠杆菌利用乳糖的适应现象,法国的Jacobi和Monod等人做了一系列遗传学和生化学研究实验,于1961年提出乳糖操纵元(lac operor)学说,如图19.3所示。图19.3中z、a和b型是大肠杆菌编码利用乳糖所需酶类的基因,p是转录z、a、b所需要的启动子,调控基因编码 合成调控蛋白R,R能与0结合而阻碍从p开始的基因转录,所以o就是调节基因开放的操纵序列,乳糖能改变R结构使其不能与结合,因而乳糖 浓度增高时基因就开放,转录合成所编码的酶类,这样大肠杆菌就能适应外界乳糖供应的变化而改变利用乳糖的状况,这个模型是人们在科学 实验的基础上第一次开始认识基因表达调控的分子机理。 二、操纵元(operon)的基本组成 乳糖操纵元模型被以后的许多研究实验所证实,对其有了更深入的认识,并且发现其他原核生物基因调控也有类似的操纵元组织,操纵元 是原核基因表达调控的一种重要的组织形式,大肠杆菌的基因多数以操纵元的形式组成基因表达调控的单元。下面就以半乳糖操纵元为例子说 明操纵元的最基本的组成组件(elements), (一)结构基因群 操纵元中被调控的编码蛋白质的基因可称为结构基因((structural gene,SG)。一个操纵元中含有2个以上的结构基因,多的可达十几个。每 个结构基因是一个连续的开放读框(open reading frame),5'端有翻译起始码(DNA存储链上是ATG,转录成mRNA就是AUG),3端有翻译终止 码(DNA存储链上是TAA、TGA或TAG,转录成mRNA就是UAA、UGA或UAG)。各结构基因头尾衔接、串连排列,组成结构基因群。至少在 第一个结构基因5'侧具有核糖体结合位点(ribosome binding site,RBS),因而当这段含多个结构基因的DNA被转录成多顺反子mRNA,就能被核 糖体所识别结合、并起始翻译。核糖体沿mRNA移动;在合成完第一个编码的多肽后,核糖体可以不脱离mRNA而继续翻译合成下一个基因编 码的多肽,直至合成完这条多顺反子mRNA所编码的全部多肽。 乳糖操纵元含有z、y和a三个结构基因。z基因长3510bp,编码含1170个氨基酸、分子量为135,000的多肽,以四聚体形式组成有活性的β -半乳糖苷酶,催化乳糖转变为别乳糖(allolactose),再分解为半乳糖和萄萄糖;y基因长780bp,编码由260个氨基酸组成、分子量30?000的 半乳糖透过酶,促使环境中的乳糖进入细菌:基因长825bp,编码含275氨基酸、分子量为32?000的转乙酰基酶,以二聚体活性形式催化半乳 糖的乙酰化。z基因s'侧具有大肠杆菌核糖体识别结合位点((ribosome binding site,RBS)特征的Shine?Dalgarno(SD)序列,因而当乳糖操纵元开 放时,核糖体能结合在转录产生的mRNA上。由于z、y、a三个基因头尾相接,上一个基因的翻译终止码靠近下一个基因的翻译起始码,因而 同一个核糖体能沿此转录生成的多顺反子(polycistron)mRNA移动,在翻译合成了上一个基因编码的蛋白质后,不从mRNA上掉下来而继续沿 mRNA移动合成下一个基因编码的蛋白质,一气依次合成基因群所编码的所有蛋白质。 (二)启动子 启动子(promoter,P)是指能被RNA聚合酶识别、结合并启动基因转录的一段DNA序列。操纵元至少有一个启动子,一般在第一个结构基 因5'侧上游,控制整个结构基因群的转录。?用RNA聚合酶与分离的一段DNA双链混合,再加入外切核酸酶去水解DNA,结果只有被RNA聚合 酶识别结合而被保护的那段DNA不被水解,由此可以测出启动子的范围及其序列。虽然不同的启动子序列有所不同,但比较已经研究过的上百 种原核生物的启动子的序列,发现有一些共同的规律,它们一般长40·60bp,含A裙碱基对较多,某些段落是很相似的,这些相似的保守性段 落称为共有性序列(consensus sequences)。如图19.4所示,启动子一般可分为识别(R,recognition)、结合(B,binding)和起始(L,initiation)三个区 段。转录起始第一个碱基(通常标记位置为+I)最常见的是A;在·1Obp附近有TATAAT一组共有序列,因为这段共有序列是Pribnow首先发现 的,称为Pribnow盒(Pribnow box);在·3Sbp处又有TTGACA一组共有序列。 启动子名称 -35区 -10区 +1 ......TTGACA...... N17......TTAACT... N7......A..... Ptyr-tRNA .....TTTACA..... N16......TATGAT.. N7G…
大肠杆菌可以利用葡萄糖、乳糖、麦芽糖、阿拉伯糖等作为碳源而生长繁殖。当培养基中有葡萄糖和乳糖时,细菌优先使用葡萄糖,当葡 萄糖耗尽,细菌停止生长,经过短时间的适应,就能利用乳糖,细菌继续呈指数式繁殖增长(图19-1)。 图19-1 大肠杆菌二阶段生长现象 图19-2 β-半乳糖苷酶的作用 大肠杆菌利用乳糖至少需要两个酶:促使乳糖进入细菌的乳糖透过酶(lactose permease)催化乳糖分解第一步的β-半乳糖苷酶(β- galactosidase)(图19-2)。 在环境中没有乳糖或其他β-半乳糖苷时,大肠杆菌合成β-半乳糖苷酶量极少,加入乳糖2-3分钟后,细菌大量合成β-半乳糖苷酶,其量可 提高千倍以上,在以乳糖作为唯一碳源时,菌体内的β-半乳糖苷酶量可占到细菌总蛋白量的3%。在上述二阶段生长细菌利用乳糖再次繁殖前, 也能测出细菌中β-半乳糖苷酶活性显著增高的过程。这种典型的诱导现象,是研究基因表达调控的极好模型。 图19-3 Jacob和Monod提出的lacoperon模 针对大肠杆菌利用乳糖的适应现象,法国的Jacob和Monod等人做了一系列遗传学和生化学研究实验,于1961年提出乳糖操纵元(lac operon)学说,如图19-3所示。图19-3中z、a和b型是大肠杆菌编码利用乳糖所需酶类的基因,p是转录z、a、b所需要的启动子,调控基因i编码 合成调控蛋白R,R能与o结合而阻碍从p开始的基因转录,所以o就是调节基因开放的操纵序列,乳糖能改变R结构使其不能与o结合,因而乳糖 浓度增高时基因就开放,转录合成所编码的酶类,这样大肠杆菌就能适应外界乳糖供应的变化而改变利用乳糖的状况,这个模型是人们在科学 实验的基础上第一次开始认识基因表达调控的分子机理。 二、操纵元(operon)的基本组成 乳糖操纵元模型被以后的许多研究实验所证实,对其有了更深入的认识,并且发现其他原核生物基因调控也有类似的操纵元组织,操纵元 是原核基因表达调控的一种重要的组织形式,大肠杆菌的基因多数以操纵元的形式组成基因表达调控的单元。下面就以半乳糖操纵元为例子说 明操纵元的最基本的组成组件(elements)。 (一)结构基因群 操纵元中被调控的编码蛋白质的基因可称为结构基因(structural gene, SG)。一个操纵元中含有2个以上的结构基因,多的可达十几个。每 个结构基因是一个连续的开放读框(open reading frame),5′端有翻译起始码(DNA存储链上是ATG,转录成mRNA就是AUG),3′端有翻译终止 码(DNA存储链上是TAA、TGA或TAG,转录成mRNA就是UAA、UGA或UAG)。各结构基因头尾衔接、串连排列,组成结构基因群。至少在 第一个结构基因5′侧具有核糖体结合位点(ribosome binding site, RBS),因而当这段含多个结构基因的DNA被转录成多顺反子mRNA,就能被核 糖体所识别结合、并起始翻译。核糖体沿mRNA移动;在合成完第一个编码的多肽后,核糖体可以不脱离mRNA而继续翻译合成下一个基因编 码的多肽,直至合成完这条多顺反子mRNA所编码的全部多肽。 乳糖操纵元含有z、y和a三个结构基因。z基因长3510bp,编码含1170个氨基酸、分子量为135,000的多肽,以四聚体形式组成有活性的β -半乳糖苷酶,催化乳糖转变为别乳糖(allolactose),再分解为半乳糖和葡萄糖;y基因长780bp,编码由260个氨基酸组成、分子量30?000的 半乳糖透过酶,促使环境中的乳糖进入细菌;a基因长825bp,编码含275氨基酸、分子量为32?000的转乙酰基酶,以二聚体活性形式催化半乳 糖的乙酰化。z基因5′侧具有大肠杆菌核糖体识别结合位点(ribosome binding site, RBS)特征的Shine?Dalgarno(SD)序列,因而当乳糖操纵元开 放时,核糖体能结合在转录产生的mRNA上。由于z、y、a三个基因头尾相接,上一个基因的翻译终止码靠近下一个基因的翻译起始码,因而 同一个核糖体能沿此转录生成的多顺反子(polycistron)mRNA移动,在翻译合成了上一个基因编码的蛋白质后,不从mRNA上掉下来而继续沿 mRNA移动合成下一个基因编码的蛋白质,一气依次合成基因群所编码的所有蛋白质。 (二)启动子 启动子(promoter,P)是指能被RNA聚合酶识别、结合并启动基因转录的一段DNA序列。操纵元至少有一个启动子,一般在第一个结构基 因5′侧上游,控制整个结构基因群的转录。?用RNA聚合酶与分离的一段DNA双链混合,再加入外切核酸酶去水解DNA,结果只有被RNA聚合 酶识别结合而被保护的那段DNA不被水解,由此可以测出启动子的范围及其序列。虽然不同的启动子序列有所不同,但比较已经研究过的上百 种原核生物的启动子的序列,发现有一些共同的规律,它们一般长40-60bp,含A桾碱基对较多,某些段落是很相似的,这些相似的保守性段 落称为共有性序列(consensus sequences)。如图19-4所示,启动子一般可分为识别(R,recognition)、结合(B,binding)和起始(I, initiation)三个区 段。转录起始第一个碱基(通常标记位置为+1)最常见的是A;在-10bp附近有TATAAT一组共有序列,因为这段共有序列是Pribnow首先发现 的,称为Pribnow盒(Pribnow box);在-35bp处又有TTGACA一组共有序列 。 启动子名称 -35区 -10区 +1 P trp ……TTGACA…… N17……TTAACT… N7……A…… P tyr-tRNA ……TTTACA…… N16……TATGAT… N7…G……

Plac ......TTGACA N17......TATGTT N7.A. PrecA ......CTGATG...... N17......TATAAT.. N7..A.. Para .TTGACA. N17......TACTGT. N7..A. APR .TGACA.. N17......GATAAT... N6A… APL TGACA. N17......GATACT.. N6A… T7A2 .....TGACA.. N17......TACGAT. N6A.… favⅢ ......TTGACA..... N17......TATAAT... N6..G.. RNA聚合陈保护区 翻泽起始 -35☒ -10区 一+1 PpG转录开始 图19.4原核生物基因转录起始区 不同的启动子序列不同,与RNA聚合酶的亲和力不同,启动转录的频率高低不同,即不同的启动子起动基因转录的强弱不同,例如:PL、 PR、P?T7属强启动子,而P1ac则是较弱的启动. (三)操纵子 操纵子(operator)是指能被调控蛋白特异性结合的一段DNA序列,常与启动子邻近或与启动子序列重叠,当调控蛋白结合在操纵子序列 上,会影响其下游基因转录的强弱。以前许多书中将操纵子称为操纵基因(operator gene)。但现在基因定义是为蛋白质编码的核酸序列,而操 纵序列并不是编码蛋白质的基因,却是起着调控基因表达强弱的作用,正如启动序列不叫启动基因而称为启动子一样,操纵序列就可称为操纵 子。以前将operor译为操纵子则可改译为操纵元,即基因表达操纵的单元之意. 举乳糖操纵元中的操纵子为例,如图19·5所示,其操纵子(o)序列位于启动子()与被调控的基因之间,部分序列与启动子序列重叠。仔细 分析该操纵子序列,可见这段双链DNA具有回文(palindrome)样的对称性一级结构,能形成十字形的茎环(stem loop)构造。不少操纵子都具有 类似的对称性序列,可能与特定蛋白质的结合相关。 图评起始 浴器品 0区 -84 “67 -2 mRNA P区 转录起帕 0区序列 -10 -7 -1+1 +10 +20 +30 □口几口n「 TGTTGTGTGGAATTGTGAGCGGATAACAATTTCACACAGG ACAACACACOTTAACACICOCCTATTGTTAAAGTGTGTCC 转录起始点 对称辅 图19-5乳糖操纵元的P.0区及0区序列 阻遏蛋白与操纵子结合,就妨碍了RNA聚合酶与启动子的结合及其后阝·半乳糖苷酶等基因的转录起始,从而阻遏了这群基因的表达。最 早只把与阻遏蛋白结合、起阻遏作用的序列称为操纵子,但其后发现有的操纵元中同一操纵序列与不同构像的蛋白质结合,可以分别起阻遏或 激活基因表达的作用,阿拉伯糖操纵元中的序列就是典型的例子。因而凡能与调控蛋白特异性结合、从而影响基因转录强弱的序列,不论其对 基因转录的作用是减弱、阻止或增强、开放,都可称为操纵子。 四)调控基因 调控基因(regulatorygene)是编码能与操纵序列结合的调控蛋白的基因。与操纵子结合后能减弱或阻止其调控基因转录的调控蛋白称为阻遏 蛋白(repressive protein),其介导的调控方式称为负性调控(negativeregulation);与操纵子结合后能增强或起动调控基因转录的调控蛋白称为 激活蛋白(activatingprotein),所介导的调控方式称为正性调控(positive regulation)。 某些特定的物质能与调控蛋白结合,使调控蛋白的空间构像发生变化,从而改变其对基因录的影响,这些特定物质可称为效应物 (effector),其中凡能引起诱导发生的分子称为诱导剂(inducer),能导致阻遏发生的分子称为阻遏剂或辅助阻遏剂(corepressor)。 例如在乳糖操纵元中,调控基因1cl位于P1ac邻近,有其自身的启动子和终止子,转录方向和结构基因群的转录方向一致,编码产生由 347个氨基酸组成的调控蛋白R,在环境没有乳糖存在的情况下,R形成分子量为152000的活性四聚体,能特异地与操纵子o紧密结合,从而阻 止利用乳糖的酶类基因的转录,所以R是乳糖操纵元的阻遏蛋白:当环境中有足够的乳糖时,乳糖受B,半乳糖苷酶作用转变为别乳糖,别乳糖 与R结合,使R的空间构像变化,四聚体解聚成单体,失去与操纵子特异性紧密结合的能力,从而解除了阻遏蛋白的作用,使其后的基因得以 转录合成利用乳糖的酶类。在这过程中乳糖(实际起作用的是别乳糖)就是诱导剂,与R结合起到去阻遏作用(derepression),诱导了利用乳糖的 酶类基因转录开放。 许多调控蛋白都是变构蛋白(allostericprotein),通过与上述类似的方式与效应物结合变空间构像,从而改变活性,起到调节基因转录表达 的作用。 (五)终止子 终止子(terminatorT)是给予RNA聚合酶转录终止信号的DNA序列。在一个操纵元中至少在构基因群最后一个基因的后面有一个终止子
P lac ……TTGACA…… N17……TATGTT… N7…A…… P recA ……CTGATG…… N17……TATAAT… N7…A…… P ara ……TTGACA…… N17……TACTGT… N7…A…… λPR ……TTGACA…… N17……GATAAT… N6…A…… λPL ……TTGACA…… N17……GATACT… N6…A…… T7 A2 ……TTGACA…… N17……TACGAT… N6…A…… fd Ⅷ ……TTGACA…… N17……TATAAT… N6…G…… 图19-4 原核生物基因转录起始区 不同的启动子序列不同,与RNA聚合酶的亲和力不同,启动转录的频率高低不同,即不同的启动子起动基因转录的强弱不同,例如:PL、 PR、P?T7属强启动子,而P1ac则是较弱的启动。 (三)操纵子 操纵子(operator)是指能被调控蛋白特异性结合的一段DNA序列,常与启动子邻近或与启动子序列重叠,当调控蛋白结合在操纵子序列 上,会影响其下游基因转录的强弱。以前许多书中将操纵子称为操纵基因(operator gene)。但现在基因定义是为蛋白质编码的核酸序列,而操 纵序列并不是编码蛋白质的基因,却是起着调控基因表达强弱的作用,正如启动序列不叫启动基因而称为启动子一样,操纵序列就可称为操纵 子。以前将operon译为操纵子则可改译为操纵元,即基因表达操纵的单元之意。 举乳糖操纵元中的操纵子为例,如图19-5所示,其操纵子(o)序列位于启动子(p)与被调控的基因之间,部分序列与启动子序列重叠。仔细 分析该操纵子序列,可见这段双链DNA具有回文(palindrome)样的对称性一级结构,能形成十字形的茎环(stem loop)构造。不少操纵子都具有 类似的对称性序列,可能与特定蛋白质的结合相关。 图19-5 乳糖操纵元的P-O区及O区序列 阻遏蛋白与操纵子结合,就妨碍了RNA聚合酶与启动子的结合及其后β-半乳糖苷酶等基因的转录起始,从而阻遏了这群基因的表达。最 早只把与阻遏蛋白结合、起阻遏作用的序列称为操纵子,但其后发现有的操纵元中同一操纵序列与不同构像的蛋白质结合,可以分别起阻遏或 激活基因表达的作用,阿拉伯糖操纵元中的序列就是典型的例子。因而凡能与调控蛋白特异性结合、从而影响基因转录强弱的序列,不论其对 基因转录的作用是减弱、阻止或增强、开放,都可称为操纵子。 (四)调控基因 调控基因(regulatorygene)是编码能与操纵序列结合的调控蛋白的基因。与操纵子结合后能减弱或阻止其调控基因转录的调控蛋白称为阻遏 蛋白(repressive protein),其介导的调控方式称为负性调控(negativeregulation);与操纵子结合后能增强或起动调控基因转录的调控蛋白称为 激活蛋白(activatingprotein),所介导的调控方式称为正性调控(positive regulation)。 某些特定的物质能与调控蛋白结合,使调控蛋白的空间构像发生变化,从而改变其对基因录的影响,这些特定物质可称为效应物 (effector),其中凡能引起诱导发生的分子称为诱导剂(inducer),能导致阻遏发生的分子称为阻遏剂或辅助阻遏剂(corepressor)。 例如在乳糖操纵元中,调控基因1acI位于P1ac邻近,有其自身的启动子和终止子,转录方向和结构基因群的转录方向一致,编码产生由 347个氨基酸组成的调控蛋白R,在环境没有乳糖存在的情况下,R形成分子量为152000的活性四聚体,能特异地与操纵子o紧密结合,从而阻 止利用乳糖的酶类基因的转录,所以R是乳糖操纵元的阻遏蛋白;当环境中有足够的乳糖时,乳糖受β-半乳糖苷酶作用转变为别乳糖,别乳糖 与R结合,使R的空间构像变化,四聚体解聚成单体,失去与操纵子特异性紧密结合的能力,从而解除了阻遏蛋白的作用,使其后的基因得以 转录合成利用乳糖的酶类。在这过程中乳糖(实际起作用的是别乳糖)就是诱导剂,与R结合起到去阻遏作用(derepression),诱导了利用乳糖的 酶类基因转录开放。 许多调控蛋白都是变构蛋白(allostericprotein),通过与上述类似的方式与效应物结合变空间构像,从而改变活性,起到调节基因转录表达 的作用。 (五)终止子 终止子(terminatorT)是给予RNA聚合酶转录终止信号的DNA序列。在一个操纵元中至少在构基因群最后一个基因的后面有一个终止子
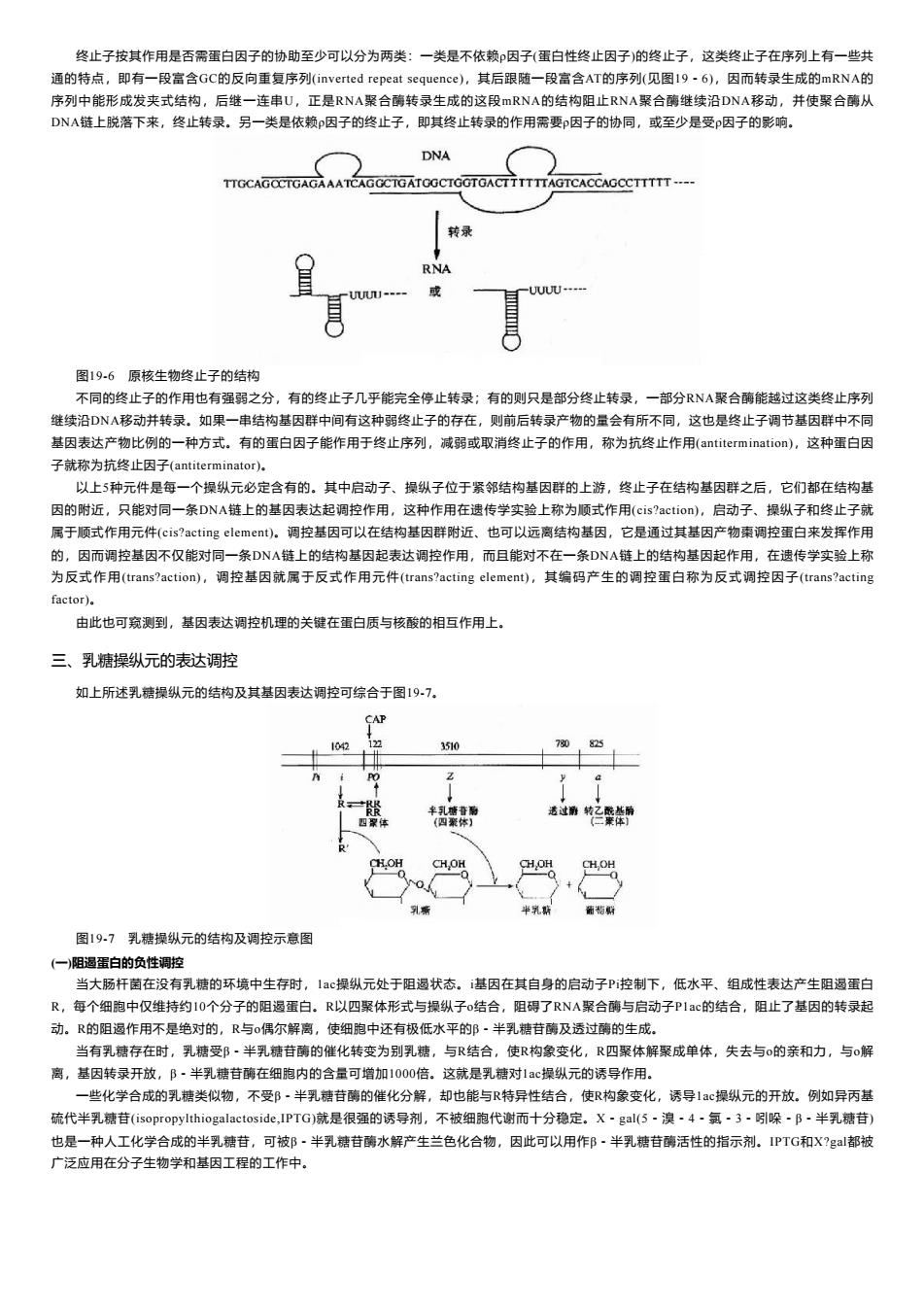
终止子按其作用是否需蛋白因子的协助至少可以分为两类:一类是不依赖因子(蛋白性终止因子)的终止子,这类终止子在序列上有一些共 通的特点,即有一段富含GC的反向重复序列(inverted repeat sequence),其后跟随一段富含AT的序列(见图19~6),因而转录生成的mRNA的 序列中能形成发夹式结构,后继一连串U,正是RNA聚合酶转录生成的这段mRNA的结构阻止RNA聚合酶继续沿DNA移动,并使聚合酶从 DNA链上脱落下来,终止转录。另一类是依赖p因子的终止子,即其终止转录的作用需要p因子的协同,或至少是受因子的影响. DNA TTGCAGOCTGAGAAATCAGGCTGATOGCTGGTGACTTTTTTAGTCACCAGCCTTTTT---- 转录 RNA --- ---- 图19-6原核生物终止子的结构 不同的终止子的作用也有强弱之分,有的终止子几乎能完全停止转录:有的则只是部分终止转录,一部分RNA聚合酶能越过这类终止序列 继续沿DNA移动并转录。如果一串结构基因群中间有这种弱终止子的存在,则前后转录产物的量会有所不同,这也是终止子调节基因群中不同 基因表达产物比例的一种方式。有的蛋白因子能作用于终止序列,减弱或取消终止子的作用,称为抗终上作用(antitermination),这种蛋白因 子就称为抗终止因子(antiterminator). 以上5种元件是每一个操纵元必定含有的。其中启动子、操纵子位于紧邻结构基因群的上游,终止子在结构基因群之后,它们都在结构基 因的附近,只能对同一条DNA链上的基因表达起调控作用,这种作用在遗传学实验上称为顺式作用(cis?action),启动子、操纵子和终止子就 属于顺式作用元件(cis?acting element)。调控基因可以在结构基因群附近、也可以远离结构基因,它是通过其基因产物索调控蛋白来发挥作用 的,因而调控基因不仅能对同一条DNA链上的结构基因起表达调控作用,而且能对不在一条DNA链上的结构基因起作用,在遗传学实验上称 为反式作用(trans?action),调控基因就属于反式作用元件(trans?acting element),其编码产生的调控蛋白称为反式调控因子(trans?acting factor). 由此也可窥测到,基因表达调控机理的关键在蛋白质与核酸的相互作用上。 三、乳糖操纵元的表达调控 如上所述乳糖操纵元的结构及其基因表达调控可综合于图197。 CAP 3510 78 (四聚体】 过转名聚 CH.OH CH,OH CH,OH 乳帮 葡萄期 图19-7乳糖操纵元的结构及调控示意图 (一)阻遏蛋白的负性调控 当大肠杆菌在没有乳糖的环境中生存时,1c操纵元处于阻遏状态。i基因在其自身的启动子P控制下,低水平、组成性表达产生阻遏蛋白 R,每个细胞中仅维持约10个分子的阻遏蛋白。R以四聚体形式与操纵子o结合,阻碍了RNA聚合酶与启动子PIc的结合,阻止了基因的转录起 动。R的阻遏作用不是绝对的,R与o偶尔解离,使细胞中还有极低水平的邹·半乳糖苷酶及透过酶的生成. 当有乳糖存在时,乳糖受邹·半乳糖苷酶的催化转变为别乳糖,与R结合,使R构象变化,R四聚体解聚成单体,失去与o的亲和力,与o解 离,基因转录开放,阝·半乳糖苷酶在细胞内的含量可增加1000倍。这就是乳糖对1c操纵元的诱导作用。 一些化学合成的乳糖类似物,不受B·半乳糖苷酶的催化分解,却也能与R特异性结合,使R构象变化,诱导1c操纵元的开放。例如异丙基 硫代半乳糖苷(isopropylthiogalactoside,IPTG)就是很强的诱导剂,不被细胞代谢而十分稳定。X-gal(5·溴·4·氯·3·吲哚-B-半乳糖苷) 也是一种人工化学合成的半乳糖苷,可被B·半乳糖苷酶水解产生兰色化合物,因此可以用作B·半乳糖苷酶活性的指示剂。PTG和X?g都被 广泛应用在分子生物学和基因工程的工作中
终止子按其作用是否需蛋白因子的协助至少可以分为两类:一类是不依赖ρ因子(蛋白性终止因子)的终止子,这类终止子在序列上有一些共 通的特点,即有一段富含GC的反向重复序列(inverted repeat sequence),其后跟随一段富含AT的序列(见图19-6),因而转录生成的mRNA的 序列中能形成发夹式结构,后继一连串U,正是RNA聚合酶转录生成的这段mRNA的结构阻止RNA聚合酶继续沿DNA移动,并使聚合酶从 DNA链上脱落下来,终止转录。另一类是依赖ρ因子的终止子,即其终止转录的作用需要ρ因子的协同,或至少是受ρ因子的影响。 图19-6 原核生物终止子的结构 不同的终止子的作用也有强弱之分,有的终止子几乎能完全停止转录;有的则只是部分终止转录,一部分RNA聚合酶能越过这类终止序列 继续沿DNA移动并转录。如果一串结构基因群中间有这种弱终止子的存在,则前后转录产物的量会有所不同,这也是终止子调节基因群中不同 基因表达产物比例的一种方式。有的蛋白因子能作用于终止序列,减弱或取消终止子的作用,称为抗终止作用(antitermination),这种蛋白因 子就称为抗终止因子(antiterminator)。 以上5种元件是每一个操纵元必定含有的。其中启动子、操纵子位于紧邻结构基因群的上游,终止子在结构基因群之后,它们都在结构基 因的附近,只能对同一条DNA链上的基因表达起调控作用,这种作用在遗传学实验上称为顺式作用(cis?action),启动子、操纵子和终止子就 属于顺式作用元件(cis?acting element)。调控基因可以在结构基因群附近、也可以远离结构基因,它是通过其基因产物棗调控蛋白来发挥作用 的,因而调控基因不仅能对同一条DNA链上的结构基因起表达调控作用,而且能对不在一条DNA链上的结构基因起作用,在遗传学实验上称 为反式作用(trans?action),调控基因就属于反式作用元件(trans?acting element),其编码产生的调控蛋白称为反式调控因子(trans?acting factor)。 由此也可窥测到,基因表达调控机理的关键在蛋白质与核酸的相互作用上。 三、乳糖操纵元的表达调控 如上所述乳糖操纵元的结构及其基因表达调控可综合于图19-7。 图19-7 乳糖操纵元的结构及调控示意图 (一)阻遏蛋白的负性调控 当大肠杆菌在没有乳糖的环境中生存时,1ac操纵元处于阻遏状态。i基因在其自身的启动子Pi控制下,低水平、组成性表达产生阻遏蛋白 R,每个细胞中仅维持约10个分子的阻遏蛋白。R以四聚体形式与操纵子o结合,阻碍了RNA聚合酶与启动子P1ac的结合,阻止了基因的转录起 动。R的阻遏作用不是绝对的,R与o偶尔解离,使细胞中还有极低水平的β-半乳糖苷酶及透过酶的生成。 当有乳糖存在时,乳糖受β-半乳糖苷酶的催化转变为别乳糖,与R结合,使R构象变化,R四聚体解聚成单体,失去与o的亲和力,与o解 离,基因转录开放,β-半乳糖苷酶在细胞内的含量可增加1000倍。这就是乳糖对1ac操纵元的诱导作用。 一些化学合成的乳糖类似物,不受β-半乳糖苷酶的催化分解,却也能与R特异性结合,使R构象变化,诱导1ac操纵元的开放。例如异丙基 硫代半乳糖苷(isopropylthiogalactoside,IPTG)就是很强的诱导剂,不被细胞代谢而十分稳定。X-gal(5-溴-4-氯-3-吲哚-β-半乳糖苷) 也是一种人工化学合成的半乳糖苷,可被β-半乳糖苷酶水解产生兰色化合物,因此可以用作β-半乳糖苷酶活性的指示剂。IPTG和X?gal都被 广泛应用在分子生物学和基因工程的工作中

B一半乳能苷链 CH.OH H0木-Q, OH HOCH, 乳渐 B一半乳籍苷满 CHOH CH, 年H,OH H -OS C-H HO -0 OH ●1, IPTG OH X- 图19-8乳糖,IPTG和X?gal的结构 (二)CAP的正性调控 细菌中的cAMP含量与萄萄糖的分解代谢有关,当细菌利用萄萄糖分解供给能量时,cAMP生成少而分解多,cAMP含量低:相反,当环境 中无葡萄糖可供利用时,cAMP含量就升高。细菌中有一种能与cAMP特异结合的cAMP受体蛋白CRP(cAMp receptor protein),当CRP未与 cAMP结合时它是没有活性的,当cAMP浓度升高时,CRP与cAMP结合并发生空间构象的变化而活化,称为CAP(CRP?cAMp activated protein),能以二聚体的方式与特定的DNA序列结合. 在Iac操纵元的启动子PIac上游端有一段与PIac部分重叠的序列,能与CAP特异结合,称为CAP结合位点(CApbinding site)。CAP与这段序 列结合时,可增强RNA聚合酶的转录活性,使转录提高50倍。相反,当有葡萄糖可供分解利用时,cAMP浓度降低,CRP不能被活化,Ic操 纵元的结构基因表达下降。 截藏被糖→+++→降解产物 ⊙ ① ATP- -cAMP- 5'AMP CRP CAP (非活性状态) 一(活性状态) y 图199葡萄糖利用对乳糖操纵元的影响 由于Plac是弱启动子,单纯因乳糖的存在发生去阻遏使1ac操纵元转录开放,还不能使细胞很好利用乳糖,必须同时有CAP来加强转录活 性,细菌才能合成足够的酶来利用乳糖。1c操纵元的强诱导既需要有乳糖的存在,又需要没有葡萄糖可供利用。通过这种机制,细菌优先利 用环境中的葡萄糖,只有无葡萄糖而又有乳糖时,细菌才去充分利用乳糖。 细菌对葡萄糖以外的其他糖(如阿拉伯糖、半乳糖、麦芽糖等)的利用上也有类似对乳糖利的情况,在含有编码利用阿拉伯糖的酶类基因群 的阿拉伯糖操纵元(araoperon)、半乳糖操纵元(gal operon)中也有CAP结合位点,CAP也起类似的正性调控作用。所以CAP的通用名称是分解 代谢基因激活蛋白(catabolic gene activator protein)。 不难看出:CAP结合位点就是一种起正性调控作用的操纵子,CAP则是对转录起正性作用的控蛋白索激活蛋白,编码CRP的基因也是一个 调控基因,不过它并不在1c操纵元的附近,CAP可以对几个操纵元都起作用。 从上所述,乳糖操纵元属于可诱导操纵元(inducible operon),这类操纵元通常是关闭的,当受效应物作用后诱导开放转录。这类操纵元使 细菌能适应环境的变化,最有效地利用环境能提供的能源底物。 四、色氨酸操纵元 色氨酸是构成蛋白质的组分,一般的环境难以给细菌提供足够的色氨酸,细菌要生存繁殖通常需要自己经过许多步骤合成色氨酸,但是一 旦环境能够提供色氨酸时,细菌就会充分利用外界的色氨酸、减少或停止合成色氨酸,以减轻自己的负担。细菌所以能做到这点是因为有色氨 酸操纵元(trp operon)的调控。 (一)色氨酸操纵元的结构与阻遏蛋白的负性调控 如图19-10所示,合成色氨酸所需要酶类的基因E、D、C、B、A等头尾相接串连排列组成结构基因群,受其上游的启动子P虹和操纵子o的 调控,调控基因pR的位置远离P-o-结构基因群,在其自身的启动子作用下,以组成性方式低水平表达分子量为47000的调控蛋白R。R并没有 与0结合的活性,当环境能提供足够浓度的色氨酸时,R与色氨酸结合后构象变化而活化,就能够与0特异性亲和结合,阻遏结构基因的转录, 因此这是属于一种负性调控的、可阻遏的操纵元(repressible operon),即这操纵元通常是开放转录的,当有效应物(色氨酸为阻遏剂)作用时, 则阻遏关闭转录。细菌不少生物合成系统的操纵元都属于这种类型,其调控可使细菌处在生存繁殖最经济最节省的状态
图19-8 乳糖,IPTG和X?gal的结构 (二)CAP的正性调控 细菌中的cAMP含量与葡萄糖的分解代谢有关,当细菌利用葡萄糖分解供给能量时,cAMP生成少而分解多,cAMP含量低;相反,当环境 中无葡萄糖可供利用时,cAMP含量就升高。细菌中有一种能与cAMP特异结合的cAMP受体蛋白CRP(cAMp receptor protein),当CRP未与 cAMP结合时它是没有活性的,当cAMP浓度升高时,CRP与cAMP结合并发生空间构象的变化而活化,称为CAP(CRP?cAMp activated protein),能以二聚体的方式与特定的DNA序列结合。 在1ac操纵元的启动子P1ac上游端有一段与Plac部分重叠的序列,能与CAP特异结合,称为CAP结合位点(CApbinding site)。CAP与这段序 列结合时,可增强RNA聚合酶的转录活性,使转录提高50倍。相反,当有葡萄糖可供分解利用时,cAMP浓度降低,CRP不能被活化,1ac操 纵元的结构基因表达下降。 图19-9 葡萄糖利用对乳糖操纵元的影响 由于P1ac是弱启动子,单纯因乳糖的存在发生去阻遏使1ac操纵元转录开放,还不能使细胞很好利用乳糖,必须同时有CAP来加强转录活 性,细菌才能合成足够的酶来利用乳糖。1ac操纵元的强诱导既需要有乳糖的存在,又需要没有葡萄糖可供利用。通过这种机制,细菌优先利 用环境中的葡萄糖,只有无葡萄糖而又有乳糖时,细菌才去充分利用乳糖。 细菌对葡萄糖以外的其他糖(如阿拉伯糖、半乳糖、麦芽糖等)的利用上也有类似对乳糖利的情况,在含有编码利用阿拉伯糖的酶类基因群 的阿拉伯糖操纵元(araoperon)、半乳糖操纵元(gal operon)中也有CAP结合位点,CAP也起类似的正性调控作用。所以CAP的通用名称是分解 代谢基因激活蛋白(catabolic gene activator protein)。 不难看出:CAP结合位点就是一种起正性调控作用的操纵子,CAP则是对转录起正性作用的控蛋白棗激活蛋白,编码CRP的基因也是一个 调控基因,不过它并不在1ac操纵元的附近,CAP可以对几个操纵元都起作用。 从上所述,乳糖操纵元属于可诱导操纵元(inducible operon),这类操纵元通常是关闭的,当受效应物作用后诱导开放转录。这类操纵元使 细菌能适应环境的变化,最有效地利用环境能提供的能源底物。 四、色氨酸操纵元 色氨酸是构成蛋白质的组分,一般的环境难以给细菌提供足够的色氨酸,细菌要生存繁殖通常需要自己经过许多步骤合成色氨酸,但是一 旦环境能够提供色氨酸时,细菌就会充分利用外界的色氨酸、减少或停止合成色氨酸,以减轻自己的负担。细菌所以能做到这点是因为有色氨 酸操纵元(trp operon)的调控。 (一)色氨酸操纵元的结构与阻遏蛋白的负性调控 如图19-10所示,合成色氨酸所需要酶类的基因E、D、C、B、A等头尾相接串连排列组成结构基因群,受其上游的启动子Ptrp和操纵子o的 调控,调控基因trpR的位置远离P-o-结构基因群,在其自身的启动子作用下,以组成性方式低水平表达分子量为47000的调控蛋白R。R并没有 与o结合的活性,当环境能提供足够浓度的色氨酸时,R与色氨酸结合后构象变化而活化,就能够与o特异性亲和结合,阻遏结构基因的转录, 因此这是属于一种负性调控的、可阻遏的操纵元(repressible operon),即这操纵元通常是开放转录的,当有效应物(色氨酸为阻遏剂)作用时, 则阻遏关闭转录。细菌不少生物合成系统的操纵元都属于这种类型,其调控可使细菌处在生存繁殖最经济最节省的状态
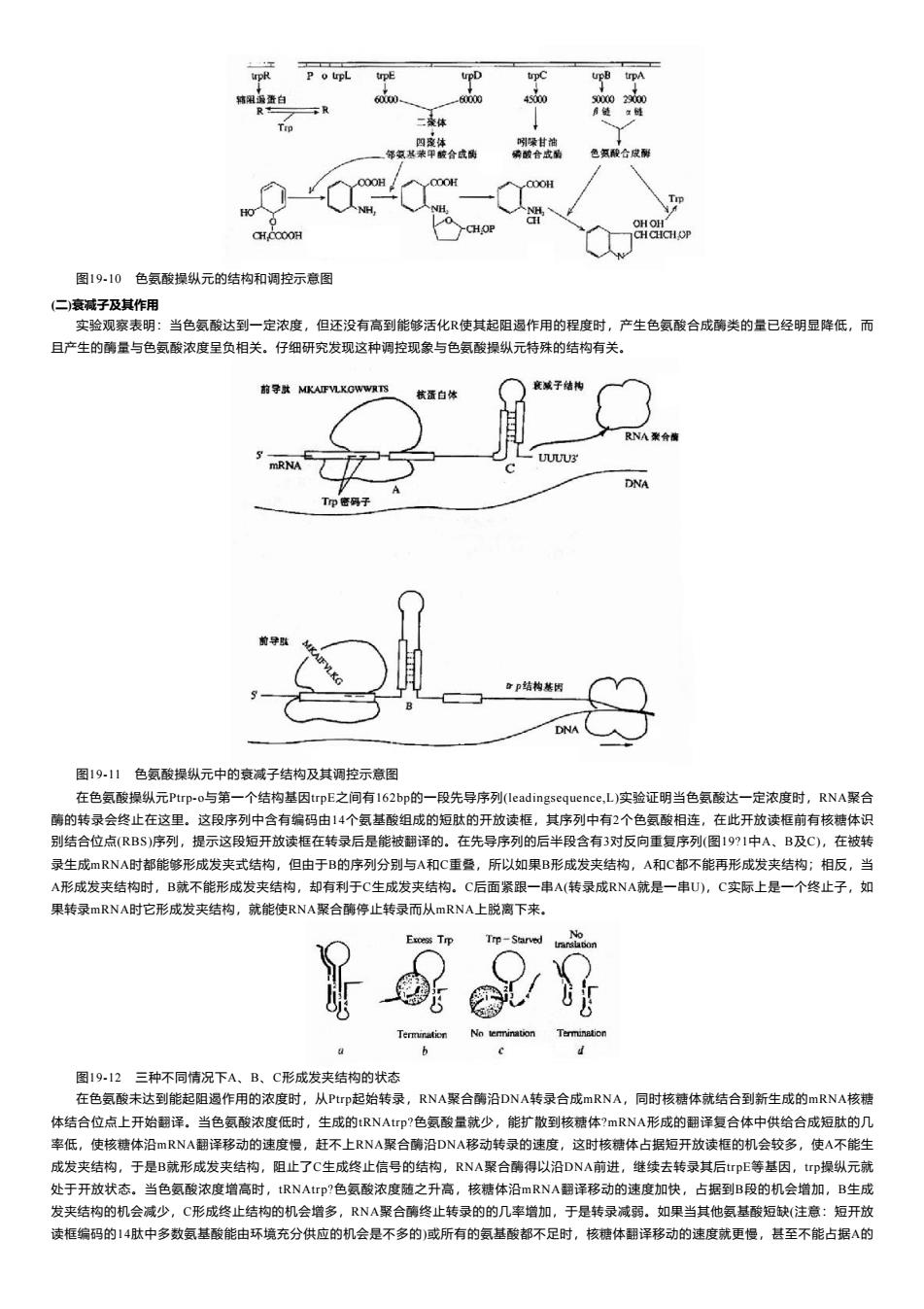
P o upL trpE trpD trpC upB trpA 韩阻透蛋白 60000、 -60000 45000 5000029000 R中 疗链:时 二桑体 四魔体 明染甘油 邻氨基表甲酸合成倒 磷酸合成酵 色氮酸合成解 Tr HO店 OHOH CHCCOOH CHCHCH OP 图19-10色氨酸操纵元的结构和调控示意图 (二)衰减子及其作用 实验观察表明:当色氨酸达到一定浓度,但还没有高到能够活化R使其起阻遏作用的程度时,产生色氨酸合成酶类的量已经明显降低,而 且产生的酶量与色氨酸浓度呈负相关。仔细研究发现这种调控现象与色氨酸操纵元特殊的结构有关。 前导款MKAIFVLKGWWRTS 襄减子结构 核蛋自体 RNA聚合南 UU几U DNA Gp结构基因 DNA 图19-11色氨酸操纵元中的衰减子结构及其调控示意图 在色氨酸操纵元Ptrp-o与第一个结构基因trpE之间有162bp的一段先导序列(leadingsequence,.L)实验证明当色氨酸达一定浓度时,RNA聚合 酶的转录会终止在这里。这段序列中含有编码由14个氨基酸组成的短肽的开放读框,其序列中有2个色氨酸相连,在此开放读框前有核糖体识 别结合位点(RBS)序列,提示这段短开放读框在转录后是能被翻译的。在先导序列的后半段含有3对反向重复序列(图19?1中A、B及C),在被转 录生成mRNA时都能够形成发夹式结构,但由于B的序列分别与A和C重叠,所以如果B形成发夹结构,A和C都不能再形成发夹结构;相反,当 A形成发夹结构时,B就不能形成发夹结构,却有利于C生成发夹结构。C后面紧跟一串A(转录成RNA就是一串U),C实际上是一个终止子,如 果转录mRNA时它形成发夹结构,就能使RNA聚合酶停止转录而从mRNA上脱离下来。 Exoess Trp Trp-Starved 图19-12三种不同情况下A、B、C形成发夹结构的状态 在色氨酸未达到能起阻遏作用的浓度时,从Ptp起始转录,RNA聚合酶沿DNA转录合成mRNA,同时核糖体就结合到新生成的mRNA核糖 体结合位点上开始翻译。当色氨酸浓度低时,生成的tRNAtrp?色氨酸量就少,能扩散到核糖体?mRNA形成的翻译复合体中供给合成短肽的几 率低,使核糖体沿mRNA翻译移动的速度慢,赶不上RNA聚合酶沿DNA移动转录的速度,这时核糖体占据短开放读框的机会较多,使A不能生 成发夹结构,于是B就形成发夹结构,阻止了C生成终止信号的结构,RNA聚合酶得以沿DNA前进,继续去转录其后trpE等基因,tp操纵元就 处于开放状态。当色氨酸浓度增高时,tRNAtrp?色氨酸浓度随之升高,核糖体沿mRNA翻译移动的速度加快,占据到B段的机会增加,B生成 发夹结构的机会减少,C形成终止结构的机会增多,RNA聚合酶终止转录的的几率增加,于是转录减弱。如果当其他氨基酸短缺(注意:短开放 读框编码的14肽中多数氨基酸能由环境充分供应的机会是不多的)或所有的氨基酸都不足时,核糖体翻译移动的速度就更慢,甚至不能占据A的
图19-10 色氨酸操纵元的结构和调控示意图 (二)衰减子及其作用 实验观察表明:当色氨酸达到一定浓度,但还没有高到能够活化R使其起阻遏作用的程度时,产生色氨酸合成酶类的量已经明显降低,而 且产生的酶量与色氨酸浓度呈负相关。仔细研究发现这种调控现象与色氨酸操纵元特殊的结构有关。 图19-11 色氨酸操纵元中的衰减子结构及其调控示意图 在色氨酸操纵元Ptrp-o与第一个结构基因trpE之间有162bp的一段先导序列(leadingsequence,L)实验证明当色氨酸达一定浓度时,RNA聚合 酶的转录会终止在这里。这段序列中含有编码由14个氨基酸组成的短肽的开放读框,其序列中有2个色氨酸相连,在此开放读框前有核糖体识 别结合位点(RBS)序列,提示这段短开放读框在转录后是能被翻译的。在先导序列的后半段含有3对反向重复序列(图19?1中A、B及C),在被转 录生成mRNA时都能够形成发夹式结构,但由于B的序列分别与A和C重叠,所以如果B形成发夹结构,A和C都不能再形成发夹结构;相反,当 A形成发夹结构时,B就不能形成发夹结构,却有利于C生成发夹结构。C后面紧跟一串A(转录成RNA就是一串U),C实际上是一个终止子,如 果转录mRNA时它形成发夹结构,就能使RNA聚合酶停止转录而从mRNA上脱离下来。 图19-12 三种不同情况下A、B、C形成发夹结构的状态 在色氨酸未达到能起阻遏作用的浓度时,从Ptrp起始转录,RNA聚合酶沿DNA转录合成mRNA,同时核糖体就结合到新生成的mRNA核糖 体结合位点上开始翻译。当色氨酸浓度低时,生成的tRNAtrp?色氨酸量就少,能扩散到核糖体?mRNA形成的翻译复合体中供给合成短肽的几 率低,使核糖体沿mRNA翻译移动的速度慢,赶不上RNA聚合酶沿DNA移动转录的速度,这时核糖体占据短开放读框的机会较多,使A不能生 成发夹结构,于是B就形成发夹结构,阻止了C生成终止信号的结构,RNA聚合酶得以沿DNA前进,继续去转录其后trpE等基因,trp操纵元就 处于开放状态。当色氨酸浓度增高时,tRNAtrp?色氨酸浓度随之升高,核糖体沿mRNA翻译移动的速度加快,占据到B段的机会增加,B生成 发夹结构的机会减少,C形成终止结构的机会增多,RNA聚合酶终止转录的的几率增加,于是转录减弱。如果当其他氨基酸短缺(注意:短开放 读框编码的14肽中多数氨基酸能由环境充分供应的机会是不多的)或所有的氨基酸都不足时,核糖体翻译移动的速度就更慢,甚至不能占据A的

序列,结果有利于A和C发夹结构的形成,于是RNA聚合酶停止转录,等于告诉细菌:“整个氨基酸都不足,即使合成色氨酸也不能合成蛋白 质,不如不合成以节省能量”。 由此可见,先导序列起到随色氨酸浓度升高降低转录的作用,这段序列就称为衰减子attenuator))。在trp操纵元中,对结构基因的转录阻遏 蛋白的负调控起到粗调的作用,而衰减子起到细调的作用。细菌其他氨基酸合成系统的许多操纵元(如组氨酸、苏氨酸、亮氨酸、异亮氨酸、 苯丙氨酸等操纵元)中也有类似的衰减子存在。 第三节】 真核基因表达调控 一、真核基因组的复杂性 与原核生物比较,真核生物的基因组更为复杂,可列举如下。 ▲真核基因组比原核基因组大得多,大肠杆菌基因组约4×106bp,哺乳类基因组在109bp数量级,比细菌大千倍:大肠杆菌约有4000个基 因,人则约有10万个基因。 ▲真核生物主要的遗传物质与组蛋白等构成染色质,被包裹在核膜内,核外还有遗传成分(如线粒体DNA等),这就增加了基因表达调控的 层次和复杂性。 ▲原核生物的基因组基本上是单倍体,而真核基因组是二倍体。 ▲如前所述,细菌多数基因按功能相关成串排列,组成操纵元的基因表达调控的单元,共同开启或关闭,转录出多顺反子(polycistro)的 mRNA;真核生物则是一个结构基因转录生成一条mRNA,即mRNA是单顺反子(monocistron),基本上没有操纵元的结构,而真核细胞的许多 活性蛋白是由相同和不同的多肽形成的亚基构成的,这就涉及到多个基因协调表达的问题,真核生物基因协调表达要比原核生物复杂得多。 ▲原核基因组的大部分序列都为基因编码,而核酸杂交等实验表明:哺乳类基因组中仅约10%的序列为蛋白质、RNA、tRNA等编码,其 余约90%的序列功能至今还不清楚。 ▲原核生物的基因为蛋白质编码的序列绝大多数是连续的,而真核生物为蛋白质编码的基因绝大多数是不连续的,即有外显子(xo)和内 含子(intron),转录后需经剪接(splicing)去除内含子,才能翻译获得完整的蛋白质,这就增加了基因表达调控的环节。 ▲原核基因组中除rRNA、tRNA基因有多个拷贝外,重复序列不多。哺乳动物基因组中则存在大量重复序列(repetitive sequences)。用复 性动力学等实验表明有三类重复序列:@高度重复序列(highly repetitive sequences)),这类序列一般较短,长10-30Obp,在哺乳类基因组中重 复106次左右,占基因组DNA序列总量的10·60%,人的基因组中这类序列约占20%,功能还不明了。②中度重复序列(moderatelyrepetitive sequences),这类序列多数长100-500bp,重复101-105次,占基因组10-40%。例如哺乳类中含量最多的一种称为Alu的序列,长约300bp, 在哺乳类不同种属间相似,在基因组中重复3-×105次,在人的基因组中约占7%,功能也还不很清楚。在人的基因组中18S/28 SrRNA基因重复 280次,5 SrRNA基因重复2000次,tRNA基因重复1300次,5种组蛋白的基因串连成簇重复30-40次,这些基因都可归入中度重复序列范围。③ 单拷贝序列(single copy sequences)。这类序列基本上不重复,占哺乳类基因组的50-80%,在人基因组中约占65%。绝大多数真核生物为蛋白 质编码的基因在单倍体基因组中都不重复,是单拷贝的基因。 从上述可见真核基因组比原核基因组复杂得多,至今人类对真核基因组的认识还很有限,使现在国际上制订的人基因组研究计划(humn gene project)完成,绘出人全部基因的染色体定位图,测出人基因组IO9bp全部DNA序列后,要搞清楚人全部基因的功能及其相互关系,特别 是要明了基因表达调控的全部规律,还需要经历很长期限巨的研究过程。 二、真核基因表达调控的特点 尽管我们现在对真核基因表达调控知道还不多,但与原核生物比较它具有一些明显的特点。 (一)真核基因表达调控的环节更多 如前所述,基因表达是基因经过转录、翻译、产生有生物活性的蛋白质的整个过程。同原核生物一样,转录依然是真核生物基因表达调控 的主要环节。但真核基因转录发生在细胞核(线粒体基因的转录在线粒体内),翻译则多在胞浆,两个过程是分开的,因此其调控增加了更多的 环节和复杂性,转录后的调控占有了更多的分量。图19-13扼要地列出真核基因表达的各个可能的环节
序列,结果有利于A和C发夹结构的形成,于是RNA聚合酶停止转录,等于告诉细菌:“整个氨基酸都不足,即使合成色氨酸也不能合成蛋白 质,不如不合成以节省能量”。 由此可见,先导序列起到随色氨酸浓度升高降低转录的作用,这段序列就称为衰减子attenuator)。在trp操纵元中,对结构基因的转录阻遏 蛋白的负调控起到粗调的作用,而衰减子起到细调的作用。细菌其他氨基酸合成系统的许多操纵元(如组氨酸、苏氨酸、亮氨酸、异亮氨酸、 苯丙氨酸等操纵元)中也有类似的衰减子存在。 第三节 真核基因表达调控 一、真核基因组的复杂性 与原核生物比较,真核生物的基因组更为复杂,可列举如下。 ▲真核基因组比原核基因组大得多,大肠杆菌基因组约4×106bp,哺乳类基因组在109bp数量级,比细菌大千倍;大肠杆菌约有4000个基 因,人则约有10万个基因。 ▲真核生物主要的遗传物质与组蛋白等构成染色质,被包裹在核膜内,核外还有遗传成分(如线粒体DNA等),这就增加了基因表达调控的 层次和复杂性。 ▲原核生物的基因组基本上是单倍体,而真核基因组是二倍体。 ▲如前所述,细菌多数基因按功能相关成串排列,组成操纵元的基因表达调控的单元,共同开启或关闭,转录出多顺反子(polycistron)的 mRNA;真核生物则是一个结构基因转录生成一条mRNA,即mRNA是单顺反子(monocistron),基本上没有操纵元的结构,而真核细胞的许多 活性蛋白是由相同和不同的多肽形成的亚基构成的,这就涉及到多个基因协调表达的问题,真核生物基因协调表达要比原核生物复杂得多。 ▲原核基因组的大部分序列都为基因编码,而核酸杂交等实验表明:哺乳类基因组中仅约10%的序列为蛋白质、rRNA、tRNA等编码,其 余约90%的序列功能至今还不清楚。 ▲原核生物的基因为蛋白质编码的序列绝大多数是连续的,而真核生物为蛋白质编码的基因绝大多数是不连续的,即有外显子(exon)和内 含子(intron),转录后需经剪接(splicing)去除内含子,才能翻译获得完整的蛋白质,这就增加了基因表达调控的环节。 ▲原核基因组中除rRNA、tRNA基因有多个拷贝外,重复序列不多。哺乳动物基因组中则存在大量重复序列(repetitive sequences)。用复 性动力学等实验表明有三类重复序列:①高度重复序列(highly repetitive sequences),这类序列一般较短,长10-300bp,在哺乳类基因组中重 复106次左右,占基因组DNA序列总量的10-60%,人的基因组中这类序列约占20%,功能还不明了。②中度重复序列(moderatelyrepetitive sequences),这类序列多数长100-500bp,重复101-105次,占基因组10-40%。例如哺乳类中含量最多的一种称为Alu的序列,长约300bp, 在哺乳类不同种属间相似,在基因组中重复3-×105次,在人的基因组中约占7%,功能也还不很清楚。在人的基因组中18S/28SrRNA基因重复 280次,5SrRNA基因重复2000次,tRNA基因重复1300次,5种组蛋白的基因串连成簇重复30-40次,这些基因都可归入中度重复序列范围。③ 单拷贝序列(single copy sequences)。这类序列基本上不重复,占哺乳类基因组的50-80%,在人基因组中约占65%。绝大多数真核生物为蛋白 质编码的基因在单倍体基因组中都不重复,是单拷贝的基因。 从上述可见真核基因组比原核基因组复杂得多,至今人类对真核基因组的认识还很有限,使现在国际上制订的人基因组研究计划(human gene project)完成,绘出人全部基因的染色体定位图,测出人基因组109bp全部DNA序列后,要搞清楚人全部基因的功能及其相互关系,特别 是要明了基因表达调控的全部规律,还需要经历很长期艰巨的研究过程。 二、真核基因表达调控的特点 尽管我们现在对真核基因表达调控知道还不多,但与原核生物比较它具有一些明显的特点。 (一)真核基因表达调控的环节更多 如前所述,基因表达是基因经过转录、翻译、产生有生物活性的蛋白质的整个过程。同原核生物一样,转录依然是真核生物基因表达调控 的主要环节。但真核基因转录发生在细胞核(线粒体基因的转录在线粒体内),翻译则多在胞浆,两个过程是分开的,因此其调控增加了更多的 环节和复杂性,转录后的调控占有了更多的分量。图19-13扼要地列出真核基因表达的各个可能的环节

真核基因表达的调控 DNA 扩增 一重样 转录前测控 细影核 丢失 转录 转录调控 初始转录物 国工内复赛腰:型头,能尾) 中每饰(甲盖化复化还眼转位一】 转录后调控 √RNA 转适 阵解 核苷破 68 》翻译调控 制译 8说多杜前身物 加工(内切、-S-S-形成) 维饰(佛酸化、乙酰化,甲最化 乳译后调控 ,如人塘基.指类) 降解8成熟激白质 氨蒸酸 执行功德 图19·13真核生物基因表达调控的可能环节 图19·13总结了以前章节叙述过的基因表达过程,并作了一些新补充。图中标出了真核细胞在分化过程中会发生基因重排(gee rearrangement),即胚原性基因组中某些基因会再组合变化形成第二级基因。例如编码完整抗体蛋白的基因是在淋巴细胞分化发育过程中,由 原来分开的几百个不同的可变区基因经选择、组合、变化,与恒定区基因一起构成稳定的、为特定的完整抗体蛋白编码的可表达的基因。这种 基因重排使细胞可能利用几百个抗体基因的片段,组合变化而产生能编码达108种不同抗体的基因,其中就有复杂的基因表达调控机理。 此外,真核细胞中还会发生基因扩增(geneamplification),即基因组中的特定段落在某些情况下会复制产生许多拷贝。最早发现的是蛙的 成熟卵细胞在受精后的发育过程中其rRNA基因(可称为DNA)可扩增2000倍,以后发现其他动物的卵细胞也有同样的情况,这很显然适合了受 精后迅速发育分裂要合成大量蛋白质,需要有大量核糖体。又如MTX(methotrexate)是叶酸的结构类似物,一些哺乳类细胞会对含有利用叶酸 所必需的二氢叶酸还原酶(dihydrofolate reductase,DHFR)基因的DNA区段扩增40?O0倍,使DHFR的表达量显著增加,从而提高对MTX的抗 性。基因的扩增无疑能够大幅度提高基因表达产物的量,但这种调控机理至今还不清楚。 (二)真核基因的转录与染色质的结构变化相关 真核基因组DNA绝大部分都在细胞核内与组蛋白等结合成染色质,染色质的结构、染色质中NA和组蛋白的结构状态都影响转录,至少有 以下现象: 1.染色质结构影响基因转录细胞分裂时染色体的大部分到间期时松开分散在核内,称为常染色质(euchromatir),松散的染色质中的基因 可以转录。染色体中的某些区段到分裂期后不像其他部分解旋松开,仍保持紧凑折叠的结构,在间期核中可以看到其浓集的斑块,称为异染色 质(heterochromatin),其中从未见有基因转录表达;原本在常染色质中表达的基因如移到异染色质内也会停止表达;哺乳类雌体细胞2条X染色 体,到间期一条变成异染色质者,这条X染色体上的基因就全部失活。可见紧密的染色质结构阻止基因表达。 2.组蛋白的作用早期体外实验观察到组蛋白与DNA结合阻止DNA上基因的转录,去除组蛋基因又能够转录。组蛋白是碱性蛋白质,带正 电荷,可与DNA链上带负电荷的磷酸基相结合,从而遮蔽了DNA分子,妨碍了转录,可能扮演了非特异性阻遏蛋白的作用;染色质中的非组 蛋白成分具有组织细胞特异性,可能消除组蛋白的阻遏,起到特异性的去阻遏促转录作用。 发现核小体后,进一步观察核小体结构与基因转录的关系,发现活跃转录的染色质区段,有富含赖氨酸的组蛋白(H1组蛋白)水平降低, H2AH2B组蛋白二聚体不稳定性增加、组蛋白乙酰化(acetylation)和泛素化(ubiquitination),以及H3组蛋白巯基化等现象,这些都是核小体不 稳定或解体的因素或指征。转录活跃的区域也常缺乏核小体的结构。这些都表明核小体结构影响基因转录。 3.转录活跃区域对核酸酶作用敏感度增加染色质DNA受DNase I作用通常会被降解成00、400,bp的片段,反映了完整的核小体规则的 重复结构。但活跃进行转录的染色质区域受DNase I消化常出现1O0~200bp的DNA片段,且长短不均一,说明其DNA受组蛋白掩盖的结构有变 化,出现了对DNase I高敏感点(hypersensitive site)。这种高敏感点常出现在转录基因的s'侧区(5'flanking region)、3'未端或在基因上,多在调 控蛋白结合位点的附近,分析该区域核小体的结构发生变化,可能有利于调控蛋白结合而促进转录。 4.DNA拓扑结构变化天然双链DNA的构象大多是负性超螺旋。当基因活跃转录时,RNA聚合酶转录方向前方DNA的构象是正性超螺 旋,其后面的DNA为负性超螺旋。正性超螺旋会拆散核小体,有利于RNA聚合酶向前移动转录;而负性超螺旋则有利于核小体的再形成。 5.DNA碱基修饰变化真核DNA中的胞密啶约有5%被甲基化为5?甲基胞嘧啶(5?methylcytidine,m5C),而话跃转录的DNA段落中胞嘧啶甲 基化程度常较低。这种甲基化最常发生在某些基因5'侧区的CG序列中,实验表明这段序列甲基化可使其后的基因不能转录,甲基化可能阻碍 转录因子与DNA特定部位的结合从而影响转录。如果用基因打靶的方法除去主要的DNA甲基化酶,小鼠的胚胎就不能正常发育而死亡,可见 DNA的甲基化对基因表达调控是重要的。 由此可见,染色质中的基因转录前先要有一个被激活的过程,但目前对激活机制还缺乏认识。 三)真核基因表达以正性调控为主 真核RNA聚合酶对启动子的亲和力很低,基本上不依靠自身来起始转录,需要依赖多种激活蛋白的协同作用。真核基因调控中虽然也发现 有负性调控组件,但其存在并不普遍;真核基因转录表达的调控蛋白也有起阻遏和激活作用或兼有两种作用者,但总的是以激活蛋白的作用为
图19-13 真核生物基因表达调控的可能环节 图19-13总结了以前章节叙述过的基因表达过程,并作了一些新补充。图中标出了真核细胞在分化过程中会发生基因重排(gene rearrangement),即胚原性基因组中某些基因会再组合变化形成第二级基因。例如编码完整抗体蛋白的基因是在淋巴细胞分化发育过程中,由 原来分开的几百个不同的可变区基因经选择、组合、变化,与恒定区基因一起构成稳定的、为特定的完整抗体蛋白编码的可表达的基因。这种 基因重排使细胞可能利用几百个抗体基因的片段,组合变化而产生能编码达108种不同抗体的基因,其中就有复杂的基因表达调控机理。 此外,真核细胞中还会发生基因扩增(geneamplification),即基因组中的特定段落在某些情况下会复制产生许多拷贝。最早发现的是蛙的 成熟卵细胞在受精后的发育过程中其rRNA基因(可称为rDNA)可扩增2000倍,以后发现其他动物的卵细胞也有同样的情况,这很显然适合了受 精后迅速发育分裂要合成大量蛋白质,需要有大量核糖体。又如MTX(methotrexate)是叶酸的结构类似物,一些哺乳类细胞会对含有利用叶酸 所必需的二氢叶酸还原酶(dihydrofolate reductase, DHFR)基因的DNA区段扩增40?00倍,使DHFR的表达量显著增加,从而提高对MTX的抗 性。基因的扩增无疑能够大幅度提高基因表达产物的量,但这种调控机理至今还不清楚。 (二)真核基因的转录与染色质的结构变化相关 真核基因组DNA绝大部分都在细胞核内与组蛋白等结合成染色质,染色质的结构、染色质中NA和组蛋白的结构状态都影响转录,至少有 以下现象: 1.染色质结构影响基因转录 细胞分裂时染色体的大部分到间期时松开分散在核内,称为常染色质(euchromatin),松散的染色质中的基因 可以转录。染色体中的某些区段到分裂期后不像其他部分解旋松开,仍保持紧凑折叠的结构,在间期核中可以看到其浓集的斑块,称为异染色 质(heterochromatin),其中从未见有基因转录表达;原本在常染色质中表达的基因如移到异染色质内也会停止表达;哺乳类雌体细胞2条X染色 体,到间期一条变成异染色质者,这条X染色体上的基因就全部失活。可见紧密的染色质结构阻止基因表达。 2.组蛋白的作用 早期体外实验观察到组蛋白与DNA结合阻止DNA上基因的转录,去除组蛋基因又能够转录。组蛋白是碱性蛋白质,带正 电荷,可与DNA链上带负电荷的磷酸基相结合,从而遮蔽了DNA分子,妨碍了转录,可能扮演了非特异性阻遏蛋白的作用;染色质中的非组 蛋白成分具有组织细胞特异性,可能消除组蛋白的阻遏,起到特异性的去阻遏促转录作用。 发现核小体后,进一步观察核小体结构与基因转录的关系,发现活跃转录的染色质区段,有富含赖氨酸的组蛋白(H1组蛋白)水平降低, H2A·H2B组蛋白二聚体不稳定性增加、组蛋白乙酰化(acetylation)和泛素化(ubiquitination),以及H3组蛋白巯基化等现象,这些都是核小体不 稳定或解体的因素或指征。转录活跃的区域也常缺乏核小体的结构。这些都表明核小体结构影响基因转录。 3.转录活跃区域对核酸酶作用敏感度增加 染色质DNA受DNase Ⅰ作用通常会被降解成00、400……bp的片段,反映了完整的核小体规则的 重复结构。但活跃进行转录的染色质区域受DNase Ⅰ消化常出现100-200bp的DNA片段,且长短不均一,说明其DNA受组蛋白掩盖的结构有变 化,出现了对DNase Ⅰ高敏感点(hypersensitive site)。这种高敏感点常出现在转录基因的5′侧区(5′flanking region)、3′末端或在基因上,多在调 控蛋白结合位点的附近,分析该区域核小体的结构发生变化,可能有利于调控蛋白结合而促进转录。 4.DNA拓扑结构变化 天然双链DNA的构象大多是负性超螺旋。当基因活跃转录时,RNA聚合酶转录方向前方DNA的构象是正性超螺 旋,其后面的DNA为负性超螺旋。正性超螺旋会拆散核小体,有利于RNA聚合酶向前移动转录;而负性超螺旋则有利于核小体的再形成。 5.DNA碱基修饰变化 真核DNA中的胞嘧啶约有5%被甲基化为5?甲基胞嘧啶(5?methylcytidine,m5C),而活跃转录的DNA段落中胞嘧啶甲 基化程度常较低。这种甲基化最常发生在某些基因5′侧区的CpG序列中,实验表明这段序列甲基化可使其后的基因不能转录,甲基化可能阻碍 转录因子与DNA特定部位的结合从而影响转录。如果用基因打靶的方法除去主要的DNA甲基化酶,小鼠的胚胎就不能正常发育而死亡,可见 DNA的甲基化对基因表达调控是重要的。 由此可见,染色质中的基因转录前先要有一个被激活的过程,但目前对激活机制还缺乏认识。 (三)真核基因表达以正性调控为主 真核RNA聚合酶对启动子的亲和力很低,基本上不依靠自身来起始转录,需要依赖多种激活蛋白的协同作用。真核基因调控中虽然也发现 有负性调控组件,但其存在并不普遍;真核基因转录表达的调控蛋白也有起阻遏和激活作用或兼有两种作用者,但总的是以激活蛋白的作用为

主。即多数真核基因在没有调控蛋白作用时是不转录的,需要表达时就要有激活的蛋白质来促进转录。换言之:真核基因表达以正性调控为主 导。 三、真核基因转录水平的调控 真核细胞的三种RNA聚合酶(I、Ⅱ和Ⅲ)中,只有RNA聚合酶Ⅱ能转录生成mRNA,以下主要讨论RNA聚合酶Ⅱ的转录调控。 (一)顺式作用组件cis?acting elements) 真核基因的顺式调控组件是基因周围能与特异转录因子结合而影响转录的DNA序列。其中主要是起正性调控作用的顺式作用组件,包括启 动子(promoter)、增强子(enhancer);近年又发现起负性调控作用的组件枣沉寂子(silencer). 1.启动子与原核启动子的含义相同,是指RNA聚合酶结合并起动转录的DNA序列。但真核同启动子间不像原核那样有明显共同一致的序 列,而且单靠RNA聚合酶难以结合DNA而起动转录,而是需要多种蛋白质因子的相互协调作用,不同蛋白质因子又能与不同DNA序列相互作 用,不同基因转录起始及其调控所需的蛋白因子也不完全相同,因而不同启动子序列也很不相同,要比原核更复杂、序列也更长。真核启动子 一般包括转录起始点及其上游约100-20Obp序列,包含有若干具有独立功能的DNA序列元件,每个元件约长7-30bp。最常见的哺乳类RNA聚 合酶Ⅱ启动子中的元件序列见表19·1. 表19·1哺乳类RNA聚合酶I启动子中常见的元件 结合的蛋白因子 元件名称 共同序列 名称 分子量 结合DNA长度 TATAbOx TATAAAA TBP 30,000 ~10bp GC box GGGCGG SP-1 105,000 ~20bp CAA box GGCCAATCT CTF/NFI 60,000 -22bp Octamer ATTTGCAT Oct-1 76,000 ~10bp 0t-2 53,000 ~20bp kB GGGACTTTCC NFkB 44,000 -10bp ATF GTGACGT AFT 20bp 启动子中的元件可以分为两种: @核心启动子元件(core promoter element)指RNA聚合酶起始转录所必需的最小的DNA序列,包括转录起始点及其上游-25/-30bp处的 TATA盒。核心元件单独起作用时只能确定转录起始位点和产生基础水平的转录。 ②上游启动子元件(upstream promoter element)包括通常位于·7Obp附近的CAAT盒和GC盒、以及距转录起始点更远的上游元件。这些 元件与相应的蛋白因子结合能提高或改变转录效率。不同基因具有不同的上游启动子元件,其位置也不相同,这使得不同的基因表达分别有不 同的调控。图19.14以人金属硫蛋白基因为例子, 说明真核基因上游启动子元件的组织情况和各元件相应结合的转录因子。 The regulatory region of a human metallothionein gene GRE BLE MREMRE BLE TRE MRE GC MRE TATA ■1,深:器了明■ -260-20-220-20-180-160-140-120-100-80-60-40-20 型 60® Protein hinding PIC 图19·14人金属硫蛋白基因的调控区 2.增强子是一种能够提高转录效率的顺式调控元件,最早是在SV40病毒中发现的长约200bp的一段DNA,可使旁侧的基因转录提高100 倍,其后在多种真核生物,甚至在原核生物中都发现了增强子。增强子通常占100~200p长度,也和启动子一样由若干组件构成,基本核心组 件常为8·12bp,可以单拷贝或多拷贝串连形式存在。增强子的作用有以下特点: ①增强子提高同一条DNA链上基因转录效率,可以远距离作用,通常可距离1·4kb、个别情况下离开所调控的基因30kb仍能发挥作用 而且在基因的上游或下游都能起作用。 ②增强子作用与其序列的正反方向无关,将增强子方向倒置依然能起作用。而将启动子倒就不能起作用,可见增强子与启动子是很不相同 的。 ③增强子要有启动子才能发挥作用,没有启动子存在,增强子不能表现活性。但增强子对动子没有严格的专一性,同一增强子可以影响不 同类型启动子的转录。例如当含有增强子的病毒基因组整合入宿主细胞基因组时,能够增强整合区附近宿主某些基因的转录;当增强子随某些 染色体段落移位时,也能提高移到的新位置周围基因的转录。使某些癌基因转录表达增强,可能是肿瘤发生的因素之一。 ④增强子的作用机理虽然还不明确,但与其他顺式调控元件一样,必须与特定的蛋白质因结合后才能发挥增强转录的作用。增强子一般具 有组织或细胞特异性,许多增强子只在某些细胞或组织中表现活性,是由这些细胞或组织中具有的特异性蛋白质因子所决定的。 3沉寂子最早在酵母中发现,以后在T淋巴细胞的T抗原受体基因的转录和重排中证实这种负调控顺式元件的存在。目前对这种在基因转 录降低或关闭中起作用的序列研究还不多,但从已有的例子看到:沉寂子的作用可不受序列方向的影响,也能远距离发挥作用,并可对异源基 因的表达起作用。 (二)反式作用因子(trans?actingfactors) 以反式作用影响转录的因子可统称为转录因子(transcription factors,TF)。RNA聚合酶是一种反式作用于转录的蛋白因子。在真核细胞中 RNA聚合酶通常不能单独发挥转录作用,而需要与其他转录因子共同协作。与RNA聚合酶I、Ⅱ、Ⅲ相应的转录因子分别称为TFI、TFⅡ
主。即多数真核基因在没有调控蛋白作用时是不转录的,需要表达时就要有激活的蛋白质来促进转录。换言之:真核基因表达以正性调控为主 导。 三、真核基因转录水平的调控 真核细胞的三种RNA聚合酶(Ⅰ、Ⅱ和Ⅲ)中,只有RNA聚合酶Ⅱ能转录生成mRNA,以下主要讨论RNA聚合酶Ⅱ的转录调控。 (一)顺式作用组件(cis?acting elements) 真核基因的顺式调控组件是基因周围能与特异转录因子结合而影响转录的DNA序列。其中主要是起正性调控作用的顺式作用组件,包括启 动子(promoter)、增强子(enhancer);近年又发现起负性调控作用的组件枣沉寂子(silencer)。 1.启动子 与原核启动子的含义相同,是指RNA聚合酶结合并起动转录的DNA序列。但真核同启动子间不像原核那样有明显共同一致的序 列,而且单靠RNA聚合酶难以结合DNA而起动转录,而是需要多种蛋白质因子的相互协调作用,不同蛋白质因子又能与不同DNA序列相互作 用,不同基因转录起始及其调控所需的蛋白因子也不完全相同,因而不同启动子序列也很不相同,要比原核更复杂、序列也更长。真核启动子 一般包括转录起始点及其上游约100-200bp序列,包含有若干具有独立功能的DNA序列元件,每个元件约长7-30bp。最常见的哺乳类RNA聚 合酶Ⅱ启动子中的元件序列见表19-1。 表19-1 哺乳类RNA聚合酶Ⅱ启动子中常见的元件 元件名称 共同序列 结合的蛋白因子 名称 分子量 结合DNA长度 TATAbox TATAAAA TBP 30,000 ~10bp GC box GGGCGG SP-1 105,000 ~20bp CAA box GGCCAATCT CTF/NF1 60,000 ~22bp Octamer ATTTGCAT Oct-1 76,000 ~10bp Oct-2 53,000 ~20bp kB GGGACTTTCC NFkB 44,000 ~10bp ATF GTGACGT AFT ? 20bp 启动子中的元件可以分为两种: ①核心启动子元件(core promoter element) 指RNA聚合酶起始转录所必需的最小的DNA序列,包括转录起始点及其上游-25/-30bp处的 TATA盒。核心元件单独起作用时只能确定转录起始位点和产生基础水平的转录。 ②上游启动子元件(upstream promoter element) 包括通常位于-70bp附近的CAAT盒和GC盒、以及距转录起始点更远的上游元件。这些 元件与相应的蛋白因子结合能提高或改变转录效率。不同基因具有不同的上游启动子元件,其位置也不相同,这使得不同的基因表达分别有不 同的调控。图19-14以人金属硫蛋白基因为例子,说明真核基因上游启动子元件的组织情况和各元件相应结合的转录因子。 图19-14 人金属硫蛋白基因的调控区 2.增强子 是一种能够提高转录效率的顺式调控元件,最早是在SV40病毒中发现的长约200bp的一段DNA,可使旁侧的基因转录提高100 倍,其后在多种真核生物,甚至在原核生物中都发现了增强子。增强子通常占100-200bp长度,也和启动子一样由若干组件构成,基本核心组 件常为8-12bp,可以单拷贝或多拷贝串连形式存在。增强子的作用有以下特点: ①增强子提高同一条DNA链上基因转录效率,可以远距离作用,通常可距离1-4kb、个别情况下离开所调控的基因30kb仍能发挥作用, 而且在基因的上游或下游都能起作用。 ②增强子作用与其序列的正反方向无关,将增强子方向倒置依然能起作用。而将启动子倒就不能起作用,可见增强子与启动子是很不相同 的。 ③增强子要有启动子才能发挥作用,没有启动子存在,增强子不能表现活性。但增强子对动子没有严格的专一性,同一增强子可以影响不 同类型启动子的转录。例如当含有增强子的病毒基因组整合入宿主细胞基因组时,能够增强整合区附近宿主某些基因的转录;当增强子随某些 染色体段落移位时,也能提高移到的新位置周围基因的转录。使某些癌基因转录表达增强,可能是肿瘤发生的因素之一。 ④增强子的作用机理虽然还不明确,但与其他顺式调控元件一样,必须与特定的蛋白质因结合后才能发挥增强转录的作用。增强子一般具 有组织或细胞特异性,许多增强子只在某些细胞或组织中表现活性,是由这些细胞或组织中具有的特异性蛋白质因子所决定的。 3.沉寂子 最早在酵母中发现,以后在T淋巴细胞的T抗原受体基因的转录和重排中证实这种负调控顺式元件的存在。目前对这种在基因转 录降低或关闭中起作用的序列研究还不多,但从已有的例子看到:沉寂子的作用可不受序列方向的影响,也能远距离发挥作用,并可对异源基 因的表达起作用。 (二)反式作用因子(trans?actingfactors) 以反式作用影响转录的因子可统称为转录因子(transcription factors, TF)。RNA聚合酶是一种反式作用于转录的蛋白因子。在真核细胞中 RNA聚合酶通常不能单独发挥转录作用,而需要与其他转录因子共同协作。与RNA聚合酶Ⅰ、Ⅱ、Ⅲ相应的转录因子分别称为TFⅠ、TFⅡ
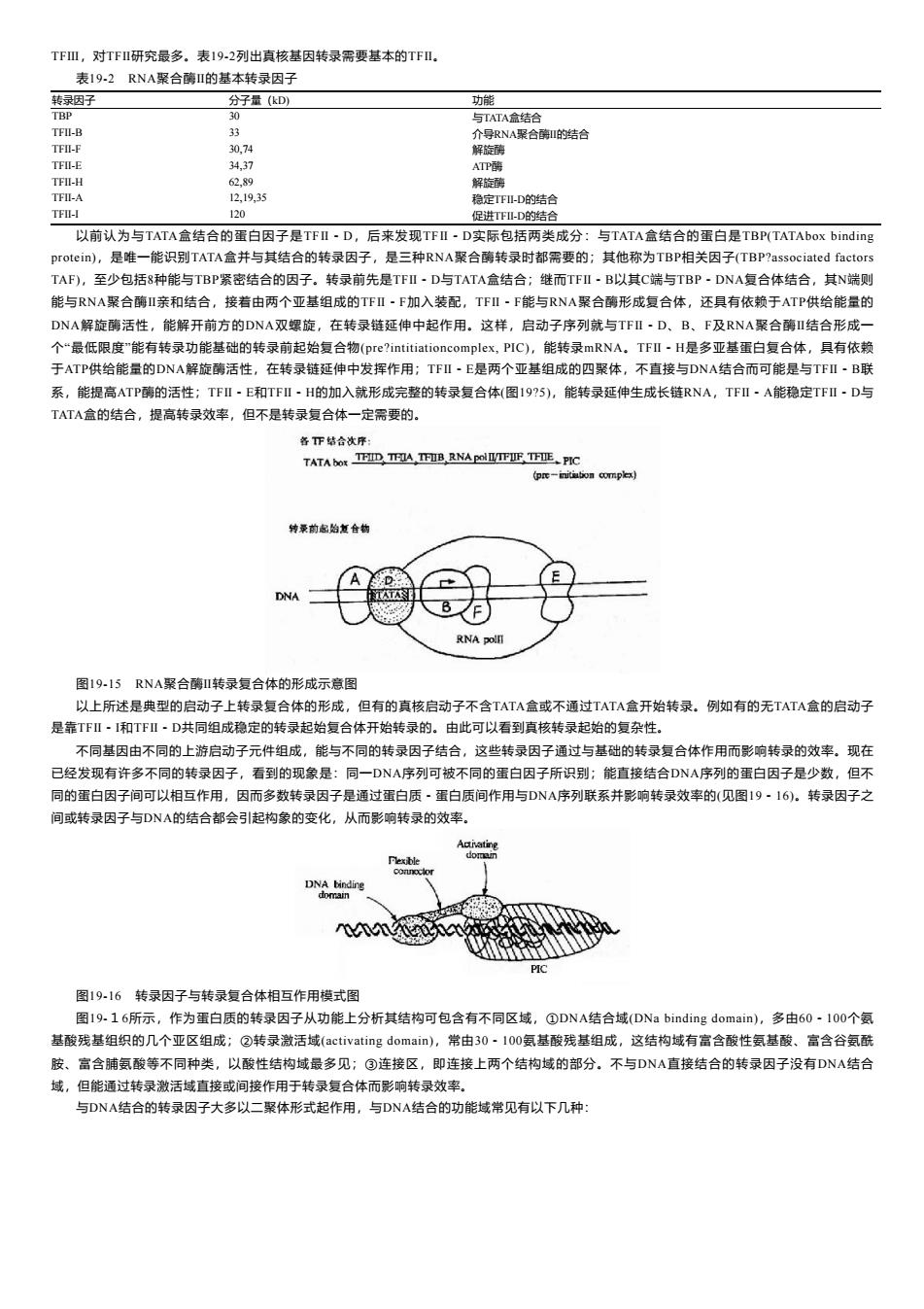
TFⅢ,对TFⅡ研究最多。表192列出真核基因转录需要基本的TFⅡ. 表19-2RNA聚合酶I的基本转录因子 转录因子 分子量(kD) 功能 TBP 30 与TATA盒结合 TFI-B 33 介导RNA聚合酶的结合 TFI-F 30,74 解旋酶 TFI-E 34,37 ATP薛 TFII-H 62,89 解旋藓 TFII-A 12,19,35 稳定TFI-D的结合 TFI-I 120 促进TF-D的结合 以前认为与TATA盒结合的蛋白因子是TFⅡ~D,后来发现TFⅡ·D实际包括两类成分:与TATA盒结合的蛋白是TBP(TATAbox binding protein),是唯一能识别TATA盒并与其结合的转录因子,是三种RNA聚合酶转录时都需要的;其他称为TBP相关因子(TBP?associated factors TAF),至少包括8种能与TBP紧密结合的因子。转录前先是TFI·D与TATA盒结合;继而TFI·B以其C端与TBP,DNA复合体结合,其N端则 能与RNA聚合酶I亲和结合,接着由两个亚基组成的TFI·F加入装配,TFI·F能与RNA聚合酶形成复合体,还具有依赖于ATP供给能量的 DNA解旋酶活性,能解开前方的DNA双螺旋,在转录链延伸中起作用。这样,启动子序列就与TFⅡ·D、B、F及RNA聚合酶Ⅱ结合形成一 个“最低限度"能有转录功能基础的转录前起始复合物(pre?intitiationcomplex,PIC),能转录mRNA。TFI~H是多亚基蛋白复合体,具有依赖 于ATP供给能量的DNA解旋酶活性,在转录链延伸中发挥作用;TFI·E是两个亚基组成的四聚体,不直接与DNA结合而可能是与TFⅡ-B联 系,能提高ATP酶的活性;TFⅡ-E和TFⅡ-H的加入就形成完整的转录复合体(图19?5),能转录延伸生成长链RNA,TFⅡ·A能稳定TFⅡ·D与 TATA盒的结合,提高转录效率,但不是转录复合体一定需要的。 各T下结合次序: TATA bOR TF四,TFA,TB,RNAPOTFUF TFI正、PIC (pre-initiution complex) 特桑前虚始复合物 DNA RNA pollT 图19-15RNA聚合酶I转录复合体的形成示意图 以上所述是典型的启动子上转录复合体的形成,但有的真核启动子不含TATA盒或不通过TATA盒开始转录。例如有的无TATA盒的启动子 是靠T℉Ⅱ·I和T℉Ⅱ·D共同组成稳定的转录起始复合体开始转录的。由此可以看到真核转录起始的复杂性。 不同基因由不同的上游启动子元件组成,能与不同的转录因子结合,这些转录因子通过与基础的转录复合体作用而影响转录的效率。现在 已经发现有许多不同的转录因子,看到的现象是:同一DNA序列可被不同的蛋白因子所识别:能直接结合DNA序列的蛋白因子是少数,但不 同的蛋白因子间可以相互作用,因而多数转录因子是通过蛋白质·蛋白质间作用与DNA序列联系并影响转录效率的(见图19·16)。转录因子之 间或转录因子与DNA的结合都会引起构象的变化,从而影响转录的效率。 Flexible DNA binding domain 图19-16转录因子与转录复合体相互作用模式图 图19.16所示,作为蛋白质的转录因子从功能上分析其结构可包含有不同区域,①DNA结合域(DNa binding domain),多由60·100个氨 基酸残基组织的几个亚区组成;②转录激活域(activating domain),常由30·I00氨基酸残基组成,这结构域有富含酸性氨基酸、富含谷氨酰 胺、富含脯氨酸等不同种类,以酸性结构域最多见;③连接区,即连接上两个结构域的部分。不与DNA直接结合的转录因子没有DNA结合 域,但能通过转录激活域直接或间接作用于转录复合体而影响转录效率。 与DNA结合的转录因子大多以二聚体形式起作用,与DNA结合的功能域常见有以下几种:
TFⅢ,对TFⅡ研究最多。表19-2列出真核基因转录需要基本的TFⅡ。 表19-2 RNA聚合酶Ⅱ的基本转录因子 转录因子 分子量(kD) 功能 TBP 30 与TATA盒结合 TFⅡ-B 33 介导RNA聚合酶Ⅱ的结合 TFⅡ-F 30,74 解旋酶 TFⅡ-E 34,37 ATP酶 TFⅡ-H 62,89 解旋酶 TFⅡ-A 12,19,35 稳定TFⅡ-D的结合 TFⅡ-I 120 促进TFⅡ-D的结合 以前认为与TATA盒结合的蛋白因子是TFⅡ-D,后来发现TFⅡ-D实际包括两类成分:与TATA盒结合的蛋白是TBP(TATAbox binding protein),是唯一能识别TATA盒并与其结合的转录因子,是三种RNA聚合酶转录时都需要的;其他称为TBP相关因子(TBP?associated factors TAF),至少包括8种能与TBP紧密结合的因子。转录前先是TFⅡ-D与TATA盒结合;继而TFⅡ-B以其C端与TBP-DNA复合体结合,其N端则 能与RNA聚合酶Ⅱ亲和结合,接着由两个亚基组成的TFⅡ-F加入装配,TFⅡ-F能与RNA聚合酶形成复合体,还具有依赖于ATP供给能量的 DNA解旋酶活性,能解开前方的DNA双螺旋,在转录链延伸中起作用。这样,启动子序列就与TFⅡ-D、B、F及RNA聚合酶Ⅱ结合形成一 个“最低限度”能有转录功能基础的转录前起始复合物(pre?intitiationcomplex, PIC),能转录mRNA。TFⅡ-H是多亚基蛋白复合体,具有依赖 于ATP供给能量的DNA解旋酶活性,在转录链延伸中发挥作用;TFⅡ-E是两个亚基组成的四聚体,不直接与DNA结合而可能是与TFⅡ-B联 系,能提高ATP酶的活性;TFⅡ-E和TFⅡ-H的加入就形成完整的转录复合体(图19?5),能转录延伸生成长链RNA,TFⅡ-A能稳定TFⅡ-D与 TATA盒的结合,提高转录效率,但不是转录复合体一定需要的。 图19-15 RNA聚合酶Ⅱ转录复合体的形成示意图 以上所述是典型的启动子上转录复合体的形成,但有的真核启动子不含TATA盒或不通过TATA盒开始转录。例如有的无TATA盒的启动子 是靠TFⅡ-I和TFⅡ-D共同组成稳定的转录起始复合体开始转录的。由此可以看到真核转录起始的复杂性。 不同基因由不同的上游启动子元件组成,能与不同的转录因子结合,这些转录因子通过与基础的转录复合体作用而影响转录的效率。现在 已经发现有许多不同的转录因子,看到的现象是:同一DNA序列可被不同的蛋白因子所识别;能直接结合DNA序列的蛋白因子是少数,但不 同的蛋白因子间可以相互作用,因而多数转录因子是通过蛋白质-蛋白质间作用与DNA序列联系并影响转录效率的(见图19-16)。转录因子之 间或转录因子与DNA的结合都会引起构象的变化,从而影响转录的效率。 图19-16 转录因子与转录复合体相互作用模式图 图19-16所示,作为蛋白质的转录因子从功能上分析其结构可包含有不同区域,①DNA结合域(DNa binding domain),多由60-100个氨 基酸残基组织的几个亚区组成;②转录激活域(activating domain),常由30-100氨基酸残基组成,这结构域有富含酸性氨基酸、富含谷氨酰 胺、富含脯氨酸等不同种类,以酸性结构域最多见;③连接区,即连接上两个结构域的部分。不与DNA直接结合的转录因子没有DNA结合 域,但能通过转录激活域直接或间接作用于转录复合体而影响转录效率。 与DNA结合的转录因子大多以二聚体形式起作用,与DNA结合的功能域常见有以下几种: