
海南大学棒*专业课程教学大组 《无机化学A》课程教学大纲 课程中文名称(英文名称):无机化学A(Inorganic Chemistry A) 课程代码:GHX024 课程类别:学科基础必修课 课程性质:必修课 课程学时:64学时 学分:4学分 适用专业:应用化学、化学工程与工艺 先修课程:高等数学、高中化学 一、课程介绍 《无机化学》是研究无机物质组成、结构、性质和变化规律的一门科学,对无机化学的基本概 念、化学反应中的能量变化、化学反应速度和化学平衡、电解质的电离平衡、氧化还原和电化学、物 质结构基础、重要元素及其化合物的性质等知识进行系统讲解,使学生掌握无机化学的化学反应基 本原理、物质结构的基础理论和元素化学的基本理论和基础知识,同时使学生了解无机化学相关的 新领域,开阔学生的眼界,为后续课程学习打下坚实的基础。 本门课程为化学及化工专业必修的第一门化学基础课,于第一学年开设。 二、课程教学目的和任务 通过本门课程学习,学生将掌握理想气体状态方程式、化学热力学、化学动力学、化学平衡、 酸碱平衡、沉淀溶解平衡、氧化还原、元素周期律、原子结构、分子结构等基本原理知识,以及重 要元素和化合物的主要结构、性质、制备、用途,培养学生独立利用无机化学知识解决具体实践问 题、自学和利用参考资料等方面的能力,也为后续课程的学习和未来工作奠定扎实理论基础。各章 列出课程教学任务及基本要求如下。 第一章气体 熟练掌握理想气体状态方程。 掌握分压、分体积概念及计算。 理解真实气体与理想气体的偏差,理解范德华方程。 了解气体分子动理论。 第二章热化学 理解热力学的术语和基本概念。 熟练掌握热力学第一定律文字表述和数学表达式
海南大学*****专业课程教学大纲 《无机化学A》课程教学大纲 课程中文名称(英文名称):无机化学 A (Inorganic Chemistry A) 课程代码: GHX024 课程类别:学科基础必修课 课程性质:必修课 课程学时: 64 学时 学 分: 4 学分 适用专业: 应用化学、化学工程与工艺 先修课程:高等数学、高中化学 一、课程介绍 《无机化学》是研究无机物质组成、结构、性质和变化规律的一门科学,对无机化学的基本概 念、化学反应中的能量变化、化学反应速度和化学平衡、电解质的电离平衡、氧化还原和电化学、 物 质结构基础、重要元素及其化合物的性质等知识进行系统讲解,使学生掌握无机化学的化学反应基 本原理、物质结构的基础理论和元素化学的基本理论和基础知识,同时使学生了解无机化学相关的 新领域,开阔学生的眼界,为后续课程学习打下坚实的基础。 本门课程为化学及化工专业必修的第一门化学基础课,于第一学年开设。 二、课程教学目的和任务 通过本门课程学习,学生将掌握理想气体状态方程式、化学热力学、化学动力学、化学平衡、 酸碱平衡、沉淀溶解平衡、氧化还原、元素周期律、原子结构、分子结构等基本原理知识,以及重 要元素和化合物的主要结构、性质、制备、用途,培养学生独立利用无机化学知识解决具体实践问 题、自学和利用参考资料等方面的能力,也为后续课程的学习和未来工作奠定扎实理论基础。各章 列出课程教学任务及基本要求如下。 第一章 气体 熟练掌握理想气体状态方程。 掌握分压、分体积概念及计算。 理解真实气体与理想气体的偏差,理解范德华方程。 了解气体分子动理论。 第二章 热化学 理解热力学的术语和基本概念。 熟练掌握热力学第一定律文字表述和数学表达式

海南大学*专业课程教学大钢 理解功、热、热力学能、烙、标准摩尔反应焓、标准摩尔生成格、标准摩尔燃烧焓等概念。 掌握Hess定律及反应热效应计算方法。 第三章化学动力学基础 理解化学反应速率的概念。 理解反应速率常数以及反应级数的概念。 掌握通过实验确立速率方程的方法。 了解一级、二级反应的速率方程及其应用 理解阿累尼乌斯方程的意义,并掌握其应用。 理解活化能及指前因子的意义。 理解气相双分子碰撞理论和过渡状态理论的基本观点及有关概念。 了解基元反应速率理论的基本思想:了解催化作用。(可自学) 第四章化学平衡熵和Gibbs函数 掌握标准平衡常数的定义、计算及实验测定。 熟练掌握标准平衡常数的应用。 理解化学平衡的移动及影响因素。 了解热力学第三定律,规定熵、标准嫡,理解标准摩尔反应熵定义及计算 理解热力学第二定律的意义。 掌握吉布斯函数变判据、标准摩尔生成吉布斯函数△fGm、△rGm9的计算及与平衡的关系。 理解范特霍夫方程。 第五章酸碱平衡 理解酸碱质子理论的基本概念 掌握水的解离平衡和溶液的pH。 熟练掌握一元弱酸弱碱和盐的解离平衡及计算,掌握多元弱酸的解离平衡。 熟练掌握缓冲溶液州计算,理解缓冲溶液的作用原理。 掌握配合物的组成、化学式与命名,配位反应和配位平衡的有关计算。 第六章沉淀溶解平衡 理解溶解度和溶度积的概念,熟练掌握溶度积与溶解度的关系及计算。 熟练掌握溶度积规则、理解影响沉淀-溶解平衡的因素: 掌握沉淀-溶解平衡的移动的有关计算: 掌握分步沉淀及沉淀的转化。 第七章氧化还原反应电化学基础 理解氧化还原反应基本概念: 掌握分子离子法配平氧化还原方程式的方法: 了解原电池的组成、电能与化学能互变的规律: 掌握原电池的表达符号:
海南大学*****专业课程教学大纲 理解功、热、热力学能、焓、标准摩尔反应焓、标准摩尔生成焓、标准摩尔燃烧焓等概念。 掌握 Hess 定律及反应热效应计算方法。 第三章 化学动力学基础 理解化学反应速率的概念。 理解反应速率常数以及反应级数的概念。 掌握通过实验确立速率方程的方法。 了解一级、二级反应的速率方程及其应用。 理解阿累尼乌斯方程的意义,并掌握其应用。 理解活化能及指前因子的意义。 理解气相双分子碰撞理论和过渡状态理论的基本观点及有关概念。 了解基元反应速率理论的基本思想;了解催化作用。(可自学) 第四章 化学平衡 熵和 Gibbs 函数 掌握标准平衡常数的定义、计算及实验测定。 熟练掌握标准平衡常数的应用。 理解化学平衡的移动及影响因素。 了解热力学第三定律,规定熵、标准熵,理解标准摩尔反应熵定义及计算。 理解热力学第二定律的意义。 掌握吉布斯函数变判据、标准摩尔生成吉布斯函数ΔfGm、ΔrGm 的计算及与平衡的关系。 理解范特霍夫方程。 第五章 酸碱平衡 理解酸碱质子理论的基本概念。 掌握水的解离平衡和溶液的 pH。 熟练掌握一元弱酸弱碱和盐的解离平衡及计算,掌握多元弱酸的解离平衡。 熟练掌握缓冲溶液 pH 计算,理解缓冲溶液的作用原理。 掌握配合物的组成、化学式与命名,配位反应和配位平衡的有关计算。 第六章 沉淀溶解平衡 理解溶解度和溶度积的概念,熟练掌握溶度积与溶解度的关系及计算。 熟练掌握溶度积规则、理解影响沉淀-溶解平衡的因素; 掌握沉淀-溶解平衡的移动的有关计算; 掌握分步沉淀及沉淀的转化。 第七章 氧化还原反应 电化学基础 理解氧化还原反应基本概念; 掌握分子离子法配平氧化还原方程式的方法; 了解原电池的组成、电能与化学能互变的规律; 掌握原电池的表达符号;

海南大学棒*专业课程教学大钢 掌握电极电势的概念,熟练掌握Nernst方程式的计算: 掌握电极电势的应用、元素电势图的意义及应用 第八章原子结构 了解原子结构的波尔理论,了解微观粒子的波粒二象性,不确定原理与微观粒子运动的统计规 律(可自学)。 理解波函数、能级的概念 掌握四个量子数的物理意义、5、p、d原子轨道的形状和伸展方向、原子轨道能级图、原子基 态的核外电子排布规律: 掌握多电子原子的电子层结构、能级及核外电子排布: 掌握元素周期表结构、理解元素性质的周期性。 第九章分子结构 掌握价键理论的基本内容: 掌握杂化轨道理论和价层电子对互斥理论的基本内容及在判别分子构型中的应用: 理解分子轨道理论的基本内容: 掌握02、2的分子轨道排布: 了解键参数意义。 第十章固体结构 了解品体结构的特征与晶格理论,晶体类型: 掌握离子晶体的结构、晶格能概念: 了解金属品体的概念,理解金属健理论,能带理论: 掌握离子极化原理和离子极化对物质性质的影响: 了解分子晶体的结构,理解分子偶极矩、分子间作用力以及氢链。 第十一章配合物结构 了解配合物的空间构型、异构现象和磁性: 掌握配合物的价键理论的要点,并用于解释配合物的有关性质: 掌握晶体场理论,并用于解释配合物的有关性质。 第十二章S区元素 了解碱金属和碱土金属元素的通性、性质与结构、一般的制备方法以及性质: 掌握碱金属和碱土金属元素的氢氧化物的碱性和溶解性,以及它们盐类的溶解性、稳定性等性 质的变化规律。 了解锂、铍的特性及对角线规则。 第十三章P区元素 根据元素在周期表中的位置及原子结构的特点理解和掌握非金属元素的通性。 掌握硼的单质、氢化物、含氧化合物的结构与性质,硼原子的结构特点和硼在形成化合物时的
海南大学*****专业课程教学大纲 掌握电极电势的概念,熟练掌握 Nernst 方程式的计算; 掌握电极电势的应用、元素电势图的意义及应用。 第八章 原子结构 了解原子结构的波尔理论,了解微观粒子的波粒二象性,不确定原理与微观粒子运动的统计规 律(可自学)。 理解波函数、能级的概念; 掌握四个量子数的物理意义、s、p、d 原子轨道的形状和伸展方向、原子轨道能级图、原子基 态的核外电子排布规律; 掌握多电子原子的电子层结构、能级及核外电子排布; 掌握元素周期表结构、理解元素性质的周期性。 第九章 分子结构 掌握价键理论的基本内容; 掌握杂化轨道理论和价层电子对互斥理论的基本内容及在判别分子构型中的应用; 理解分子轨道理论的基本内容; 掌握 O2、N2 的分子轨道排布; 了解键参数意义。 第十章 固体结构 了解晶体结构的特征与晶格理论,晶体类型; 掌握离子晶体的结构、晶格能概念; 了解金属晶体的概念,理解金属键理论,能带理论; 掌握离子极化原理和离子极化对物质性质的影响; 了解分子晶体的结构,理解分子偶极矩、分子间作用力以及氢键。 第十一章 配合物结构 了解配合物的空间构型、异构现象和磁性; 掌握配合物的价键理论的要点,并用于解释配合物的有关性质; 掌握晶体场理论,并用于解释配合物的有关性质。 第十二章 S 区元素 了解碱金属和碱土金属元素的通性、性质与结构、一般的制备方法以及性质; 掌握碱金属和碱土金属元素的氢氧化物的碱性和溶解性,以及它们盐类的溶解性、稳定性等性 质的变化规律。 了解锂、铍的特性及对角线规则。 第十三章 P 区元素 根据元素在周期表中的位置及原子结构的特点理解和掌握非金属元素的通性。 掌握硼的单质、氢化物、含氧化合物的结构与性质,硼原子的结构特点和硼在形成化合物时的
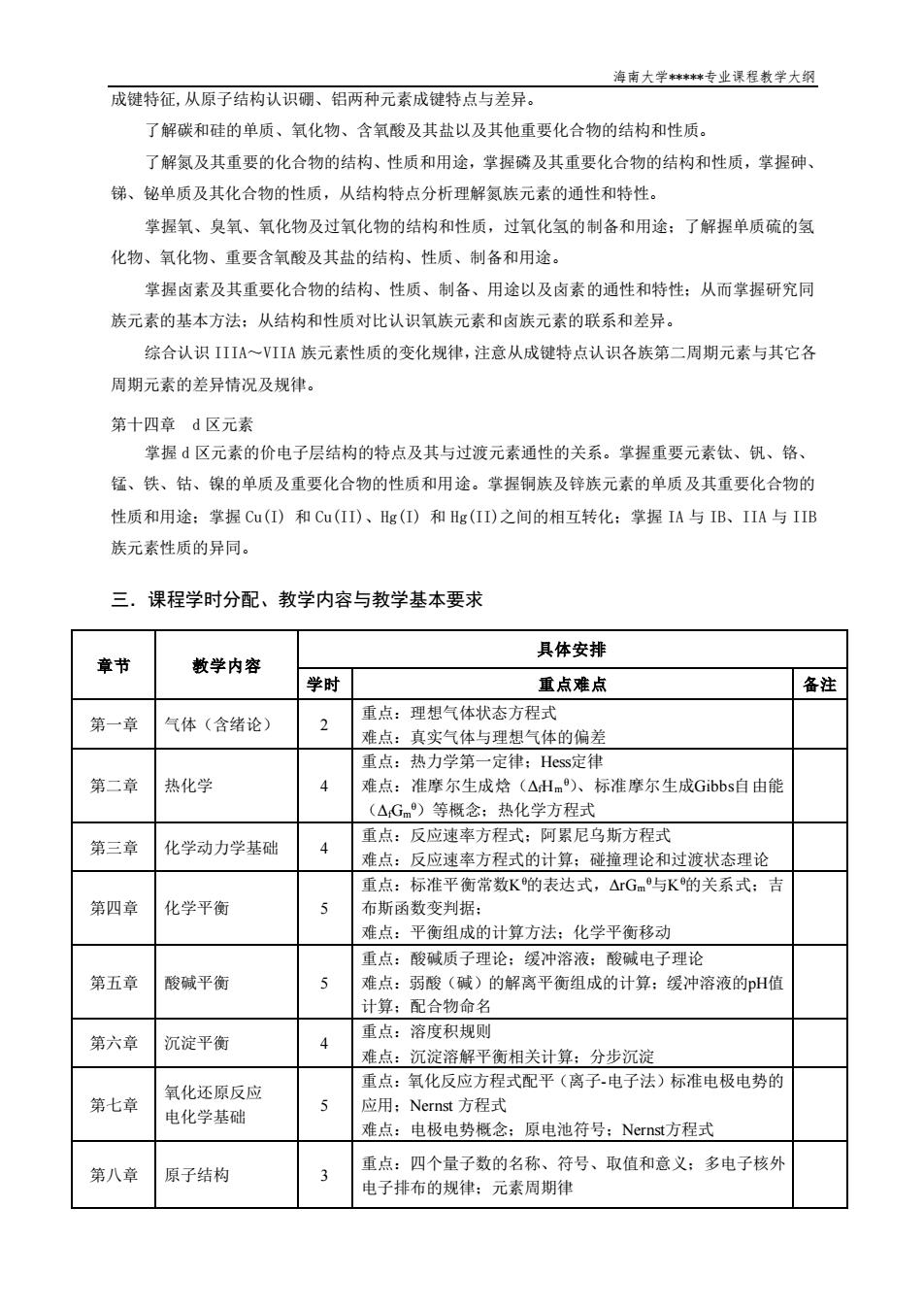
海南大学**专业课程教学大钢 成键特征,从原子结构认识硼、铝两种元素成键特点与差异。 了解碳和硅的单质、氧化物、含氧酸及其盐以及其他重要化合物的结构和性质。 了解氨及其重要的化合物的结构、性质和用途,掌握磷及其重要化合物的结构和性质,掌握砷 绨、铋单质及其化合物的性质,从结构特点分析理解氮族元素的通性和特性。 掌握氧、臭氧、氧化物及过氧化物的结构和性质,过氧化氢的制备和用途:了解握单质硫的氢 化物、氧化物、重要含氧酸及其盐的结构、性质、制备和用途。 掌握卤素及其重要化合物的结构、性质、制备、用途以及卤素的通性和特性:从而掌握研究同 族元素的基本方法:从结构和性质对比认识氧族元素和卤族元素的联系和差异。 综合认识IIIA~VIA族元素性质的变化规律,注意从成键特点认识各族第二周期元素与其它各 周期元素的差异情况及规律 第十四章d区元素 掌握d区元素的价电子层结构的特点及其与过渡元素通性的关系。掌握重要元素钛、钒、铬、 锰、铁、钴、镍的单质及重要化合物的性质和用途。掌握铜族及锌族元素的单质及其重要化合物的 性质和用途:掌握Cu()和Cu(II)、Hg()和Hg(II)之间的相互转化:掌握IA与IB、IIA与IIB 族元素性质的异同。 三.课程学时分配、教学内容与教学基本要求 章节 教学内容 具体安排 学时 重点难点 备注 重点:理相气体状态方程式 第一章 气体(含绪论】 难点:真实气体与理想气体的偏差 重点:热力学第一定律:Hes定有 第二章 热化学 难点:准摩尔生成格(△Hm)、标准摩尔生成Gibbs自由能 (△,Gm)等概念:热化学方程式 重点:反应速率方程式:阳累尼乌斯方程式 第三章 化学动力学基础 难点:反应速率方程式的计算:碰撞理论和过渡状态理论 重点:标准平衡常数K的表达式,△rGm与K的关系式:吉 第四章 化学平衡 布斯函数变判据: 难点:平衡组成的计算方法:化学平衡移动 重点:酸碱质子理论:缓冲溶液:酸碱电子理论 第五章 酸碱平衡 弱酸(碱)的解离平衡组成的计算:缓冲溶液的H馆 计算:配合物命名 重点:溶度积规则 第六章 沉淀平衡 难点:沉淀溶解平衡相关计算:分步沉淀 重点:氧化反应方程式配平(离子电子法)标准电极电势的 第七章 氧化还原反应 电化学基础 5 应用:Nernst方程式 滩点:电极电势概念:原电池符号:Nernst方程式 第八章 原子结构 重点:四个量子数的名称、符号、取值和意义:多电子核外 电子排布的规律:元素周期律
海南大学*****专业课程教学大纲 成键特征,从原子结构认识硼、铝两种元素成键特点与差异。 了解碳和硅的单质、氧化物、含氧酸及其盐以及其他重要化合物的结构和性质。 了解氮及其重要的化合物的结构、性质和用途,掌握磷及其重要化合物的结构和性质,掌握砷、 锑、铋单质及其化合物的性质,从结构特点分析理解氮族元素的通性和特性。 掌握氧、臭氧、氧化物及过氧化物的结构和性质,过氧化氢的制备和用途;了解握单质硫的氢 化物、氧化物、重要含氧酸及其盐的结构、性质、制备和用途。 掌握卤素及其重要化合物的结构、性质、制备、用途以及卤素的通性和特性;从而掌握研究同 族元素的基本方法;从结构和性质对比认识氧族元素和卤族元素的联系和差异。 综合认识 IIIA~VIIA 族元素性质的变化规律,注意从成键特点认识各族第二周期元素与其它各 周期元素的差异情况及规律。 第十四章 d 区元素 掌握 d 区元素的价电子层结构的特点及其与过渡元素通性的关系。掌握重要元素钛、钒、铬、 锰、铁、钴、镍的单质及重要化合物的性质和用途。掌握铜族及锌族元素的单质及其重要化合物的 性质和用途;掌握 Cu(I) 和 Cu(II)、Hg(I) 和 Hg(II)之间的相互转化;掌握 IA 与 IB、IIA 与 IIB 族元素性质的异同。 三.课程学时分配、教学内容与教学基本要求 章节 教学内容 具体安排 学时 重点难点 备注 第一章 气体(含绪论) 2 重点:理想气体状态方程式 难点:真实气体与理想气体的偏差 第二章 热化学 4 重点:热力学第一定律;Hess定律 难点:准摩尔生成焓(ΔfHm θ)、标准摩尔生成Gibbs自由能 (ΔfGm θ)等概念;热化学方程式 第三章 化学动力学基础 4 重点:反应速率方程式;阿累尼乌斯方程式 难点:反应速率方程式的计算;碰撞理论和过渡状态理论 第四章 化学平衡 5 重点:标准平衡常数Kθ的表达式,ΔrGm θ与Kθ的关系式;吉 布斯函数变判据; 难点:平衡组成的计算方法;化学平衡移动 第五章 酸碱平衡 5 重点:酸碱质子理论;缓冲溶液;酸碱电子理论 难点:弱酸(碱)的解离平衡组成的计算;缓冲溶液的pH值 计算;配合物命名 第六章 沉淀平衡 4 重点:溶度积规则 难点:沉淀溶解平衡相关计算;分步沉淀 第七章 氧化还原反应 电化学基础 5 重点:氧化反应方程式配平(离子-电子法)标准电极电势的 应用;Nernst 方程式 难点:电极电势概念;原电池符号;Nernst方程式 第八章 原子结构 3 重点:四个量子数的名称、符号、取值和意义;多电子核外 电子排布的规律;元素周期律
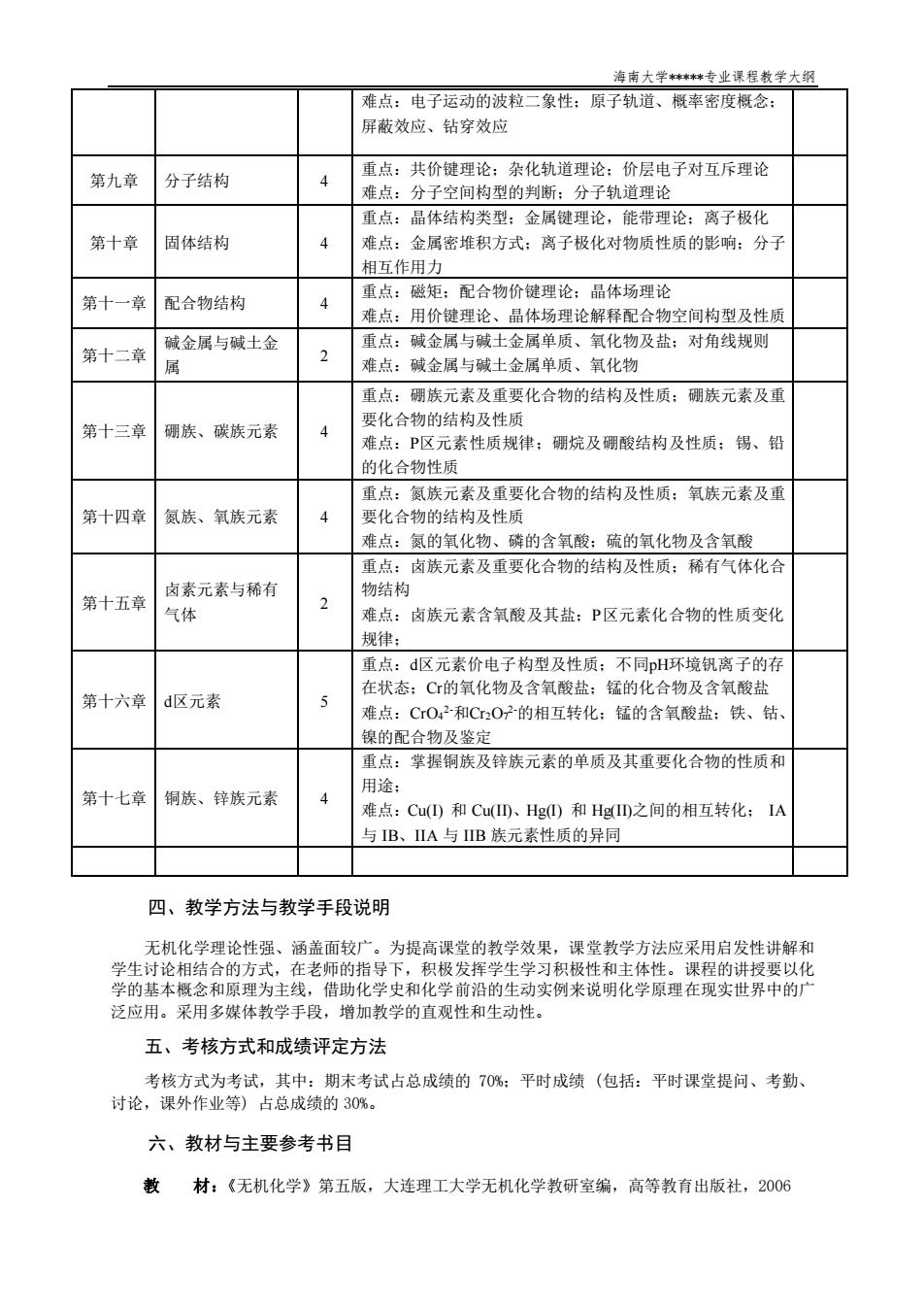
海南大学**专业课程教学大钢 难点:电子运动的波粒二象性:原子轨道、概率密度概念: 屏素效应、钻穿效应 第九章 分子结构 重点:共价键理论:杂化轨道理论:价层电子对互斥理论 难点:分子空间构型的判断:分子轨道理论 重点:品体结构类型:金属键理论,能带理论:离子极化 第十章 固体结构 难点:金属密堆积方式:离子极化对物质性质的影响:分子 相互作用力 第十一章配合物结构 重点:磁矩:配合物价键理论:晶体场理论 4 难占,用价键理论、品体场理论解轻配合物空间构型及性质 第十二章 碱金属与碱土金 重点:碱金属与碱土金属单质、氧化物及盐:对角线规则 2 屈 难点:碱金属与碱土金属单质、氧化物 重点:硼族元素及重要化合物的结构及性质:硼族元素及重 第十三章 硼族、碳族元素 要化合物的结构及性质 难点:P区元素性质规律:硼烷及硼酸结构及性质:锡、铅 的化合物性质 重点:氮族元素及重要化合物的结构及性质:氧族元素及重 第十四章 氮族、氧族元素 4 要化合物的结构及性质 难点:氨的氧化物、磷的含氧酸:硫的氧化物及含氧酸 重点:卤族元素及重要化合物的结构及性质:稀有气体化合 物结构 第十五章 卤素元素与稀有 气体 难点:卤族元素含氧酸及其盐:P区元素化合物的性质变化 规律 重点:d区元素价电子构型及性质:不同H环境钒离子的存 在状态:C的氧化物及含氧酸盐:锰的化合物及含氧酸盐 第十六章d区元素 难点:CO42和CO72-的相互转化:锰的含氧酸盐:铁、钴 锦的配合物及鉴定 重点:掌握铜族及锌族元素的单质及其重要化合物的性质和 第十七章铜族、锌族元素 用途 难点:Cu()和CuID、Hg)和HgID之间的相互转化:IA 与IB、A与B族元素性质的异同 四、教学方法与教学手段说明 无机化学理论性强、函盖面较广,为提高课微的教学效果,课赏数学方法应采用启发性进解和 学生讨论相结合的方式,在老师的指导下,积极发挥学生学习积极性和主体性。课程的讲授要以化 学的基本概念和原理为主线,借助化学史和化学前沿的生动实例来说明化学原理在现实世界中的广 泛应用。采用多媒体教学手段,增加教学的直观性和生动性。 五、考核方式和成绩评定方法 考核方式为考试,其中:期末考试占总成绩的70%:平时成绩(包括:平时课堂提问、考勤、 讨论,课外作业等)占总成绩的30%。 六、教材与主要参考书目 教材:《无机化学》第五版,大连理工大学无机化学教研室编,高等教有出版社,2006
海南大学*****专业课程教学大纲 难点:电子运动的波粒二象性;原子轨道、概率密度概念; 屏蔽效应、钻穿效应 第九章 分子结构 4 重点:共价键理论;杂化轨道理论;价层电子对互斥理论 难点:分子空间构型的判断;分子轨道理论 第十章 固体结构 4 重点:晶体结构类型;金属键理论,能带理论;离子极化 难点:金属密堆积方式;离子极化对物质性质的影响;分子 相互作用力 第十一章 配合物结构 4 重点:磁矩;配合物价键理论;晶体场理论 难点:用价键理论、晶体场理论解释配合物空间构型及性质 第十二章 碱金属与碱土金 属 2 重点:碱金属与碱土金属单质、氧化物及盐;对角线规则 难点:碱金属与碱土金属单质、氧化物 第十三章 硼族、碳族元素 4 重点:硼族元素及重要化合物的结构及性质;硼族元素及重 要化合物的结构及性质 难点:P区元素性质规律;硼烷及硼酸结构及性质;锡、铅 的化合物性质 第十四章 氮族、氧族元素 4 重点:氮族元素及重要化合物的结构及性质;氧族元素及重 要化合物的结构及性质 难点:氮的氧化物、磷的含氧酸;硫的氧化物及含氧酸 第十五章 卤素元素与稀有 气体 2 重点:卤族元素及重要化合物的结构及性质;稀有气体化合 物结构 难点:卤族元素含氧酸及其盐;P区元素化合物的性质变化 规律; 第十六章 d区元素 5 重点:d区元素价电子构型及性质;不同pH环境钒离子的存 在状态;Cr的氧化物及含氧酸盐;锰的化合物及含氧酸盐 难点:CrO4 2-和Cr2O7 2-的相互转化;锰的含氧酸盐;铁、钴、 镍的配合物及鉴定 第十七章 铜族、锌族元素 4 重点:掌握铜族及锌族元素的单质及其重要化合物的性质和 用途; 难点:Cu(I) 和 Cu(II)、Hg(I) 和 Hg(II)之间的相互转化; IA 与 IB、IIA 与 IIB 族元素性质的异同 四、教学方法与教学手段说明 无机化学理论性强、涵盖面较广。为提高课堂的教学效果,课堂教学方法应采用启发性讲解和 学生讨论相结合的方式,在老师的指导下,积极发挥学生学习积极性和主体性。课程的讲授要以化 学的基本概念和原理为主线,借助化学史和化学前沿的生动实例来说明化学原理在现实世界中的广 泛应用。采用多媒体教学手段,增加教学的直观性和生动性。 五、考核方式和成绩评定方法 考核方式为考试,其中:期末考试占总成绩的 70%;平时成绩 (包括:平时课堂提问、考勤、 讨论,课外作业等) 占总成绩的 30%。 六、教材与主要参考书目 教 材:《无机化学》第五版,大连理工大学无机化学教研室编,高等教育出版社,2006

海南大学专业课程教学大钢 参考书目: 无机化学(第2版),宋天佑,徐家宁,程功臻,史苏华,高等教有出版社,2010 无机化学(第四版),杨宏孝,颜秀茹,高等教育出版社出版,2010 3. 无机化学,龚孟瀛,科学出版社,2010 4.无机化学,黄可龙,科学出版社,2007 执笔人:尹学琼 审核人 批准人: 审定时间:2017年6月6日
海南大学*****专业课程教学大纲 参考书目: 1. 无机化学(第 2 版),宋天佑,徐家宁,程功臻,史苏华, 高等教育出版社, 2010 2. 无机化学(第四版),杨宏孝,颜秀茹,高等教育出版社出版,2010 3. 无机化学,龚孟濂,科学出版社,2010 4. 无机化学,黄可龙,科学出版社,2007 执笔人:尹学琼 审核人: 批准人: 审定时间: 2017 年 6 月 6 日