
实验十二质粒DNA的小量制备、电泳检测及细菌转化 I.质粒DNA的小量制备 一实验目的 学习并掌握质粒的小量制备技术。 二实验材料和用具 菌种:E.coli DH5apUC19 培养基:LB:Tryptone1%,Yeast Extract0.5%,NaCI 19%,pH7.2 (Agar2%):120℃灭菌20min。 D0O01碧云天质粒小量抽提试剂盒(或其它公司的产品) 恒温培养箱、恒温摇床、超净工作台、台式高速离心机、台式小型振荡仪、P管 (Eppendorf管,1.5ml微量离心管入、加样器、吸头等。 三原理 实验采用国产的质粒小量抽提试剂盒。它是一种新型的离子交换柱,在特 定的条件下,使质粒能在离心过柱的瞬间,结合到质粒纯化柱上,在一定条件下 又能将质粒充分洗脱,从而实现质粒的快速纯化。而且在提取过程中,无需酚 氯仿抽提、无需酒精沉淀,可在较短时间内完成质粒的提取和纯化。 四实验内容 1.细菌培养及茵体的收获。 2.用试剂盒进行小量质粒制备 五实验步骤 1.将E.co菌株接种到液体LB培养基中,加入氨苄青霉素至100μgml,150rpm振荡16h: 2.吸取1.5ml培养南液与1.5ml离心管中,13000rpm室温下离心2min。倒掉上清,然后 倒置于吸水纸上,使液体流尽:
实验十二 质粒 DNA 的小量制备、电泳检测及细菌转化 Ⅰ. 质粒 DNA 的小量制备 一 实验目的 学习并掌握质粒的小量制备技术。 二 实验材料和用具 菌种:E.coli DH5/pUC19 培养基:LB:Tryptone 1%,Yeast Extract 0.5%,NaCl 1%,pH7.2 (Agar 2%);120℃灭菌 20min。 D0001 碧云天质粒小量抽提试剂盒(或其它公司的产品) 恒温培养箱、恒温摇床、超净工作台、台式高速离心机、台式小型振荡仪、 EP 管 (Eppendorf 管,1.5ml 微量离心管)、加样器、吸头等。 三 原理 实验采用国产的质粒小量抽提试剂盒。它是一种新型的离子交换柱,在特 定的条件下,使质粒能在离心过柱的瞬间,结合到质粒纯化柱上,在一定条件下 又能将质粒充分洗脱,从而实现质粒的快速纯化。而且在提取过程中,无需酚- 氯仿抽提、无需酒精沉淀,可在较短时间内完成质粒的提取和纯化。 四 实验内容 1. 细菌培养及菌体的收获。 2. 用试剂盒进行小量质粒制备。 五 实验步骤 1. 将 E.coli 菌株接种到液体 LB 培养基中,加入氨苄青霉素至 100g/ml,150rpm 振荡 16h; 2. 吸取 1.5ml 培养菌液与 1.5ml 离心管中,13000rpm 室温下离心 2min。倒掉上清,然后 倒置于吸水纸上,使液体流尽;

3.加入150ul溶液I,vortex或弹起沉淀,使完全散开,无絮块。 4.加入200如溶液Ⅱ,颠倒离心管68次,使细菌完全裂解,溶液透明,注意不能振荡: 5.加入500如l溶液Ⅲ,颠倒6-8次,可见白色絮状物产生: 6.13000pm离心10min。离心时准备好质粒纯化柱及最后的质粒收集管 7.直接将上清液倒入质粒纯化柱,13000pm离心1min,使质粒结合于纯化柱上: 8.倒弃收集管内的液体,在质粒纯化柱内加入750ul溶液V,13000pm离心1mim,洗去 杂质: 9.倒弃收集管内液体,13000pm离心1min,除去残留液体 10.将质粒纯化柱放在质粒收集管上,加50ul溶液V至管内柱面上,放置1min 11.13000rpm离心1min,所得液体就是质粒。质粒于-20℃冰箱保藏备用。 六注意事项 1.在使用前,在溶液V(洗涤液)加入40ml无水乙醇或43ml95%乙醇,然后在瓶盖 上作好记号。 2.溶液Ⅱ在温度较低时,可能会产生沉淀,需先用水浴加热溶解,混匀后再使用。溶 液Ⅱ易被空气中的CO2酸化,用完后应立即盖紧瓶盖。 七思考题 1.加入溶液Ⅱ后,为什么不能剧烈振荡 附录一:pUC19图谱
3. 加入 150l 溶液Ⅰ,vortex 或弹起沉淀,使完全散开,无絮块。 4. 加入 200l 溶液Ⅱ,颠倒离心管 6~8 次,使细菌完全裂解,溶液透明,注意不能振荡; 5. 加入 500l 溶液Ⅲ,颠倒 6~8 次,可见白色絮状物产生; 6. 13000rpm 离心 10min。离心时准备好质粒纯化柱及最后的质粒收集管; 7. 直接将上清液倒入质粒纯化柱,13000rpm 离心 1min,使质粒结合于纯化柱上; 8. 倒弃收集管内的液体,在质粒纯化柱内加入 750l 溶液Ⅳ,13000rpm 离心 1min,洗去 杂质; 9. 倒弃收集管内液体,13000rpm 离心 1min,除去残留液体; 10. 将质粒纯化柱放在质粒收集管上,加 50ul 溶液Ⅴ至管内柱面上,放置 1min; 11. 13000rpm 离心 1min,所得液体就是质粒。质粒于-20℃冰箱保藏备用。 六 注意事项 1. 在使用前,在溶液Ⅳ(洗涤液)加入 40ml 无水乙醇或 43ml95%乙醇,然后在瓶盖 上作好记号。 2. 溶液Ⅱ在温度较低时,可能会产生沉淀,需先用水浴加热溶解,混匀后再使用。溶 液Ⅱ易被空气中的 CO2 酸化,用完后应立即盖紧瓶盖。 七 思考题 1. 加入溶液Ⅱ后,为什么不能剧烈振荡? 附录一:pUC19 图谱

Ⅱ.质粒DNA的电泳检测 一实验目的 学习并掌握琼脂糖凝胶电泳检测DNA的技术。 二实验材料 琼脂糖,TAE缓冲液,加样缓冲液,溴化乙锭(EB),标准分子量Marker 电泳仪、稳压电源、凝胶电泳成像仪等 三实验原理 琼脂糖电泳或聚丙烯酰胺凝胶电泳是分离、鉴定和纯化D八NA片段的有效方法。琼脂糖 凝胶的分辨能力要比聚丙烯酰胺凝胶低,但其分离范围较广。用各种浓度的琼脂糖凝胶可分 离长度20Obp50kb的DNA.。琼脂糖凝胶通常采用水平装置在强度和方向恒定的电场下电 泳。直接用低浓度的荧光嵌入染料溴化乙锭进行染色,可确定DNA在凝胶中的位置。 四实验内容 对所提取的质粒DNA样品进行电泳检测 五实验步骤 1.制胶(见图3) ()胶模两端用胶带封严,架好梳子备用: (2)称取0,2g的琼脂糖于100ml烧杯中,加入20mTAE,加热熔化至无颗粒状琼脂糖 冷却到60℃左右加入EB(终浓度0.5μg/ml),摇匀,即倒入胶模中凝固30min以上: (3)临用前,撕去封口胶带,放入电泳槽中,倒入适量的电泳缓冲液TAE(淹过胶面), 拔取梳子备用。 2.样品准备 取已提取好的质粒DNA5ul于500ul指管中,加入1ul的加样缓冲液,混匀: 3.电泳 ()将样品和5标准分子质量分别点样到梳孔中:
Ⅱ. 质粒 DNA 的电泳检测 一 实验目的 学习并掌握琼脂糖凝胶电泳检测 DNA 的技术。 二 实验材料 琼脂糖,TAE 缓冲液,加样缓冲液,溴化乙锭(EB),标准分子量 Marker 电泳仪、稳压电源、凝胶电泳成像仪等 三 实验原理 琼脂糖电泳或聚丙烯酰胺凝胶电泳是分离、鉴定和纯化 DNA 片段的有效方法。琼脂糖 凝胶的分辨能力要比聚丙烯酰胺凝胶低,但其分离范围较广。用各种浓度的琼脂糖凝胶可分 离长度 200bp~50kb 的 DNA.。琼脂糖凝胶通常采用水平装置在强度和方向恒定的电场下电 泳。直接用低浓度的荧光嵌入染料溴化乙锭进行染色,可确定 DNA 在凝胶中的位置。 四 实验内容 对所提取的质粒 DNA 样品进行电泳检测。 五 实验步骤 1. 制胶(见图 3) (1) 胶模两端用胶带封严,架好梳子备用; (2) 称取 0.2g 的琼脂糖于 100ml 烧杯中,加入 20mlTAE,加热熔化至无颗粒状琼脂糖, 冷却到 60℃左右加入 EB(终浓度 0.5g/ml),摇匀,即倒入胶模中凝固 30min 以上; (3) 临用前,撕去封口胶带,放入电泳槽中,倒入适量的电泳缓冲液 TAE(淹过胶面), 拔取梳子备用。 2. 样品准备 取已提取好的质粒 DNA 5l 于 500l 指管中,加入 1l 的加样缓冲液,混匀; 3. 电泳 (1) 将样品和 5l 标准分子质量分别点样到梳孔中;
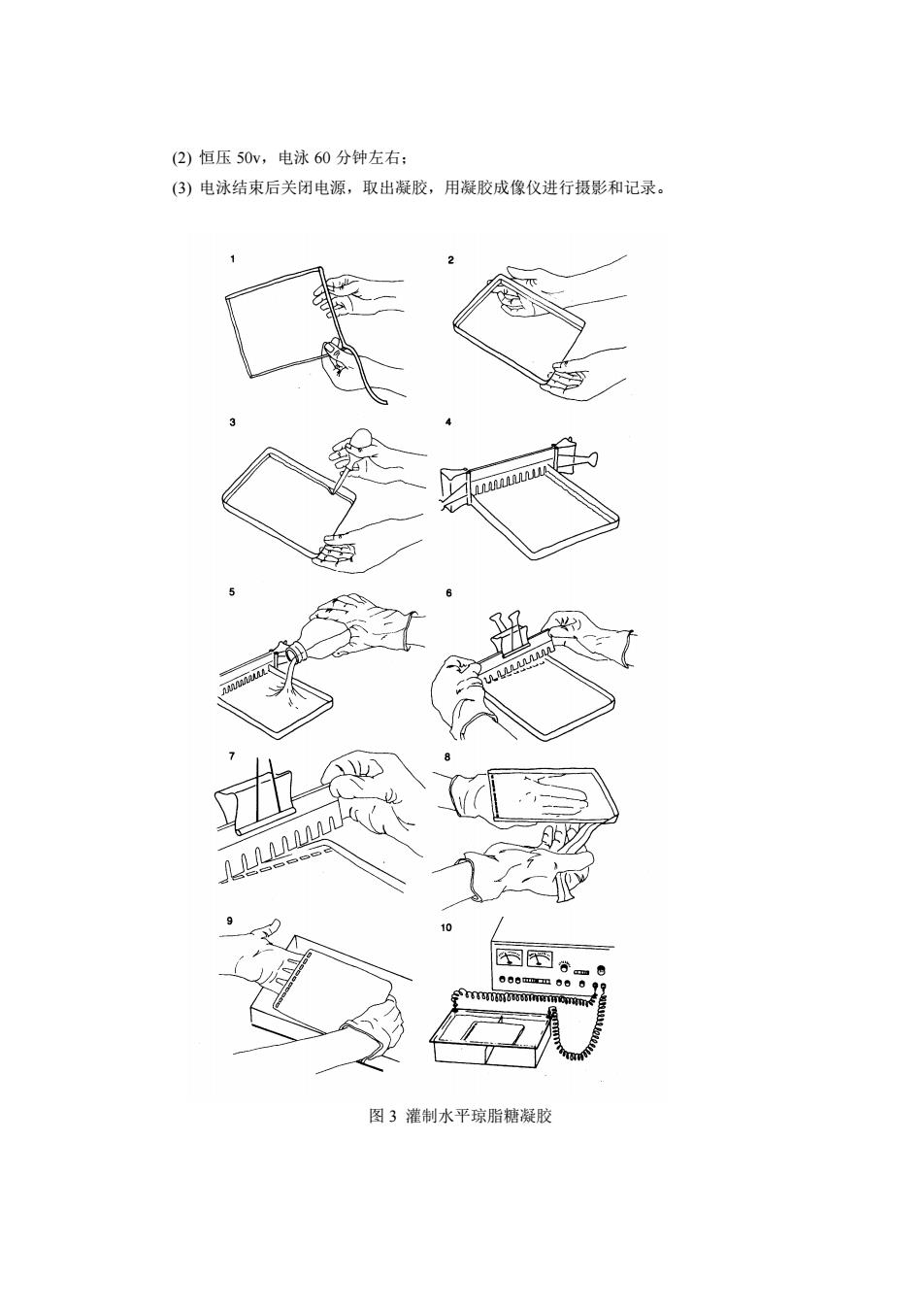
(2)恒压50v,电泳60分钟左右: (仔)电泳结束后关闭电源,取出凝胶,用凝胶成像仪进行摄影和记录。 图3灌制水平琼脂糖凝
(2) 恒压 50v,电泳 60 分钟左右; (3) 电泳结束后关闭电源,取出凝胶,用凝胶成像仪进行摄影和记录。 图 3 灌制水平琼脂糖凝胶

六实验结果 将质粒DNA条带与DNA MW Marker进行比对,对质粒提取结果进行分析。 七注意事项 溴化乙锭是强诱变剂,并有中度毒性,取用含有这一染料的溶液时务必戴上手套,这些 溶液经使用后应按下面介绍的方法进行净化处理。 附录一 溴化乙锭稀溶液的处理 (适用于含有0.5μgml的溴化乙锭的电泳缓冲液) 方法一 1.每100ml溶液中加入2.9 g Amberlite XAD-16,这是一种非离子型多聚吸附剂,可向 Rohm&Haas公司购置: 2.于室温放置12小时,不时摇动: 3.用Whatman 1滤纸过滤溶液,丢弃滤液: 4.用塑料袋封装滤纸和Amberlite树脂,作为有害废物予以丢弃。 方法二 1.每100ml溶液中加入100mg粉状活性炭: 2.于室温放置1小时,不时摇动: 3.用Whatman I号滤纸过滤溶液,丢弃滤液: 4.用塑料袋封装滤纸和活性炭,作为有害废物予以丢弃。 附录二 1.电泳缓冲液 Tris-乙酸(TAE):0.04mol/LTris-乙酸,0.001mol/LEDTA。 浓储藏液液(50×TAE):每升含有242 g Tris碱,57.1ml冰乙酸,10ml0.5 mol/LEDTA (pH8.0) 2.0.5mol/L EDTA (pH8.0) 在80ml蒸馏水中加入18.61 g EDTA-Na·2H2O,在磁力搅拌器上剧烈搅拌,用NaOH 调节溶液的pH值至8.0,然后定容至1000ml,分装后灭菌备用
六 实验结果 将质粒 DNA 条带与 DNA MW Marker 进行比对,对质粒提取结果进行分析。 七 注意事项 溴化乙锭是强诱变剂,并有中度毒性,取用含有这一染料的溶液时务必戴上手套,这些 溶液经使用后应按下面介绍的方法进行净化处理。 附录一 溴化乙锭稀溶液的处理 (适用于含有 0.5g/ml 的溴化乙锭的电泳缓冲液) 方法一 1. 每 100ml 溶液中加入 2.9g Amberlite XAD-16,这是一种非离子型多聚吸附剂,可向 Rohm & Haas 公司购置; 2. 于室温放置 12 小时,不时摇动; 3. 用 Whatman 1 滤纸过滤溶液,丢弃滤液; 4. 用塑料袋封装滤纸和 Amberlite 树脂,作为有害废物予以丢弃。 方法二 1. 每 100ml 溶液中加入 100mg 粉状活性炭; 2. 于室温放置 1 小时,不时摇动; 3. 用 Whatman 1 号滤纸过滤溶液,丢弃滤液; 4. 用塑料袋封装滤纸和活性炭,作为有害废物予以丢弃。 附录二 1. 电泳缓冲液 Tris-乙酸(TAE):0.04mol/L Tris-乙酸,0.001mol/L EDTA。 浓储藏液液(50×TAE):每升含有 242g Tris 碱,57.1ml 冰乙酸,10ml 0.5mol/L EDTA (pH8.0) 2. 0.5mol/L EDTA(pH8.0) 在 80ml 蒸馏水中加入 18.61g EDTA-Na·2H2O,在磁力搅拌器上剧烈搅拌,用 NaOH 调节溶液的 pH 值至 8.0,然后定容至 1000ml,分装后灭菌备用

Ⅲ大肠杆菌的转化实验 一实验目的 学习并掌握大肠杆菌感受态细胞的制备及外源基因导入细胞的技术 二实验材料和用具 南种:E.coli DH5a 质粒:pUC19: 培养基:LB: 1.LB液体试管:5ml/管 2.LB液体三角瓶:20ml/250ml三角瓶: 3.LB+Amp平板:Ampicillin加量100μgml: 器材:恒温培养箱、恒温摇床、离心机、超净工作台、高压蒸汽灭菌锅、涂布棒、EP 管、 可调移液器、吸头等。 三实验原理 转化活性是检测质粒生物活性的重要指标。用于转化的受体细胞一般是限制-修饰系统 缺陷的变异株,以防止对外源DNA的切割。质粒能否进入受体细胞取决于该细胞是否处于 容易吸收外源DNA的感受态。细胞的感受态可以通过理化因素诱导产生。大肠杆菌是常用 的受体南,其感受态一般是通过用CaC2在0℃条件下处理细胞而形成。细胞处于0℃的CaC2 低渗溶液中,会膨胀成球形,细胞膜的通透性发生改变,转化混合物中的质粒DNA形成抗 Dnase的羟基-钙磷酸复合粘附于细胞表面,经42℃短时间热激处理,促进细胞吸收DNA复 合物,在LB培养基上培养数小时后,球形细胞复原并增殖,在选择培养基上便可获得所需 的转化子。 四实验内容 1.制备E.coli DH5a的感受态细胞: 2.进行质粒pUC19的转化
Ⅲ 大肠杆菌的转化实验 一 实验目的 学习并掌握大肠杆菌感受态细胞的制备及外源基因导入细胞的技术。 二 实验材料和用具 菌种:E.coli DH5; 质粒:pUC19; 培养基:LB: 1. LB 液体试管:5ml/管; 2. LB 液体三角瓶:20ml/250ml 三角瓶; 3. LB+Amp 平板:Ampicillin 加量 100g/ml; 器材:恒温培养箱、恒温摇床、离心机、超净工作台、高压蒸汽灭菌锅、涂布棒、EP 管、 可调移液器、吸头等。 三 实验原理 转化活性是检测质粒生物活性的重要指标。用于转化的受体细胞一般是限制-修饰系统 缺陷的变异株,以防止对外源 DNA 的切割。质粒能否进入受体细胞取决于该细胞是否处于 容易吸收外源 DNA 的感受态。细胞的感受态可以通过理化因素诱导产生。大肠杆菌是常用 的受体菌,其感受态一般是通过用CaCl2 在0℃条件下处理细胞而形成。细胞处于0℃的CaCl2 低渗溶液中,会膨胀成球形,细胞膜的通透性发生改变,转化混合物中的质粒 DNA 形成抗 Dnase 的羟基-钙磷酸复合粘附于细胞表面,经 42℃短时间热激处理,促进细胞吸收 DNA 复 合物,在 LB 培养基上培养数小时后,球形细胞复原并增殖,在选择培养基上便可获得所需 的转化子。 四 实验内容 1. 制备 E.coli DH5的感受态细胞; 2. 进行质粒 pUC19 的转化

五操作步骤 1.菌种在LB液体培养基中活化,37℃,150rpm振荡培养过夜: 2.转接到新鲜LB液体培养基中,接种量5%: 3.37℃,150rpm培养至0D60o=0.2-0.25: 4.将培养液放入冰浴冷却10min: 5.取1.5ml培养液于6500rpm离心5min,弃上清液: 6.加0.75ml冰冷CaC溶液(50mmol/LCaC2,10mmol/LTris,pH8.0),用混匀器混匀 或用手指弹离心管混匀: 7.将离心管置于冰浴45min: 8.6S00rpm5min离心收集细胞 9.将细胞小心悬浮于0.1ml冰冷CaC,溶液中(用移液器小心混匀): 10.加1l质粒,小心混匀,置冰浴45min: 11.将离心管置于42℃恒温水浴热处理2min(准确:): 12.加1mlLB液体培养基后于37℃、150rpm振荡培养1h 13.取0.1ml培养液涂布至LB+Amp平板上: 14.将平板倒置于37℃恒温培养箱中培养过夜。 六实验结果 观察转化结果,并进行分析。 七思考题 1.本实验成功的关键是什么? 2.什么是感受态细胞,用什么方法获得感受态细胞? 3.本实验中转化的原理是什么?pUC19质粒有何特点?
五 操作步骤 1. 菌种在 LB 液体培养基中活化,37℃,150rpm 振荡培养过夜; 2. 转接到新鲜 LB 液体培养基中,接种量 5%; 3. 37℃,150rpm 培养至 OD600=0.2~0.25; 4. 将培养液放入冰浴冷却 10min; 5. 取 1.5ml 培养液于 6500rpm 离心 5min,弃上清液; 6. 加 0.75ml 冰冷 CaCl2 溶液(50mmol/LCaCl2,10mmol/L Tris,pH8.0),用混匀器混匀 或用手指弹离心管混匀; 7. 将离心管置于冰浴 45min; 8. 6500rpm 5min 离心收集细胞; 9. 将细胞小心悬浮于 0.1ml 冰冷 CaCl2 溶液中(用移液器小心混匀); 10. 加 1l 质粒,小心混匀,置冰浴 45min; 11. 将离心管置于 42℃恒温水浴热处理 2min(准确!); 12. 加 1mlLB 液体培养基后于 37℃、150rpm 振荡培养 1h; 13. 取 0.1ml 培养液涂布至 LB+Amp 平板上; 14. 将平板倒置于 37℃恒温培养箱中培养过夜。 六 实验结果 观察转化结果,并进行分析。 七 思考题 1. 本实验成功的关键是什么? 2. 什么是感受态细胞,用什么方法获得感受态细胞? 3. 本实验中转化的原理是什么?pUC19 质粒有何特点?