
实验十水的卫生细菌学检验(综合) )水中大肠菌群数的测定 一、目的要求 学习大肠菌群数的检测原理和方法。 二、实验材料 1.样品:水样 2.培养基:乳糖胆盐发酵管(单料及双料),伊红美兰琼脂(EMB)平板,乳糖发酵管。 3.其他:显微镜,酒精灯,无菌吸管(10ml、1m),接种环,较玻片等 三、基本原理 水中的病原茵多数来源于病人和病畜的粪便。由于病原菌的数量少,检测过程复杂, 因此,直接测它们的存在是非常困难的专业化工作。由于大肠菌群在粪便中数量大,在体外 存活时间与肠道致病南相近,且检验方法比较简 ,因此一般采用测定大肠菌群或大肠杆 的数量来作为水被粪便污染的标志。如果水中大肠菌群的菌数超过一定的数量,则说明此水 已被粪便污染,并有可能含有病原菌。 大肠菌群的定义是指一群好氧和兼性厌氧、革兰氏阴性、无芽孢的杆状细菌,并能在乳 糖培养基中,经37℃2448h培养能产酸产气。我国规定每升自来水中大肠菌群不得超过3 个。检测大肠菌群的方法有稀释培养法和膜滤法两种,其中稀释 养法是标准分析法,为我 国大多黄 生 位和水厂所使用。它包括初发酵试验、平板分离和复发酵试 三个部分 四、方法与步 1.采样:取100ml磨口带塞玻璃瓶,包扎后,干热灭菌备用。 取自来水样时,至少应先放水5in,以冲去龙头口所带的微生物,获得主流管 中有代表性的水样。取样时,用右手握瓶,左手启开瓶塞,用覆盖瓶口的纸托住瓶塞, 收集样 后, 起将瓶口塞好, 并用线 在原处扎 好。注意手指不得触及 瓶口内部。在静水中取样时,先用右手揭去塞子,瓶口朝下浸入水下约30cm处,然后 将瓶子反转过来,待水注满后,取出塞好瓶口。如果水在流动,瓶口必须迎着水流, 以免手上的细菌被水冲进瓶子。 2. 水样放置过程中,内含的细菌数目和类型会发生变化,所以要求水样品应于6~10℃贮存, 不超过 初发酵试验 :吸取待检样品接种于乳糖胆盐发酵管内,10ml接种量采用双料发酵管,而 ml及1ml以下接种量采用单料管。每一接种量接种3管,置于35-37℃培养24士2h。将产 酸、产气的发酵管按下列程序继续进行检验。 4. 在指示性培养基上分离培养:将产气的发酵管中的发酵液在EMB平板或远藤氏平板上 划线分离,置于35-37C培养1824h 5. 革兰氏染色 及镜检:于上述平板上长出的菌落中挑取1~2个大肠菌群可疑菌落进行镜检 和革兰氏染色。 6. 复发醇试验:将上述镜检之菌落同时接种于乳糖发酵管,置于35~37C培养24士2h,观 察产气情况。 1. 结果:凡是在乳糖胆盐发酵管产酸、产气,在指示性培养基上能生长的,革兰氏染色为 阴性的无芽孢杆菌 ,在复发酵管中 酸、 气的,即说明 有大肠菌群的 存在 大肠 菌群阳性:有一项不符的,即说明无大肠菌群的细菌存在一大肠菌群阴性
实验十 水的卫生细菌学检验(综合) a) 水中大肠菌群数的测定 一、目的要求 学习大肠菌群数的检测原理和方法。 二、实验材料 1. 样品:水样 2. 培养基:乳糖胆盐发酵管(单料及双料),伊红美兰琼脂(EMB)平板,乳糖发酵管。 3. 其他:显微镜,酒精灯,无菌吸管(10m1、1m1),接种环,载玻片等 三、基本原理 水中的病原菌多数来源于病人和病畜的粪便。由于病原菌的数量少,检测过程复杂, 因此,直接测它们的存在是非常困难的专业化工作。由于大肠菌群在粪便中数量大,在体外 存活时间与肠道致病菌相近,且检验方法比较简便,因此一般采用测定大肠菌群或大肠杆菌 的数量来作为水被粪便污染的标志。如果水中大肠菌群的菌数超过一定的数量,则说明此水 已被粪便污染,并有可能含有病原菌。 大肠菌群的定义是指一群好氧和兼性厌氧、革兰氏阴性、无芽孢的杆状细菌,并能在乳 糖培养基中,经 37℃24~48h 培养能产酸产气。我国规定每升自来水中大肠菌群不得超过 3 个。检测大肠菌群的方法有稀释培养法和膜滤法两种,其中稀释培养法是标准分析法,为我 国大多数卫生单位和水厂所使用。它包括初发酵试验、平板分离和复发酵试验三个部分。 四、方法与步骤 1. 采样:取100ml磨口带塞玻璃瓶,包扎后,干热灭菌备用。 取自来水样时,至少应先放水5min,以冲去龙头口所带的微生物,获得主流管 中有代表性的水样。取样时,用右手握瓶,左手启开瓶塞,用覆盖瓶口的纸托住瓶塞, 收集样品后,连同覆盖纸一起将瓶口塞好,并用线绳在原处扎好。注意手指不得触及 瓶口内部。在静水中取样时,先用右手揭去塞子,瓶口朝下浸入水下约30cm处,然后 将瓶子反转过来,待水注满后,取出塞好瓶口。如果水在流动,瓶口必须迎着水流, 以免手上的细菌被水冲进瓶子。 2. 水样放置过程中,内含的细菌数目和类型会发生变化,所以要求水样品应于6~10℃贮存, 并不超过6h。 3. 初发酵试验:吸取待检样品接种于乳糖胆盐发酵管内,10ml接种量采用双料发酵管,而 lml及lml以下接种量采用单料管。每一接种量接种3管,置于35~37℃培养24士2h。将产 酸、产气的发酵管按下列程序继续进行检验。 4. 在指示性培养基上分离培养:将产气的发酵管中的发酵液在EMB平板或远藤氏平板上 划线分离,置于35~37C培养18~24h。 5. 革兰氏染色及镜检:于上述平板上长出的菌落中挑取1~2个大肠菌群可疑菌落进行镜检 和革兰氏染色。 6. 复发酵试验:将上述镜检之菌落同时接种于乳糖发酵管,置于35~37C培养24土2h,观 察产气情况。 7. 结果:凡是在乳糖胆盐发酵管产酸、产气,在指示性培养基上能生长的,革兰氏染色为 阴性的无芽孢杆菌,在复发酵管中产酸、产气的,即说明有大肠菌群的细菌存在—大肠 菌群阳性;有一项不符的,即说明无大肠菌群的细菌存在—大肠菌群阴性
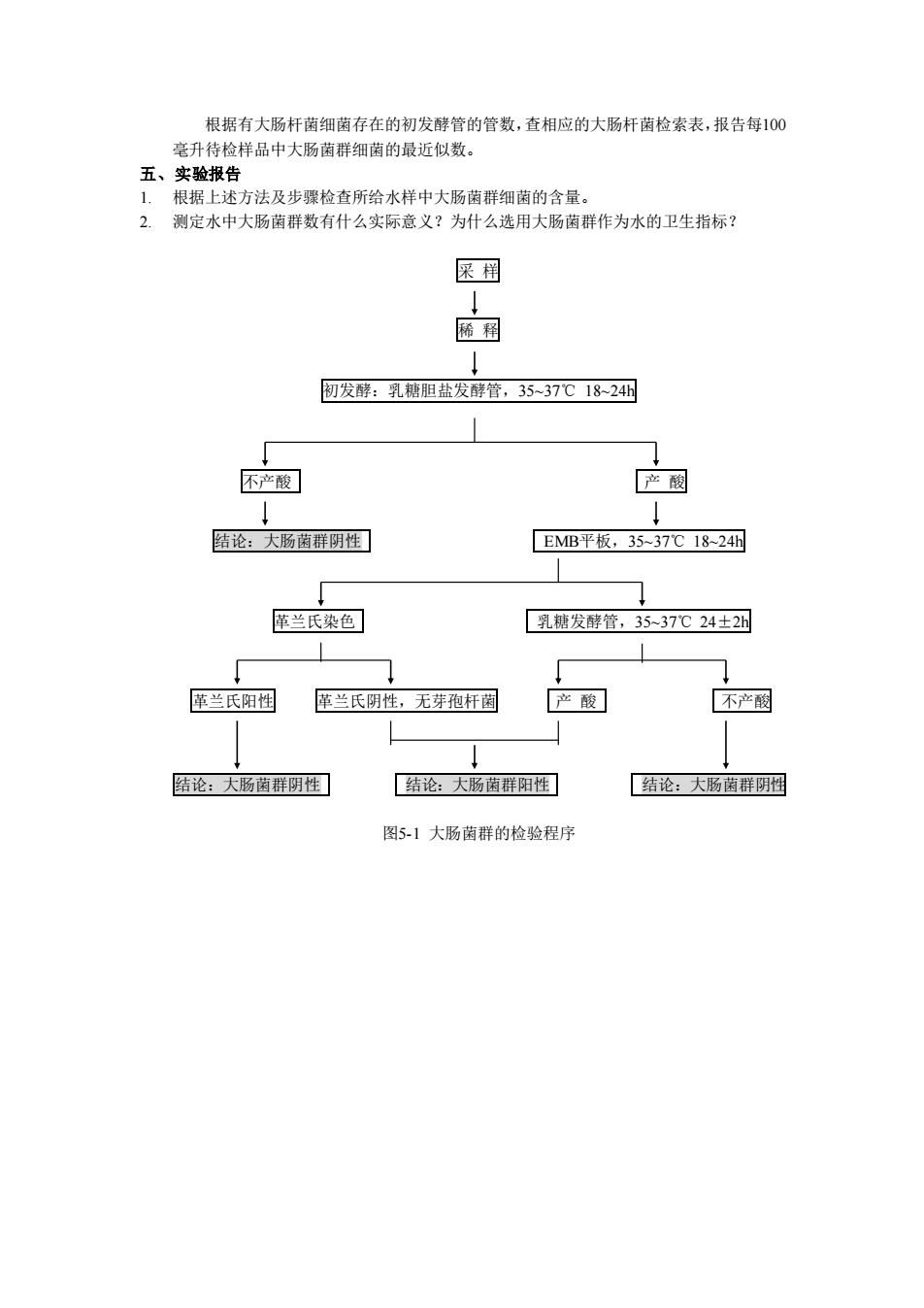
根据有大肠杆菌细菌存在的初发酵管的管数,查相应的大肠杆菌检索表,报告每100 毫升待检样品中大肠茵群细菌的最近似数。 五、实验报告 1,根据上述方法及步骤检查所给水样中大肠菌群细菌的含量。 2.测定水中大肠南群数有什么实际意义?为什么选用大肠菌群作为水的卫生指标? 保相 稀稻 初发酵:乳糖胆盐发酵管,3537℃1824 不产酸 产圆 陆论:大肠菌群阴性 EMB平板,35-37C18-24 革兰氏染色 乳糖发酵管,35-37℃24±2 革兰氏阳田 革兰氏阴性,无芽孢杆闲 产酸 不产國 结论:大肠菌群阴性 结论:大肠菌群阳性】 结论:大肠菌样阴的 图5-1大肠茵群的检验程序
根据有大肠杆菌细菌存在的初发酵管的管数,查相应的大肠杆菌检索表,报告每100 毫升待检样品中大肠菌群细菌的最近似数。 五、实验报告 1. 根据上述方法及步骤检查所给水样中大肠菌群细菌的含量。 2. 测定水中大肠菌群数有什么实际意义?为什么选用大肠菌群作为水的卫生指标? 采 样 稀 释 初发酵:乳糖胆盐发酵管,35~37℃ 18~24h 不产酸 产 酸 结论:大肠菌群阴性 EMB平板,35~37℃ 18~24h 革兰氏染色 乳糖发酵管,35~37℃ 24±2h 革兰氏阳性 革兰氏阴性,无芽孢杆菌 产 酸 不产酸 结论:大肠菌群阴性 结论:大肠菌群阳性 结论:大肠菌群阴性 图5-1 大肠菌群的检验程序
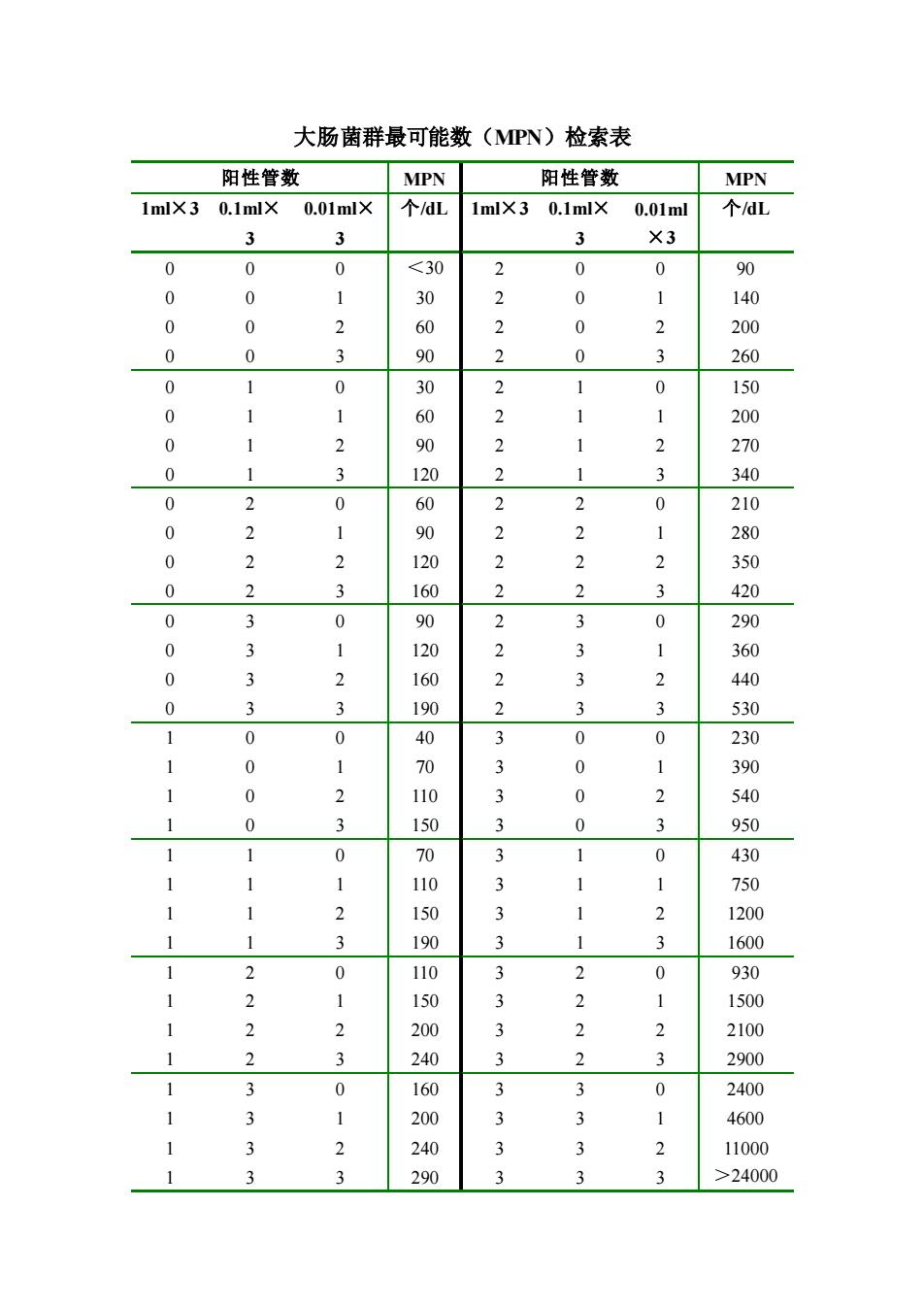
大肠菌群最可能数(MPN)检索表 阳性管数 MPN 阳性管数 MPN 1mlX3 0.1mlX 0.01mlX 个dL 1mlX3 0.1mlX 0.01ml 个dL 3 3 3 X3 0 0 0 24000
大肠菌群最可能数(MPN)检索表 阳性管数 MPN 阳性管数 MPN 1ml×3 0.1ml× 3 0.01ml× 3 个/dL 1ml×3 0.1ml× 3 0.01ml ×3 个/dL 0 0 0 <30 2 0 0 90 0 0 1 30 2 0 1 140 0 0 2 60 2 0 2 200 0 0 3 90 2 0 3 260 0 1 0 30 2 1 0 150 0 1 1 60 2 1 1 200 0 1 2 90 2 1 2 270 0 1 3 120 2 1 3 340 0 2 0 60 2 2 0 210 0 2 1 90 2 2 1 280 0 2 2 120 2 2 2 350 0 2 3 160 2 2 3 420 0 3 0 90 2 3 0 290 0 3 1 120 2 3 1 360 0 3 2 160 2 3 2 440 0 3 3 190 2 3 3 530 1 0 0 40 3 0 0 230 1 0 1 70 3 0 1 390 1 0 2 110 3 0 2 540 1 0 3 150 3 0 3 950 1 1 0 70 3 1 0 430 1 1 1 110 3 1 1 750 1 1 2 150 3 1 2 1200 1 1 3 190 3 1 3 1600 1 2 0 110 3 2 0 930 1 2 1 150 3 2 1 1500 1 2 2 200 3 2 2 2100 1 2 3 240 3 2 3 2900 1 3 0 160 3 3 0 2400 1 3 1 200 3 3 1 4600 1 3 2 240 3 3 2 11000 1 3 3 290 3 3 3 >24000

b)水中细菌总数的测定 一、目的要求 学习掌握平板茵落计数的原理和方法。 二、实验材料 菌液:大肠杆菌南悬液 培养基:营养琼脂培养基,无菌生理盐水 3.1ml、10ml无菌移液管,无茵培养皿等 三、基本原理 平板菌落计数法是根据在固体培养基上形成的一个菌落是由一个单细胞繁殖而成的肉 眼可见的子细胞群体这一微生物的培养特征而设计的一种计数方法。将样品进行不同稀释。 使微生物分 散开 以单细胞存在。再 量的稀释液涂布于平板上,培养后, 每一个活细 即能形成一个菌落。统计菌落的数目,根据稀释的倍数及取样接种量即可换算出样品中的含 菌数。现在倾向用菌落形成单位(colony-forming units,cfu)来表示样品的活菌含量。平板 菌落计数法可用于测定单细胞或单孢子微生物菌液的浓度,成品检验和水质检查。 四、操作步骤 ! 编号 取无菌培养皿9套,每3套为一组,在每组皿底分别写上10 10 文无南管理列于管果上,传次标明o,向管中客义:另是 闲生理盐水。 2.稀释:用1ml无菌吸管精确地吸取1ml己充分混匀的菌悬液,注入101试管中(注意吸 管不要碰到水面)。然后另取1支无菌吸管,于10试管中来回吹吸三次,使之混匀, 即成10稀释液。再从10试管中吸1ml注入102试管中,重复上述操作,直至制成10 稀释液 3.取样:用三支1ml无菌吸管分别吸取101、102和103稀释液各1ml,对号放入编好号的 无南培养皿中。 4.倾注平板:尽快向上述盛有不同稀释度菌液的平皿中倒入融化后冷却至45℃左右的营养 琼脂培养基,每皿约15ml,置水平位置迅速旋转平皿,使培养基与菌液混合均匀,而又 不使培养基荡出或溅到皿盖上, 培养:待培养基凝固后,倒置于37℃恒温培养箱中培养24h。 6.计数:数各皿中菌落数,算出同一稀释度三个平皿上菌落平均数,按下述报告计算结果。 菌落数报告原则: 1)洗择平均菌落数在30300之间的稀释度,乘以稀释倍数 2)若有两个稀释度的菌落数均在30-300之间,则应视二者菌数之比值如何。如果比值小 于2.0,应报告其平均数:如果比值大于2.0,则报告其中较小的数字。 3)如所有稀释度的菌落数均大于300,则应以稀释度最高的平均菌落数计算。 4)如所有稀释度的菌落数均小于30,则应以稀释度最低的平均数菌落计算。 5)如果所有稀释度的菌落数均不在30300之间,其中一部分大于300,一部分小于30 则应以最接折30或300的平均菌落数计算。 6)菌落总数在100以内,按实有数报告 大于100时,采用两位有效数字,后面的数字四 舍五入处理,为了缩短数字的长度,可用10的指数来表示
b) 水中细菌总数的测定 一、目的要求 学习掌握平板菌落计数的原理和方法。 二、实验材料 1. 菌液:大肠杆菌菌悬液 2. 培养基:营养琼脂培养基,无菌生理盐水 3. 1ml、10ml 无菌移液管,无菌培养皿等 三、基本原理 平板菌落计数法是根据在固体培养基上形成的一个菌落是由一个单细胞繁殖而成的肉 眼可见的子细胞群体这一微生物的培养特征而设计的一种计数方法。将样品进行不同稀释, 使微生物分散并以单细胞存在。再用一定量的稀释液涂布于平板上,培养后,每一个活细胞 即能形成一个菌落。统计菌落的数目,根据稀释的倍数及取样接种量即可换算出样品中的含 菌数。现在倾向用菌落形成单位(colony-forming units,cfu)来表示样品的活菌含量。平板 菌落计数法可用于测定单细胞或单孢子微生物菌液的浓度,成品检验和水质检查。 四、操作步骤 1. 编号:取无菌培养皿 9 套,每 3 套为一组,在每组皿底分别写上 10-1、10-2、10-3。另取 3 支无菌空试管排列于试管架上,依次标明 10-1、10-2、10-3,并向试管中各加入 9ml 无 菌生理盐水。 2. 稀释:用 1ml 无菌吸管精确地吸取 1ml 已充分混匀的菌悬液,注入 10-1 试管中(注意吸 管不要碰到水面)。然后另取 1 支无菌吸管,于 10-1 试管中来回吹吸三次,使之混匀, 即成 10-1 稀释液。再从 10-1 试管中吸 1ml 注入 10-2 试管中,重复上述操作,直至制成 10-3 稀释液。 3. 取样:用三支 1ml 无菌吸管分别吸取 10-1、10-2和 10-3 稀释液各 1ml,对号放入编好号的 无菌培养皿中。 4. 倾注平板:尽快向上述盛有不同稀释度菌液的平皿中倒入融化后冷却至 45℃左右的营养 琼脂培养基,每皿约 15ml,置水平位置迅速旋转平皿,使培养基与菌液混合均匀,而又 不使培养基荡出或溅到皿盖上。 5. 培养:待培养基凝固后,倒置于 37℃恒温培养箱中培养 24h。 6. 计数:数各皿中菌落数,算出同一稀释度三个平皿上菌落平均数,按下述报告计算结果。 菌落数报告原则: 1) 选择平均菌落数在 30~300 之间的稀释度,乘以稀释倍数。 2) 若有两个稀释度的菌落数均在 30~300 之间,则应视二者菌数之比值如何。如果比值小 于 2.0,应报告其平均数;如果比值大于 2.0,则报告其中较小的数字。 3) 如所有稀释度的菌落数均大于 300,则应以稀释度最高的平均菌落数计算。 4) 如所有稀释度的菌落数均小于 30,则应以稀释度最低的平均数菌落计算。 5) 如果所有稀释度的菌落数均不在 30~300 之间,其中一部分大于 300,一部分小于 30, 则应以最接近 30 或 300 的平均菌落数计算。 6) 菌落总数在 100 以内,按实有数报告,大于 100 时,采用两位有效数字,后面的数字四 舍五入处理,为了缩短数字的长度,可用 10 的指数来表示
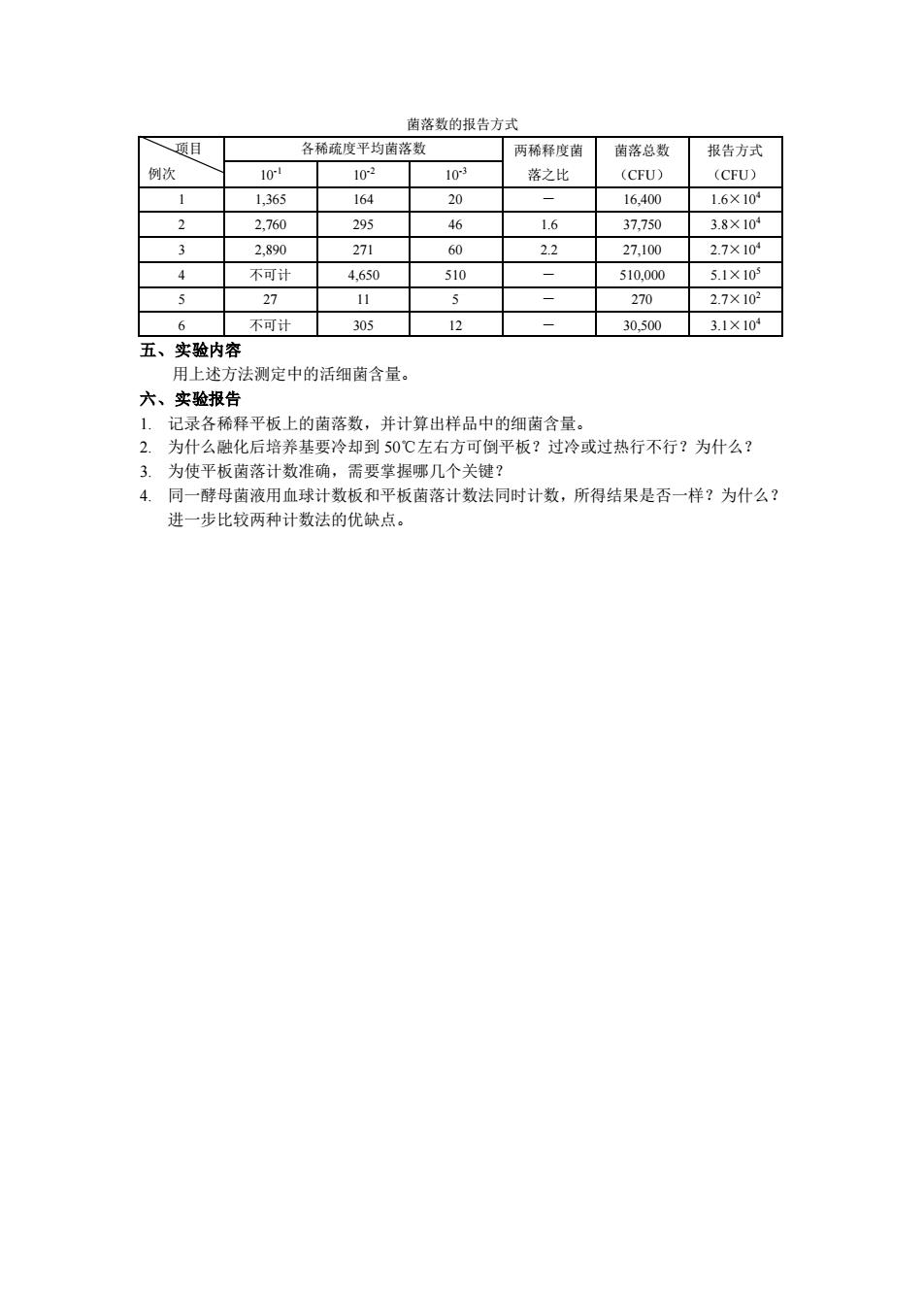
茵落数的报告方式 题目 各稀疏度平均菌落数 菌落总数 报告方式 落之 (CFU (CFU 1,365 164 20 16.400 1.6×10° 2.760 295 46 1.6 37.750 3.8X104 22 27.100 27×10 不可 4.6 51 510,00 5.1×10 27 11 270 2.7×103 不可计 305 12 30.500 3.1×10° 五、实验内容 法测定中的活细菌含量 六、实验报告 1.记录各稀释平板上的菌落数,并计算出样品中的细菌含量。 2.为什么融化后培养基要冷却到50℃左右方可倒平板?过冷或过热行不行?为什么? 3.为使平板菌落计数准确,需要掌握哪几个关键? 4.同一酵母菌液用血球计数板 板落计数法同时计数,所得结果是否一样?为什么? 进一步比较两种计数法的优缺点
菌落数的报告方式 项目 例次 各稀疏度平均菌落数 两稀释度菌 落之比 菌落总数 (CFU) 报告方式 10-1 10-2 10-3 (CFU) 1 1,365 164 20 - 16,400 1.6×104 2 2,760 295 46 1.6 37,750 3.8×104 3 2,890 271 60 2.2 27,100 2.7×104 4 不可计 4,650 510 - 510,000 5.1×105 5 27 11 5 - 270 2.7×102 6 不可计 305 12 - 30,500 3.1×104 五、实验内容 用上述方法测定中的活细菌含量。 六、实验报告 1. 记录各稀释平板上的菌落数,并计算出样品中的细菌含量。 2. 为什么融化后培养基要冷却到 50℃左右方可倒平板?过冷或过热行不行?为什么? 3. 为使平板菌落计数准确,需要掌握哪几个关键? 4. 同一酵母菌液用血球计数板和平板菌落计数法同时计数,所得结果是否一样?为什么? 进一步比较两种计数法的优缺点