
那 标准溶液的配制与标定
标准溶液的配制与标定

NaOH标准溶液的配制与标定 目的 1、掌握NaOH标准溶液的配制、保存方法 2、进一步学习天平、容量器皿(滴定管、移液 管、容量瓶等)的使用. 3、掌握酚酞指示剂确定终点的方法。 4、学习NaOH标准溶液的标定方法 5、 了解邻苯二甲酸氢钾的性质与应用
NaOH标准溶液的配制与标定 目的 1、掌握NaOH标准溶液的配制、保存方法 2、进一步学习天平、容量器皿(滴定管、移液 管、容量瓶等)的使用. 3、掌握酚酞指示剂确定终点的方法。 4、学习 NaOH标准溶液的标定方法 5、了解邻苯二甲酸氢钾 的性质与应用

原理 由于NaOH固体易吸收空气中的 C0,和水分,故只能选用标定法(间 接法)来配制,即先配成近似浓度的 溶液,再用基准物质或已知准确浓 度的标准溶液标定其准确浓度。通 常配制0.1moL1的溶液。 圈 图
由于NaOH固体易吸收空气中的 CO2和水分,故只能选用标定法(间 接法)来配制,即先配成近似浓度的 溶液, 再用基准物质或已知准确浓 度的标准溶液标定其准确浓度。通 常配制0.1mol·L-1的溶液。 原理

原理 标定:用基准物质准确标定出NaOH溶液的 浓度 常用基准物质:邻苯二甲酸氢钾,草酸 (1)邻苯二甲酸氢钾: 优点:易制得纯品,在空气中不吸水,易 保存,摩尔质量大,与NaOH反应的计量比 为1:1。在100~125°℃下干燥12h后使用 晶 國 制
原理 ▪ 标定:用基准物质准确标定出NaOH溶液的 浓度 ▪ 常用基准物质:邻苯二甲酸氢钾,草酸 ▪ (1) 邻苯二甲酸氢钾: ▪ 优点:易制得纯品,在空气中不吸水,易 保存,摩尔质量大,与NaOH反应的计量比 为1:1。在100~125℃下干燥1~2h后使用
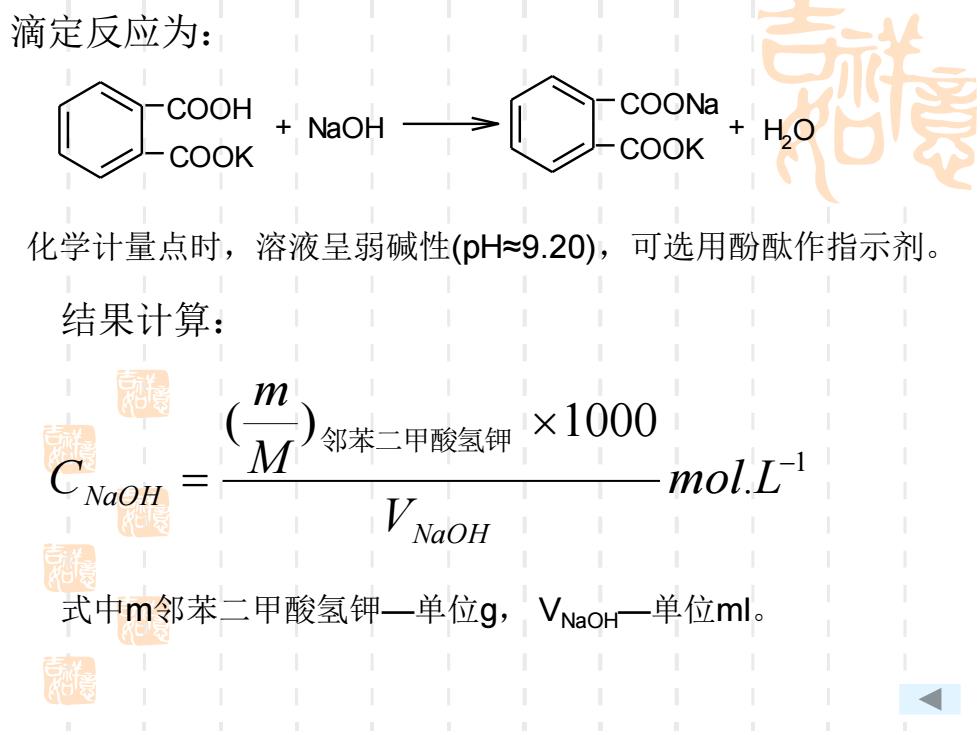
滴定反应为: COOH COONa NaOH +H0 COOK COOK 化学计量点时,溶液呈弱碱性(pH9.20),可选用酚酞作指示剂。 结果计算: 邻苯二甲酸氢钾 ×1000 NaOH mol.L VNaOH 式中m邻苯二甲酸氢钾一单位g,VNao一单位ml
COOH COOK + NaOH COOK COONa + H2 O 滴定反应为: 1 . ( ) 1000 − = mol L V M m C NaOH NaOH 邻苯二甲酸氢钾 式中m邻苯二甲酸氢钾—单位g, VNaOH—单位ml。 化学计量点时,溶液呈弱碱性(pH≈9.20),可选用酚酞作指示剂。 结果计算:

(2)草酸H2C204·2H20: 草酸在相对湿度为5%~95%时稳定。1(能否放置在干 燥器中保存?)用不含CO2的水配制草酸溶液,且暗处保 存。注意:光和M2+能加快空气氧化草酸,草酸溶液本身 也能自动分解。 化学计量点时,溶液呈弱碱性(pH≈8.4),可选用酚酞作 指示剂。 滴定反应为: H2C204+2NaOH Na2C204+2H2O 2( 其验×1000 结果计算: CNaOH M )草酸 mol.L VNaOH 式中m草酸一单位g,VNo一单位ml。 标准溶液的浓度要保留4位有效数字
(2)草酸 H2C204﹒2H2O: 草酸在相对湿度为5%~95%时稳定。(能否放置在干 燥器中保存?)用不含CO2的水配制草酸溶液,且暗处保 存。注意:光和Mn2+能加快空气氧化草酸,草酸溶液本身 也能自动分解。 化学计量点时,溶液呈弱碱性(pH≈8.4),可选用酚酞作 指示剂。 滴定反应为: H2C204 + 2NaOH = Na2C204 + 2H2O 式中m草酸—单位g, VNaOH—单位ml。 标准溶液的浓度要保留4位有效数字。 1 . 2( ) 1000 − = mol L V M m C NaOH NaOH 草酸 结果计算:

步骤 1、0.1mo-L-1NaOH溶液的标定 用差减法准确称取0.4~0.6g已烘干的邻苯 二甲酸氢钾三份,分别放入三个已编号的 250mL锥形瓶中,加20~30mL水溶解(可稍加 热以促进溶解)—2~3d酚酞—NaOH溶液 滴定。—微红色(30S内不褪) 记录 VNaOH? 计算C NaOH和标定结果的相对偏差。 和喝 雨
步骤 1、0.1mol·L-1NaOH溶液的标定 用差减法准确称取0.4~0.6g已烘干的邻苯 二甲酸氢钾三份,分别放入三个已编号的 250mL锥形瓶中,加20~30mL水溶解(可稍加 热以促进溶解)——2~3d酚酞——NaOH溶液 滴定——微红色(30S内不褪)——记录 VNaOH,计算C NaOH和标定结果的相对偏差
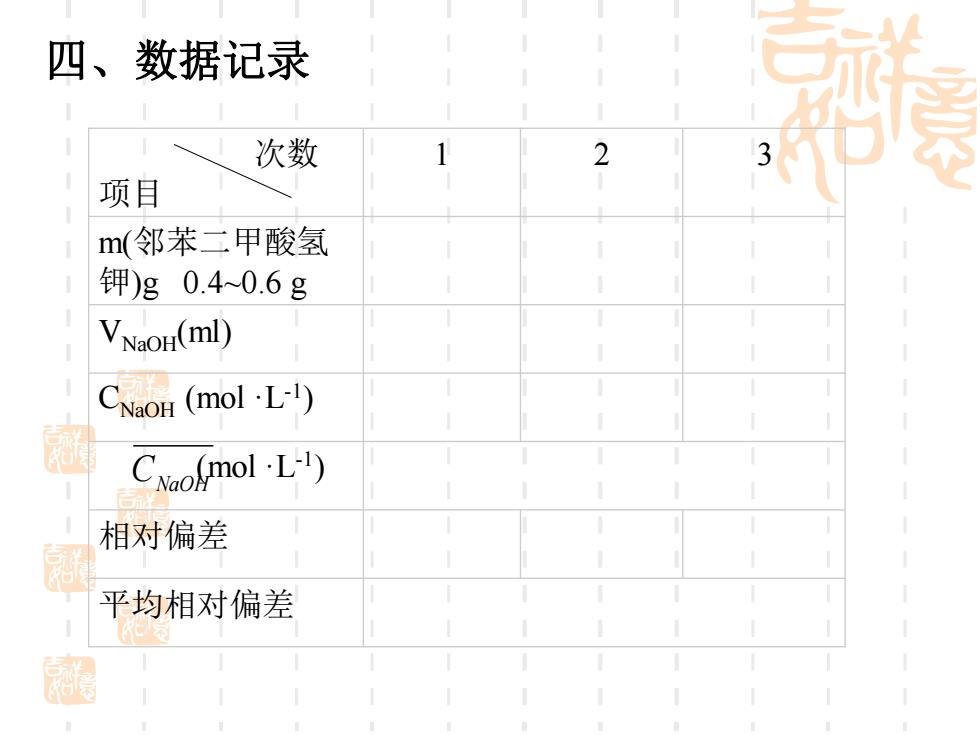
四、数据记录 次数 项目 m(邻苯二甲酸氢 钾)g0.40.6g VNaoH(ml) CNaoH (molL) CNomol-L-') 相对偏差 平均相对偏差
次数 项目 1 2 3 m(邻苯二甲酸氢 钾)g 0.4~0.6 g VNaOH(ml) CNaOH (mol·L-1) (mol·L - 1 ) 相对偏差 平均相对偏差 CNaOH 四、数据记录

五、问题讨论: 1、NaOH因吸收C02而混有少量的Na2C03,以致在实 验中导致误差,必须设法除去C032离子,如何配制不 含C0,2的Na0H溶液? 方法(1).用小烧杯于台秤上称取较理论计算量稍多的 NaOH,用不含C0,蒸馏水迅速冲洗两次,溶解并定溶。 (2).制备饱和Na0H(50%,NaC0,基本不溶)待NaC0g 下沉后,取上层清液用不含C0,的蒸馏水稀释. (3).于NaOH溶液中,加少量Ba(OH),或BaCI,取上层清液 用不含C0,的蒸馏水稀释. 2、配制好的溶液如何保存? 实验课本p158
五、问题讨论: 1、NaOH 因吸收CO2而混有少量的Na2CO3,以致在实 验中导致误差,必须设法除去CO3 2-离子,如何配制不 含CO3 2-的NaOH溶液? 方法(1).用小烧杯于台秤上称取较理论计算量稍多的 NaOH,用不含CO2蒸馏水迅速冲洗两次,溶解并定溶。 (2).制备饱和NaOH(50%, Na2 CO3基本不溶)待Na2 CO3 下沉后,取上层清液用不含CO2的蒸馏水稀释. (3).于NaOH溶液中,加少量Ba(OH)2或BaCI2 ,取上层清液 用不含CO2的蒸馏水稀释. 2、配制好的溶液如何保存? 实验课本p158

盐酸标准溶液 二、原理 一、 目的要求 由于浓盐酸容易挥发,不能用它们 1.掌握减量法准确称取基准物的方 来直接配制具有准确浓度的标准溶 1 法。 液,因此,配制HC标准溶液时, 2.掌握滴定操作并学会正确判断滴 只能先配制成近似浓度的溶液,然 定终点的方法。 后用基准物质标定它们的准确浓度, 3.学会配制和标定盐酸标准溶液的 或者用另一已知准确浓度的标准溶 方法。 液滴定该溶液,再根据它们的体积 比计算该溶液的准确浓度。 三、试剂 标定HC溶液的基准物质常用的是 1.浓盐酸36.5%(密度1.19) 无水Na2C03,其反应式如下: Na2CO3 +2HCI 2NaCl 2.溴甲酚绿-甲基红混合液指示 +C02+H2O 剂:量取30mL溴甲酚绿乙醇溶 滴定至反应完全时,溶液pH为 液(2g/儿),加入20mL甲基 3.89,通常选用溴甲酚绿-甲基红 红乙醇溶液(1g/儿),混匀。 混合液作指示剂
盐酸标准溶液 ▪ 二、原理 ▪ 由于浓盐酸容易挥发,不能用它们 来直接配制具有准确浓度的标准溶 液,因此,配制HCl标准溶液时, 只能先配制成近似浓度的溶液,然 后用基准物质标定它们的准确浓度, 或者用另一已知准确浓度的标准溶 液滴定该溶液,再根据它们的体积 比计算该溶液的准确浓度。 ▪ 标定HCl溶液的基准物质常用的是 无水Na2CO3,其反应式如下: ▪ Na2CO3 + 2HCl = 2NaCl + CO2 + H2O ▪ 滴定至反应完全时,溶液pH为 3.89,通常选用溴甲酚绿-甲基红 混合液作指示剂。 ▪ 一、目的要求 ▪ 1.掌握减量法准确称取基准物的方 法。 ▪ 2.掌握滴定操作并学会正确判断滴 定终点的方法。 ▪ 3.学会配制和标定盐酸标准溶液的 方法。 ▪ 三、试剂 ▪ 1.浓盐酸:36.5%(密度1.19) ▪ 2.溴甲酚绿-甲基红混合液指示 剂:量取30mL溴甲酚绿乙醇溶 液(2g/L),加入20mL甲基 红乙醇溶液(1g/L),混匀