
模块二 容量分析法
模块二 容量分析法

容量分析法的特点 将一种已知准确浓度的试剂溶液(滴定 液),滴加到被测物质的溶液中,或者是将 被测物质的溶液滴加到标准溶液中,直到所 加的试剂与被测物质按化学计量定量反应为 止,然后根据试剂溶液的浓度和用量,计算 被测物质的含量
容量分析法的特点 ⚫ 将一种已知准确浓度的试剂溶液(滴定 液),滴加到被测物质的溶液中,或者是将 被测物质的溶液滴加到标准溶液中,直到所 加的试剂与被测物质按化学计量定量反应为 止,然后根据试剂溶液的浓度和用量,计算 被测物质的含量

等当点(化学计量点) 消耗的滴定液的摩尔数=被测物摩尔数 滴定终点 指示剂的变色点 (允许与化学计量点的误差≤0.1%)
等当点(化学计量点) 消耗的滴定液的摩尔数=被测物摩尔数 滴定终点 指示剂的变色点 (允许与化学计量点的误差≤0.1%)

·滴定终点与等当点不符一 滴定误差,需 要选择合适的指示剂指示终点。 ●通常用于测定高含量或中含量组分,即被 测组分的含量在1%以上。容量分析法比较准 确,一般情况下相对误差可达02%以下。 ● 容量分析法操作简便、快速、比较准确, 仪器普通易得
⚫ 滴定终点与等当点不符——滴定误差,需 要选择合适的指示剂指示终点。 ⚫ 通常用于测定高含量或中含量组分,即被 测组分的含量在1%以上。容量分析法比较准 确,一般情况下相对误差可达0.2%以下。 ⚫ 容量分析法操作简便、快速、比较准确, 仪器普通易得

常用容量分析法 酸碱滴定法 非水溶液滴定法 亚硝酸钠滴定法 碘量法 配位滴定法
常用容量分析法 ⚫ 酸碱滴定法 ⚫ 非水溶液滴定法 ⚫ 亚硝酸钠滴定法 ⚫ 碘量法 ⚫ 配位滴定法

酸碱滴定法 (一) 基本原理 利用酸和碱在水溶液中以质子转 移为基础的滴定分析方法
一、酸碱滴定法 (一)基本原理 利用酸和碱在水溶液中以质子转 移为基础的滴定分析方法
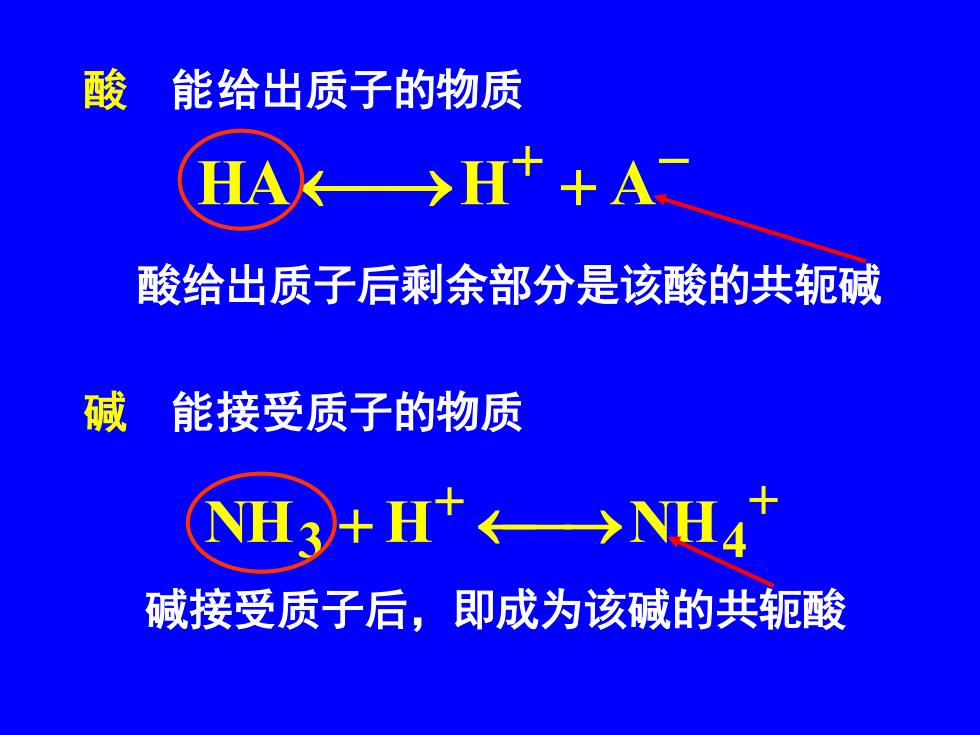
酸 能给出质子的物质 >H+A 酸给出质子后剩余部分是该酸的共轭碱 碱 能接受质子的物质 NH3+H+←→N巡4 碱接受质子后,即成为该碱的共轭酸
酸 能给出质子的物质 碱 能接受质子的物质 + − HA⎯→H + A + ⎯→ + NH3 + H NH4 酸给出质子后剩余部分是该酸的共轭碱 碱接受质子后,即成为该碱的共轭酸

越容易给出质子的物质酸性越强 强酸的共轭碱是弱碱 越容易接受质子的物质碱性越强 强碱的共轭酸是弱酸
越容易给出质子的物质酸性越强 强酸的共轭碱是弱碱 越容易接受质子的物质碱性越强 强碱的共轭酸是弱酸

(二)直接滴定法 ●用滴定液直接滴定待测物质,根据滴定液 的消耗量,计算供试品的含量。 ●碱滴定液可直接滴定强酸、弱酸、混合酸、 多元酸、强酸弱碱盐。 酸滴定液可直接滴定强碱、弱碱、强碱弱 ●i 酸盐
(二)直接滴定法 ⚫用滴定液直接滴定待测物质,根据滴定液 的消耗量,计算供试品的含量。 ⚫碱滴定液可直接滴定强酸、弱酸、混合酸、 多元酸、强酸弱碱盐。 ⚫酸滴定液可直接滴定强碱、弱碱、强碱弱 酸盐

(三)间接滴定法 ●用定量过量的滴定液A与待测物质反应完 全后,再用另一种滴定液来滴定剩余滴定 液A,根据A、B的消耗量来计算药物含量。 ◆适用于难溶于水的酸性或碱性药物、化学 反应速度慢或直接滴定时难以选择指示剂的 物质
(三)间接滴定法 ⚫用定量过量的滴定液A与待测物质反应完 全后,再用另一种滴定液B来滴定剩余滴定 液A,根据A、B的消耗量来计算药物含量。 ⚫适用于难溶于水的酸性或碱性药物、化学 反应速度慢或直接滴定时难以选择指示剂的 物质