
第五章氧化还原滴定法 5.1氧化还原反应的方向和程度 5.1.1 条件电位 氧化还原反应一电子的转移 Ox+Red2 Red+Ox2 由电对电位p(Ox/Red)的高低判断反 应的方向
1 第五章 氧化还原滴定法 5.1 氧化还原反应的方向和程度 5.1.1 条件电位 氧化还原反应—电子的转移 Ox1 + Red2 = Red1+Ox2 由电对电位 的高低判断反 应的方向 (Ox / Red)

可逆电对Ox+ne=Red的电位为 (Ox/Red)=(Ox/Red) a(Ox) 名a(Red) Nernst方程式 o(标准电位)与温度t有关 25℃时: o(Ox/Red)=o(Ox/Red)+ 0.059 g a(Ox) (Red) 氧化还原滴定通常在室温进行,不考虑温度影响
2 可逆电对 Ox+ne=Red 的电位为 0.059 (Ox) (Ox / Red) (Ox / Red) lg (Red) a n a = + (标准电位)与温度t有关 25℃时: Nernst 方程式 (Ox) (Ox / Red) (Ox / Red) lg (Red) RT a nF a = + 氧化还原滴定通常在室温进行, 不考虑温度影响

电位与分析浓度的关系为: a(Ox)=c(Ox)MOx)/aox a(Red)=c(Red).yRed)/&Red D=o+0.059 0.059,c(0x) c(Red) 称条件电位 表示c(Ox)=cRed)=1moLl时电对的电 位,与介质条件(L,有关,也与温度t有关, 可查附录表8 3
3 电位与分析浓度的关系为: Red Ox 0.059 (Ox) lg (Re 0.059 (Ox) lg n d ) (Red) c n c + = + 表示c(Ox)=c(Red)= 1mol·L-1时电对的电 位, 与介质条件(I, )有关, 也与温度t有关. 可查附录表III·8 a(Ox)=c(Ox)·(Ox)/Ox a(Red)=c(Red)·(Red)/Red 称条件电位
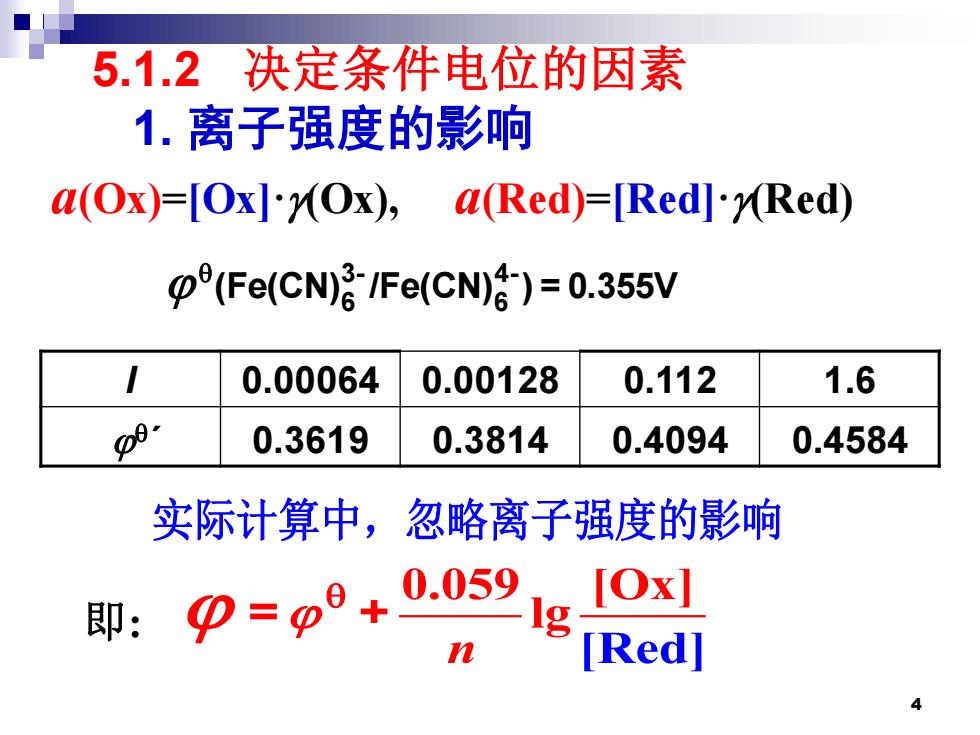
5.1.2决定条件电位的因素 1.离子强度的影响 a(Ox)=[Ox].MOx),a(Red)=[Red]-rRed) (Fe(CN)-/Fe(CN))=0.355V 0.00064 0.00128 0.112 1.6 p9 0.3619 0.3814 0.4094 0.4584 实际计算中,忽略离子强度的影响 即:p=p9+0.059 [Ox] [Red] 4
4 5.1.2 决定条件电位的因素 1. 离子强度的影响 3- 4- 6 6 (Fe(CN) /Fe(CN) ) = 0.355V I 0.00064 0.00128 0.112 1.6 ´ 0.3619 0.3814 0.4094 0.4584 实际计算中,忽略离子强度的影响 0.059 [Ox] l [ e g n R d] 即: = + a(Ox)=[Ox]·(Ox), a(Red)=[Red]·(Red)

2.生成沉淀的影响(改变浓度比值) Ox,p八,还原性/;Reg,9,氧化/ 性 例如,碘量法测铜(例5.1) (Cu27ur)=0.17,p(,1r)=04vS2032 2Cu2++4=2Cul↓+l2 []=1.0molL1时 o0'(Cu2+/Cut)=0.86v>p(l,r) 5
5 2.生成沉淀的影响 (改变浓度比值) Ox , , 还原性 ; Red , , 氧化 性 . 例如,碘量法测铜 (例 5.1) (Cu /Cu 0.17 V, I / I 0.54V ) ( 2 ) 2+ + - = = - 2 2+ 2Cu +4I = 2CuI +I - -1 - 2 [I ] = 1.0mol L = 0.86 V > (I /I ) 2+ + 时 (Cu /Cu ) S2O3 2-
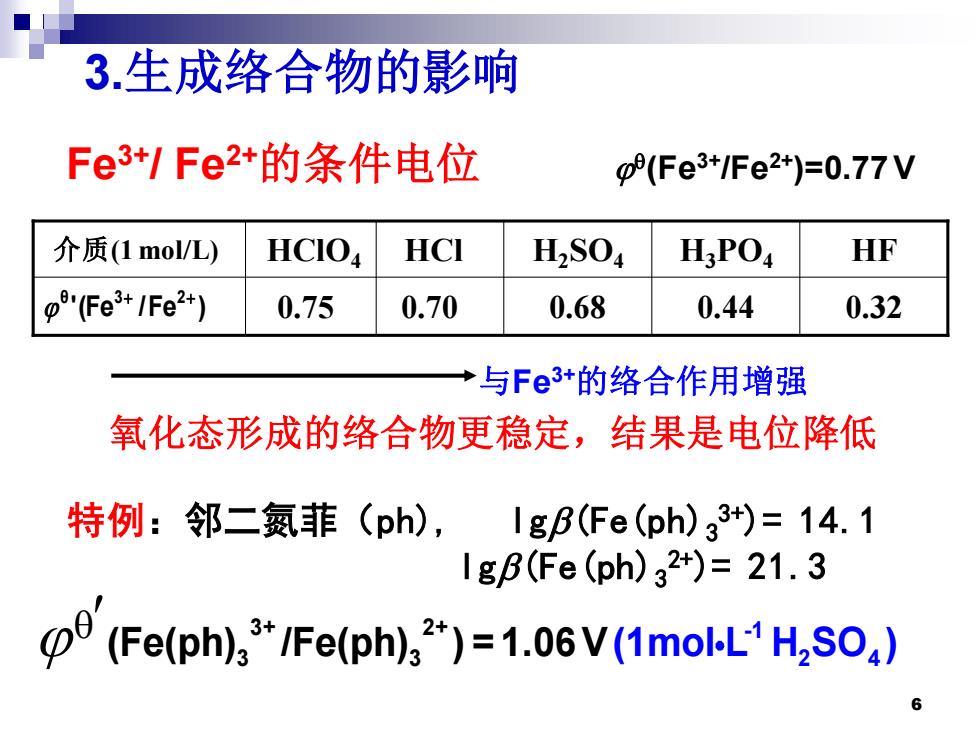
3.生成络合物的影响 Fe3+/Fe2+的条件电位 0(Fe3+Fe2+)=0.77V 介质(1mol/L) HCIO HCI H2S04 H:PO HF (Fe+/Fe2+) 0.75 0.70 0.68 0.44 0.32 ·与Fe3+的络合作用增强 氧化态形成的络合物更稳定,结果是电位降低 特例:邻二氮菲(ph),IgB(Fe(ph)33+)=14.1 lgB(fe(ph)32+)=21.3 (Fe(ph)"/Fe(ph)")=1.06V(1molL1H,SO,)
6 3.生成络合物的影响 特例:邻二氮菲(ph), lgb(Fe(ph)3 3+)= 14.1 lgb(Fe(ph)3 2+)= 21.3 3+ 2+ 3 -1 3 2 4 (Fe(ph) /Fe(ph) ) = 1.06V(1mol L H SO ) Fe3+/ Fe2+的条件电位 (Fe3+/Fe2+)=0.77 V 氧化态形成的络合物更稳定,结果是电位降低 0.75 0.70 0.68 0.44 0.32 介质(1 mol/L) HClO4 HCl H2SO4 H3PO4 HF '(Fe /Fe ) θ 3+ 2+ 与Fe3+的络合作用增强

例5.2碘量法测Cu2+时,样品中含Fe3+. 已知: 0(fe3+Fe2*)=0.77N,o(U,/)=0.54V pH=3.0,[F]=0.1moL1时, p9(Fe3*1fe2*)=0.32V Fe3+不再氧化I,Fe3+的干扰被消除
7 例5.2 碘量法测Cu2+时, 样品中含Fe3+ . pH=3.0, [F ]=0.1mol·L-1时, 3+ 2+ (Fe /Fe ) = 0.32V 已知: , 3+ 2+ - 2 (Fe /Fe ) = 0.77V (I /I ) = 0.54V Fe3+不再氧化I -,Fe3+的干扰被消除

4.溶液酸度的影响 1. [H]或[OH参加电极反应,包括在 Nernst方程中,直接影响电位值. H3AsO,+2H++2e=HAsO2+2H2O AiVVAm) 2 [HASO2] 2.影响Ox或Red的存在形式 8
8 4. 溶液酸度的影响 1. [H+ ]或[OH- ]参加电极反应, 包括在 Nernst方程中, 直接影响电位值. + 3 4 2 2 0.059 [H AsO ] = (As(V)/As(III))+ lg 2 [HAsO ] [H ] 2. 影响Ox或Red的存在形式 例 H3AsO4+2H++2e=HAsO2+2H2O
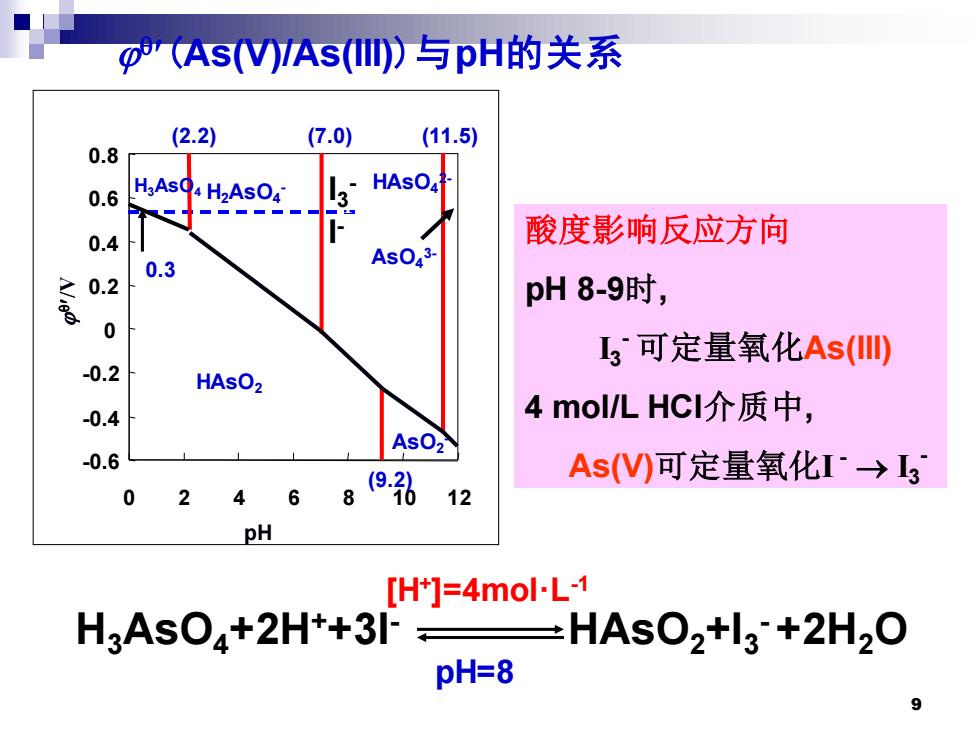
o'(As(VAs(II)与pH的关系 (2.2) (7.0) (11.5) 0.8 HAsO 0.6 H;AsQ H2ASO4 3 0.4 酸度影响反应方向 0.3 0.2 pH8-9时, 0 3可定量氧化As(II) -0.2 HAsO2 -0.4 4 mol/L HCI介质中, AsO2 -0.6 As()可定量氧化I→3 0 2 6 12 pH [H+]=4mol.L-1 H3AsO+2H++3 -HAsO2+l3+2H2O pH=8
9 (As(V)/As(III))与pH的关系 酸度影响反应方向 pH 8-9时, I3 - 可定量氧化As(III) 4 mol/L HCl介质中, As(V)可定量氧化I - → I3 - -0.6 -0.4 -0.2 0 0.2 0.4 0.6 0.8 0 2 4 6 8 10 12 (2.2) (7.0) (11.5) H2AsO4 H3AsO4 - (9.2) HAsO4 2- AsO4 3- AsO2 - HAsO2 /V pH I3 - I - 0.3 I3 - I - H3AsO4+2H++3I- HAsO2+I3 - +2H2O [H+ ]=4mol·L-1 pH=8

生物化学家称在pH7时的o'为条件电位。 因为在一个细胞内pH接近于7。例: 反应 p 02+4H+4e=2H20 +1.229 +0.816 02(g)+2H+2e=H202 +0.69 +0.295 脱氢抗坏血酸+2H++2e=抗坏血酸+0.390+0.058 富马酸盐+2H++2e=丁二酸盐+0.433 +0.031 每当H在氧化还原反应中出现时,电位都与pH有关, 10
10 生物化学家称在pH7时的 为条件电位。 因为在一个细胞内pH接近于7。例: 反 应 O2+4H++4e=2H2O +1.229 +0.816 O2 (g)+2H++2e=H2O2 +0.69 +0.295 脱氢抗坏血酸+2H++2e=抗坏血酸 +0.390 +0.058 富马酸盐+2H++2e=丁二酸盐 +0.433 +0.031 每当H+在氧化还原反应中出现时,电位都与pH有关