
第4章酸碱滴定法
1 第4章 酸碱滴定法

4.1酸碱反应及其平衡常数 4.1.1酸碱反应 酸 共轭碱 质子 HAc Ac + NH4* NHg + HCO3 111111 C032- H6Y2+ HsY+ + 酸碱半反应 通式:HA A- + H 共轭酸 碱 + 质子 2
2 4.1 酸碱反应及其平衡常数 4.1.1 酸碱反应 酸 共轭碱 + 质子 HAc Ac- + H+ NH4 + NH3 + H+ HCO3 - CO3 2- + H+ H6Y2+ H5Y+ + H+ 通式: HA A— + H+ 共轭酸 碱 + 质子 酸 碱 半 反 应
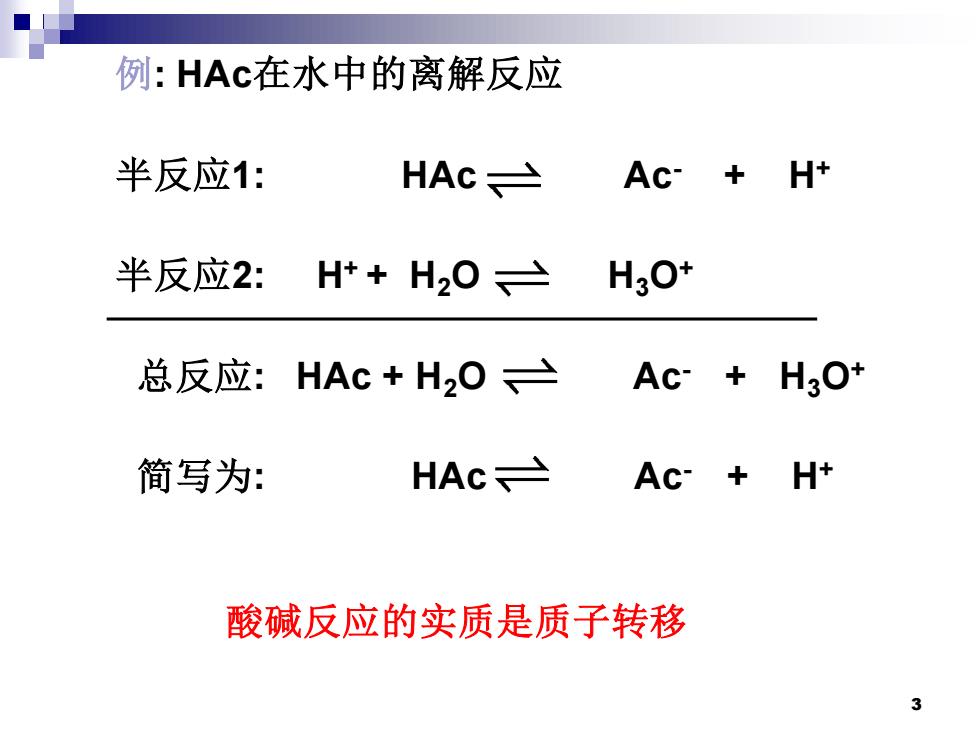
例:HAc在水中的离解反应 半反应1: HAc≥ Ac-+H+ 半反应2:Ht+H20≥ H3O* 总反应:HAc+H2O≥ Ac+H3O* 简写为: HAc≌ Ac-+H+ 酸碱反应的实质是质子转移 3
3 例: HAc在水中的离解反应 半反应1: HAc Ac- + H+ 半反应2: H+ + H2O H3O+ 总反应: HAc + H2O Ac- + H3O+ 简写为: HAc Ac- + H+ 酸碱反应的实质是质子转移

3.1.2酸碱反应类型及平衡常数 a.一元弱酸碱的离解反应 HA H2O A-+H3O+ E,=a(H)a(A) a(HA) A-+H2O≥HA+OH K。=aHA)a(OH) a(A) 4
4 3.1.2 酸碱反应类型及平衡常数 a. 一元弱酸碱的离解反应 + a (H ) (A ) (HA) a a K a − = − HA + H2O A — + H3O+ A — + H2O HA + OH — b (HA) (OH ) (A) a a K a − =

b.水的质子自递反应: H20+H20≥H3O++OH (25°C) Kw=a(H)a(0H)=1.00x10-4 共轭酸碱对(HA-A一)的K与K的关系为: k-lgaa)- a灯 a(A) pKa+pkp pKw =14.00 5
5 b. 水的质子自递反应: H2O + H2O H3O+ + OH- (25°C) p p p 14.00 K K K a b w + = = 14 w K a a (H ) (OH ) 1.00 10 + − − = = + - a b w - (H ) (A ) (HA) (OH ) (HA) (A ) a a a a K K K a a − = = 共轭酸碱对(HA-A-)的Ka与Kb的关系为 :

c.多元酸碱的离解反应 Ka, A3- Kw pKD=14.00-pKag K三Kaw pK2=14.00-pK2 pK3=14.00-pK1 6
6 1 w b a i n i K K K − + = c. 多元酸碱的离解反应 pKb1 = 14.00 – pKa 3 pKb2 = 14.00 – pKa 2 pKb3 = 14.00 – pKa 1 b1 K b2 K b3 K 2 Ka 3 Ka 1 Ka H3A H2A- HA2- A3-

d.酸碱中和反应(滴定反应): K一滴定反应常数 1 H++OH≥H2O K= =104.00 H++A≥HA 1 K K OH+HA≥H2O+AK,=K 7
7 d. 酸碱中和反应(滴定反应) : Kt—滴定反应常数 H+ + OH- H2O H+ + A- HA OH- + HA H2O + A- 14.00 t w 1 K 10 K = = b w ( ) K K t b 1 K K = t a 1 K K = a w ( ) K K

4.1.3活度与浓度 溶液无限稀时:y=1 M=Y·C 中性分子:y=1 溶剂活度:a=1 Debye-Hiickel公式: .509z2V7 -lgyi= (适用于1<0.1) 1+BavI 腐子强度:12∑ :离子电荷 常数:B=3.28(25C),与温度、介电常数有关 离子体积参数:,单位:nm(可查表) 8
8 4.1.3 活度与浓度 a c = : 1 : 1 : 1 a = = = 溶液无限稀时 中性分子 溶剂活度 Debye-Hückel公式: 2 0.509 lg 0.1) 1 i i z I I Ba I − = + 。 (适用于 。 2 o 1 : : 2 : 3.28(25 C), : , :nm ( ) i i i I c z z B a = = 离子强度 离子电荷 常数 与温度、介电常数有关 离子体积参数 单位 可查表
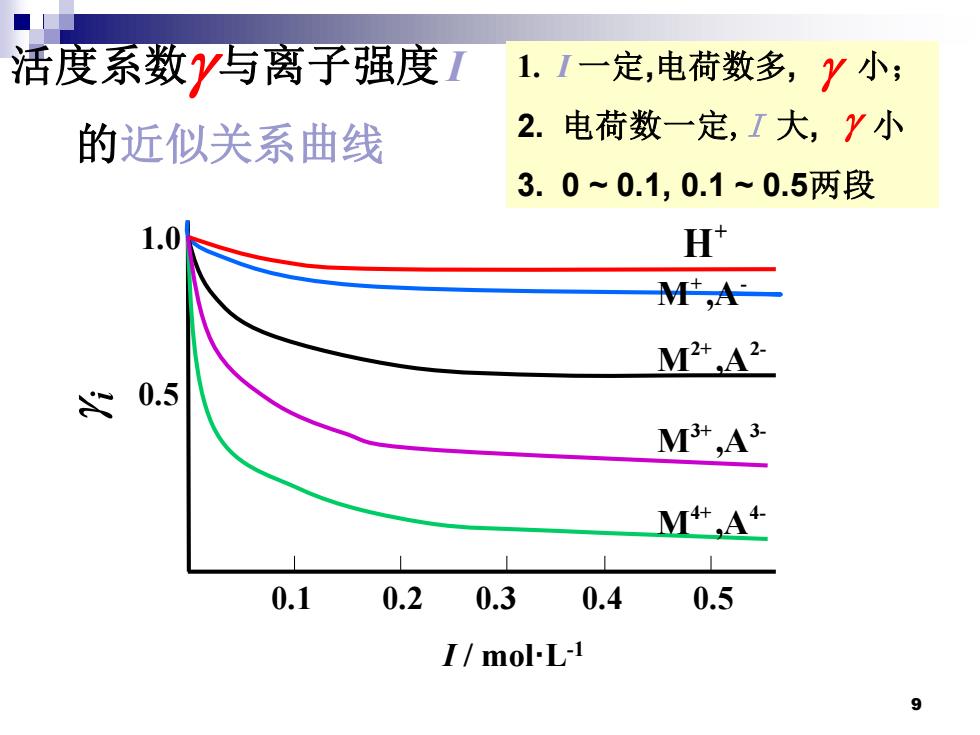
活度系数y写离子强度1 1.1一定,电荷数多,Y小: 的近似关系曲线 2.电荷数一定,I大,Y小 3.0~0.1,0.1~0.5两段 1.0 H' M,一 M2+A2 0.5 M+,A3 M+,A4 0.1 0.2 0.3 0.4 0.5 I/mol-L-1 9
9 1. I 一定,电荷数多 , 小; 2. 电荷数一定,I 大, 小 3. 0 ~ 0.1, 0.1 ~ 0.5两段 1.0 0.5 M ,A 3+ 3- M ,A 2+ 2- M ,A+ - + H M ,A 4+ 4- I / mol·L-1 0.1 0.2 0.3 0.4 0.5 活度系数 与离子强度I 的近似关系曲线

3.1.4 活度常数K2、浓度常数K及混合常数K 反应:HAC≥H++AC a(H*).a(Ac) pKm=4.76 a(HAc) K5-Ac]_a)a(e) y(HAc) [HAc] a(HAc) r(H)(Ac) Ka r(H)r(Ac) (I=0.1,y(H)=0.826,y(Ac)=0.770) pK=4.56 10
10 3.1.4 活度常数Ka、浓度常数 及混合常数 反应:HAc H+ + Ac- + - a a c a [H ][Ac ] (H ) (Ac ) (HAc) [HA (H ) (Ac ) , p 4.76 ( c] (HAc) (H ) (A HAc) c ) a a K K a K a a a + − + − + − = = = = C p 56 a K = 4. a (H ) (Ac ) K + − = C Ka M Ka ( 0.1, (H ) 0.826, (Ac ) 0.770) I + − = = =