
电位法和永停滴定法 本章内容包括电化学分析法及其分类;化学电池 的组成,相界电位,液接电位;指示电极及其分类, 基本内 常见的参比电极;pH玻璃电极构造、响应机制、 Nernst方程式和性能,测量溶液pH的原理和方法, 复合pH电极;离子选择电极基本结构、Nernst方程 式、选择性系数,电极分类及常见电极、测量方法 及测量误差;电化学生物传感器与微电极技术;电 位滴定法的原理和特点,确定终点的方法;永停滴 定法的原理、I-V滴定曲线
电位法和永停滴定法 基 本 内 容 本章内容包括电化学分析法及其分类;化学电池 的组成,相界电位,液接电位;指示电极及其分类, 常见的参比电极;pH玻璃电极构造、响应机制、 Nernst方程式和性能,测量溶液pH的原理和方法, 复合pH电极;离子选择电极基本结构、Nernst方程 式、选择性系数,电极分类及常见电极、测量方法 及测量误差;电化学生物传感器与微电极技术;电 位滴定法的原理和特点,确定终点的方法;永停滴 定法的原理、I-V滴定曲线

电位法和永停滴定法 potentiometry analysis metho dand dead-stop titration §1电化学分析法概述 §2电位法的基本原理 §3直接电位法 §4电位滴定法 §5永停滴定法
电位法和永停滴定法 potentiometry analysis metho dand dead-stop titration §1 电化学分析法概述 §2 电位法的基本原理 §3 直接电位法 §4 电位滴定法 §5 永停滴定法

§1电化学分析法概述 1.定义:电化学分析法是根据电化学原理和物质的电 化学性质而建立起来的一类分析方法。 将试样溶液与适当的电极组成化学电池,然后根据 电池电化学参数(电压、电流、电导、电阻、电量等) 的强度或变化情况对被测组分其进行分析方法
§1 电化学分析法概述 1.定义:电化学分析法是根据电化学原理和物质的电 化学性质而建立起来的一类分析方法。 将试样溶液与适当的电极组成化学电池,然后根据 电池电化学参数(电压、电流、电导、电阻、电量等) 的强度或变化情况对被测组分其进行分析方法

2.分类: 按分析测定的电化学参数的不同分为: (1)电解分析法:电重量法,库仑法,库仑滴定法: (2)电位分析法:直接电位法,电位滴定法; 3)电导分析法:直接电导法,电导滴定法; (4)伏安分析法:极谱法,溶出伏安法, 电流滴定法(含永停滴定法)
2.分类: 按分析测定的电化学参数的不同分为: ⑴电解分析法:电重量法,库仑法,库仑滴定法; ⑵电位分析法:直接电位法,电位滴定法; ⑶电导分析法:直接电导法,电导滴定法; ⑷伏安分析法:极谱法,溶出伏安法, 电流滴定法(含永停滴定法)

3.特点: (1)仪器设备简单,易于实现微型化、自动化, 分析速度快; (2)准确度高,重现性和稳定性好, (3)灵敏度高,10-4~108mol/L; (4)选择性好(排除干扰); (5)应用广泛(常量、微量和痕量分析);
3.特点: (1)仪器设备简单,易于实现微型化、自动化, 分析速度快; (2)准确度高,重现性和稳定性好; (3)灵敏度高,10-4~10-8 mol / L; (4)选择性好(排除干扰); (5)应用广泛(常量、微量和痕量分析);

§2电位法基本原理 一、化学电池: 是实现化学反应能和电能相互转换的装置,由两个电 极、电解液和外电路组成。 (一)分类: 1.原电池:将化学能转化为电能的装置(电极反应自发进 行)。 直接电位法,电位滴定法 2.电解池:将电能转化为化学能的装置(电极反应非自发 进行)。 永停滴定法
一、化学电池: 是实现化学反应能和电能相互转换的装置,由两个电 极、电解液和外电路组成。 (一)分类: 1.原电池:将化学能转化为电能的装置(电极反应自发进 行)。 直接电位法,电位滴定法 2.电解池:将电能转化为化学能的装置(电极反应非自发 进行)。 永停滴定法 §2 电位法基本原理
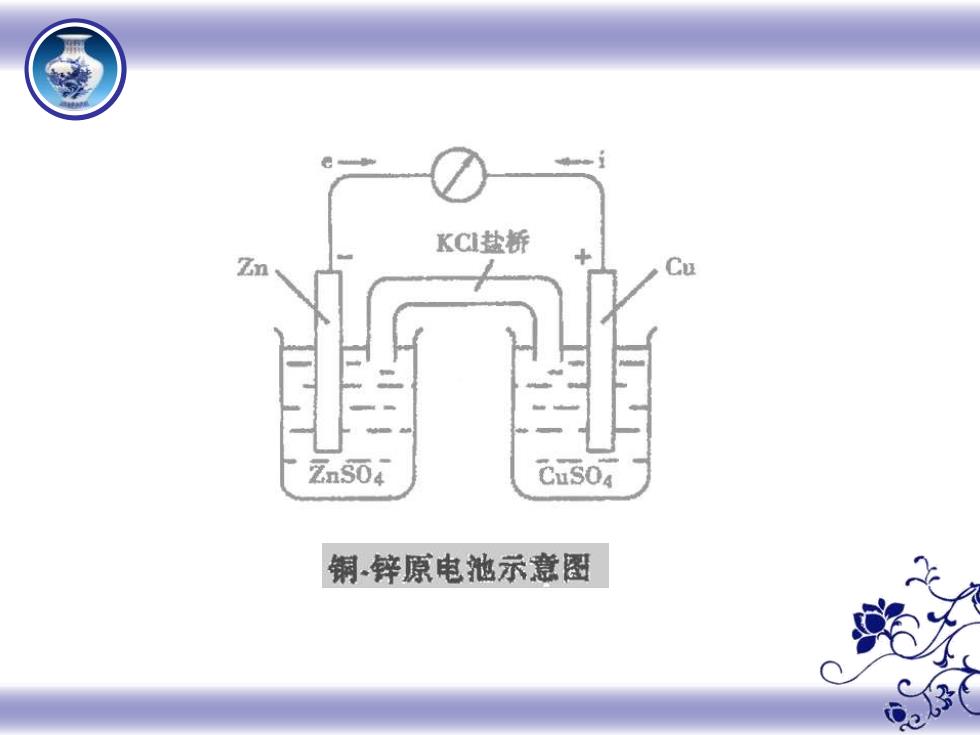
KCl盐桥 ZnS04 CuSO4 铜锌原电池示意图 03

二)电池的表示与电池的电极反应 表示形式: ()发生氧化反应的负极在左,发生还原反应的正极在 右,按电池组成的顺序书写; (2)用丨表示电池组成的每个接界面; (3)用表示盐桥,表明具有两个接界面; (4)溶液注明活度,气体注明压力; (⑤)同一溶液中的不同组分用,隔开,使用惰性电极应 注明
(二)电池的表示与电池的电极反应 表示形式: ⑴ 发生氧化反应的负极在左,发生还原反应的正极在 右,按电池组成的顺序书写; ⑵ 用︱表示电池组成的每个接界面; ⑶ 用‖表示盐桥,表明具有两个接界面; ⑷ 溶液注明活度,气体注明压力; ⑸ 同一溶液中的不同组分用 , 隔开,使用惰性电极应 注明

原电池(Daniel电池一 铜锌电池): (-Zn Zn2+(1mol/L)Cu2+(1mol/L)|Cu (+ 4c2+=0.377 42,+/a=-0.7631 电极反应 (-)Zn极Zn-2e 华+(氧化反应) (+)Cu极Cu2++2e毛u(还原反应) 电池反应 Zn Cu2+ 2++Cu(氧化还原反应) E=-=0.337-(-0.763)=1.100(无液接电位)Q 03
原电池(Daniel 电池——铜锌电池) : (-) Zn︱Zn2+(1mol/L)‖Cu2+(1mol/L)︱Cu (+) V Cu Cu 2+ = 0.377 V Zn Zn 2+ = −0.763 电极反应 (-)Zn极 Zn – 2e Zn2+ (氧化反应) (+)Cu极 Cu2+ + 2e Cu (还原反应) 电池反应 Zn + Cu2+ Zn2+ + Cu (氧化还原反应) E = + − − = 0.337 − (−0.763) =1.100(无液接电位)

电解池:外加电压,与电池电动势方向相反。 (阳)Cu|Cu2+(1mol/)lZn2+(1mol/L)|Zn(阴) 电极反应 (阴极)Zn极 Zn2+2e Zn(还原反应) (阳极)Cu极 Cu -2e 2±(氧化反应) 电池反应 Zn2+Cu 飞+€由2+ (被动氧化还原反应)
电解池:外加电压,与电池电动势方向相反。 (阳)Cu︱Cu2+(1mol/L)‖Zn2+(1mol/L)︱Zn (阴) 电极反应 (阴极)Zn极 Zn2+ + 2e Zn (还原反应) (阳极)Cu极 Cu - 2e Cu2+ (氧化反应) 电池反应 Zn2+ + Cu Zn + Cu2+ (被动氧化还原反应)