
第三章第三节 本节内容要点:重金属污染的特点、迁移方式、吸附作用、氧化还原作用、沉淀作用、配合作用、生物效 应、存在形态等。 1)金属污染的特点 重金属元素很多,在环境污染研究中所说的重金属主要是指汞、镉、铅、铬以及类金属种等生物毒性 品著的元素,也指且有一定在性的重金属,如锌、铜、镍、结、锡等。其中最引起人们重视的是汞、锅 铅、等 重金属污染的特点是:(1)天然水中的微量重金属就可产生毒性效应。重金属产生毒性大小的浓度范 围取决于该金属的性质(如价态、形态),如汞、镉产生毒性的浓度范围是0.001~0.01mgL,(2)微生物 不仅不能降解重金属,相反地某些重金属元素可在微生物作用下转化为金属有机化合物,产生更大的毒性。 例如,汞在甲基结氨素存在下能转化为毒性更大的甲基汞。(3)生物体对重金属有言集作用。生物体从环境 中摄取重金属,可经过食物苗的生物放大作用。逐级在较高的生物体内成千上万倍地富集起来。4)重金属 可通过食物、饮水、呼吸等多种途径进入人体,从面对人体健康产生不利的影响,有些重金属对人体的毛 紧性危害影响往往需要一二十年才显示出来。 总之,重金属是具有猎在危害的重要污染物。与其他许多污染物不同,重金属的污染威胁在于它不能 被微生物所分解:相反地,生物体可以富集重金属,并且把某些重金属转化为毒性更大的金属有机化合物。 白从50年代日本出现水促病和痛痛病以后,重金属的环境污染向避受到人们的极大关注。不少学者对重 金属的水环境问愿,特别是对重金属在水环境中的迁移转化问愿进行了广泛深入的研究。所谓重金属迁移 指的是重金属在自然环境中随着时间的改变而发生的空间位置的改变。而重金属的转化指的是随着介质 件的改变而使重金屈的存在状态发生变化。 本节内容要点:重金属污染的特点、迁移方式、吸附作用、氧化还原作用、沉淀作用、配合作用、生物效 应、存在形态等。 2)水体中重金属的迁移 按照物质的运动形式,重金属在水环境中的迁移可分为机成迁移、物理化学迁移和生物迁移。机械迁 移是指重金属离子以溶解态或颗粒态的形式被水流搬运。例如,我国黄河流域水士流失严重,相当一部分 面金属可通过泥沙着水流迁移,水体中的面金属也可被吸附在水中的粒物上,防水流而迁移。物理 学迁移是指重金属以简单离子、络离子或可溶性分子在水环境中通过一系列物理化学作用所实行的迁移 转化过程,这种迁移转化的结果决定了重金属在水环境中的存在形式、富集状况和潜在危害程度。生物迁 移指重金属通过生物体的新陈代测、生长、死亡等过程所实现的迁移,这是一种复杂的迁移,正是由于这 种迁移,才使重金属被有机体(如鱼类)富集起来,再经由食物链,构成对人体的咸助 水体中重金属元素的迁移转化,以何种形式为主,应视具体情况而定,如长江、黄河每天都有大量的 重金属随泥沙流失,重金属的迁移应以机械迁移为主。当然,机械迁移比较简单,对生物迁移认识还不够, 所以本节将着重讨论水体中重金属的物理化学迁移转化。 本节内容要点:重金属污染的特点、迁移方式、吸附作用、氧化还原作用、沉淀作用、配合作用、生物效 应、存在形态等。 3)水体中胶体物质对凰金属的吸邪作用 天然水体中存在着大量的是浮颗粒物,如黏士矿物、水合氧化物等无机高分子化合物和腐殖质等有机
第三章 第三节 本节内容要点:重金属污染的特点、迁移方式、吸附作用、氧化还原作用、沉淀作用、配合作用、生物效 应、存在形态等。 1) 金属污染的特点 重金属元素很多,在环境污染研究中所说的重金属主要是指汞、镉、铅、铬以及类金属砷等生物毒性 显著的元素,也指具有一定毒性的重金属,如锌、铜、镍、钴、锡等。其中最引起人们重视的是汞、镉、 铅、铬等。 重金属污染的特点是:(1)天然水中的微量重金属就可产生毒性效应。重金属产生毒性大小的浓度范 围取决于该金属的性质(如价态、形态),如汞、镉产生毒性的浓度范围是 0.001~0.01mg/L。(2)微生物 不仅不能降解重金属,相反地某些重金属元素可在微生物作用下转化为金属有机化合物,产生更大的毒性。 例如,汞在甲基钴氨素存在下能转化为毒性更大的甲基汞。(3)生物体对重金属有富集作用。生物体从环境 中摄取重金属,可经过食物链的生物放大作用,逐级在较高的生物体内成千上万倍地富集起来。(4)重金属 可通过食物、饮水、呼吸等多种途径进入人体,从而对人体健康产生不利的影响,有些重金属对人体的积 累性危害影响往往需要一二十年才显示出来。 总之,重金属是具有潜在危害的重要污染物。与其他许多污染物不同,重金属的污染威胁在于它不能 被微生物所分解;相反地,生物体可以富集重金属,并且把某些重金属转化为毒性更大的金属有机化合物。 自从 50 年代日本出现水俣病和痛痛病以后,重金属的环境污染问题受到人们的极大关注。不少学者对重 金属的水环境问题,特别是对重金属在水环境中的迁移转化问题进行了广泛深入的研究。所谓重金属迁移 指的是重金属在自然环境中随着时间的改变而发生的空间位置的改变。而重金属的转化指的是随着介质条 件的改变而使重金属的存在状态发生变化。 本节内容要点:重金属污染的特点、迁移方式、吸附作用、氧化还原作用、沉淀作用、配合作用、生物效 应、存在形态等。 2) 水体中重金属的迁移 按照物质的运动形式,重金属在水环境中的迁移可分为机械迁移、物理化学迁移和生物迁移。机械迁 移是指重金属离子以溶解态或颗粒态的形式被水流搬运。例如,我国黄河流域水土流失严重,相当一部分 重金属可通过泥沙随着水流迁移,水体中的重金属也可被吸附在水中的颗粒物上,随水流而迁移。物理化 学迁移是指重金属以简单离子、络离子或可溶性分子在水环境中通过一系列物理化学作用所实行的迁移和 转化过程,这种迁移转化的结果决定了重金属在水环境中的存在形式、富集状况和潜在危害程度。生物迁 移指重金属通过生物体的新陈代谢、生长、死亡等过程所实现的迁移,这是一种复杂的迁移,正是由于这 种迁移,才使重金属被有机体(如鱼类)富集起来,再经由食物链,构成对人体的威胁。 水体中重金属元素的迁移转化,以何种形式为主,应视具体情况而定,如长江、黄河每天都有大量的 重金属随泥沙流失,重金属的迁移应以机械迁移为主。当然,机械迁移比较简单,对生物迁移认识还不够, 所以本节将着重讨论水体中重金属的物理化学迁移转化。 本节内容要点:重金属污染的特点、迁移方式、吸附作用、氧化还原作用、沉淀作用、配合作用、生物效 应、存在形态等。 3) 水体中胶体物质对重金属的吸附作用 天然水体中存在着大量的悬浮颗粒物,如黏土矿物、水合氧化物等无机高分子化合物和腐殖质等有机

高分子化合物,它们是天然水体中存在的主要胶体物质。研究表明,水体中重金属及农药等微量污染物 部分结合在各类胶体微粒上,它们在周-液界面发生各种物理化学反应过程。实际上微量污染物在水体中的 浓度和形态分有。在很大程度上取决于水体中各类胶体的行为。与此同时,胶体微粒作为微量污染物的朝 体,它们的絮凝沉降、扩敢迁移等过程决定着污染物的去向和归宿。由于胶体具有巨大的比表面、表面 和带电荷,能够强烈地吸附各种分子和离子,对重金属离子在水体中的迁移有重大影响。胶体的吸附作用 是使重金属从水中转入固相的主要途径。在天然水体中,重金属在水相中含量极微,而主要言集于固相中, 在很大程度上与胶体的吸附作用有关。因此,胶体的吸附作用对水环境中重金属的过程转化及生物生态效 应有重要影响 。水体中胶体物质的种类 天然水体中的胶体一般可分为三大类:即无机胶体,包括各种次生黏土矿物和各种水合氧化物:有机 胶体,包括天然的和人工合成的高分子有机物、蛋白质、腐殖质等:有机无机胶体复合体, 黏土矿物是环境中无机胶体的最重要也是最复杂的成分。黏土矿物是在原生矿物风化过程中形成的 其成分是铝硅酸盐,具有片状晶体构选。黏士矿物的品体基本是由两种原子层构成的, 一种是由硅氧四 体构成的原子层,又称硅氧片:另一种是铝包氧原子层,又称水铝片,是由一个铝原子和六个氧或氢氧原 子组成的八而体(详见土壤污染化学)。黏土矿物可分为三大类,即高岭石类(由一层硅氧片和一层水铝片组 成,属1:1两层型黏土矿物):蒙脱石类(由两层硅氧片夹一层水铝片结合而成一品层,2:1三层型黏 矿物):伊利石类(2:1型酷土矿物)。伊利石类的品格与蒙殿石相似,不同点在于在伊利石的四面体中有 部分S+被AP+冒换,由此减少的正电荷由处在两层间的K+所补供,这些K+似乎起着桥梁作用,把相邻 的两层紧紧结合在一起。黏土矿物是天然水中具有显著胶体化学特征的微拉。微粒表面存在未和的氧 子和羟基,品层之间吸附有可交换的阳高子及水分子。微拉的半径一般小于10山,因此在水体中往往形 》防休 无机胶体除黏土矿物外,还有铁、铝、锰、硅等水合氧化物,它们的基本组成为Fe(OH)2,Fe(OH) AI(OH)3、MnO(OH)2、MnO2、Si(OH)4、SiO2等,随pH不同,各种形态的比例不同。实际上在一定 条件下,铁、铝等均能聚合成多核配合物,或称为无机高分子溶胶。 水体中的有机胶体主要是腐殖质。由于腐质是一种阴性高分子电解质,其形态构型与官能团的离 解程度有关。在p州较高的碱性溶液中,或离子强度较低的条件下,羟基和我基大多离解,因此高分子 着孕现负电荷方向相互排斥,构型伸展,亲水性极强,因而高分子趋于溶解。在p州较低的酸性溶液中, 或有较高浓度的金属阳离子共存时,各官能团难于离解而电荷减少,高分子趋向于卷缩成团。亲水性弱, 因而趋于沉淀或凝聚 腐殖质除能与金属离子整合以外,还能与水中的水合氧化物、黏士物等无机胶体物质结合成为有机 无机胶体复合物。天然水体中同时存在若各种物质。由于带电不同或吸附等作用。它们可相互作用结合 为某种聚集体,即成为水中悬浮物。这种悬浮物的结构、组成随水质和水体组成等变化, 一般说来,悬 物是以黏土矿物为核心,有机物和水合金属氧化物结合在黏土物表面上,并成为各微粒间的架桥物质 水中盘浮物可沉隆进入底泥:反之在水流中冲刷下来可重新悬浮在水中。由于瑟浮物对微量污染物有强烈 的吸附作用,所以它对污染物的迁移转化起着重要作用。 ·胶体物质对污染物的吸附作用 (口)黏土矿物对重金属的吸附 黏士矿物吸附水中金属离子的机制,目前还未完全搞清。这里仅介绍两种黏士物吸附重金属高子的 机理,一种是离子交换吸附机制,即黏土物的微粒通过层状结构边缘的羟基氢和-OM基中M+高子以及 层状结构之间的M+离子,与水中的重金属离子交换而将其吸附(见图3-3)
高分子化合物,它们是天然水体中存在的主要胶体物质。研究表明,水体中重金属及农药等微量污染物大 部分结合在各类胶体微粒上,它们在固-液界面发生各种物理化学反应过程。实际上微量污染物在水体中的 浓度和形态分布,在很大程度上取决于水体中各类胶体的行为。与此同时,胶体微粒作为微量污染物的载 体,它们的絮凝沉降、扩散迁移等过程决定着污染物的去向和归宿。由于胶体具有巨大的比表面、表面能 和带电荷,能够强烈地吸附各种分子和离子,对重金属离子在水体中的迁移有重大影响。胶体的吸附作用 是使重金属从水中转入固相的主要途径。在天然水体中,重金属在水相中含量极微,而主要富集于固相中, 在很大程度上与胶体的吸附作用有关。因此,胶体的吸附作用对水环境中重金属的过程转化及生物生态效 应有重要影响。 ● 水体中胶体物质的种类 天然水体中的胶体一般可分为三大类:即无机胶体,包括各种次生黏土矿物和各种水合氧化物;有机 胶体,包括天然的和人工合成的高分子有机物、蛋白质、腐殖质等;有机无机胶体复合体。 黏土矿物是环境中无机胶体的最重要也是最复杂的成分。黏土矿物是在原生矿物风化过程中形成的, 其成分是铝硅酸盐,具有片状晶体构造。黏土矿物的晶体基本是由两种原子层构成的,一种是由硅氧四面 体构成的原子层,又称硅氧片;另一种是铝氢氧原子层,又称水铝片,是由一个铝原子和六个氧或氢氧原 子组成的八面体(详见土壤污染化学)。黏土矿物可分为三大类,即高岭石类(由一层硅氧片和一层水铝片组 成,属 1∶1 两层型黏土矿物);蒙脱石类(由两层硅氧片夹一层水铝片结合而成一晶层,2∶1 三层型黏土 矿物);伊利石类(2∶1 型黏土矿物)。伊利石类的晶格与蒙脱石相似,不同点在于在伊利石的四面体中有 部分 Si4+被 Al3+置换,由此减少的正电荷由处在两层间的 K+所补偿,这些 K+似乎起着桥梁作用,把相邻 的两层紧紧结合在一起。黏土矿物是天然水中具有显著胶体化学特征的微粒。微粒表面存在未饱和的氧原 子和羟基,晶层之间吸附有可交换的阳离子及水分子。微粒的半径一般小于 10 μm,因此在水体中往往形 成胶体。 无机胶体除黏土矿物外,还有铁、铝、锰、硅等水合氧化物,它们的基本组成为 Fe(OH)2、Fe(OH)3、 Al(OH)3、MnO(OH)2、MnO2、Si(OH)4、SiO2等,随 pH 不同,各种形态的比例不同。实际上在一定 条件下,铁、铝等均能聚合成多核配合物,或称为无机高分子溶胶。 水体中的有机胶体主要是腐殖质。由于腐殖质是一种弱阴性高分子电解质,其形态构型与官能团的离 解程度有关。在 pH 较高的碱性溶液中,或离子强度较低的条件下,羟基和羧基大多离解,因此高分子沿 着呈现负电荷方向相互排斥,构型伸展,亲水性极强,因而高分子趋于溶解。在 pH 较低的酸性溶液中, 或有较高浓度的金属阳离子共存时,各官能团难于离解而电荷减少,高分子趋向于卷缩成团,亲水性弱, 因而趋于沉淀或凝聚。 腐殖质除能与金属离子螯合以外,还能与水中的水合氧化物、黏土矿物等无机胶体物质结合成为有机 无机胶体复合物。天然水体中同时存在着各种物质,由于带电不同或吸附等作用,它们可相互作用结合 为某种聚集体,即成为水中悬浮物。这种悬浮物的结构、组成随水质和水体组成等变化。一般说来,悬浮 物是以黏土矿物为核心,有机物和水合金属氧化物结合在黏土矿物表面上,并成为各微粒间的架桥物质。 水中悬浮物可沉降进入底泥;反之在水流中冲刷下来可重新悬浮在水中。由于悬浮物对微量污染物有强烈 的吸附作用,所以它对污染物的迁移转化起着重要作用。 ● 胶体物质对污染物的吸附作用 (1)黏土矿物对重金属的吸附 黏土矿物吸附水中金属离子的机制,目前还未完全搞清。这里仅介绍两种黏土矿物吸附重金属离子的 机理。一种是离子交换吸附机制,即黏土矿物的微粒通过层状结构边缘的羟基氢和-OM 基中 M+离子以及 层状结构之间的 M+离子,与水中的重金属离子交换而将其吸附(见图 3-3)
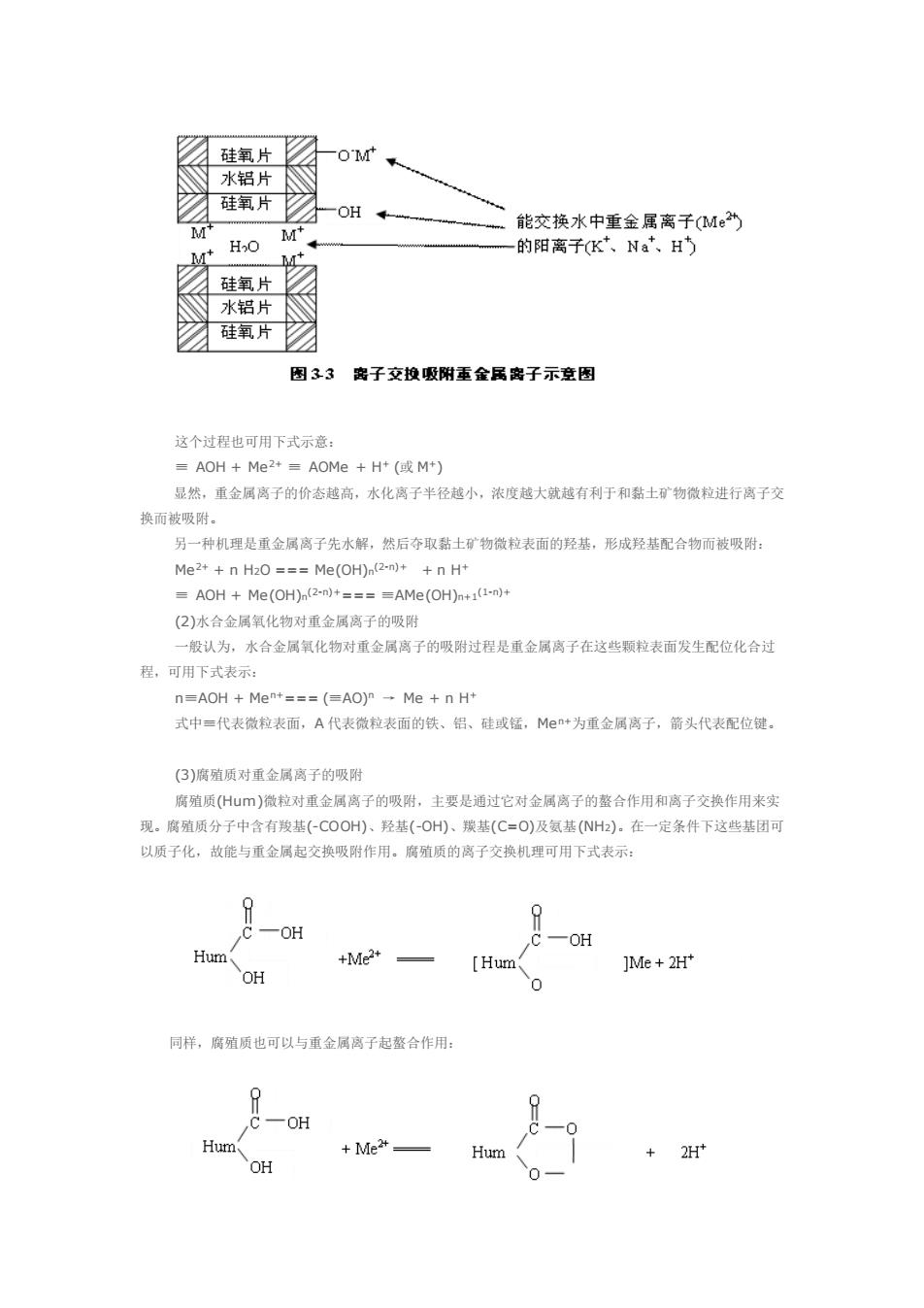
硅氧片 -OM 的水铝片 硅氧片 -OH+ 能交筷水中重金属离子(M” M -的阳离子K,Na、H M" 硅氧片 水铝片 硅氧片☑ 图33 密子交投吸附重金属离子示图 这个过程也可用下式示意: AOH+Me+=AOMe +H(M) 显然,重金属离子的价态越高,水化高子半径越小,浓度越大就越有利于和黏士矿物微粒进行离子交 换而被吸附 另一种机理是重金属离子先水解,然后夺取黏士矿物微粒表而的羟基,形成羟基配合物而被吸附: Me++n H2O===Me(OH)n(-)++n H* =AOH+Me(OH)(2m)+====AMe(OH)+1() (2)水合金属氧化物对重金属离子的吸附 一般认为,水合金属氧化物对重金属离子的吸附过程是重金属离子在这些颗粒表面发生配位化合过 程,可用下式表示 n=AOH Me+===(=AO)-Me n H* 式中=代表微粒表面,A代表微粒表面的铁、铝、硅或锰,M+为重金属离子,箭头代表配位键。 (3)腐殖质对重金属离子的吸附 腐殖质(H山m)微拉对重金属离子的吸附,主要是通过它对金属离子的整合作用和离子交换作用来实 现。腐殖质分子中含有羧基(-COOH)、羟基(-O)、基(C=O)及氨基(NH),在一定条件下这些基团可 以质子化,故能与重金属起交换吸附作用。腐殖质的离子交换机理可用下式表示 一0H Hum +Me2+ [Hum ]Me+2H OH 问样,腐殖质也可以与重金属离子起整合作用: -OH Hu 2H OH
这个过程也可用下式示意: ≡ AOH + Me2+ ≡ AOMe + H+ (或 M+) 显然,重金属离子的价态越高,水化离子半径越小,浓度越大就越有利于和黏土矿物微粒进行离子交 换而被吸附。 另一种机理是重金属离子先水解,然后夺取黏土矿物微粒表面的羟基,形成羟基配合物而被吸附: Me2+ + n H2O === Me(OH)n (2-n)+ + n H+ ≡ AOH + Me(OH)n (2-n)+=== ≡AMe(OH)n+1(1-n)+ (2)水合金属氧化物对重金属离子的吸附 一般认为,水合金属氧化物对重金属离子的吸附过程是重金属离子在这些颗粒表面发生配位化合过 程,可用下式表示: n≡AOH + Men+=== (≡AO)n → Me + n H+ 式中≡代表微粒表面,A 代表微粒表面的铁、铝、硅或锰,Men+为重金属离子,箭头代表配位键。 (3)腐殖质对重金属离子的吸附 腐殖质(Hum)微粒对重金属离子的吸附,主要是通过它对金属离子的螯合作用和离子交换作用来实 现。腐殖质分子中含有羧基(-COOH)、羟基(-OH)、羰基(C=O)及氨基(NH2)。在一定条件下这些基团可 以质子化,故能与重金属起交换吸附作用。腐殖质的离子交换机理可用下式表示: 同样,腐殖质也可以与重金属离子起螯合作用:

应当指出,殖质与重金属离子的两种吸附作用的相对大小与水中重金属离子的浓度及性质密切料 关,一般认为,当重金属离子浓度较高时,以交换吸附作用为主,如M2+与腐殖质以高子交换吸附为主 魔殖质对C2+、N2+以整合作用为主,与Z2+或C02+则可以同时发生离子交换和整合作用,当然,腐殖 颜的性质、水体的pH及组成对上述吸附作用也有较大的影响。 若要了解重金属与腐殖质离子交换吸附或整合作用的相对大小,可用NHAc或EDTA溶液解吸吸附 在腐殖质上的金属离子,计算可得定量结果。NH4AC能与腐殖酸-金属体系进行下列反应: 9 一OH C一OH [Hum JM+2NH*—[a ]NH)2+M24 0 所以。NH4AC架吸的重金属离子是临殖酸通过离子交撞暖附的离子,解吸的重金属数量,可以表示高 殖酸离子交换吸附的强弱,解吸数量大,高子交换吸附。反之,亦然。而被EDTA解吸的则是被殖酸 霰合吸附的那一部分金属离子。 在腐殖质对有机分子的吸附中。分子间作用力占重要地位。当有机物解离成正离子时,能被腐殖质离 子交换吸附。腐殖质还可以通过配位交换、氢健等作用吸附有机物,如腐殖质活性骏基氢可与阿特拉津氮 杂苯环上的氨形成氢键,面将其吸附, ·吸附量与吸附速率 (1)吸附量及吸附等温式 水体中胶体物质对重金属等污染物的吸附平衡属动态平衡,在一定条件下暖附达到平南后,单位质量 吸附剂所吸附的吸附物的量称为吸附量,以Q表示,它表示吸附剂的吸附能力。天然水体中胶体颗粒物的 吸附能力与其组成、性质、比表面、浓度有关,也与污染物的组成、形态、浓度有关,还与水体的温度 pH、氧化还原电位(E)以及共存无机物与有机物的情况有关。在恒温等条件下,吸附量Q与吸附物平衡 浓度c的关系曲线称为吸附等温线,其相应的数学方程式称为吸附等温式。适用于水体颗粒物对污染物的 吸附等温式有弗菜特利希(Freundlich)和朗格缪尔(Langmuir)两种等温式。 Freundlich吸谢等温式为: O=K.CR 式中K为表示吸附强度的常数:n为另一常数,其值介于0~1之间:当n=1时,Q与c呈直线 关系,Q=Kc:当0<n<1时,Q与c并非直线关系。若将Q=Kcn改为: lao =laK+n la c 这样,1gQ与gc为直线关系,从直线的斜率和距即可求出n和K,例如,Khan研究了腐殖酸 吸附2,4-D的n为0.789,截距lgK为0.869μmo/g,由此可得出吸附等温式为: 1g0=0.869+0.7891gc(25℃) Langmuir吸附等温式为 Q=Q0-C/(A+C) 式中Q为吸附量,Q0为饱和吸附量,c为被吸附物的平衡浓度,A为半饱和吸附量时吸附物的平 衡浓度(图3-4)。显然,A值越小,达到半饱和吸附量时残留在液相中的被吸附物浓度越小,即吸附剂的 吸附强度大:相反,A值越大,吸附强度越小
应当指出,腐殖质与重金属离子的两种吸附作用的相对大小与水中重金属离子的浓度及性质密切相 关。一般认为,当重金属离子浓度较高时,以交换吸附作用为主。如 Mn2+与腐殖质以离子交换吸附为主, 腐殖质对 Cu2+、Ni2+以螯合作用为主,与 Zn2+或 Co2+则可以同时发生离子交换和螯合作用。当然,腐殖 质的性质、水体的 pH 及组成对上述吸附作用也有较大的影响。 若要了解重金属与腐殖质离子交换吸附或螯合作用的相对大小,可用 NH4Ac 或 EDTA 溶液解吸吸附 在腐殖质上的金属离子,计算可得定量结果。NH4Ac 能与腐殖酸-金属体系进行下列反应: 所以,NH4Ac 解吸的重金属离子是腐殖酸通过离子交换吸附的离子,解吸的重金属数量,可以表示腐 殖酸离子交换吸附的强弱,解吸数量大,离子交换吸附强。反之,亦然。而被 EDTA 解吸的则是被腐殖酸 螯合吸附的那一部分金属离子。 在腐殖质对有机分子的吸附中,分子间作用力占重要地位。当有机物解离成正离子时,能被腐殖质离 子交换吸附。腐殖质还可以通过配位交换、氢键等作用吸附有机物,如腐殖质活性羧基氢可与阿特拉津氮 杂苯环上的氮形成氢键,而将其吸附。 ● 吸附量与吸附速率 (1)吸附量及吸附等温式 水体中胶体物质对重金属等污染物的吸附平衡属动态平衡。在一定条件下吸附达到平衡后,单位质量 吸附剂所吸附的吸附物的量称为吸附量,以 Q 表示,它表示吸附剂的吸附能力。天然水体中胶体颗粒物的 吸附能力与其组成、性质、比表面、浓度有关,也与污染物的组成、形态、浓度有关,还与水体的温度、 pH、氧化还原电位(pE)以及共存无机物与有机物的情况有关。在恒温等条件下,吸附量 Q 与吸附物平衡 浓度 c 的关系曲线称为吸附等温线,其相应的数学方程式称为吸附等温式。适用于水体颗粒物对污染物的 吸附等温式有弗莱特利希(Freundlich)和朗格缪尔(Langmuir)两种等温式。 Freundlich 吸附等温式为: Q=K·cn 式中 K 为表示吸附强度的常数; n 为另一常数,其值介于 0~1 之间;当 n=1 时, Q 与 c 呈直线 关系, Q=K·c;当 0<n<1 时, Q 与 c 并非直线关系。若将 Q=K·cn 改为: lgQ =lgK + n lg c 这样,lgQ 与 lgc 为直线关系,从直线的斜率和截距即可求出 n 和 K。例如,Khan 研究了腐殖酸 吸附 2,4-D 的 n 为 0.789,截距 lgK 为 0.869 μmol/g,由此可得出吸附等温式为: lgQ = 0.869+0.789lg c (25℃) Langmuir 吸附等温式为: Q=Q0·c/(A+c) 式中 Q 为吸附量,Q0为饱和吸附量,c 为被吸附物的平衡浓度,A 为半饱和吸附量时吸附物的平 衡浓度(图 3-4)。显然,A 值越小,达到半饱和吸附量时残留在液相中的被吸附物浓度越小,即吸附剂的 吸附强度大;相反,A 值越大,吸附强度越小

Q-0 Q-Qc (A+e) Q--ela 图3-4 Langmuir吸附等温线 从Langmuir等温式看,在c较低时,式中c与A相比可忽略不计,于是得Q=Qoc/A,此时Q与 c成正比,即图3-4中等温吸附线的第1段。在c很大时,c>A,结果是Q=Q0,即吸附量恒定而与平 衡浓度无关(线段)。在c适中时,Q=Q0c(A+C),吸附量Q随平衡浓度c提高而逐渐增加(钱段)。 对于在一定条件下的待定体系,O加与A均为常数,可以通过实验测出。为了方使地求出常数O0利 A,可将Langmuir等温式改写为 1/Q=1/Q0 +A/Qoc 然后将1/Q/对1/c作图,得到直线型等温线,从截距和斜率求出Q0和A值。 以上两种吸附等温式及其他许多吸附等温式仅适用于胶体微粒总体或其中各组分单独存在时的吸附 量情况。实际上,水中污染物有许多种,而胶体物质也可以有多种组分,故以上两种等温吸附式还不能准 确表达水中胶体物质对污染物吸附的实际情况,这个问题正在研究之中。 水体中沉积物或悬浮颗粒物对有机污染物的吸附(s0 rption)主要包括表面吸附(aG rption)和分 (partitio)两种机理,它们的相对贡献率与沉积物或悬浮颗粒物的组成(如有机碳含量)及有机物本身的性 质(如辛醇-水分配系数、溶解度等)有关。 2)暖附速老 吸附速率即为单位时间内吸附到吸附剂上的吸附物浓度,通过实验可测得吸附速率。假定在某一温度 下,吸附物的起始浓度为C0,C:为t时问吸附物的浓度,C0-C:则为经过t时刻被吸附在吸附剂上的吸附物 浓度,将c0C:对t作图(如图3-5).曲线上某点的切线即为该时的吸附速度。单位为mgLh:如从图中 原点作各条曲线的切线,其斜就是在相同C0条件下 ,各相应温度的吸附速
图 3-4 Langmuir 吸附等温线 从 Langmuir 等温式看,在 c 较低时,式中 c 与 A 相比可忽略不计,于是得 Q=Q0·c/A,此时 Q 与 c 成正比,即图 3-4 中等温吸附线的第Ⅰ段。在 c 很大时,c >>A,结果是 Q=Q0,即吸附量恒定而与平 衡浓度无关(线段Ⅲ)。在 c 适中时,Q=Q0·c/ (A+c),吸附量 Q 随平衡浓度 c 提高而逐渐增加(线段Ⅱ)。 对于在一定条件下的特定体系,Q0与 A 均为常数,可以通过实验测出。为了方便地求出常数 Q0 和 A,可将 Langmuir 等温式改写为: 1/Q = 1/Q0 + A/Q0·c 然后将 1/Q/对 1/c 作图,得到直线型等温线,从截距和斜率求出 Q0和 A 值。 以上两种吸附等温式及其他许多吸附等温式仅适用于胶体微粒总体或其中各组分单独存在时的吸附 量情况。实际上,水中污染物有许多种,而胶体物质也可以有多种组分,故以上两种等温吸附式还不能准 确表达水中胶体物质对污染物吸附的实际情况,这个问题正在研究之中。 水体中沉积物或悬浮颗粒物对有机污染物的吸附(sorption)主要包括表面吸附(adsorption)和分配 (partition)两种机理,它们的相对贡献率与沉积物或悬浮颗粒物的组成(如有机碳含量)及有机物本身的性 质(如辛醇-水分配系数、溶解度等)有关。 (2)吸附速率 吸附速率即为单位时间内吸附到吸附剂上的吸附物浓度。通过实验可测得吸附速率。假定在某一温度 下,吸附物的起始浓度为 c0,ct为 t 时间吸附物的浓度,c0-ct则为经过 t 时刻被吸附在吸附剂上的吸附物 浓度,将 c0-ct对 t 作图(如图 3-5)。曲线上某点的切线即为该时的吸附速度,单位为 mg/L·h;如从图中 原点作各条曲线的切线,其斜率就是在相同 c0条件下,各相应温度的吸附速率
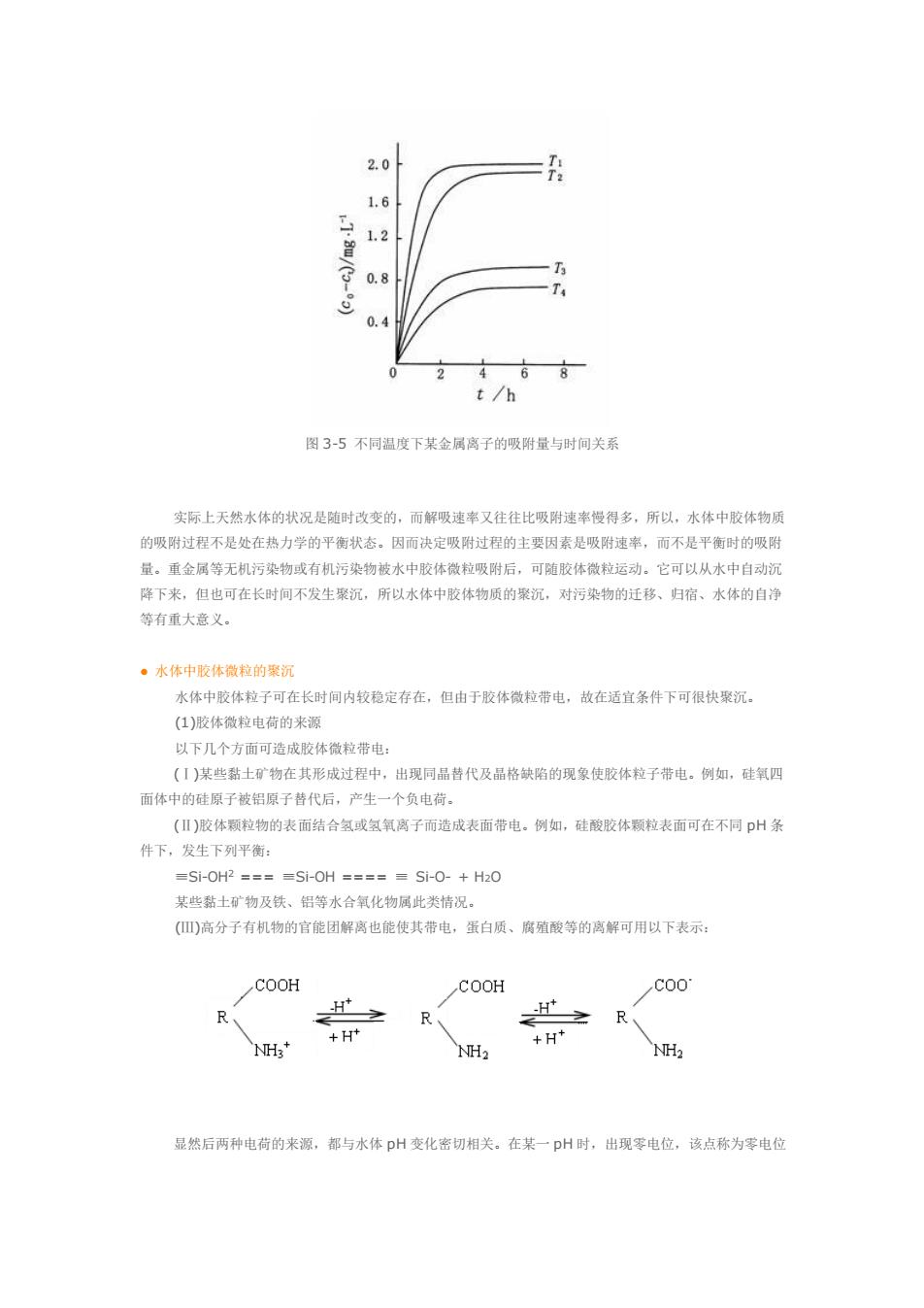
16 1.2 T 0.4 2 468 t/h 图3-5不同温度下某金属离子的吸附量与时间关系 实际上天然水体的状况是随时改变的,而解吸速率又往往比吸附速率慢得多,所以,水体中胶体物质 的吸附过程不是处在热力学的平衡状态。因而决定吸附过程的生要因素是吸附速半,而不是平衡时的吸附 量。重金属等无机污染物或有机污染物被水中胶体微拉吸附后。可随胶体微楚运动,它可以从水中自动沉 降下来,但也可在长时间不发生聚沉,所以水体中胶体物质的聚沉,对污染物的迁移、归宿、水体的自溶 等有重大意义。 。水体中骸体微粒的案沉 水体中胶体粒子可在长时间内校稳定存在,但由于胶体微粒带电,故在适宜条件下可很快聚沉。 (1)胶体微粒电荷的来源 以下几个方面可造成胶体微粒带电 (1)某些黏土矿物在其形成过程中,出现同品昔代及品格缺陷的现象使胶体粒子带电。例如,硅氧四 面体中的硅原子被铝原子替代后,产生一个负电荷, ()胶体颗粒物的表面结合氢或氢氧离子而造成表面带电。例如,硅酸胶体颗粒表面可在不同pH条 件下,发生下列平衡 =Si-0HP==-Si-0H=====Si-0-+H0 某些黏十矿物及铁、铝等水合氧化物属此类情况。 (高分子有机物的官能团解离也能使其带电,蛋白质、病殖酸等的离解可用以下表示。 COOH COOH c00 R H H R、 NH NH2 之R 显然后两种电荷的来源,都与水体pH变化密切相关。在某一pH时,出现零电位,该点称为零电位
图 3-5 不同温度下某金属离子的吸附量与时间关系 实际上天然水体的状况是随时改变的,而解吸速率又往往比吸附速率慢得多,所以,水体中胶体物质 的吸附过程不是处在热力学的平衡状态。因而决定吸附过程的主要因素是吸附速率,而不是平衡时的吸附 量。重金属等无机污染物或有机污染物被水中胶体微粒吸附后,可随胶体微粒运动。它可以从水中自动沉 降下来,但也可在长时间不发生聚沉,所以水体中胶体物质的聚沉,对污染物的迁移、归宿、水体的自净 等有重大意义。 ● 水体中胶体微粒的聚沉 水体中胶体粒子可在长时间内较稳定存在,但由于胶体微粒带电,故在适宜条件下可很快聚沉。 (1)胶体微粒电荷的来源 以下几个方面可造成胶体微粒带电: (Ⅰ)某些黏土矿物在其形成过程中,出现同晶替代及晶格缺陷的现象使胶体粒子带电。例如,硅氧四 面体中的硅原子被铝原子替代后,产生一个负电荷。 (Ⅱ)胶体颗粒物的表面结合氢或氢氧离子而造成表面带电。例如,硅酸胶体颗粒表面可在不同 pH 条 件下,发生下列平衡: ≡Si-OH2 === ≡Si-OH ==== ≡ Si-O- + H2O 某些黏土矿物及铁、铝等水合氧化物属此类情况。 (Ⅲ)高分子有机物的官能团解离也能使其带电,蛋白质、腐殖酸等的离解可用以下表示: 显然后两种电荷的来源,都与水体 pH 变化密切相关。在某一 pH 时,出现零电位,该点称为零电位

点,简称零电点,相应的pH值简称pH2pC(见表3-8).因此水体pH对胶体吸附有较大的影响。一方面。 DH决定着胶体的性质:另一方面,重金属的存在形态也与水体H有关, 表3-8水体中常见物质的DHzDC 5 0 2.1 长石 20 2.4 钠长石 (V)胶体微粒表面结合或吸附水中某些离子、配高子或有机高子等,使题拉表面带电。例 FeO(OH)(s)+HPO42 FeOHPO+(s)+OH- (2)水体中胶体微粒的双电层特征 即盐土广物微拉的型由层结均为州道明胶体的结的。盐士矿物特拉的老面指负由特,空吸附游液中 正离子(称为反离子)。由于离子的热运动,正离子将扩散分布在微粒界面的周用。图3-6中,界面NM是 黏土矿物微粒表面的一部分,符号”+“表示被吸附的正离子.实际界面周围的溶液中有正离子,也有负离 子:因微粒负电场作用,正高子过剩,显然与界面NM距离越远的液面,由于微粒电场力不断诚弱,正离 子过利趋势也越小,直至为零。这样由界面 图3-6黏士旷物微粒双电层及其反高子扩散分布示意图 NM和同它距离为d正离子过剩刚刚为零的液面CD,构成了微粒扩散双电层。实验证明,与微粒界 而紧靠的NM至AB液层,将随微粒一起运动,称为不流动层(固定层):其厚度为δ,约与离子大小相近。 而离界面稍远的AB至CD液层,不跟微粒一起运动,称为流动液层(付扩散层),其厚度为d-百,曲线NC 表示相对界面不同距离的液面电位,液面CD电中性,设其电位为零,并作为衡量其他液面电位的基酒 界面NM电位为E,称为胶体微粒总电位。不流动层与流动层交界液面AB的电位为5,称为胶体微粒的ξ 电位或电动电位。不流动液层中总有一部分与微粒电性相反的离子,所以E电位的绝对值小于总电位E的 绝对值。由于同种胶体微粒具有相同的ξ电位,当它们被此接近时,在静电斥力作用下分开,故胶体微 可长时间稳定存在而不发生聚沉
点,简称零电点,相应的 pH 值简称 pHzpc (见表 3-8)。因此水体 pH 对胶体吸附有较大的影响。一方面, pH 决定着胶体的性质;另一方面,重金属的存在形态也与水体 pH 有关。 表 3-8 水体中常见物质的 pHzpc (Ⅳ)胶体微粒表面结合或吸附水中某些离子、配离子或有机离子等,使颗粒表面带电。例 FeO(OH)(s) + HPO4 2- = FeOHPO4 - (s) + OH- (2)水体中胶体微粒的双电层特征 现以黏土矿物微粒的双电层结构为例说明胶体的结构。黏土矿物微粒的表面带负电荷,它吸附溶液中 正离子(称为反离子)。由于离子的热运动,正离子将扩散分布在微粒界面的周围。图 3-6 中,界面 NM 是 黏土矿物微粒表面的一部分,符号"+"表示被吸附的正离子。实际界面周围的溶液中有正离子,也有负离 子;因微粒负电场作用,正离子过剩,显然与界面 NM 距离越远的液面,由于微粒电场力不断减弱,正离 子过剩趋势也越小,直至为零。这样由界面 图 3-6 黏土矿物微粒双电层及其反离子扩散分布示意图 NM 和同它距离为 d 正离子过剩刚刚为零的液面 CD,构成了微粒扩散双电层。实验证明,与微粒界 面紧靠的 NM 至 AB 液层,将随微粒一起运动,称为不流动层(固定层);其厚度为 δ,约与离子大小相近。 而离界面稍远的 AB 至 CD 液层,不跟微粒一起运动,称为流动液层(扩散层),其厚度为 d-δ。曲线 NC 表示相对界面不同距离的液面电位,液面 CD 呈电中性,设其电位为零,并作为衡量其他液面电位的基准。 界面 NM 电位为 E,称为胶体微粒总电位。不流动层与流动层交界液面 AB 的电位为 ξ,称为胶体微粒的 ξ 电位或电动电位。不流动液层中总有一部分与微粒电性相反的离子,所以 ξ 电位的绝对值小于总电位 E 的 绝对值。由于同种胶体微粒具有相同的 ξ 电位,当它们彼此接近时,在静电斥力作用下分开,故胶体微粒 可长时间稳定存在而不发生聚沉

实际上水体中胶体结构是很复杂的。侧如,黏土矿物大多数为薄板状结构,具有一定厚度,故除有 面表面外,还有边缘表面。在天然水体中黏土矿物板面常垦电负性,边面则垦正电性,使双电层的结构复 杂化,常表现出板面与另一微粒的边面相互吸引而结合,具有自然雾凝的特征。 高分子电解质如腐殖酸、蛋白质等,其电荷是由官能团的离解产生的,离解度即电荷值由水体p州 监决定,其表面电位还与官能团的数量和分布特征有关。双电层的结构也与围体表面的双电层结构不同 铁、铝、锰、硅等的水合氧化物或固体氧化物,其表面电荷是因结合氢离子或氢氧离子产生的,因而 表而电荷强烈地依懒于溶液的pH值。在天然水体中时常呈电负性,在低pH值时可呈正电性,在固定pH 值时,表面上有恒定的电位,这种双电层有明显的两性性质,因此零电点是其主要参数。 (3)胶体微粒的聚沉 胶体微粒的聚沉是指胶体厕粒通过碰撞结合成聚集体而发生沉淀现象,这现象也称凝聚。彩响胶体 微粒聚沉的因素是多种多样的,包括电解质的浓度、微粒的沫度、水体温度、p州值及流动状况、带相反电 荷微粒何相互作用等,其中主要因素是电解质浓度。从微粒本身结构看,微粒带同号电荷及微粒周用有水 化膜是使其稳定的两个士要原因。若消除这两个因素,微粒便可聚沉 图3-7是电解质浓度对ξ电位的影响,若曲线NC表示在带负电荷的黏土溶液中,没有加入电解质时 颜拉图围各液面的电位分布。当溶液加入电解质后,其中正离子会更多地被微粒吸附讲固定层,而使£申 拉绝对值下降,即由ξ下降到子,同时由于固定层中正离子增多,而扩散层中正离子相对减少,引起扩 双电层厚度变薄(由d变为d)。如果E电位降到不足以排斥胶体微粒相互碰撞时的分子间作用力,则微料 会聚集变大,并在重力作用下沉降。胶体微粒开始明显聚沉的E电位,称为临界电位。若加入的电解顺离 子能被微粒大量吸附到圆定层内 ,可使电位减为零,甚至变号。若ξ电位等于零时,表明胶体微粒及其 同定层的整体垦现电中性面处于等电状态,若E电位变号后绝对值较大,又可阻止胶体微拉的聚沉,总之 E电位大约在士0.0V时,胶体微粒在溶液中相当稳定。引入电解质到足够浓度,E电位变化到临界电位(大 的士0.03V)时,胶体微粒就会开始明显聚沉,且电解质中影响电位的离子价数越高,所起的凝聚作用越 强。 图3-7电解质对ξ电位的影 某些胶体微粒(如有机高分子胶体微粒)本身具有一定的亲水性,直接吸附水分子形成水化膜。对于这
实际上水体中胶体结构是很复杂的。例如,黏土矿物大多数为薄板状结构,具有一定厚度,故除有板 面表面外,还有边缘表面。在天然水体中黏土矿物板面常呈电负性,边面则呈正电性,使双电层的结构复 杂化,常表现出板面与另一微粒的边面相互吸引而结合,具有自然絮凝的特征。 高分子电解质如腐殖酸、蛋白质等,其电荷是由官能团的离解产生的,离解度即电荷值由水体 pH 值决定,其表面电位还与官能团的数量和分布特征有关。双电层的结构也与固体表面的双电层结构不同。 铁、铝、锰、硅等的水合氧化物或固体氧化物,其表面电荷是因结合氢离子或氢氧离子产生的,因而 表面电荷强烈地依赖于溶液的 pH 值。在天然水体中时常呈电负性,在低 pH 值时可呈正电性,在固定 pH 值时,表面上有恒定的电位,这种双电层有明显的两性性质,因此零电点是其主要参数。 (3)胶体微粒的聚沉 胶体微粒的聚沉是指胶体颗粒通过碰撞结合成聚集体而发生沉淀现象,这现象也称凝聚。影响胶体 微粒聚沉的因素是多种多样的,包括电解质的浓度、微粒的浓度、水体温度、pH 值及流动状况、带相反电 荷微粒间相互作用等,其中主要因素是电解质浓度。从微粒本身结构看,微粒带同号电荷及微粒周围有水 化膜是使其稳定的两个主要原因。若消除这两个因素,微粒便可聚沉。 图 3-7 是电解质浓度对 ξ 电位的影响,若曲线 NC 表示在带负电荷的黏土溶液中,没有加入电解质时 颗粒周围各液面的电位分布,当溶液加入电解质后,其中正离子会更多地被微粒吸附进固定层,而使 ξ 电 位绝对值下降,即由 ξ 下降到 ξ′,同时由于固定层中正离子增多,而扩散层中正离子相对减少,引起扩散 双电层厚度变薄(由 d 变为 d′)。如果 ξ 电位降到不足以排斥胶体微粒相互碰撞时的分子间作用力,则微粒 会聚集变大,并在重力作用下沉降。胶体微粒开始明显聚沉的 ξ 电位,称为临界电位。若加入的电解质离 子能被微粒大量吸附到固定层内,可使 ξ 电位减为零,甚至变号。若 ξ 电位等于零时,表明胶体微粒及其 固定层的整体呈现电中性而处于等电状态。若 ξ 电位变号后绝对值较大,又可阻止胶体微粒的聚沉。总之, ξ 电位大约在±0.07V 时,胶体微粒在溶液中相当稳定。引入电解质到足够浓度,ξ 电位变化到临界电位(大 约±0.03 V)时,胶体微粒就会开始明显聚沉,且电解质中影响 ξ 电位的离子价数越高,所起的凝聚作用越 强。 图 3-7 电解质对 ξ 电位的影响 某些胶体微粒(如有机高分子胶体微粒)本身具有一定的亲水性,直接吸附水分子形成水化膜。对于这

类胶体的聚沉来说,要降低电位,但更重要的是要去除水化膜,否则带有水化膜的有机胶体微粒相互 距离较大,分子间作用力很弱,难以聚沉。一般在有大量电解质存在时,可以满足上述两个方面的需要, 使有机胶体微粒在水中聚沉 胶体粒子除能聚集成沉淀外,还能形成松散状絮状物,该过程称为胶体微粒的絮凝,絮状物称凝絮物 例如,腐殖质分子中的我基和酚羟基可与水合氧化铁胶体微粒表而的铁整合,而腐殖质分子中可供整合的 成分很多,这样有可能形成胶体微粒腐殖质胶体微粒的庞大聚集体,从而絮凝沉降。 实际水体中微粒可出现多种方式的聚沉和絮凝作用。影响胶体凝聚的因素是复杂的。除电解质外 还有胶体微粒的浓度、水体的温度、pH值及流动状况、带相反电性的胶体微粒的相互作用、光的作用等因 素。 ·胶体微粒的吸附和聚沉对污染物的响 吸附作用可垫制水体中金属离子的浓度。胶体的吸附作用是使许多微量金属从饱和的天然水中转入因 相的最重要的途径。胶体的吸附作用在很大程度上控制若微量金属在水环墙中的分布和富集状况。大量窗 料表明,在水环境中所有富含胶体的沉积物由于吸附作用几乎都富集C? NR. Ba24、Zn24、Pb2 可、U等金属,加帝纳(0.Gardiner,1974)的试验表明,底泥和悬浮物对Cd2+的吸附作用及其可能发生的 解吸作用是控制问水中C+浓度的主要因素。很多学者研究了水环境中胶体对无机二价汞的吸附特征。颜 尼enne)指出,铁和锰的水合氧化物对Hg2*的吸附作用能有效地控制Hg2的浓度.安德逊(Anderson) 发现,氧化铁能吸附大量Hg2+,尤其是在pH6.5~7.0时, 不同吸附剂对金属离子的吸附有较大的差别。P.A.Krenkel和E.B.Shin等研究了各种天然和人工合 成的吸附剂对HgC的吸附作用,其吸附能力大致顺序是:含硫的沉积物(还原态的)>商业去污剂(硅的混 合物、活性碳)>三维黏士矿物(伊利石、蒙脱石)>含蛋白去污剂>铁,锰氧化物及不含硫的天然有机物 不含硫但含胺的合成有机去污剂、二维黏土矿物和细砂。若以每分钟每克吸附剂所吸附的HC2的微克数 多少来排列,则吸附顺序为:硫醇(84.2)>>伊利石(65.3)>蒙脱石(35.7)>胺类化合物(10.5)>高龄石 (9.7)>含碳基的有机物(7.3)>细砂(2.9)>中砂(1.7)>粗砂(1.6) 高广生、陈静生研究了我国主要河流(珠江广州段、长江南京段、黄河花园口段、松花江和黑龙江同 江设)县浮物的地球化学性质与对锅离子吸附作用的相关性和地域分布规律,认为我国主要河流悬浮物的有 效载体阳离子交换量(见表3-9)与其黏士矿物组成(见表3-10)有很好的相关性,并且与相应流域代表性 壤的黏土矿物类型、硅铝分子比率和胡敏酸/富里酸之比值也有较好的相关性。 水体DH对吸附剂吸附重金属离子有一定的响。王略等(1983年)研究了金沙江题粒物对Cu2+ Zn2、C、C02。NP:的吸附作用。结果表明,江水pH值是控制金属离子向圆相证移的主要因。 颗粒物的吸附作用使水中金属离子在较低的H值下向固相迁移。总吸附量随DH增高而增大。各元素均 有一临界D州值,超过了该值,离子的水解、沉淀则起主要作用。颗粒物的粒度和浓度及几种离子共存时 对吸附有影响
类胶体的聚沉来说,虽要降低 ξ 电位,但更重要的是要去除水化膜,否则带有水化膜的有机胶体微粒相互 距离较大,分子间作用力很弱,难以聚沉。一般在有大量电解质存在时,可以满足上述两个方面的需要, 使有机胶体微粒在水中聚沉。 胶体粒子除能聚集成沉淀外,还能形成松散状絮状物,该过程称为胶体微粒的絮凝,絮状物称凝絮物。 例如,腐殖质分子中的羧基和酚羟基可与水合氧化铁胶体微粒表面的铁螯合,而腐殖质分子中可供螯合的 成分很多,这样有可能形成胶体微粒 腐殖质 胶体微粒的庞大聚集体,从而絮凝沉降。 实际水体中微粒间可出现多种方式的聚沉和絮凝作用。影响胶体凝聚的因素是复杂的。除电解质外, 还有胶体微粒的浓度、水体的温度、pH 值及流动状况、带相反电性的胶体微粒的相互作用、光的作用等因 素。 ● 胶体微粒的吸附和聚沉对污染物的影响 吸附作用可控制水体中金属离子的浓度。胶体的吸附作用是使许多微量金属从饱和的天然水中转入固 相的最重要的途径。胶体的吸附作用在很大程度上控制着微量金属在水环境中的分布和富集状况。大量资 料表明,在水环境中所有富含胶体的沉积物由于吸附作用几乎都富集 Cu2+、Ni2+、Ba2+、Zn2+、Pb2+、 Tl、U 等金属。加帝纳(J.Gardiner,1974)的试验表明,底泥和悬浮物对 Cd2+的吸附作用及其可能发生的 解吸作用是控制河水中 Cd2+浓度的主要因素。很多学者研究了水环境中胶体对无机二价汞的吸附特征。颜 尼(Jenne)指出,铁和锰的水合氧化物对 Hg2+的吸附作用能有效地控制 Hg2+的浓度。安德逊(Anderson) 发现,氧化铁能吸附大量 Hg2+,尤其是在 pH 6.5~7.0 时。 不同吸附剂对金属离子的吸附有较大的差别。P.A.Krenkel 和 E.B.Shin 等研究了各种天然和人工合 成的吸附剂对 HgCl2的吸附作用,其吸附能力大致顺序是:含硫的沉积物(还原态的)>商业去污剂(硅的混 合物、活性碳)>三维黏土矿物(伊利石、蒙脱石)>含蛋白去污剂>铁、锰氧化物及不含硫的天然有机物> 不含硫但含胺的合成有机去污剂、二维黏土矿物和细砂。若以每分钟每克吸附剂所吸附的 HgCl2的微克数 多少来排列,则吸附顺序为:硫醇(84.2)>>伊利石(65.3)>蒙脱石(35.7)>胺类化合物(10.5)>高岭石 (9.7)>含碳基的有机物(7.3)>细砂(2.9)>中砂(1.7)>粗砂(1.6)。 高广生、陈静生研究了我国主要河流(珠江广州段、长江南京段、黄河花园口段、松花江和黑龙江同 江段)悬浮物的地球化学性质与对镉离子吸附作用的相关性和地域分布规律,认为我国主要河流悬浮物的有 效载体阳离子交换量(见表 3-9)与其黏土矿物组成(见表 3-10)有很好的相关性,并且与相应流域代表性土 壤的黏土矿物类型、硅铝分子比率和胡敏酸/富里酸之比值也有较好的相关性。 水体 pH 对吸附剂吸附重金属离子有一定的影响。王晓蓉等(1983 年)研究了金沙江颗粒物对 Cu2+、 Zn2+、Cd2+、Co2+、Ni2+的吸附作用。结果表明,江水 pH 值是控制金属离子向固相迁移的主要原因。 颗粒物的吸附作用使水中金属离子在较低的 pH 值下向固相迁移。总吸附量随 pH 增高而增大。各元素均 有一临界 pH 值,超过了该值,离子的水解、沉淀则起主要作用。颗粒物的粒度和浓度及几种离子共存时 对吸附有影响
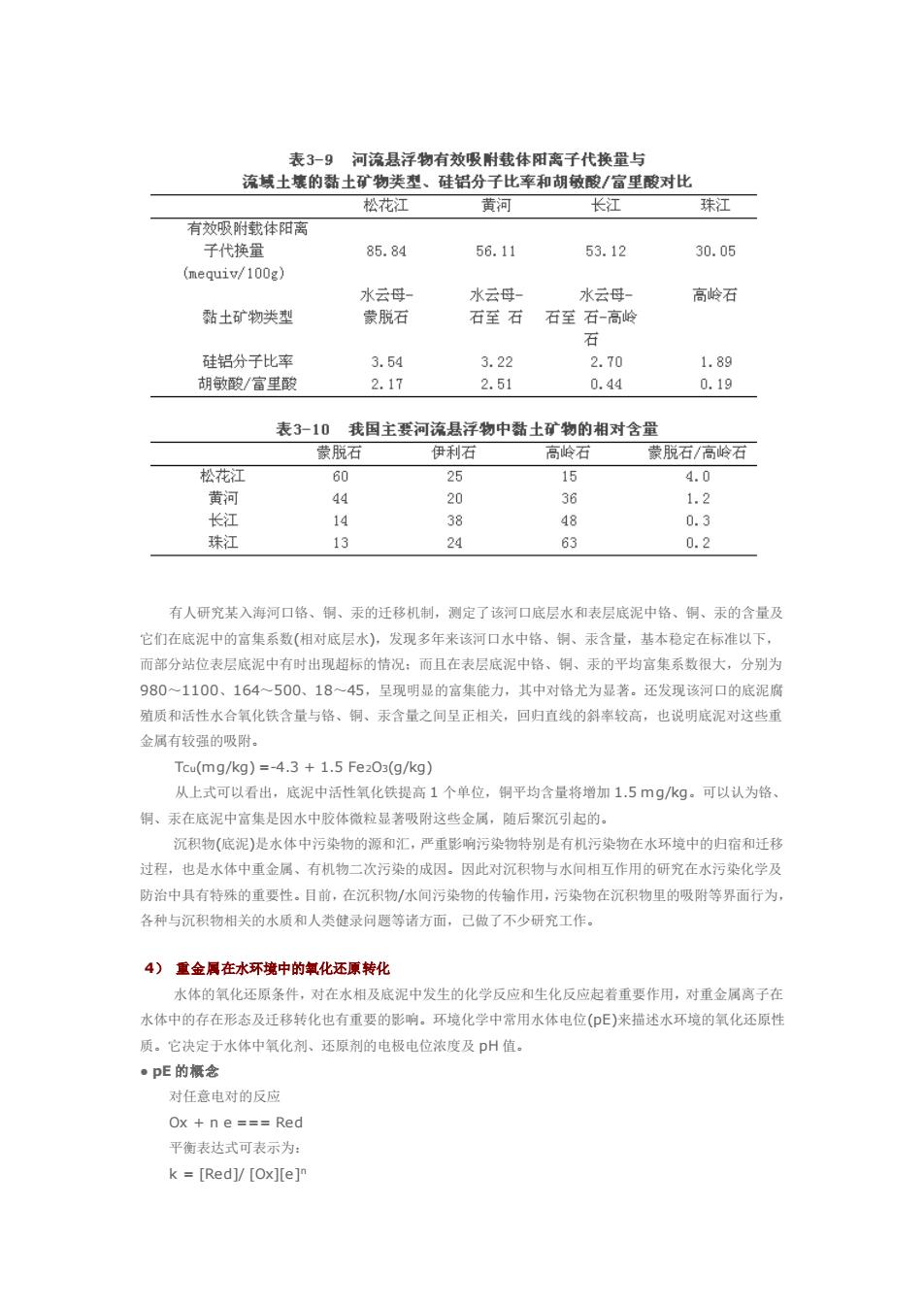
表39河流县浮物有效吸附裁休阳离千代掩量与 流域土壤的黏土矿物类型、硅铝分子比率和胡敏酸/富里酸对比 松花江 黄河 有效吸附载体阳离 长江 珠江 子代换量 85.84 56.11 53.12 30.05 (mequiv/100g 水云母 高岭石 黏土矿物类型 蒙脱石 石至石石至石-高岭 3.22 1.89 2.17 2.51 0.44 0.1g 表3-10 我国主要河流县浮物中黏士矿物的相对含量 蒙脱石 伊利石 高龄石 蒙脱石/高岭石 松花江 60 25 15 4.0 44 20 36 1.2 长 14 38 48 0.3 珠江 13 24 63 0.2 有人研究某入海河口路、铜、汞的迁移机制,测定了该河口底层水和表层底泥中格、制、汞的含量及 它们在底泥中的富集系数(相对底层水)。发现多年来该河口水中络、铜、汞含量,基本稳定在标准以下 而部分站位表层底泥中有时出现超标的情况:而且在表尽底泥中铬、铜、汞的平均富集系数很大,分别为 9801100、164~500、18~45.是现明显的富集能力,其中对路尤为显著。还发现该河口的底泥腐 殖质和活性水合氧化铁含量与格、铜、汞含量之间呈正相关,回归直线的斜率较高,也说明底泥对这些重 金属有较强的吸附, Tcu(mg/kg)=-4.3+1.5Fe203(g/kg) 从上式可以看出,底泥中活性氧化铁提高1个单位,铜平均含量将增加1.5mg/kg可以认为 铜、汞在底泥中富集是因水中胶体微粒显著吸附这些金属,随后聚沉引起的。 沉积物(底泥)是水体中污染物的源和汇,严重影南污染物特别是有机污染物在水环境中的归宿和迁移 过程,也是水体中重金属、有机物二次污染的成因。因此对沉积物与水间相互作用的研究在水污染化学及 防治中具有特殊的重要性。目前,在沉积物/水间污染物的传输作用,污染物在沉积物里的吸附等界面行为 各种与汇积物相关的水质和人类健录问题等诸方面,已做了不少研究工作, 4)重金属在水环境中的氢化还原转化 水体的氧化还原条件,对在水相及底泥中发生的化学反应和生化反应起着重要作用。对重金属离子在 水体中的存在形态及迁移转化也有重要的影响。环境化学中常用水体电位(E)来描述水环境的氧化还原性 质。它决定于水体中氧化剂、还原剂的电极电位浓度及DH值。 pE的根念 对任意电对的反应 Ox+ne===Red 平衡表达式可表示为: k=[Red]/[Ox][e]
有人研究某入海河口铬、铜、汞的迁移机制,测定了该河口底层水和表层底泥中铬、铜、汞的含量及 它们在底泥中的富集系数(相对底层水),发现多年来该河口水中铬、铜、汞含量,基本稳定在标准以下, 而部分站位表层底泥中有时出现超标的情况;而且在表层底泥中铬、铜、汞的平均富集系数很大,分别为 980~1100、164~500、18~45,呈现明显的富集能力,其中对铬尤为显著。还发现该河口的底泥腐 殖质和活性水合氧化铁含量与铬、铜、汞含量之间呈正相关,回归直线的斜率较高,也说明底泥对这些重 金属有较强的吸附。 TCu(mg/kg) =-4.3 + 1.5 Fe2O3(g/kg) 从上式可以看出,底泥中活性氧化铁提高 1 个单位,铜平均含量将增加 1.5 mg/kg。可以认为铬、 铜、汞在底泥中富集是因水中胶体微粒显著吸附这些金属,随后聚沉引起的。 沉积物(底泥)是水体中污染物的源和汇,严重影响污染物特别是有机污染物在水环境中的归宿和迁移 过程,也是水体中重金属、有机物二次污染的成因。因此对沉积物与水间相互作用的研究在水污染化学及 防治中具有特殊的重要性。目前,在沉积物/水间污染物的传输作用,污染物在沉积物里的吸附等界面行为, 各种与沉积物相关的水质和人类健录问题等诸方面,已做了不少研究工作。 4) 重金属在水环境中的氧化还原转化 水体的氧化还原条件,对在水相及底泥中发生的化学反应和生化反应起着重要作用,对重金属离子在 水体中的存在形态及迁移转化也有重要的影响。环境化学中常用水体电位(pE)来描述水环境的氧化还原性 质。它决定于水体中氧化剂、还原剂的电极电位浓度及 pH 值。 ● pE 的概念 对任意电对的反应 Ox + n e === Red 平衡表达式可表示为: k = [Red]/ [Ox][e]n