
第二章第十节 木节内容要点:酸雨、酸雨研究概况、我因酸雨概况、降水的化学组成和性质、酸雨的形成、酸雨的危害、 酸雨研究及污染控制中有关问题等。 酸沉降化学的研究开始于酸雨。50年代欧洲发现了降水酸性逐渐增强的趋势,酸雨问题受到普面 视。由于酸雨的危害较大,形成过程复杂,影响面广、持久,还可以远距离输送,酸雨问愿受到了全世界 的关注。各国相维大力开展酸市的研究,纷纷建立酸雨的监测网站,制订长朝研究计划,开展国际间合作。 近几年在酸雨研究中发现酸的干沉降不能低估,引起的环境效应往往是干、湿沉降综合的结果。因此,过 去被大量引用的“酸雨”的提法已逐渐被“酸沉降“所取代。 酸沉降是指大气中的酸性物质通过降水,如雨、雪、雾、冰雹等迁移到地表(混沉降),或酸性物质在 气流的作用下直接迁移到地表(干沉降)的过程。酸沉降化学就是研究在干、漫沉降过程中与酸有关的各种 化学问愿,包括降水的化学组成、酸的来源、形成过程和机理、存在形式、化学转化及降水组成的变化与 趋势等。因酸的干沉降研究工作起步较晚,故有关这方面的资料较少。本节将着重介绍酸的湿沉降化学, 主要内容包括酸雨的研究概况、形成机理及危害等。 1)酸南的研究 pH位小于5.6的雨雪或其他形式的大气降水称为酸雨。最早引起注意的是酸性降雨,所以习惯上统 称为酸雨,酸雨是降水水质变化的主要表现形式之一,已成为大气污染的重要特征,是当代全球性的环境 问题之一。有关酸两的研究及防治日益受到各国的重视, 现代酸雨的研究是从早期的降水化学发展而来的.早在1761~1767年,Marggraf就进行了雨雪的 降水化学测定,1872年英国化学家RA.Smth在其(空气和雨:化学气象学的开端》一书中首先使用了 "酸雨"这一术语,指出降水的化学性质受燃煤和有机物分解等因素的影,同时也指出酸雨对植物和材料 是有害的。 本世纪以来,全世界酸雨污染范围日益扩大,由北欧书扩展到中欧,又由中欧扩展到东欧,几乎整个欧 洲地区都在降酸雨。在关国东部和加食大南部酸雨也己成为辣手的问题。在北美地区,降水p州值只有3入 4的酸雨已可空见惯.美国的15个州降雨的pH平均值在4.8以下。西费吉尼亚甚至下降到1.5,这是最 严重的记录。在加拿大,酸雨的危害面积已达120~150万m乙,酸雨也席卷了亚洲大陆。1971年日本 就有酸图的报道,该年9目,东京的一场小图,有十几个行人球到眼睛刺痛,1983年日木环培厅组织酸 而委员会进行降水化学组成的监测和湖泊水质调查。几年的调查结果初步表明,p州的年平均值处于4.3 5.6之间. 我国对酸雨的研究始于0年代末期,当时在北京、上海、南京、重庆和贵阳等城市开展了局部研究 发现这些地区在不问程度上存在着酸雨问题,西南地区则很产重1982~1984年我国开展了酸的调查 为了弄清降水酸度及化学组成的时空分布情况,1985~1986年在全国范围内布设了189个监测站,523 个降水采样点,对降水数据进行了全面系统的分析。结果表明,降水年平均DH小于5.6的地区主要分在 秦岭准河以南,在此以北仅有个别地区:降水年平均p州小于5.0的地区主要在西南、华东及东南沿海 带。即我国酸雨由北向南逐渐加重,长江以南酸雨已是比较普遍的问题。酸雨情况最严重的西南地区,如 重庆、贵阳两市的雨水酸度的月平均值几乎全在p5以下。我国酸雨的主要致酸物质是硫酸盐,降水中 S02的含量普遍都很高。我国2002年酸雨区域分布和不同降水酸度城市百分比分别见图2-13和图 2-14
第二章 第十节 本节内容要点:酸雨、酸雨研究概况、我国酸雨概况、降水的化学组成和性质、酸雨的形成、酸雨的危害、 酸雨研究及污染控制中有关问题等。 酸沉降化学的研究开始于酸雨。50 年代欧洲发现了降水酸性逐渐增强的趋势,酸雨问题受 到普遍重 视。由于酸雨的危害较大,形成过程复杂,影响面广、持久,还可以远距离输送,酸雨问题受到了全世界 的关注。各国相继大力开展酸雨的研究,纷纷建立酸雨的监测网站,制订长期研究计划,开展国际间合作。 近几年在酸雨研究中发现酸的干沉降不能低估,引起的环境效应往往是干、湿沉降综合的结果。因此,过 去被大量引用的"酸雨"的提法已逐渐 被"酸沉降"所取代。 酸沉降是指大气中的酸性物质通过降水,如雨、雪、雾、冰雹等迁移到地表(湿沉降),或酸性物质在 气流的作用下直接迁移到地表(干沉降)的过程。酸沉降化学就是研究在干、湿沉降过程中与酸有关的各种 化学问题,包括降水的化学组成、酸的来源、形成过程和机理、存在形式、化学转化及降水组成的变化与 趋势等。因酸的干沉降研究工作起步较晚,故有关这方面的资料较少。本节将着重介绍酸的湿沉降化学, 主要内容包括酸雨的研究概况、形成机理及危害等。 1)酸雨的研究概况 pH 值小于 5.6 的雨雪或其他形式的大气降水称为酸雨。最早引起注意的是酸性降雨,所以习惯上统 称为酸雨。酸雨是降水水质变化的主要表现形式之一,已成为大气污染的重要特征,是当代全球性的环境 问题之一。有关酸雨的研究及防治日益受到各国的重视。 现代酸雨的研究是从早期的降水化学发展而来的。早在 1761~1767 年,Marggraf 就进行了雨雪的 降水化学测定。1872 年英国化学家 R.A.Smith 在其《空气和雨:化学气象学的开端》一书中首先使用了 "酸雨"这一术语,指出降水的化学性质受燃煤和有机物分解等因素的影响,同时也指出酸雨对植物和材料 是有害的。 本世纪以来,全世界酸雨污染范围日益扩大,由北欧扩展到中欧,又由中欧扩展到东欧,几乎整个欧 洲地区都在降酸雨。在美国东部和加拿大南部酸雨也已成为棘手的问题。在北美地区,降水 pH 值只有 3~ 4 的酸雨已司空见惯。美国的 15 个州降雨的 pH 平均值在 4.8 以下。西费吉尼亚甚至下降到 1.5,这是最 严重的记录。在加拿大,酸雨的危害面积已达 120~150 万 km2。酸雨也席卷了亚洲大陆。1971 年日本 就有酸雨的报道,该年 9 月,东京的一场小雨,有十几个行人感到眼睛刺痛。1983 年日本环境厅组织酸 雨委员会进行降水化学组成的监测和湖泊水质调查。几年的调查结果初步表明,pH 的年平均值处于 4.3~ 5.6 之间。 我国对酸雨的研究始于 70 年代末期。当时在北京、上海、南京、重庆和贵阳等城市开展了局部研究, 发现这些地区在不同程度上存在着酸雨问题,西南地区则很严重。1982~1984 年我国开展了酸雨的调查, 为了弄清降水酸度及化学组成的时空分布情况,1985~1986 年在全国范围内布设了 189 个监测站,523 个降水采样点,对降水数据进行了全面系统的分析。结果表明,降水年平均 pH 小于 5.6 的地区主要分在 秦岭淮河以南,在此以北仅有个别地区;降水年平均 pH 小于 5.0 的地区主要在西南、华东及东南沿海一 带。即我国酸雨由北向南逐渐加重,长江以南酸雨已是比较普遍的问题。酸雨情况最严重的西南地区,如 重庆、贵阳两市的雨水酸度的月平均值几乎全在 pH5以下。我国酸雨的主要致酸物质是硫酸盐,降水中 SO4 2-的含量普遍都很高。我国 2002 年酸雨区域分布和不同降水酸度城市百分比分别见图 2-13 和图 2-14
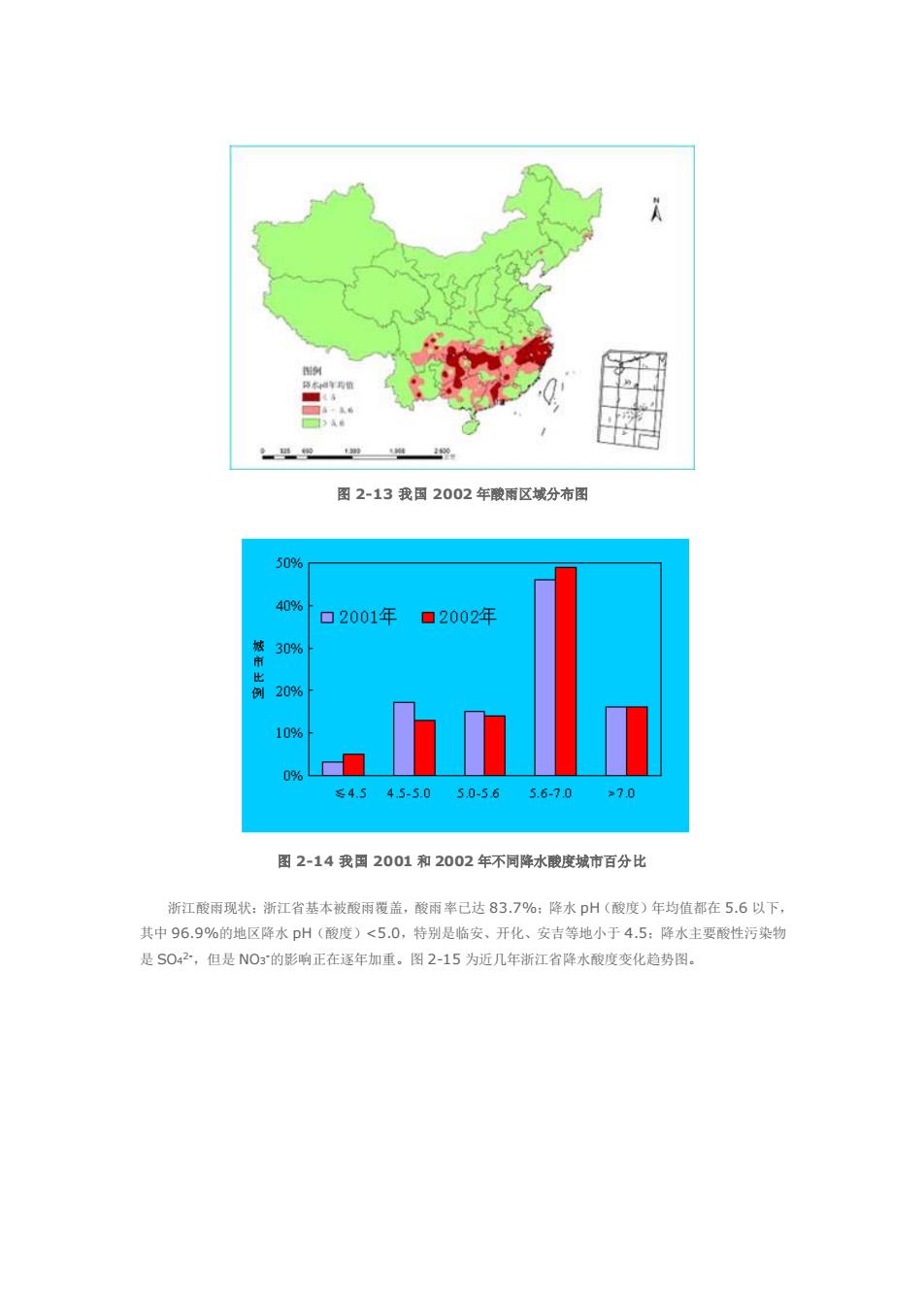
图2-13我2002年酸厢区域分布图 509% 口2001年 ·2002年 s4.545-5050-5656-90 70 图2-14我国2001和2002年不同降水酸度城市百分比 浙江酸雨现状:浙江省基本被酸雨覆盖,酸雨率已达83.7%:降水pH(酸度)年均值都在5.6以下 其中96.9%的地区降水pH(酸度)<5.0,特别是临安、开化、安吉等地小于4.5:降水主要酸性污染物 是S042,但是NOg的影响正在逐年加重。图2-15为近几年浙江省降水酸度变化趋势图
图 2-13 我国 2002 年酸雨区域分布图 图 2-14 我国 2001 和 2002 年不同降水酸度城市百分比 浙江酸雨现状:浙江省基本被酸雨覆盖,酸雨率已达 83.7%;降水 pH(酸度)年均值都在 5.6 以下, 其中 96.9%的地区降水 pH(酸度)<5.0,特别是临安、开化、安吉等地小于 4.5;降水主要酸性污染物 是 SO4 2-,但是 NO3 -的影响正在逐年加重。图 2-15 为近几年浙江省降水酸度变化趋势图
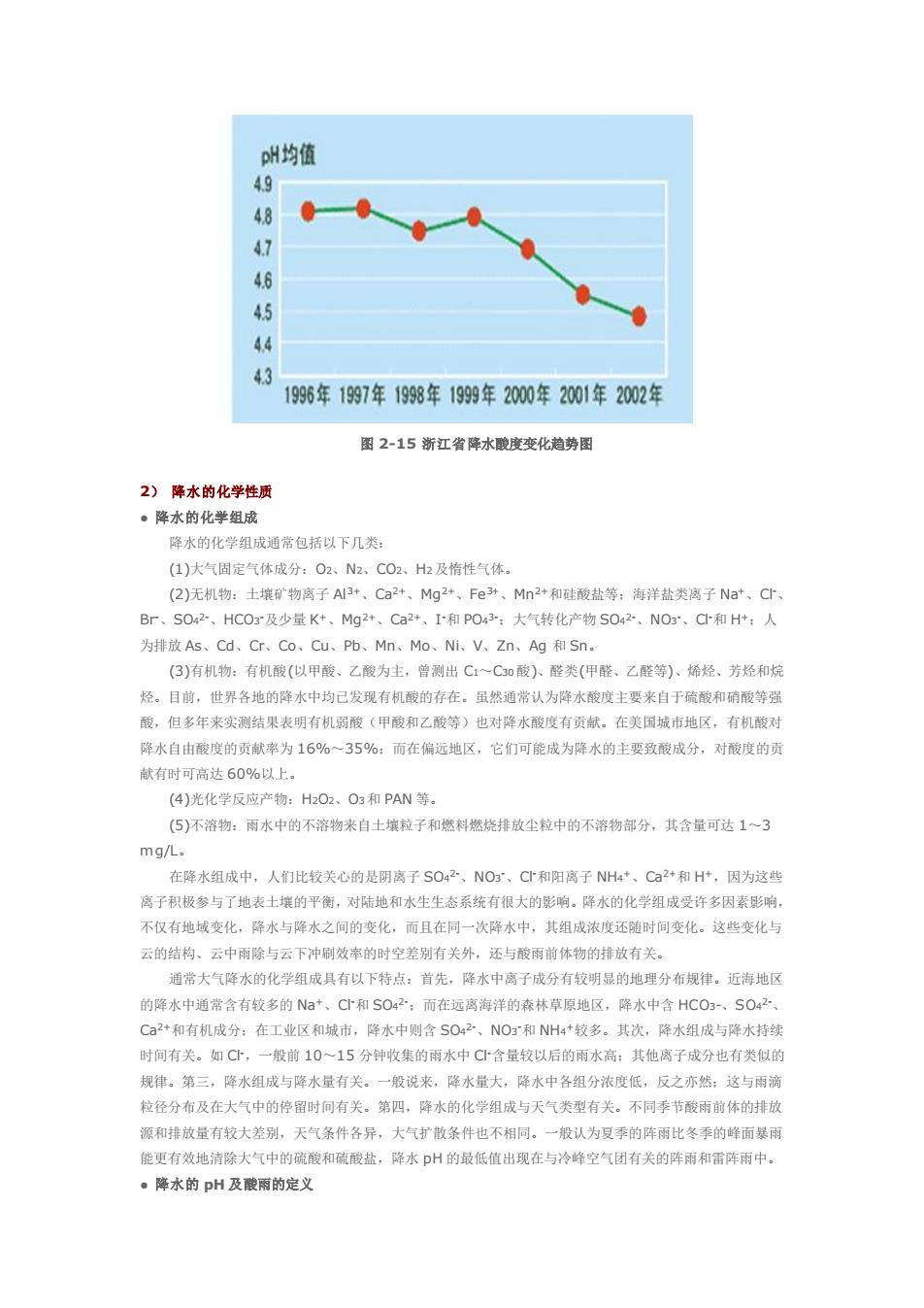
州均值 0 5 1996年1997年1998年1999年2000年2001年2002年 图2-15新江省降水晚度变化趋势图 2)降水的化学性质 ·降水的化学组成 降水的化学组成通常包括以下几类: (1)大气固定气体成分:02、N2、C02、H2及惰性气体, (2)无机物:士壤矿物离子A3+、Ca2+、Mg2,Fe、Mn2和硅酸盐等:海洋盐类离子Na、C Br、SO42、HCO及少量K+、Mg2+、Ca2+、I和PO43":大气转化产物SO42、NO3,C和H+:人 为排放As、Cd、Cr、Co、Cu、Pb、Mn、Mo、Ni.V、Zn、Ag和Sn. (3)有机物:有机酸(以甲酸、乙酸为主,曾测出C~C30酸)、醛类(甲醛、乙醛等)、烯烃、芳烃和烷 烃。目前,世界各地的降水中均已发现有机酸的存在。虽然通常认为降水酸度主要来自于硫酸和硝酸等强 酸,但多年来实测结果表明有机弱酸(甲酸和乙酸等)也对降水酸度有贡献。在关国城市地区,有机酸对 降水自由酸度的页献率为16%~35%:而在偏远地区,它们可能成为降水的主要致酸成分,对酸度的贡 献有时可高达60%以上, (4)光化学反应产物:HO2、O3和PAN等」 (⑤)不溶物:雨水中的不溶物来自士蝶粒子和燃料燃烧排放尘粒中的不溶物部分,其含量可达13 mg/L. 在降水组成中,人们比较关心的是阴离子SO42、NO、Cr和阳离子NHa*、Ca2+和H,因为这些 感子积极参与了地表十堆的平衡,对陆地和水生生态系统有很大的影响。降水的化学组成受许多因素影响 不仅有地域变化,降水与降水之同的变化,而且在同一次降水中,其组成浓度还随时间变化。这些变化与 云的结构、云中雨除与云下冲刷效名的时空差别有关外,还与酸雨前体物的排放有关。 通常大气降水的化学组成具有以下特点:首先,降水中离子成分有较明显的地理分布规律。近海地区 的降水中通常含有较多的N妇*、C小和S042,而在远高海洋的森林草原地区,降水中含HC0、S0 Ca+和有机成分:在工业区和城市,降水中则含SO42、NO:和NH4+较多。其次,降水组成与降水持到 时间有关。如C,一般前10~15分钟收集的雨水中C含量较以后的雨水高:其他离子成分也有类似的 规律。第三,降水组成与降水量有关。一般说来,降水量大,降水中各组分浓度低,反之亦然:这与雨满 粒径分布及在大气中的停留时间有关。第四,降水的化学组成与天气类型有关。不同季节酸雨前体的排成 源和排放量有较大差别,天气条件各异,大气扩散条件也不相同。一般认为夏季的阵雨比冬季的峰面暴雨 能更有效地清除大气中的硫酸和硫酸盐,降水p州的最低值出现在与冷峰空气团有关的阵雨和需阵雨中。 ●降水的pH及酸雨的定义
图 2-15 浙江省降水酸度变化趋势图 2) 降水的化学性质 ● 降水的化学组成 降水的化学组成通常包括以下几类: (1)大气固定气体成分:O2、N2、CO2、H2及惰性气体。 (2)无机物:土壤矿物离子 Al3+、Ca2+、Mg2+、Fe3+、Mn2+和硅酸盐等;海洋盐类离子 Na+、Cl-、 Br-、SO4 2-、HCO3 -及少量 K+、Mg2+、Ca2+、I -和 PO4 3-;大气转化产物 SO4 2-、NO3 -、Cl-和 H+;人 为排放 As、Cd、Cr、Co、Cu、Pb、Mn、Mo、Ni、V、Zn、Ag 和 Sn。 (3)有机物:有机酸(以甲酸、乙酸为主,曾测出 C1~C30酸)、醛类(甲醛、乙醛等)、烯烃、芳烃和烷 烃。目前,世界各地的降水中均已发现有机酸的存在。虽然通常认为降水酸度主要来自于硫酸和硝酸等强 酸,但多年来实测结果表明有机弱酸(甲酸和乙酸等)也对降水酸度有贡献。在美国城市地区,有机酸对 降水自由酸度的贡献率为 16%~35%;而在偏远地区,它们可能成为降水的主要致酸成分,对酸度的贡 献有时可高达 60%以上。 (4)光化学反应产物:H2O2、O3和 PAN 等。 (5)不溶物:雨水中的不溶物来自土壤粒子和燃料燃烧排放尘粒中的不溶物部分,其含量可达 1~3 mg/L。 在降水组成中,人们比较关心的是阴离子 SO4 2-、NO3 -、Cl-和阳离子 NH4 +、Ca2+和 H+,因为这些 离子积极参与了地表土壤的平衡,对陆地和水生生态系统有很大的影响。降水的化学组成受许多因素影响, 不仅有地域变化,降水与降水之间的变化,而且在同一次降水中,其组成浓度还随时间变化。这些变化与 云的结构、云中雨除与云下冲刷效率的时空差别有关外,还与酸雨前体物的排放有关。 通常大气降水的化学组成具有以下特点:首先,降水中离子成分有较明显的地理分布规律。近海地区 的降水中通常含有较多的 Na+、Cl-和 SO4 2-;而在远离海洋的森林草原地区,降水中含 HCO3-、SO4 2-、 Ca2+和有机成分;在工业区和城市,降水中则含 SO4 2-、NO3 -和 NH4 +较多。其次,降水组成与降水持续 时间有关。如 Cl-,一般前 10~15 分钟收集的雨水中 Cl-含量较以后的雨水高;其他离子成分也有类似的 规律。第三,降水组成与降水量有关。一般说来,降水量大,降水中各组分浓度低,反之亦然;这与雨滴 粒径分布及在大气中的停留时间有关。第四,降水的化学组成与天气类型有关。不同季节酸雨前体的排放 源和排放量有较大差别,天气条件各异,大气扩散条件也不相同。一般认为夏季的阵雨比冬季的峰面暴雨 能更有效地清除大气中的硫酸和硫酸盐,降水 pH 的最低值出现在与冷峰空气团有关的阵雨和雷阵雨中。 ● 降水的 pH 及酸雨的定义

通常认为雨水的”天然"酸度为p州5.6.此值来自如下考虑:影响天然降水pH值的因素仅为大气中 存在的C02,根据C02的全球大气浓度330mL/m3与纯水的平衡: H C0g州H0 c0·0 K C0,H,0 之H+HCo HcO; 之+0 式中:H为CO2的亨利常数:按电中性原理得: [H]=[OH]+[HC0]+2[C021 Kw/[H+]KIHPco2/[H+]+2 KiK2Pco2/[H+]2 式中:Kw为水的离子积,Pco2为C02在大气中的分压,K1、K分别为C02:H20的一级和二级电 离常数:计算可得洁净雨水的pH为5.6,故pH小于5.6的雨水被认为是酸雨。 通过对降水的多年观察,近年来已经对p州5.6能否作为酸性降水的界限以及判别人为污染的界 提出了异议。唐孝炎等在《大气环境化学》总结其主要论点如下:(1)高清洁大气中,除C02外还存在着 各种酸、碱性气态和气溶胶物质,它们通过成云过程和降水冲制过程进入雨水,降水酸度是其中各种酸。 碱性物质综合作用的结果,其pH不一定正好是5.6。(2)作为对降水pH值有决定影响的强酸,尤其是 酸和硝酸,并不都来自人为源。如火山爆发排放的SOz和海盐中的SO42等都对雨水有贡献。(3)降水DH >5.6的地区并不都意味若没有人为污染。有的地区空气中酸性物质污染亚重,但碱性尘粒或其他碱性物 质如NH含量高,降水冲刷的结果使pH值大于5.6。这涉及到降水的离子平衡。(4)州*浓度不是一个 恒量,它不能表示降水受污染的程度,同一酸度的降水,其中的SO42、NO等含量可以相差很大。在偏 远地区,降水DH低不一定表示污染严重:城市附近的降水,有时DH并不低,降水实际上已受到了污染 降水pH与其中酸、碱子的平衡有关 综上所述,pH5.6不是一个判别降水是否受到酸化和人为污染的合理界限,于是提出了降水pH的 背景值和降水污染与否的判别标准问题,这方面己做了不少研究。 由于世界各地区自然条件不同,如地质、气象、水文等的差异,会造成各地区降水pH的不同。世界 某些地区降水pH的背景值为4.79~5.00,均小于或等于5.0(见表2-11),因而认为将5.0作为酸雨 pH的界限更符合实际情况
通常认为雨水的"天然"酸度为 pH 5.6。此值来自如下考虑: 影响天然降水 pH 值的因素仅 为大气中 存在的 CO2,根据 CO2的全球大气浓度 330 m L/m3与纯水的平衡: 式中:H 为 CO2的亨利常数;按电中性原理得: [H+] = [OH-]+[HCO3 -]+2[CO3 2- ] = KW/[H+] + K1HPCO2/[H+] + 2 K1K2PCO2/[H+] 2 式中: KW 为水的离子积,PCO2为 CO2 在大气中的分压, K1、K2分别为 CO2·H2O 的一级和二级电 离常数;计算可得洁净雨水的 pH 为 5.6,故 pH 小于 5.6 的雨水被 认为是酸雨。 通过对降水的多年观察,近年来已经对 pH 5.6 能否作为酸性降水的界限以及判别人为污 染 的界限 提出了异议。唐孝炎等在《大气环境化学》总结其主要论点如下:(1)高清洁大气中 ,除 CO2外还存在着 各种酸、碱性气态和气溶胶物质,它们通过成云过程和降水冲刷过 程进入雨水,降水酸度是其中各种酸、 碱性物质综合作用的结果,其 pH 不一定正好是 5.6。(2)作为对降水 pH 值有决定影响的强酸,尤其是硫 酸和硝酸,并不都来自人为源。如火山爆发 排放的 SO2和海盐中的 SO4 2-等都对雨水有贡献。(3)降水 pH >5.6 的地区并不都意 味着没有人为污染,有的地区空气中酸性物质污染严重,但碱性尘粒或其他碱性物 质如 NH3含量高,降水冲刷的结果使 pH 值大于 5.6。这涉及 到降水的离子平衡。(4)H+浓度不是一个守 恒量,它不能表示降水受污染的程度。同一酸度的降水,其中的 SO4 2-、NO3 -等含量可以相差很大。在偏 远地区,降水 pH 低 不一定表示污染严重;城市附近的降水,有时 pH 并不低,降水实际上已受到了污染。 降水 pH 与其中酸、碱离子的平衡有关。 综上所述,pH 5.6 不是一个判别降水是否受到酸化和人为污染的合理界限,于是提出了降 水 pH 的 背景值和降水污染与否的判别标准问题,这方面已做了不少研究。 由于世界各地区自然条件不同,如地质、气象、水文等的差异,会造成各地区降水 pH 的不同。世界 某些地区降水 pH 的背景值为 4.79~5.00,均小于或等于 5.0(见表 2-11),因而认为将 5.0 作为酸雨 pH 的界限更符合实际情况

表2-11世界某些降水背景点的pH值 地 样品数 pH平均值 5.00 印度洋 N 4.9 4.9 Katherine大利亚 4.7 Sancar1os委内瑞拉 4.81 St.Geor6s大西洋白系群岛】 67 4.79 有人认为pH大于5.6的降水也未必没有受到酸性物质的人为干扰,因为即使有人为干扰,如果不是 很强烈,由于雨水有足够的缓冲容量,不会使雨水垦酸性:而pH在5.0~5.6之间的雨水有可能受到人 为活动的影响,但没有超过天然本底硫的影响范用,或者说人为形响即使存在,也不超出天然缓冲作用的 调节能力,因为雨水与天然硫平衡时的pH即为5.0.如果雨水pH小于5.0,可以确信人为影响是存在的, 所以提出以5.0作为酸雨pH值的界限更为确切。 由于实际的大气是一个非常复杂的体系,所以降水的酸性是进入水中的各种物质综合作用的结果,降 水的酸性决定于其中酸、碱性离子浓度的对比。许多事实说明随着矿物燃料清费的逐年增加,SO2、NOX 放量亦有所增加,致使大气酸化加刷。 一些背景采样点连续观测的结果表明,降水p州值有逐年下降的 趋势。例如日本岩手县绫里1976年到1992年的降水pH值从5.20降至4.85。这说明全球大气气氛正 在逐渐变化,这无疑与全球酸性污染物排放量逐年增加以及气溶胶酸化缓冲能力下降密切相关。大气中的 C02浓度也以每年2mLm3的速度增加,目前已近360mLm3。因此,全球降水酸度背景值不是稳定 不变的,从这个意义上说,将背景值下降到某一定值没有多大的实际意义。所以,现在一股仍以H5.60 作为酸性降水的判断标准。 。降水中的高子平衡 国内外的测定结果都表明,降水中的主要离子有以下几种:阴离子SO42、NO、C、HCO:阳离 子H、NH4*、Ca2+、K*、Mg2+、Na。由于市水呈电中性,因而其中的阴阳离子应基本平衡。当代表 酸性物质的阴离子总量大于代表碱性物质的阳离子总量时,降水的H含量增高,pH值降低,形成酸雨。 大气中S02和NOx的浓度高时,降水中S0:2和NO的浓度也高,使降水酸化。但由于中和作用 代表碱性成分的阳离子含量也较高时,很可能不表现为酸雨,甚至可能呈碱性降水。相反,即使大气中S0 和NOx浓度不高,但碱性物质相对更少,则降水仍然有较高的酸度· 我国北方气候干燥,土多属碱性,这些碱性土堆粒子易被风刮到大气中,对雨水中的酸起中和作用 南方气候湿铜,土壤早酸性,因而大气中缺少碱性粒子,对酸的中和能力较低。这是我国的酸性降水区域 主要集中在南方的重要原因之一。表2-12列出了重庆、北京、瑞典、美国降水中酸碱成分及降水酸度 可以看出。重庆雨水中酸性物质的含量比北京少,但碱性物质的含量比北京相对更少,所以重庆降水的 PH较北京低。比较瑞典和美国的降水成分,可以得到同样的结果。故降水的pH值和SO42浓度之间没有 良好的相关性
表 2-11 世界某些降水背景点的 pH 值 有人认为 pH 大于 5.6 的降水也未必没有受到酸性物质的人为干扰,因为即使有人为干扰,如 果不是 很强烈,由于雨水有足够的缓冲容量,不会使雨水呈酸性;而 pH 在 5.0~5.6 之间的雨 水有可能受到人 为活动的影响,但没有超过天然本底硫的影响范围,或者说人为影响即使存在,也不超出天然缓冲作用的 调节能力,因为雨水与天然硫平衡时的 pH 即为 5.0。如果雨水 pH 小于 5.0,可以确信人为影响是存在的。 所以提出以 5.0 作为酸雨 pH 值的界限更为确切。 由于实际的大气是一个非常复杂的体系,所以降水的酸性是进入水中的各种物质综合作用的结果,降 水的酸性决定于其中酸、碱性离子浓度的对比。许多事实说明随着矿物燃料消费的逐年增加,SO2、NOx 排放量亦有所增加,致使大气酸化加剧。一些背景采样点连续观测的结果表明,降水 pH 值有逐年下降的 趋势。例如日本岩手县绫里 1976 年到 1992 年的降水 pH 值从 5.20 降至 4.85。这说明全球大气气氛正 在逐渐变化,这无疑与全球酸性污染物排放量逐年增加以及气溶胶酸化缓冲能力下降密切相关。大气中的 CO2浓度也以每年 2 m L /m3的速度增加,目前已近 360 m L/m3。因此,全球降水酸度背景值不是稳定 不变的,从这个意义上说,将背景值下降到某一定值没有多大的实际意义。所以,现在一般仍以 pH 5.60 作为酸性降水的判断标准。 ● 降水中的离子平衡 国内外的测定结果都表明,降水中的主要离子有以下几种:阴离子 SO4 2-、NO3 -、Cl-、HCO3 -;阳离 子 H+、NH4 +、Ca2+、K+、Mg2+、Na+。由于雨水呈电中性,因而其中的阴阳离子应基本平衡。当代表 酸性物质的阴离子总量大于代表碱性物质的阳离子总量时,降水的 H+含量增高,pH 值降低,形成酸雨。 大气中 SO2和 NOx 的浓度高时,降水中 SO4 2-和 NO3 -的浓度也高,使降水酸化。但由于中和作用, 代表碱性成分的阳离子含量也较高时,很可能不表现为酸雨,甚至可能呈碱性降水。相反,即使大气中 SO2 和 NOx 浓度不高,但碱性物质相对更少,则降水仍然有较高的酸度。 我国北方气候干燥,土壤多属碱性,这些碱性土壤粒子易被风刮到大气中,对雨水中的酸起中和作用; 南方气候湿润,土壤呈酸性,因而大气中缺少碱性粒子,对酸的中和能力较低,这是我国的酸性降水区域 主要集中在南方的重要原因之一。表 2-12 列出了重庆、北京、瑞典、美国降水中酸碱成分及降水酸度。 可以看出, 重庆雨水中酸性物质的含量比北京少,但碱性物质的含量比北京相对更少,所以重庆降水的 pH 较北京低。比较瑞典和美国的降水成分,可以得到同样的结果。故降水的 pH 值和 SO4 2-浓度之间没有 良好的相关性

表2-12雨水酸度与酸碱成分(中g/mL) 地点 DH S02 0. c.2+ 重庆 4.12 13.29 1.39 1.53 1.21 北京 6.7 13.11 3.12 3.68 2.54 瑞典 43 3.4 19 028 056 美国 392 8.0 24 0.30 0.20 值得指出的是,我国酸雨的形成与S02的浓度及转化条件有关。西南地区大多使用高硫煤,因此S02 的放量很高:重庆、贵阳的气象条件和地形不利于S02的扩散,高气温和高混度又有利于S02的转化 加上土质星酸性,大气中碱性物质少,使该地区成为强酸性降雨区, 人为和天然排入大气的许多气态或固态物质对酸雨的形成产生多种影响,例如,飞灰中的CO、土埔 中的CaCO、天然和人为来源的NHB及其他碱性物质,可以中和酸。降水的酸度与其中的化学组成和离 子平衡密切相关。颗粒物中的M2+、Fe2+等是成酸反应的催化剂,HO2、O3及:OH、HO2自由基等对 SO2、NO2的氧化起重要作用, 3)酸雨的形成 酸雨的形成涉及一系列复杂的物理、化学过程,包括污染物的远程输送过程、成云成雨过程以及在这 些过程中发生的气相、液相和周相等均相或非均相化学反应等。 。大气中酸性物厅的形成 影响降水酸性的主要物质是HSO4、HNO,还有一些有机酸。人类活动排入大气中的SO2和NOx 部分适过干沉降直接回到地面,剩余部分在大气中经过各种氧化途径转化为硫酸和硝酸,按反应体系SO 和NOx的氧化可分为均相氧化、非均相氧化:按反应机理可分为光化学氧化、自由基氧化、能化氧化和路 氧化剂氧化.有关SO2和NOx氧化成HSO4、HNO的机理已在前两节作过介绍,这里简要概述酸性 质形成的主要过程。 图2-16概括了大气中S02和NOx转化成硫酸盐和硝酸盐的主要途径,总体可分为三种转化过程: (1)SO2和NOx在气相中氧化成H2SO:和HNO,以气溶胶或气体的形式进入液相:(2)SO2和NOx 入液相后,在液相中被氧化成SO42·和NO3¨:(3)SO2和NOx在气液界面发生化学反应转化为SO42和 NOg,这是非均相化学反应
表 2-12 雨水酸度与酸碱成分(μg/mL) 值得指出的是,我国酸雨的形成与 SO2的浓度及转化条件有关。西南地区大多使用高硫煤,因此 SO2 的排放量很高;重庆、贵阳的气象条件和地形不利于 SO2的扩散,高气温和高湿度又有利于 SO2的转化, 加上土质呈酸性,大气中碱性物质少,使该地区成为强酸性降雨区。 人为和天然排入大气的许多气态或固态物质对酸雨的形成产生多种影响。例如,飞灰中的 CaO、土壤 中的 CaCO3、天然和人为来源的 NH3及其他碱性物质,可以中和酸。降水的酸度与其中的化学组成和离 子平衡密切相关。颗粒物中的 Mn2+、Fe2+等是成酸反应的催化剂,H2O2、O3及·OH、HO2·自由基等对 SO2、NO2的氧化起重要作用。 3) 酸雨的形成 酸雨的形成涉及一系列复杂的物理、化学过程,包括污染物的远程输送过程、成云成雨过程 以及在这 些过程中发生的气相、液相和固相等均相或非均相化学反应等。 ● 大气中酸性物质的形成 影响降水酸性的主要物质是 H2SO4、HNO3,还有一些有机酸。人类活动排入大气中的 SO2和 NOx, 一部分通过干沉降直接回到地面,剩余部分在大气中经过各种氧化途径转化为硫酸和硝酸。按反应体系 SO2 和 NOx 的氧化可分为均相氧化、非均相氧化;按反应机理可分为光化学氧化、自由基氧化、催化氧化和强 氧化剂氧化。有关 SO2和 NOx 氧化成 H2SO4、HNO3的机理已在前两节作过介绍,这里简要概述酸性物 质形成的主要过程。 图 2-16 概括了大气中 SO2和 NOx 转化成硫酸盐和硝酸盐的主要途径,总体可分为三种转化过程: (1)SO2和 NOx 在气相中氧化成 H2SO4和 HNO3,以气溶胶或气体的形式进入液相;(2)SO2和 NOx 溶 入液相后,在液相中被氧化成 SO4 2-和 NO3 -;(3)SO2和 NOx 在气液界面发生化学反应转化为 SO4 2-和 NO3 -,这 是非均相化学反应

气常 气恋氧化物 气相 液成干的 中和 (s))e Ma 液相路径 图2-16大气中S042和N03生成的主要路径(Schwartz,1985) SO2和NOx的气相转化主要通过与·OH自由基反应来完成 SOz+-0H→H2S04(1) NO2+-OH→HNO3(2) 据估计在大气环境中,反应(1)产生的HS04占气相反应产生的比S0总量的98%以上:反应(2 是气相产生HNO3最主要的反应,它比反应(1)钓快10倍. 大气中有机酸主要是由碳氢化合物在大气中转化面来的。如乙醛和乙烯的反应机制大致如下: 乙醛:CHCH0+HO2一CH3CO2+H20 CH3CHO++OH→CHCO+H2O CHaCHO hv -CHa02+HO2+CO CH3C0+O2→CHCO CH3CO3.+CHaO2.CHaCOOH*HCHO +02 乙烯:CH=Ch+:OH一HOCH4O+CzH3-HOCzH4O·HCOOH C2Ha--HCOOH CH2=CH2 +03--CH200 -CH20O*-HCOOH 此外,烷经在气相中也可以氧化成有机酸。有机酸的生成机制日前还不十分请楚 S02和NOx的液相氧化,首先是它们由气态转入水相,这主要道过气体在溶液中的吸收(溶解)平衡 米实现.吸收平衡服从亨利定律。SO2和NOx在水相中可以多种形态存在,它们的摩尔分数与pH有关。 如在典型大气液滴的DH26范围内,S(IV)主要存在形态是HSO°。溶于水中的SO2和NOx可被大气 中的H02、O2及自由基OH、HO2:等氧化成S02和NO-,例如 Hz02+HS03°→S04+H*+H20 O3+HS03→H++S042 2NO2 +HS03 -2NOz+3H++5042 研究表明,在pH5时,O3氧化S(V)此H2O: 快10倍:Fe3+和MN2+催化O2氧化S(W)在高pH下可能比较重要:NO2对S(W)的氧化不重要, NOx可被,OH、H2O2、O2等氧化成NO OH+NO→HONO
图 2-16 大气中 SO4 2-和 NO3 -生成的主要路径 (Schwartz,1985) SO2和 NOx 的气相转化主要通过与·OH 自由基反应来完成: SO2 +·OH → H2SO4 (1) NO2 +·OH → HNO3 (2) 据估计在大气环境中,反应(1)产生的 H2SO4占气相反应产生的 H2SO4总量的 98 %以上;反应(2) 是气相产生 HNO3最主要的反应,它比反应(1)约快 10 倍。 大气中有机酸主要是由碳氢化合物在大气中转化而来的。如乙醛和乙烯的反应机制大致如下: 乙醛:CH3CHO + HO2· → CH3CO2·+ H2O CH3CHO + ·OH → CH3C·O + H2O CH3CHO + hν → CH3O2·+ HO2·+ CO CH3C·O + O2 → CH3CO3· CH3CO3·+ CH3O2· → CH3COOH+HCHO + O2 乙烯:CH2= CH2 + ·OH → HOC2H4O2·+ C2H3·HOC2H4O2· HCOOH C2H3· → HCOOH CH2= CH2 + O3 → ·CH2OO* ·CH2OO* → HCOOH 此外,烷烃在气相中也可以氧化成有机酸。有机酸的生成机制目前还不十分清楚。 SO2和 NOx 的液相氧化,首先是它们由气态转入水相,这主要通过气体在溶液中的吸收(溶解)平衡 来实现。吸收平衡服从亨利定律。SO2和 NOx 在水相中可以多种形态存在,它们的摩尔分数与 pH 有关。 如在典型大气液滴的 pH 2~6 范围内,S(Ⅳ)主要存在形态是 HSO3 -。溶于水中的 SO2和 NOx 可被大气 中的 H2O2、O3及自由基·OH、HO2·等氧化成 SO42 -和 NO3-。例如: H2O2 + HSO3 - → SO4 2- + H++H2O O3 + HSO3 - → H+ + SO4 2- 2NO2 + HSO3 - → 2NO2 - + 3H+ + SO4 2- 研究表明,在 pH<5 时,H2O2氧化 S(Ⅳ)是最有效的途径;当 pH>5 时,O3氧化 S(Ⅳ)比 H2O2 快 10 倍;Fe3+和 MN2 +催化 O2氧化 S(Ⅳ)在高 pH 下可能比较重要;NO2对 S(Ⅳ)的氧化不重要。 NOx 可被·OH、H2O2、O3等氧化成 NO3 -: ·OH + NO → HONO

OH NO2-NO3+H* HO2+HONO→NOr+H++HO 03+N02”→N0h-+02 后两个反应与pH有很大关系。此外,PAN的水解可能对大气中NO:有所贡献, 。降水的酸化过程 大气降水的酸度与其中的酸、碱物质的性质及相对比例有关。下面简要介绍这些物质进入降水,造成 降水酸化的过程。 酸雨的形成过程包括雨除和冲刷。在自由大气里,由于存在0.1一10m范围的凝结核而造成水蒸 的凝结,然后通过碰并和聚结等过程进一步生长从面形成云滴和雨滴。在云内,云滴相互碰并或与气溶胶 粒子碰并,同时吸收大气气体污染物,在云内部发生化学反应,这个过程叫污染物的云内清除或雨除 (n-cloud scavengingor rain out).在雨滴下落过程中,雨滴冲刑着所经过空气中的气体和气溶胶,雨 滴内部也会发生化学反应,这个过程叫做污染物的云下清除或冲刷(below-cloud scavenging or vashout)。这此过程就是降水对大气中气态物质和频粒物的洁除过程,酸化就是在这此清除过程中发生 的,如图2-17所示 气密酸和气的云内酒除 化学反 云下清附 国2-17降水的酸化过程示 (1)云内清除过程(雨除) 大气中硫酸盐和硝酸盐等气溶胶可作为活性凝结核参与成云过程:此外,水蒸气过饱和时也能产生 成核作用。由于水蒸气凝结在云滴上和云滴间的碰并,使云滴不断生长,与此同时,各种污染气体溶于 滴中并发生各种化学反应:当云滴成熟后即变成雨从云基下落,大气污染物的云内清除(雨除)过程包括气 溶胶粒子的雨除和微量气体的雨除。 气溶胶粒子进入云滴可通过以下三种机制:(1)气溶胶粒子作为水蒸气的活性凝结核进入云滴.(2) 溶胶粒子和云滴的碰并。气溶胶粒子通过布朗运动和清流运动与云滴碰并,粒径小于0.01μm的气溶胶料 子几乎都经该机制进入云滴。(3)气溶胶粒子受力运动,并沿若蒸汽压梯度方向移动而进入云滴。在对流层 大气中,若气溶胶浓度小于200~3009/m3,几乎全部粒子在成云过程中被消除。而作为活性凝结核进 入云滴、参与雨除过程是气溶胶粒子雨除的主要机制。 污染气体的雨除对云水组成的影响与气溶胶的雨除同样重要。微量气体的雨除取决于气体分子的传质 过程和在溶液中的反应性,同时还与云的类形和云滴诺有关。在污染气体的云内清除过程中,其中的一此 物质被氧化,如S()被氧化成S(W):故化学氧化速率是整个过程的决速步,液相氧化反应的速率取 于氧化剂的类型和浓度,面污染气体在云滴中的溶解度取决于气相浓度和云滴的DH值, (2)云下清除过程(冲制) 雨滴离开云基,在其下落过程中有可能继续吸收和描获大气中的污染气体和气溶胶,这就是污染物 的云下清除或降水的冲刷作用,它包括微量气体及气溶胶的云下清除
·OH + NO2 → NO3 - + H+ H2O2 + HONO → NO3 - + H+ + H2O O3 + NO2 - → NO3 - + O2 后两个反应与 pH 有很大关系。此外,PAN 的水解可能对大气中 NO3 -有所贡献。 ● 降水的酸化过程 大气降水的酸度与其中的酸、碱物质的性质及相对比例有关。下面简要介绍这些物质进入降水,造成 降水酸化的过程。 酸雨的形成过程包括雨除和冲刷。在自由大气里,由于存在 0.1~10μm 范围的凝结核而 造成水蒸气 的凝结,然后通过碰并和聚结等过程进一步生长从而形成云滴和雨滴。在云内,云滴相互碰并或与气溶胶 粒子碰并,同时吸收大气气体污染物,在云内部发生化学反应,这个过程叫污染物的云内清除或雨除 (in-cloud scavenging or rain out)。在雨滴下落过程中,雨滴冲刷着所经过空气中的气体和气溶胶,雨 滴内部也会发生化学反应,这个过程叫做污染物的云下清除或冲刷(below-cloud scavenging or washout)。这些过程就是降水对大气中气态物质和颗粒物的清除过程,酸化就是在这些清除过程中发生 的,如图 2-17 所示 。 图 2-17 降水的酸化过程示意 (1) 云内清除过程(雨除) 大气中硫酸盐和硝酸盐等气溶胶可作为活性凝结核参与成云过程;此外,水蒸气过饱和时也能产生 成核作用。由于水蒸气凝结在云滴上和云滴间的碰并,使云滴不断生长,与此同时,各种污染气体溶于云 滴中并发生各种化学反应;当云滴成熟后即变成雨从云基下落。大气污染物的云内清除(雨除)过程包括气 溶胶粒子的雨除和微量气体的雨除。 气溶胶粒子进入云滴可通过以下三种机制:(1)气溶胶粒子作为水蒸气的活性凝结核进入云滴。(2)气 溶胶粒子和云滴的碰并。气溶胶粒子通过布朗运动和湍流运动与云滴碰并。粒径小于 0.01μm 的气溶胶粒 子几乎都经该机制进入云滴。(3)气溶胶粒子受力运动,并沿着蒸汽压梯度方向移动而进入云滴。在对流层 大气中,若气溶胶浓度小于 200~300μg/m3,几乎全部粒子在成云过程中被清除。而作为活性凝结核进 入云滴、参与雨除过程是气溶胶粒子雨除的主要机制。 污染气体的雨除对云水组成的影响与气溶胶的雨除同样重要。微量气体的雨除取决于气体分子的传质 过程和在溶液中的反应性,同时还与云的类型和云滴谱有关。在污染气体的云内清除过程中,其中的一些 物质被氧化,如 S(Ⅳ)被氧化成 S(Ⅵ);故化学氧化速率是整个过程的决速步,液相氧化反应的速率取决 于氧化剂的类型和浓度,而污染气体在云滴中的溶解度取决于气相浓度和云滴的 pH 值。 (2) 云下清除过程(冲刷) 雨滴离开云基,在其下落过程中有可能继续吸收和捕获大气中的污染气体和气溶胶,这就是污染物 的云下清除或降水的冲刷作用。它包括微量气体及气溶胶的云下清除

微量气体的云下清除:云下清除过程与气体分子同液相的交换速常、气体在水中的溶解度和液相氧 速率以及雨滴在大气中的停留时间等因素有关。雨滴进入大气后会产生污染气体从气相向液相的传质过程 或从液相向气相的传质过程,传质系数随雨滴粒径增加而减小。至于雨滴内的化学反应,由于雨滴在大问 中的停留时间较短,所以 一些快反应如离子反应、强氧化剂H202、O3、自由基OH、HO2及金属离 Mn+、F3+等对S(V)的氧化反应,才会对雨滴的化学组成产生影响,而大多数的搅反应对雨满的影响较 小。在污染气体的云下清除过程中,气液闻传质速率和液相反应速率共同决定污染气体在液相的反应速率 气液传质速率控制了大雨滴中的液相反应速率,化学反应速率则控制了小雨滴的液相反应速率。在水中 解度极大或在溶液中仅参加快速离子反应使溶解度增大的微量气体,它钉的云下清除是不可逆的,其去附 事与己进入液相的浓度无关,仅与气相浓度有关。不可逆清除的气体在液相中的总浓度随雨滴降落距离而 线性增加。气体不可逆清除的清除率与其他气体无关,仅与自身的特性和南滴诺及降水量有关:清除率陶 降水量增加而增加。研究表明,雨水对SO2气体的清除系数与雨强、气相SO2浓度、NH3浓度、氧化剂 浓度以及雨水的p州初值有关,它们之间有复杂的相互作用,。 气溶胶的云下清除:雨滴在下落过程中捕获气溶胶粒子。气溶胶被捕获后,其中的可溶部分如S02 NOg、NH4+、Ca2、Mg2+、MN2*、Fe2、H、及OH等会释放出来,从而影响雨演的化学组成和 度,刘帅仁等研究了大气气溶胶在云下雨水酸化过程的作用。结果表明:()气溶胶对雨水酸度有影响, 若气溶胶的DH值低于雨水的DH值,则气溶胶起酸化作用反之,则起碱化作用:气溶眩的酸化作用强 于碱化作用。()酒 一般浓度(每Cm3含103个)下,酸性气溶胶是雨水H的重要来源 ,碱性气溶胶可消 雨水中的H:气溶胶对雨水S02的贡献较小,(C)酸性气溶胶对雨水的酸化作用随S02浓度增大而减弱, 而碱性气溶胶对雨水的碱化作用随S02浓度增大而增强:云内消除过程是市水S0⅓2的重要来源,云下气 溶骸清除过程对S02献较小.(@)HNO3对雨水H的卖献比同浓度的SO2要大几倍,气溶胶对雨水NO 的页献相当于1 ng/mL HNO3的贡献,随着HNO3浓度的增大,气溶胶的相对贡献迅速减少。()气溶服 是雨水中NH4+的重要来源.相当于NH3浓度5~8ng/mL时对雨NH4+的贡献 云内清除和云下清除过程受大气污染程度和许多环境参数的影响。云内清除和云下清除对酸而形成的 相对重要性在不同地理区域、不同源排放和不同气象条件等情况是不同的。观测结果表明,在我国一些里 污染地区,云下清除过程是很重要的。如对重庆和北京地区云下清除过程的数值模拟结果表明,重庆雨水 中的H+来以云下SO2氧化为主,气溶脑起碱化作用,北京雨水中的H+来题以云内洁险过程为主,云 气体NH和气溶胶起碱化作用可见,北京地区NH浓度高是雨水不酸的首要原因,同时也使雨水中SO 浓度偏高, 由此可见,酸雨的形成过程是非常复杂的。酸雨前体物S02、NOx除局地源排放外,还可以由远距离 给送而来。如我国南方酸性碎水存在着局地冲刷和中长距离传输双重形成机制。南方大气S02浓度较高 某些山区城市降水酸化的主要来源为局地冲刷。南方春季常出现大面积酸性降水。其主要来源是污染物中 长距离传输。污染物在一定气象条件下可传输数百公里或更远。使下风区域云水和隆水酸化。南方多数的 性降水为局地冲和传输双重来源。当云水酸度相同时,各个城市酸性气体的浓度和气溶胶的缓冲能) 决定了局地神剧和传输对降水中酸的相对页献。 如前所述,导致降水酸性的主要物质是硫酸,其次是硝酸,还有有机酸等其他酸类。现以SO2、NOX 造成降水酸化为例,概述酸雨的形成过程。 (a)由源排放的气态SO2、NOx经气相反应生成HSO4、HNO3或硫酸盐、消酸盐气溶胶: (b)云形成时,含SO42和NO3的气溶胶粒子以凝结核的形式进入降水: (C)云滴吸收了SO2NOx气体,在水相氧化形成S02、NOr (d)云滴成为雨滴,降落时清除了含有SO42、NO3的气溶胶: ()雨滴下降时吸收SO2、NOx,再在水相中转化成SO42、NO3 途径(b)、(c)为南除,(@)(e)为冲(云下清除过程):在雨除和冲过程中同时进行着SO2、NOx的
微量气体的云下清除:云下清除过程与气体分子同液相的交换速率、气体在水中的溶解度和液相氧化 速率以及雨 滴在大气中的停留时间等因素有关。雨滴进入大气后会产生污染气体从气相向液相的传质过程 或从液相向气相的传质过程,传质系数随雨滴粒径增加而减小。至于雨滴内的化学反应,由于雨滴在大气 中的停留时间较短,所以一些快反应如离子反应、强氧化剂 H2O2、O3、自由基·OH、HO2·及金属离子 Mn2+、Fe3+等对 S(Ⅳ)的氧化反应,才会对雨滴的化学组成产生影响,而大多数的慢反应对雨滴的影响较 小。在污染气体的云下清除过程中,气液间传质速率和液相反 应速率共同决定污染气体在液相的反应速率。 气液传质速率控制了大雨滴中的液相反应速率,化学反应速率则控制了小雨滴的液相反应速率。在水中溶 解度极大或在溶液中仅参加快速离子反应使溶解度增大的微量气体,它们的云下清除是不可逆的,其去除 率与已进入液相的浓度无关,仅与气相浓度有关。不可逆清除的气体在液相中的总浓度随雨滴降落距离而 线性增加。气体不可逆清除的清除率与其他气体无关,仅与自身的特性和雨滴谱及降水量有关;清除率随 降水量增加而增加。研究表明,雨水对 SO2气体的清除系数与雨强、气相 SO2浓度、NH3浓度、氧化剂 浓度以及雨水的 pH 初值有关,它们之间有复杂的相互作用。 气溶胶的云下清除:雨滴在下落过程中捕获气溶胶粒子。气溶胶被捕获后,其中的可溶部分如 SO4 2-、 NO3 -、NH4 +、Ca2+、Mg2+、MN2 +、Fe2+、H+、及 OH-等会释放出来,从而影响雨滴的化学组成和酸 度。刘帅仁等研究了大气气溶胶在云下雨水酸化过程的作用。结果表明:(a)气溶胶对雨水酸 度有影响, 若气溶胶的 pH 值低于雨水的 pH 值,则气溶胶起酸化作用;反之,则起碱化作用;气溶胶的酸化作用强 于碱化作用。(b)在一般浓度(每 cm3含 103个)下,酸性气溶胶是雨水 H+的重要来源,碱性气溶胶可消耗 雨水中的 H+;气溶胶对雨水 SO4 2-的贡献较小。(c)酸性气溶胶对雨水的酸化作用随 SO2浓度增大而减弱, 而碱性气溶胶对雨水的碱化作用随 SO2浓度增大而增强;云内清除过程是雨水 SO4 2-的重要来源,云下气 溶胶清除过程对 SO4 2-贡献较小。(d)HNO3对雨水 H+的贡献比同浓度的 SO2要大几倍,气溶胶对雨水 NO3 - 的贡献相当于 1 ng/m L HNO3的贡献,随着 HNO3浓度的增大,气溶胶的相对贡献迅速减少。(e)气溶胶 是雨水中 NH4 +的重要来源,相当于 NH3浓度 5~8ng/m L 时对雨 NH4 +的贡献。 云内清除和云下清除过程受大气污染程度和许多环境参数的影响。云内清除和云下清除对酸雨形成的 相对重要性在不同地理区域、不同源排放和不同气象条件等情况是不同的。观测结果表明,在我国一些重 污染地区,云下清除过程是很重要的。如对重庆和北京地区云下清除过程的数值模拟结果表明,重庆雨水 中的 H+来源以云下 SO2氧化为主,气溶胶起碱化作用;北京雨水中的 H+来源以云内清除过程为主,云下 气体 NH3和气溶胶起碱化作用。可见,北京地区 NH3浓度高是雨水不酸的首要原因,同时也使雨水中 SO4 2- 浓度偏高。 由此可见,酸雨的形成过程是非常复杂的。酸雨前体物 SO2、NOx 除局地源排放外,还可以由远距离 输送而来。如我国南方酸性降水存在着局地冲刷和中长距离传输双重形成机制。南方大气 SO2浓度较高的 某些山区城市降水酸化的主要来源为局地冲刷。南方春季常出现大面积酸性降水,其主要来源是污染物中 长距离传输。污染物在一定气象条件下可传输数百公里或更远,使下风区域云水和降水酸化。南方多数的 酸性降水为局地冲刷和传输双重来源。当云水酸度相同时,各个城市酸性气体的浓度和气溶胶的缓冲能力 决定了局地冲刷 和传输对降水中酸的相对贡献。 如前所述,导致降水酸性的主要物质是硫酸,其次是硝酸,还有有机酸等其他酸类。现以 SO2、NOx 造成降水酸化为例,概述酸雨的形成过程。 (a)由源排放的气态 SO2、NOx 经气相反应生成 H2SO4、HNO3或硫酸盐、硝酸盐气溶胶; (b)云形成时,含 SO4 2-和 NO3 -的气溶胶粒子以凝结核的形式进入降水; (c)云滴吸收了 SO2、NOx 气体,在水相氧化形成 SO4 2-、NO3 -; (d)云滴成为雨滴,降落时清除了含有 SO4 2-、NO3 -的气溶胶; (e)雨滴下降时吸收 SO2、NOx,再在水相中转化成 SO4 2-、NO3 -。 途径(b)、(c)为雨除,(d)(e)为冲刷(云下清除过程);在雨除和冲刷过程中同时进行着 SO2、NOx 的

吸收及其液相氧化:HO2、O3及OH、HO2对SO2、NOx液相氧化起了重要作用 大气中的其他气态物质和NH、HhO2、O3和碳氢化合物等也会被清除进入降水,其中的一些物质(如 碳氢化合物)可发生氧化转化,从面对降水起酸化作用。因此,酸雨的形成是酸化的化学过程与清除的物理 过程交织在一起的, 4)酸雨的危害 酸雨的危害是多方面的: 。对土壤生态的危者。 酸性物质不仅通过降雨湿性沉降,也可通过干性沉降于士,一方面士中的钙、镁、钾等养分被淋 溶,导致土壤日益酸化、贫瘠化,影响植物的生长:另一方面酸化的土壤形响微生物的活性。 对水生生态的危害。 酸雨可使湖泊、河流等地表水酸化,污染饮用水源。当水体pH<5时,鱼类的生长繁殖即会受到严 影响:流域土壤和湖、可底泥中的有毒金属,如铝等则会溶解在水中,毒害鱼类。水质变酸还会引起水生 生态结构上的变化:酸化后的湖泊与河流中,鱼类会减少甚至绝迹。 对植物的危音】 受到酸雨侵蚀的叶子,其叶绿素含量降低,由于光合作用受阻,使农作物产量降低,也可使族林生长 表府降任 对材料和古迹的影响 酸雨加速了许多用于建筑结构、桥梁、水坝、工业装备、供水管网及通讯电缆等材料的腐蚀,还能严 重损害古迹,历史建筑以及其他重要文化设施。 。对人体健康的影响 酸雨不仅可造成很大的经济提失,也可危害人体的健康,这种危害可以是间接的,也可以是直接的
吸收及其液相氧化;H2O2、O3及·OH、HO2·对 SO2、NOx 液相氧化起了重要作用。 大气中的其他气态物质和 NH3、H2O2、O3和碳氢化合物等也会被清除进入降水,其中的一些物质(如 碳氢化合物)可发生氧化转化,从而对降水起酸化作用。因此,酸雨的形成是酸化的化学过程与清除的物理 过程交织在一起的。 4)酸雨的危害 酸雨的危害是多方面的: ● 对土壤生态的危害。 酸性物质不仅通过降雨湿性沉降,也可通过干性沉降于土壤。一方面土壤中的钙、镁、钾等养分被淋 溶,导致土壤日益酸化、贫瘠化,影响植物的生长;另一方面酸化的土壤影响微生物的活性。 ●对水生生态的危害。 酸雨可使湖泊、河流等地表水酸化,污染饮用水源。当水体 pH<5 时,鱼类的生长繁殖即会受到严重 影响;流域土壤和湖、河底泥中的有毒金属,如铝等则会溶解在水中,毒害鱼类。水质变酸还会引起水生 生态结构上的变化;酸化后的湖泊与河流中,鱼类会减少甚至绝迹。 ●对植物的危害。 受到酸雨侵蚀的叶子,其叶绿素含量降低,由于光合作用受 阻,使农作物产量降低,也可使森林生长 速度降低。 ●对材料和古迹的影响。 酸雨加速了许多用于建筑结构、桥梁、水坝、工业装备、供水管网及通讯电缆等材料的腐蚀,还能严 重损害古迹、历史建筑以及其他重要文化设施。 ● 对人体健康的影响。 酸雨不仅可造成很大的经济损失,也可危害人体的健康,这种危害可以是间接的,也可以是直接的