
专题四有机化合物的分离、提纯与鉴别 有机化合物的分离、提纯与鉴别是研究有机化学必须具备的基本 知识与技能,有机化合物的分离通常指从混合物中把几种有机物成分 逐一分开:提纯则一般要求把杂质从主要产物中除去,有机化合物的 鉴别一般是根据不同有机化合物的特征反应,通过简单试验步骤将其 一一鉴定出来 一、有机化合物的分离和提纯 有机化合物的分离通常指从混合物中把几种有机物成分逐一分 开:提纯则一般要求把杂质从主要产物中除去。 分离和提纯有机物的方法很多,大体上可分为物理方法(如蒸馏、分 馏、水蒸气蒸馏、重结晶、升华、萃取、层析等)和化学方法两大类。 对化学方法的基本要求是方法简便易行,消耗少,被提纯物质可达较 高的纯度。 近年来一些高效物理方法,如柱层析、薄层层析,以及制备型液 相色谱等,在分离结构相近的有机物方面发挥了重要作用。 在解题时必须注意,若仅为除去少量杂质而达到提纯的目的,除 去杂质的方法可以采用不必复原的反应:若从混合物中分离几种有机 物,则分离过程中应该全部使用可复原的反应。 【例题1刂在合成乙酸乙酯的粗品中,可能含有乙酸、乙醇、乙醚和 水等少量杂质,如何将这些杂质除去?
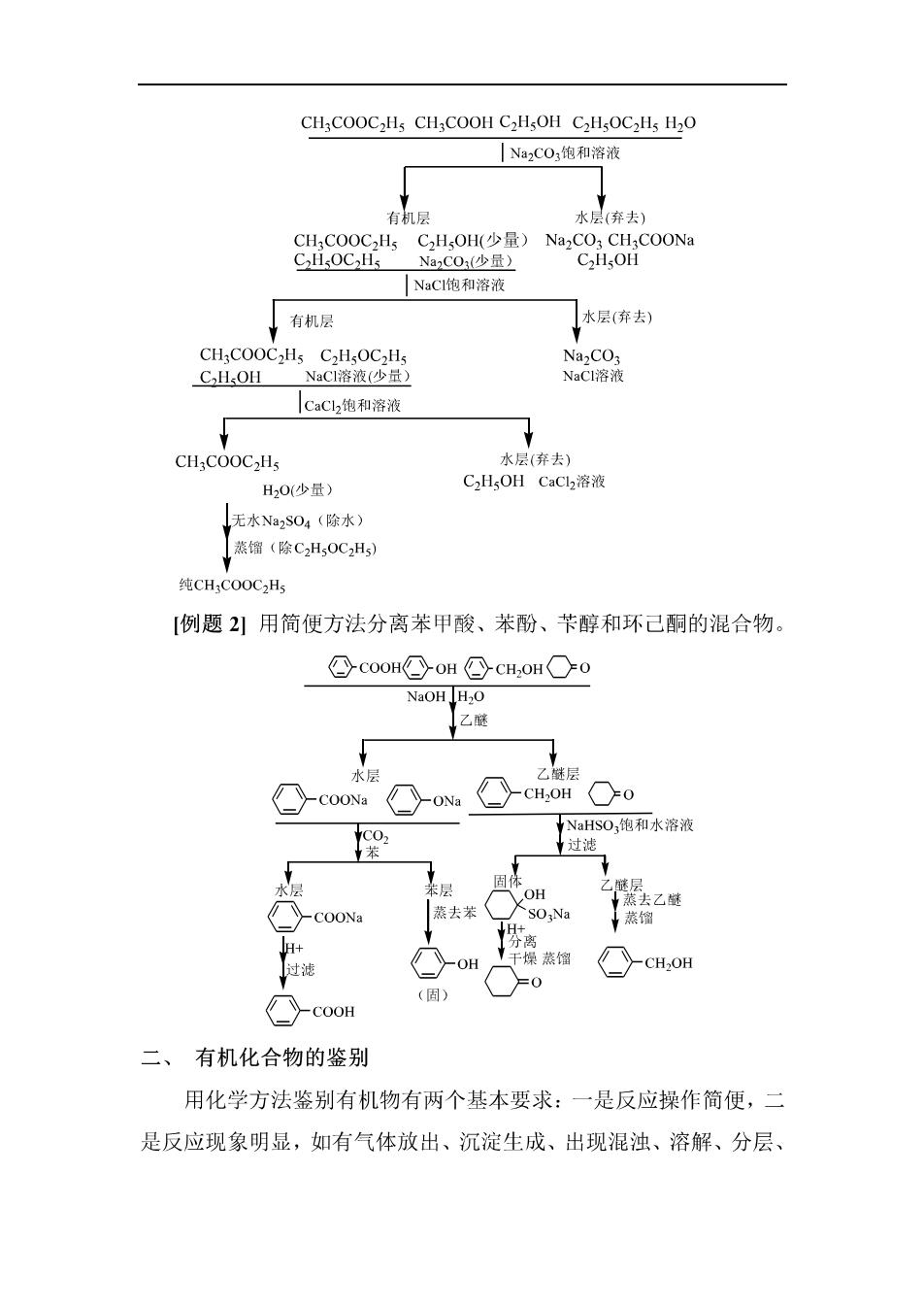
CH;COOC2Hs CH;COOH C2HsOH C2HsOC2Hs H2O |Na2CO:饱和溶液 弃去) ,C0(少 |NaCI饱和溶液 有机层 水层(弃去) CH3COOC2Hs C2HOC2Hs Na2CO3 C.HOH NaCl溶液(少量) NaCI溶液 CaCh饱和溶液 水层(弃去 H20(少量) CH,OH Cach?溶液 无水Na2S04(除水) (除C,0, 纯CHCO0CH; [例题2引用简便方法分离苯甲酸、苯酚、苄醇和环己酮的混合物。 Gco0HCoH①cH,OH○0 NaOH HO 乙醚 水后 >CH.OH0 NaHSO,饱和水溶液 过滤 去乙选 蒸馏 OH CH:OH (图】 -COOH 二、有机化合物的鉴别 用化学方法鉴别有机物有两个基本要求:一是反应操作简便,二 是反应现象明显,如有气体放出、沉淀生成、出现混浊、溶解、分层

颜色变化等。解题时要注意鉴别的先后顺序。一般把活泼的或有特征 反应的或易受干扰的物质先检出,再采用分组法,根据化合物的个性 一一鉴别。对于一组化合物中各个化合物的鉴别,可以采用图示法、 文字叙述法和列表法。解题时采用图示法较为直观、明了。各类有机 化合物的鉴别方法如下: 1、烷烃烷烃不易与酸、碱、氧化剂、还原剂反应 2、环烷烃:三元环使溴红棕色褪色,四元环以上不使溴褪色,环烷 烃不使KMnO4褪色。 3、烯烃:使KMnO,紫色褪色。使Br/CCL红棕色褪色。 一含 4、炔烃:使紫色的KMnO,褪色。 RCEC-R'+KMnO RCOOH+RCOOH+M 使Br2/CL4红棕色褪色。 Br Br RCEC-R'+Br,→RRN Br Br 与[AgNH)J广、[CuNH)J广作用生成沉淀 RCEC-H+[AgNH,h广→R-CCAg(白色) RC三C-H+[CuNH广→R-CCCu十(砖红色) 5、芳烃:与浓HS04加热溶解 +4s0→s0H 6、卤代烃:

与AgNO,/乙醇作用,生成AgX沉淀,可鉴别不同类型卤代烃。 R-X+AgNO3乙壁R-ONO2+AgX1 7、醇: (1)与金属Na作用,放出气体,可鉴别醇。 RCH2OH Na->RCH2ONa H2 (2)与KCO/HS0,作用,溶液颜色由橙色变为绿色,可鉴 别伯醇或仲醇(叔醇不反应)。 RCHOH KC2OL RCOOH+C H RCHOH KCO RC-O+C H+ (3)与Lucas试剂(浓HCV无水ZnCl2)作用,伯醇室温不反 应,仲醇几分钟后出现混浊,叔醇立即混浊、分层。可用于鉴别六个 碳原子以下醇。 R.CHOH+HCI ZnC RCHCI R3COH+HCI ZnCk RCCI (4)与1/OH作用,生成碘仿,可鉴别乙醇或甲基仲醇。 aiC4+h-o出cm+o0 OH 8、酚 1)与Cl,溶液显色反应,可鉴别酚或烯醇结构化合物。 2)与B/H0作用,生成白色沉淀,可鉴别苯酚。 OH OH 9、醚 溶解于浓酸,生成盐

0-R+→R一8R 10、醛和酮 (1)与羰基试剂作用生成沉淀。 NO2 O2N 〉=0:NaNm-0,一→大wNt①0 (2)与饱和NaHSO,作用生成白色沉淀,可鉴别醛、甲基脂肪酮或 八碳以下的环酮。 >9=0+ais0,-一a2H SO Na (3)与1/O作用,生成碘仿,可鉴别乙醛或甲基酮。 CH,一S一届+5oc十Rco0 0 (H) (4)与Tollens试剂一[AgNH)z广作用,生成银镜,可鉴别醛。 局ao+eN时r→Ae+Go (5)与Fehling试剂(Cu2/OH)作用,生成砖红色沉淀,可鉴别脂肪 醛。 R-CHO CuO CugO+RCOO 11、羧酸 (1)与NaHCO3或Na2CO3作用,放出气体,可鉴别羧酸。 RCOOH+NaHCO,→RCOONa+CO2个 (2)与Tollens试剂[AgNH)z广作用,生成银镜,可鉴别甲 酸。 HCOOH [Ag(NH3)2]-Ag+HCOO-

(3)与KMnO4H作用,使紫色褪色,可鉴别甲酸或草酸, HCOOH+KMn04 C021+Mm2 HOOC-COOH KMnO4 CO2+Mn2* 12、酰氯 HO/AgNO,放出HC1、生成白色沉淀,可鉴别酰氯。 0 R-C-CI+H20-RCOOH HCI HCI+AgNO3→AgCI 13、酰胺 与NaOH加热,放出NH3↑,可鉴别酰胺。 RCONH2 +NaOH-A RCOONa NHs 14、尿素 固体加热生成二缩脲,放出NH3↑。二缩脲与稀CuSO4/NaOH溶 液作用,生成蓝紫色,可鉴别含两个以上酰胺键的化合物。 Ndk-Nn8n益a-8Nm-8NNm 0 00 △ 15、胺 (1)兴斯堡反应:与苯磺酰氯NaOH作用,产物伯胺→溶解、仲胺 →白色沉淀,叔胺不反应,仍为油状物,可鉴别伯、仲、叔胺。 R-MItS0.C1. g+○0a匹Cot (2)与亚硝酸(NaNO,/HCI)作用:伯胺放出N2、仲胺生成黄色油 状物、脂肪叔胺溶解、芳香叔胺生成绿色固体

AH:NaNO,HCL N2 4 湖+aNO,gN-O ANO, -NR,+aN妈oN-O-NR, 16、糖 (1)Molish反应:糖与a-萘酚/酒精,浓HSO4作用,生成紫色 环,可鉴别糖类。 (2)Seliwanoff反应:酮糖与间苯二酚的浓盐酸溶液一起加热, 生成红色溶液。 (3)氧化反应: A.与AgNH)2J作用,生成银镜(或与斐林试剂作用生成砖红 色沉淀)。 CHO C00 [Ag(NH)J +Ag}或Cu,01 CH-OH CHOH B.Br/HO:红棕色褪色 CHO +Br2 H2O CH2OH CH2OH (4)成脎反应:单糖与过量的苯肼作用,生成黄色沉淀一糖脎。 CHO CH-NNH- NNH- +NHN出(过量)→ CH2OH CH2OH (5)与碘溶液反应:与【/KI溶液作用,直链淀粉呈蓝色,支链

淀粉呈紫红色 17、Q-氨基酸、蛋白质 (1)与水合茚三酮作用,显蓝紫色,可鉴别-氨基酸、多肽、 蛋白质。 (2)二缩脲反应:蛋白质与新配制的碱性硫酸铜溶液反应,呈 紫色 (3)黄蛋白反应:蛋白质中含有苯环的氨基酸,遇浓硝酸发生 硝化反应,生成黄色硝基化合物。 (4)Millon反应:蛋白质中酪氨酸的酚基遇到硝酸汞的硝酸溶 液,首先生成白色沉淀,加热后酚基与汞形成红色化合物。 鉴别一组有机物的方法可以用文字叙述,也可以列表或图示表示。 [例题刂用简单化学方法鉴别下列化合物: 苯酚、苯甲醛、丙醛、苯乙酮、苄醇、1-苯基乙醇 [解(I)文字叙述法:将上述六种化合物分别加入FCl溶液,显紫 色的为苯酚。分别取剩余的五种化合物加入2,4-二硝基苯肼,生 成黄色沉淀的是苯甲醛、丙醛、苯乙酮(第一组):不生成黄色沉 淀的是苄醇、1-苯基乙醇(第二组)。 分取第一组三种样品,加入托伦试剂,水浴加热,无银镜生 成的为苯乙酮,有银镜生成的为苯甲醛、丙醛。再取后两种化合 物,分别加入斐林试剂,水浴加热,有砖红色Cu0沉淀生成的 为丙醛,无砖红色沉淀生成的是苯甲醛。 分取第二组两种样品,加入碘液和氢氧化钠溶液,水浴加热, 有黄色CⅢ3沉淀生成的是1-苯基乙醇,不生成黄色沉淀的是苄 醇。 显然,这种表示方法比较繁琐

(2)列表法: 试剂FeCl 2,4二硝托伦试斐林试1NaOH 溶液基苯肼剂 剂 苯酚(+)紫()()() ⊙ 苯甲) (+)黄色!(+)Agl() ) 醛 丙醛() (+)黄色↓(+)Ag(+)CuO() 苯乙) (+)黄色↓) () (+)CHI3 酮 苄醇( ) () () (-) 1.苯⊙曰 () (+)CHⅢ↓ 基乙 醇 表中(+)表示与此试剂反应,()为不反应。列表法对鉴别较为复杂时 的表示有些杂乱。较为准确,且清楚的表示方法为图示法。 (3)图示法: 苯酚、苯甲醛、丙醛、苯乙酮、苄醇、1-苯基乙醇
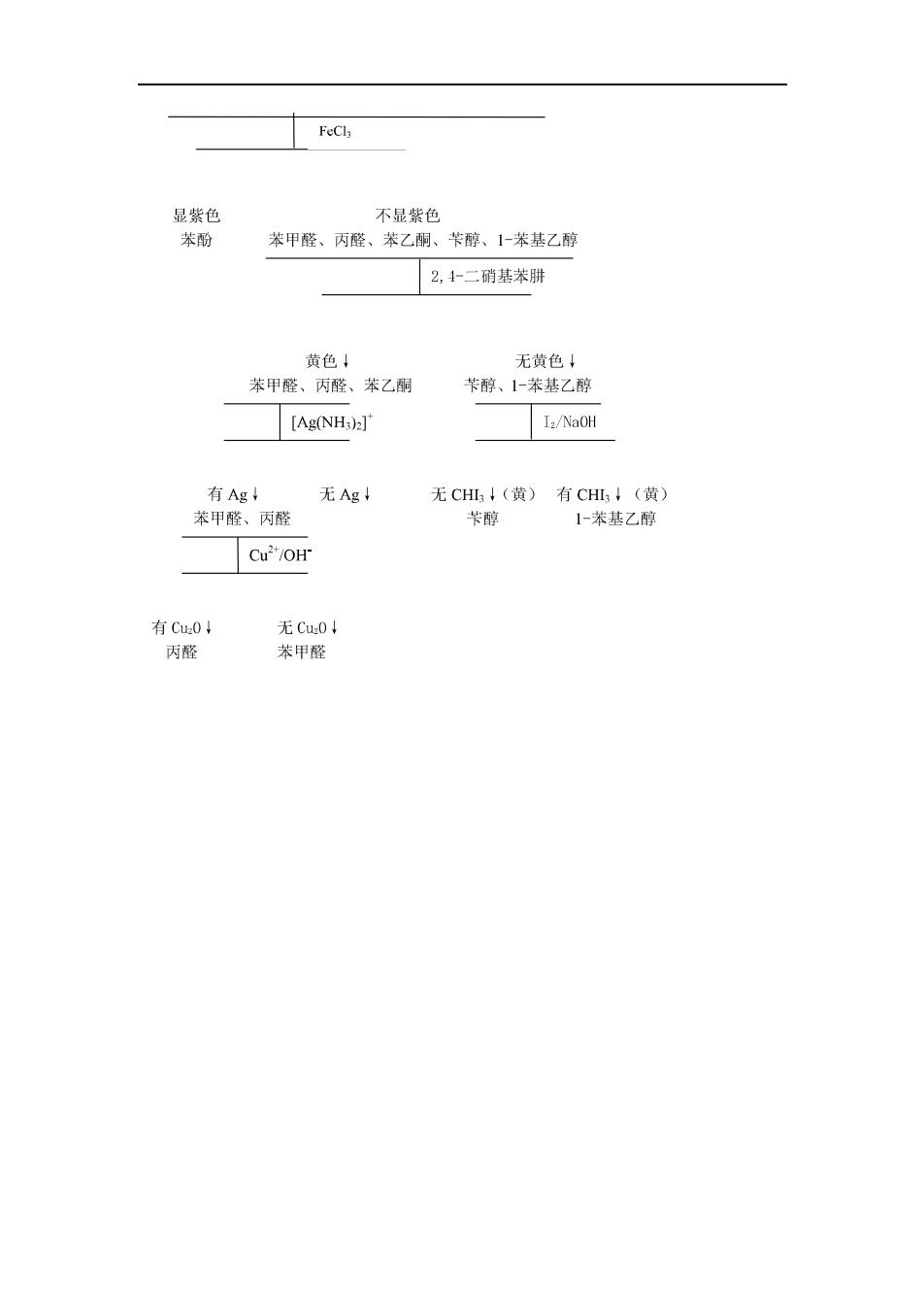
不品梦色 苯甲醛、丙醛、苯乙酮、卡醇、1上苯基乙酚 2,1二硝基茶肼 黄色 无黄色 苯甲醛、丙醛、苯乙酮 苄醇、1-苯基乙醇 [Ag(NH3)2] Ia/NaOH 有Ag 无Ag 无CH(黄)有CH!(黄) 苯甲醛、丙醛 卡醇 1-苯基乙醇 有Cu0 无Cu0 内醛 苯甲醛