
专题三典型的有机反应及其反应机理 掌握有机反应是学习有机物的性质及其相互转换、合成及应用的 基础。要学好有机化学,必须掌握大量的有机反应和必要的反应机理 一、取代反应 1.游离基取代反应 游离基取代反应的机理包括三个阶段:链的引发即吸收能量开始 产生游离基的过程;链的增长即反应连续进行的阶段:链的终止即游 离基的相互结合,使反应终止。以甲烷氯代为例,反应历程如下: 链引发:(a)C1:C1→2C 链增长:b)CH4+C→CH·+HCI (c)CH3·+CICI→CHC+C (d)CHCI+C→·CHCI+HCI (e)-CH2Cl+CI:CI CH2Cl2+CI (DC+CHC2→CHC2+HCI (gCHC2+CI:CI→CHCl+C 链终止:h)C+C→C1:C1 (①)CH3·+CH·→CHCH3 G)CH3.+C1→CHCI 下列反应也属于游离基取代反应: otR*a·○-ER 2.亲电取代反应 由亲电试剂(正离子或带有空轨道的分子)进攻芳环发生的取代 反应称为亲电取代反应。其中以卤代、硝化、磺化、傅氏反应较为重

要。 反应历程: O一CX @r一◇·B 亲电取代反应中常见的亲电试剂有:X、NO2、SO、R、R8,等 例如: O·a◇r HBr 令浓09◇o, 令+,50一◇S0,H0 ◇ +R-X球g◇R O+品x无水g◇8Rm 3.亲核取代反应 由亲核试剂(负离子或带有未共用电子对的分子)进攻电正性较 高的碳原子发生的取代反应称为亲核取代反应。这类反应主要包括卤 代烃的取代反应,醇与氢卤酸的反应,醚键的断裂,羧酸衍生物的生 成及羧酸衍生物的水解、酸解、氨解等。 ①卤代烃的亲核取代反应: RM一R-M+x 卤代烃的亲核取代反应有两种历程: SNlR—X→R*+XR+Nu:+R一Nu

不同类型卤代烃反应活性顺序: SN1 3°卤代烃2°卤代烃1°卤代烃 SN2 烯丙型>卤代烷型>乙烯型 例如: (CH,bC-Br+AgNO,乙、-(CHa)C-ONO,+AgCI(SN) ②醇与氢卤酸的反应: R-OHw2XR一OH 之R-X+0 不同氢卤酸与同一类型醇反应活性顺序为H>HB>HC1 不同醇与同一氢卤酸反应活性顺序为:CH2=CHCH2OH>R,COH >R2CHOH>RCH2OH ③醚键的断裂:在较高温度下,浓氢碘酸或浓氢溴酸能使醚键 断裂,生成卤代烃和醇或酚 RI ROHⅢRI+RI+HO ,H 例如: C:CHCH.OCH→c+c4 CHCH.O时 CH (较小烷基生成卤代烃) cc-0-a,女-CHc1.c,o(优先生成39离代超) Coa4号Cwa (氧原子与芳环形成p一π共轭体系,不易断裂,而生成苯酚)
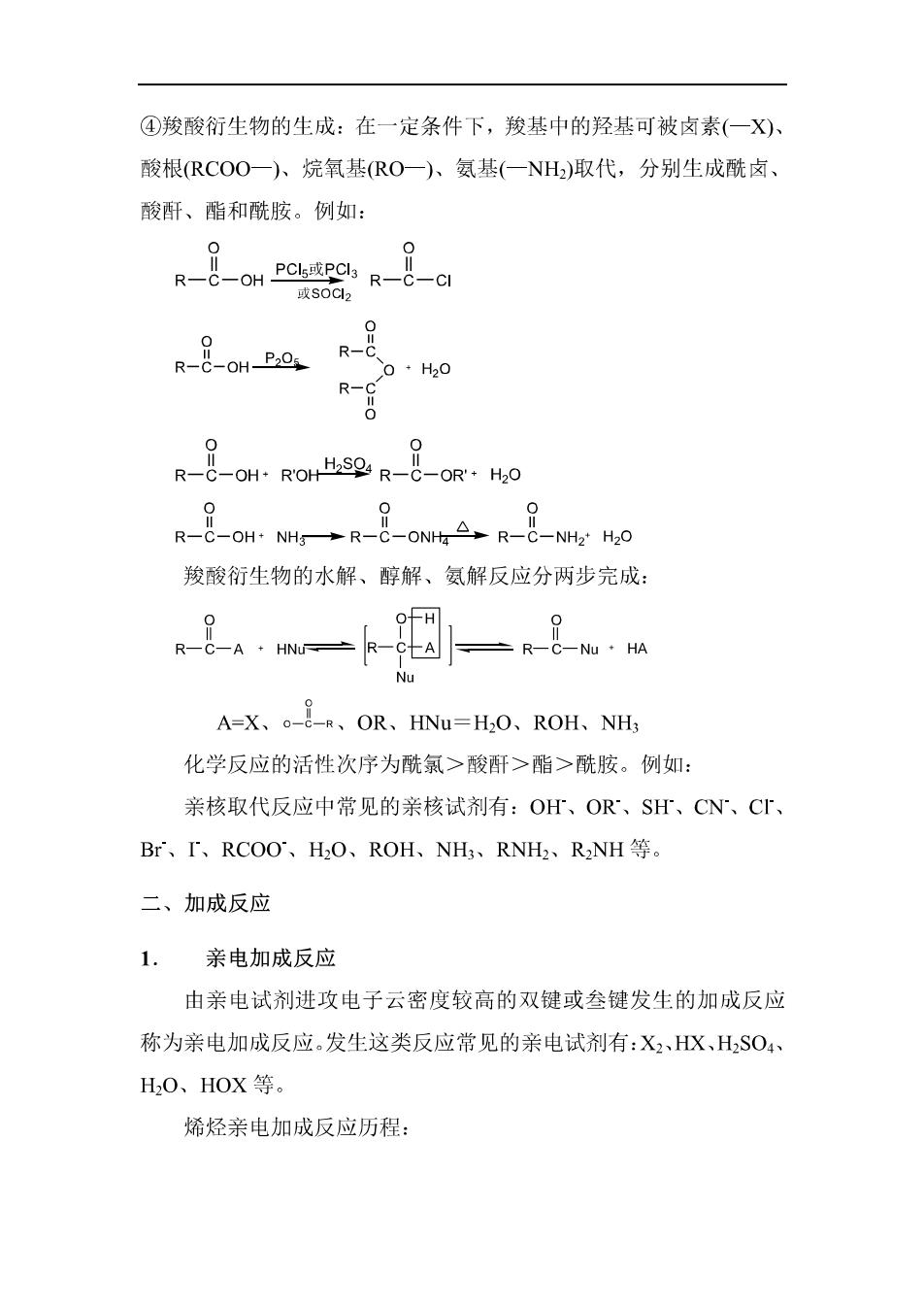
④羧酸衍生物的生成:在一定条件下,羧基中的羟基可被卤素(一X) 酸根RCOO一)人烷氧基(RO一)、氨基(一NH)取代,分别生成酰卤、 酸酐、酯和酰胺。例如: R-OH R-CI R-8-aR- 0+H20 R-C R-8-HN→R-8-ON△R-8-NH 0 羧酸衍生物的水解、醇解、氨解反应分两步完成: Nu A=X、。-&-R、OR、HINu=H,O、ROH、NH 化学反应的活性次序为酰氯>酸酐>酯>酰胺。例如: 亲核取代反应中常见的亲核试剂有:OH、OR、SH、CN、C、 Br、I'、RCOO、HO、ROH、NH、RNH、R2NH等。 二、加成反应 1.亲电加成反应 由亲电试剂进攻电子云密度较高的双键或参键发生的加成反应 称为亲电加成反应。发生这类反应常见的亲电试剂有:X2、HX、H2SO4、 H,0、HOX等。 烯烃亲电加成反应历程:
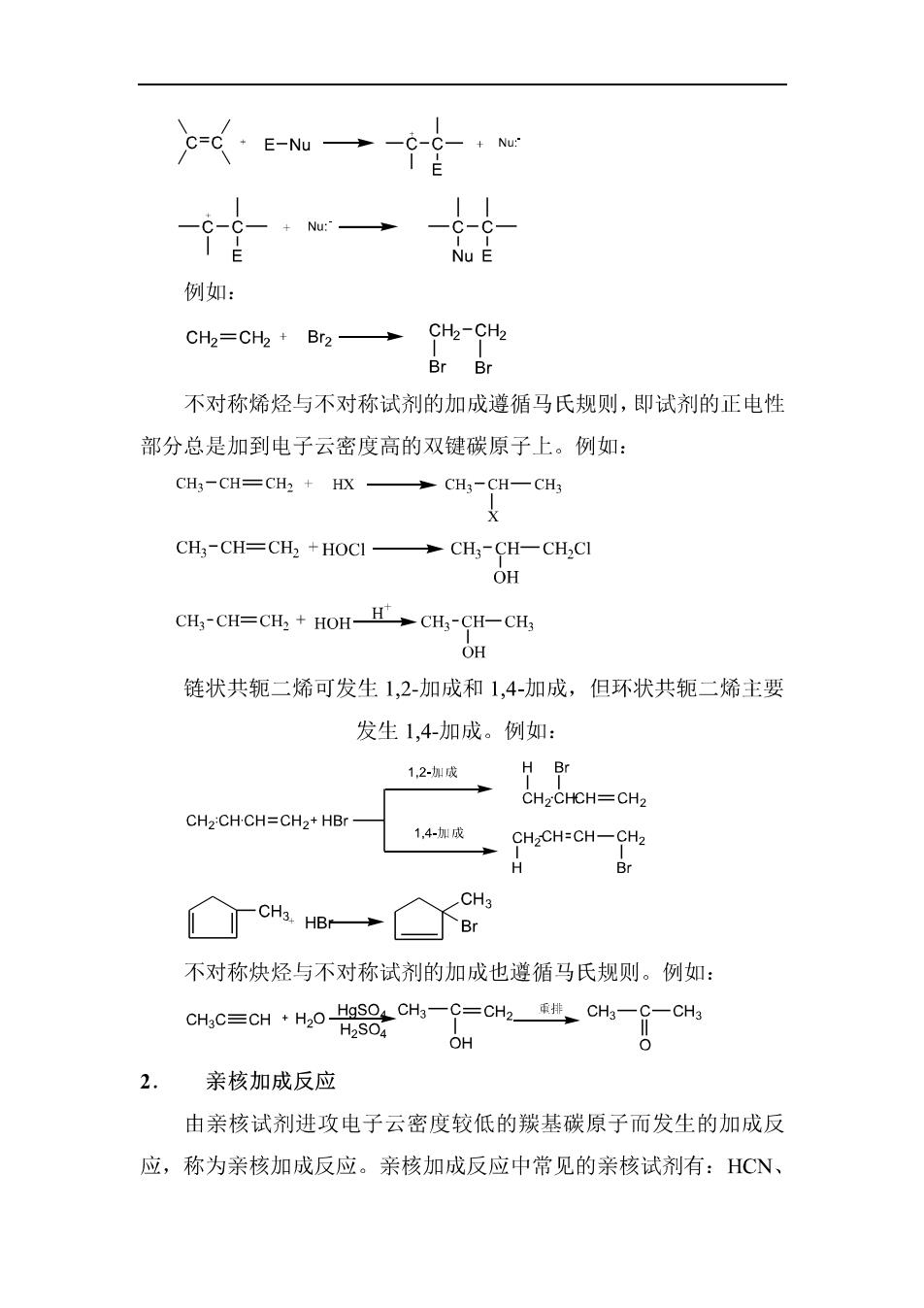
-Ew→-·w 一 例如: cH=Ch+Br2→ 不对称烯烃与不对称试剂的加成遵循马氏规则,即试剂的正电性 部分总是加到电子云密度高的双键碳原子上。例如: CH3-CH=CH2 HX CH3-CH=CH2 +HOCI-CH3-CH-CH2CI OH CH,-CH=CH:HOH-HCH-CH-CH, OH 链状共轭二烯可发生1,2-加成和1,4-加成,但环状共轭二烯主要 发生1,4-加成。例如: 12→ H Br CH2CHCH=CH2 CH2:CH-CH=CH2+HBr- 14-加成产 CHCH-CH-CH2 H Br CH3 丁cHHB→ 不对称炔烃与不对称试剂的加成也遵循马氏规则。例如: 0c=c1·H08c%一CC匙c4一g-c4 OH 0 2.亲核加成反应 由亲核试剂进攻电子云密度较低的羰基碳原子而发生的加成反 应,称为亲核加成反应。亲核加成反应中常见的亲核试剂有:HCN

RMgX、ROH、NaHSO3、NH、NH-Y等 反应历程: >C=0+Nu-E慢 E' c-0E→>c一oE C'Nu 例如:醛、酮与HCN的亲核加成(适用于醛、甲基脂肪酮、八碳 以下的环酮): OH →HC-CH-CN 醛、酮与RMgX的亲核加成(制备醇的方法): 一w0个 醛、酮与ROH的亲核加成(用于保护醛基): a业0器 H- Rc=o+HOCH CH OH FHCIC0-Ch】 RO-CH2 醛、酮与H0的亲核加成: HCHO+HOH产 只有甲醛、三氯乙醛、茚三酮等活性较强的醛、酮才与H0发 生亲核加成反应。 醛、酮与NaHSO,的亲核加成(适用于醛、甲基脂肪酮、八碳以 下的环酮,用于分离、提纯、鉴定: R R 0

羰基化合物和氨及其衍生物的亲核加成,反应不停留在加成 步,而是相继发生分子内脱水生成碳、氮双键化合物。 OH H 常见的氨的衍生物有: NHNH2 NHNHZ RNH2 NH2OH NH2NHz NO: H2N-C-NHNH2 N02 胺羟胺 苯肼2,4二硝基苯肼氨基脲 3.游离基加成反应 在过氧化物存在下,不对称烯烃与溴化氢的加成是反马氏加成, 该反应不属于亲电加成,而是游离基加成反应。例如: CCH=CH+HBr过室位CH,CH,CH2BT 三、消除反应 在一定条件下,由反应物分子中脱去一个小分子(如H,O、HX H,等)生成烯烃的反应称消除反应。 1.卤代烃的消除 卤代烃的消除反应是在氢氧化钠-醇溶液中进行的,有两种反应历程: E1历程: 慢 (CH3)3CBr (CHa)aC*Br CH3 H3C-C +Or快HC=+Ho 2-H CHa 反应速度:RC-X>RCH-X>RCH2-X

E2历程 「H -CH-CH=CH:+Br'+H:0 H---OH 反应速度:RC-X>RzCH-X>RCH-X 卤代烃的消除反应方向遵循查依采夫规则。例如 CH,CHCH,CH3NaOH-乙度cH,CH=CHCH+HBr Br 2.醇的消除 醇的消除是在硫酸存在下通过加热完成的。醇的消除反应活性顺 序为叔醇>仲醇>伯醇。消除反应的方向也遵循查依采夫规则。 醇的消除反应一般按E1历程进行。由于中间体是碳正离子,所以某 些醇会发生重排,主要得到重排的烯烃,例如: 3.霍夫曼消除 季铵碱受热分解的反应称霍夫曼消除。例如: (CH)N'oI (CHN+CHOH (CH)N'CHCH,OICH-CH+(CH)N+H.o CHCHCCHIOINCHOH CLCLCICHCHCCHCHCHCH-CHCC CH 96% 4% 四、-H取代反应 1.醛、酮的卤代及卤仿反应 因受羰基影响,醛、酮的α-H较活泼,在酸性或中性条件下易被 卤素取代。例如:

在碱性条件下卤代反应很难停留在一卤代阶段。如果-C为甲基, 、则发生肉仿反应9+大,R-之】 带有B甲基的仲醇和乙醇也能发生卤仿反应。 0 2羟醛缩合反应。含-H的醛,在稀碱作用下,发生分子间的加 成反应称为羟醛缩合反应。 R RCH2C- H HCH0OHRCH,CHCHCHO△RCH,CH:CCHO OH 含-H的醛与不含-H的醛发生交叉羟醛缩合反应。例如: CH-Cl:-Cno C CH:-CH-CHO CCHo CH 3羧酸a-H卤代。在碘、红磷、硫等催化下,羧酸的-H可以被 卤素取代。例如: dh-com兽ce-cot0ac-coan0ac-con 4.酯缩合反应。带有α-H的酯,在醇钠的存在下,两分子酯脱去 分子醇的反应称为酯缩合反应。例如: 2CH COOCHsCHON CHCCHCOOCH+CH,OH 五、氧化还原反应 1.氧化反应 在有机分子中加氧或去氢的反应称氧化反应。 ①烯烃:

KMnO4 OHOH 稀碱,冷 CH3-CH-CH2 HgC-CH=CH2 KMnO4→ CHsCOOH CO2+H20 H+ ()03 CHaCHO HCHO (2)Zn/H2O ②炔烃 KMnO4 CHaC=CH CH3COOH CO2 H2O ③芳烃侧链 ④醇: CH为CHCH KMnO4 (CHa)CCOOH R2CHOHKCrO R2C=O H R,COH_K.CrO?、不反应 H' ⑤醛: 整题a8·如 (Ar) RGH0要林试剂RCO0+Cu,0 ⑥甲酸、草酸: HCOOH-KMinO&.、co2+H20 H' o2a·的 ⑦糖:单糖、还原性双糖可被托伦试剂、斐林试剂氧化,非还原